Transición de reumatología pediátrica a reumatología general
Transición de reumatología pediátrica a reumatología general
L. Nuño Nuño, C. Udaondo Gascón.
Hospital Universitario La Paz. Madrid
Fecha de recepción: 24-01-2024
Fecha de publicación: 31 de marzo 2024
Adolescere 2024; XII (1): 58-67
Resumen
|
La transición es un proceso por el cual los pacientes pasan de una atención médica en reumatología pediátrica a una atención en reumatología de adultos, y supone un momento crítico. Idealmente debería iniciarse en las etapas más precoces de la adolescencia y continuarse un tiempo después de la transferencia a reumatología de adultos, con el fin de conseguir un automanejo de la enfermedad. Entre los objetivos del proceso de transición están introducir precozmente el concepto de transición, desarrollar una política de transición, fomentar el uso de herramientas de preparación para la transferencia, dar conocimientos en el automanejo de la enfermedad y de los tratamientos, y proveer un resumen médico para compartir con el reumatólogo de adultos. Un programa de transición eficaz podría permitir una mejora en términos de calidad de vida, actividad académica y laboral, satisfacción con la atención y resultados a largo plazo, así como una menor morbilidad y mortalidad. Palabras clave: Transición; Transferencia; Adolescencia; Adulto joven; Reumatología pediátrica; Reumatología adultos. |
Abstract
|
Transition is a process by which patients transfer from medical care in pediatric rheuma-tology to care in adult rheumatology, representing a critical period. Ideally, it should begin in the earliest stages of adolescence and continue for at least some time after transfer to adult rheumatology, in order to achieve self-management of the disease. Among the goals of the transition process include introducing the concept of transition early, develo-ping a transition policy, encouraging the use of transfer preparation tools, providing kno-wledge in disease and treatment self-management, and facilitating a medical summary to be shared with the adult rheumatologist. An effective transition program could allow for improvement in terms of quality of life, academic and work activity, satisfaction with care and long-term outcomes, as well as reduced morbidity and mortality. Key words: Transition; Transfer; Adolescence; Young adult; Pediatric rheumatology; Adult rheumatology. |
Introducción
Los síntomas osteomusculares representan la tercera causa más frecuente de consulta a esta edad en AP
La patología reumática en la edad adolescente es de especial interés, ya que los síntomas osteomusculares representan la tercera causa más frecuente de consulta a esta edad en atención primaria y hasta una tercera parte de las AIJ debutan en la edad adolescente. Por otra parte, sufrir este tipo de patologías a esta edad tiene un gran impacto físico, emocional y psicológico.
El manejo de la patología reumática puede ser especialmente complicada en esta etapa por
diversos motivos, como la falta de adherencia al tratamiento, la actitud desafiante, o la falta de seguimiento de las citas médicas. La transición de la atención pediátrica a la de adultos se reconoce actualmente como uno de los factores clave para el correcto manejo de las enfermedades crónicas de inicio en la infancia, y supone un momento crítico para conseguir involucrar a los pacientes adolescentes(1). Varios estudios han descrito que alrededor del 50 % de los pacientes con patologías reumáticas no experimentan una transferencia efectiva, con el riesgo de pérdida de seguimiento, mala adherencia al tratamiento o incluso aumento en la mortalidad(1,2). Es más probable que la transferencia tenga éxito cuando los pacientes se encuentran médica y socialmente estables y cuando existe comunicación directa entre los equipos de reumatología pediátrica y de adultos(2) (Tabla I).
Los objetivos principales de la transición son preparar a los jóvenes para manejar de forma independiente su enfermedad reumática, incluyendo el manejo de los tratamientos y el cumplimiento de las citas médicas, y garantizar un proceso organizado que facilite la transmisión de la información y el paso de los sistemas de salud pediátrica a los de adultos.
Transición y transferencia
La transición es un proceso activo y multidimensional que atiende a las necesidades médicas, psicosociales y educativas de los adolescentes
La transición se define como un proceso gradual por el cual un paciente joven con una patología crónica desarrolla las habilidades y dispone de los recursos necesarios para el cuidado de su salud durante el paso de la adolescencia a la edad adulta(3). Se trata de un proceso activo y multidimensional que atiende las necesidades tanto médicas, como psicosociales y educativas de los adolescentes. El punto fundamental es que supone un cambio de un sistema centrado en el niño y la familia a un modelo de atención centrada en el adulto. Este proceso no termina hasta que el adulto joven está totalmente integrado en una unidad de adulto. En cambio, la transferencia es un proceso estático y único, por el cual el paciente cambia de ubicación física de reumatología pediátrica a reumatología de adultos, y la información médica pasa de un especialista a otro.
Idealmente el proceso de transición debería comenzar en la adolescencia temprana, sobre los 11 años, o si no es posible, como muy tarde a los 14 años, para permitir el desarrollo de las habilidades de autocuidado necesarias. Para los pacientes que son diagnosticados por encima de los 14 años, el proceso de transición debería comenzar en el momento del diagnóstico, para poder disponer de tiempo suficiente para preparar al paciente antes de la transferencia.
Modelos de transición
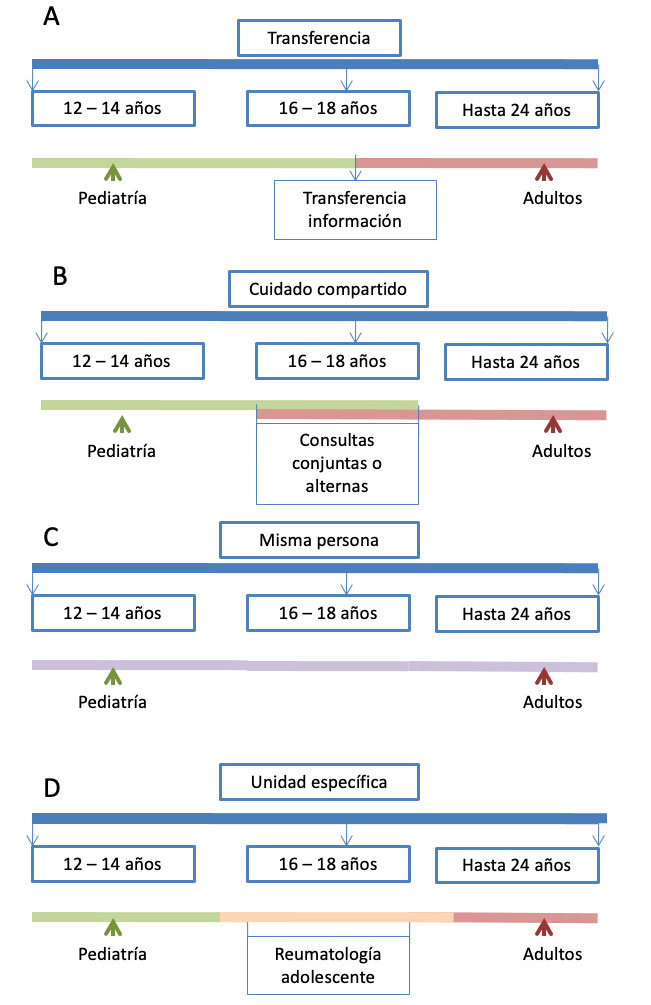
En la literatura se han descrito varios modelos de transición de pacientes de reumatología pediátrica a la atención en adultos, dependiendo de la idiosincrasia y los recursos disponibles en cada centro(4) (Figura 1).
El modelo más común se centra en la enfermedad y trasfieren al paciente según la edad cronológica, con la ayuda de un informe médico
A) El modelo más común (A) es una transición centrada en la enfermedad, en el que los servicios de pediatría y adultos funcionan de forma independiente y transfieren al paciente según la edad cronológica, con la ayuda de un informe médico. Este modelo (transferencia pura) no atiende a todos los aspectos no puramente médicos de la transición, por lo que no se considera el modelo más adecuado(5,6).
Otros modelos más centrados en la comunicación y cuidado compartido serían:
B) Cuidado compartido entre reumatología de adultos y reumatología pediátrica durante el tiempo que dure el proceso de transición, pudiendo ser:
- Consultas conjuntas ubicadas en pediatría, con participación de pediatras y reumatólogos de adultos.
- Consultas alternantes en consultas de reumatología de adultos y consultas de pediatría, previas a realización de la transferencia.
C) Seguimiento por una misma persona que actúa como reumatólogo pediátrico y reumatólogo de adultos, por lo que el seguimiento es en el mismo sitio y no se requiere un traslado de unidad.
D) Seguimiento en una unidad específica de reumatología del adolescente.
Todavía hay escasez de datos sobre el impacto de estos modelos.
Necesidades
Los principales obstáculos para la implementación del proceso de transición son la formación insuficiente del equipo médico y la escasez de recursos
Los principales obstáculos para la implementación del proceso de transición son la formación insuficiente en el equipo médico y la escasez de recursos (dotación económica, tiempo y personal)(7). Un proceso de transición deficiente, con falta de cooperación y comunicación entre el equipo reumatológico pediátrico y de adultos puede conllevar la pérdida de información sobre el inicio de la enfermedad, así como sobre terapias previas y respuesta a los tratamientos y, por tanto, dificulta una evaluación fiable de los resultados a largo plazo y su correlación con posibles predictores de respuesta.
Otros obstáculos son:
- Falta de planes de transición escritos
- Poca familiaridad con los programas de transición
- Escasa información en la historia médica recibida por los centros de reumatología para adultos desde servicios pediátricos
- Falta de coordinación o comunicación entre el equipo de pediatría y el de reumatología de adultos
- Preparación inadecuada de los adolescentes previa a la transferencia
- Escasa formación específica de los reumatólogos de adultos en patología de adolescentes
Objetivos
Los principales objetivos a conseguir por parte de los adolescentes previo a realizar la transferencia son:
- Desarrollo mental adecuado para lograr una adaptación efectiva al cambio a reumatología de adultos
- Asumir las responsabilidades de los adultos (reservar citas propias, contactar con el equipo médico para obtener asesoramiento, toma de decisiones informadas, adherencia al tratamiento y visitas, etc.)
- Fomentar la independencia y la asertividad
- Conocimiento sobre la enfermedad y los tratamientos
- Conocimiento sobre las características y el funcionamiento de reumatología de adultos
- Enfermedad clínicamente estable
- Buena adherencia y tolerancia al tratamiento
Los indicadores de una buena transición son que los pacientes no pierdan el seguimiento y que la enfermedad esté clínicamente estable
Existen diversos indicadores de una transición exitosa (Tabla II), entre los cuales se considera que el indicador más importante es que los pacientes no pierdan el seguimiento(9). Otro de los factores fundamentales para una transferencia exitosa es que la enfermedad esté clínicamente estable a nivel médico, así como durante un período de estabilidad social. Dicha situación de estabilidad aumenta las posibilidades de que un adulto joven asista a una cita programada y cumpla con el tratamiento médico.
Estructuración de las unidades de transición
El programa “Got Transition” identifica los seis elementos básicos de la transición de la atención médica, que se llevan a cabo dentro de unos plazos predefinidos. Se desarrollaron para aportar una estructura de trabajo para una implementación práctica en el proceso de transición, empezando con una política de transición y finalizando con la transferencia e integración exitosa en la atención médica del adulto(7,10). Los elementos básicos y las edades recomendadas son los siguientes:
- Concienciación del paciente y sus familiares sobre la política de transición (12 años)
- Inicio de la planificación de la transición (14 años)
- Comentar con el paciente y sus padres el modelo de atención para adultos (16 años)
- Transición al modelo de atención para adultos (18 años)
- Transferencia completa al sistema médico de adultos (18-22 años)
- Integración completa de los jóvenes en la atención de adultos (23-26 años)
El seguimiento y la monitorización regular de la transición garantiza que los pacientes reciban una preparación adecuada, y así poder identificar los pacientes que están listos para realizar la transferencia. El proceso de transición de cada paciente debe planificarse con el adolescente y sus familias, y el progreso debe documentarse en la historia médica.
Se debe contar con una política y un protocolo de transición escritos y actualizados periódicamente, que deben ser acordados por todas las partes interesadas, incluidos los jóvenes, las familias y todos los profesionales de la salud involucrados, así como contar con los recursos apropiados para apoyar su implementación. Se necesitará más tiempo y esfuerzo para los pacientes con enfermedades más complicadas, pocos recursos o falta de apoyo familiar(10).
El grupo de trabajo de PReS/EULAR ha desarrollado una serie de recomendaciones y estándares para la atención de transición de adolescentes con enfermedades reumáticas. El objetivo es facilitar modelos de atención de alta calidad, informar sobre estrategias de evaluación y definir una agenda de investigación(11). En la Tabla III se resumen las principales recomendaciones en las consultas de transición.
Los principales participantes del equipo sanitario en el equipo multidisciplinar de transición son los siguientes:
El coordinador de transición puede ser una enfermera u otro profesional de la salud, y debe facilitar la comunicación con el equipo multidisciplinar y la implementación del plan de transición
- Coordinador de transición: Es esencial contar con un coordinador de transición dentro de la clínica de reumatología pediátrica. Esta persona puede ser una enfermera u otro profesional de la salud y debe servir de enlace entre los equipos de adultos y pediátricos para garantizar la coordinación de la atención, facilitar la comunicación entre los distintos componentes del equipo multidisciplinar y la implementación del plan de atención de transición.
- Reumatólogo de adultos: Debería ser un reumatólogo interesado, comprometido y capacitado en reumatología del adolescente, y conocido por el equipo de reumatología pediátrica.
- Reumatólogo pediátrico: Igualmente debería ser una persona con especial interés, sensibilidad y formación en la patología del adolescente.
- Enfermería de enlace: Resulta muy útil el papel de enfermería en cuanto a formación y seguimiento del paciente y sus familias en todo el proceso.
Además, puede ser interesante involucrar a otros componentes en el equipo multidisciplinar, como fisioterapeutas, trabajador social o pediatría de atención primaria, en función de los recursos disponibles de cada sistema sanitario. Todos los miembros del equipo de transición deben recibir formación sobre la salud de los adolescentes y el proceso de transición.
Herramientas
La adolescencia temprana es un período crítico para fomentar la participación y el autocuidado del paciente. Existe una variedad de instrumentos de evaluación de la preparación para la transición, que pueden ser útiles como punto de partida para discutir objetivos de autogestión.
Una de las herramientas más utilizadas y mejor validadas es el cuestionario de evaluación de la preparación para la transición, que evalúa las habilidades de autocuidado(12). Otras medidas validadas de evaluación de la preparación para la transición incluyen TRANSITION-Q(13) y STARx(14).
El sitio web https://gottransition.org/ ofrece herramientas gratuitas de transición basadas en la evidencia, como herramientas de evaluación de la preparación para la transición, una check-list para la transferencia y una política de transición, entre otras.
El Colegio Americano de Reumatología incluye también herramientas para la transición como plantillas de resúmenes médicos específicamente para AIJ y LES (Medical summary juvenile idiopathic arthritis: https://rheumatology.org/api/asset/blt1377c655fb0f58d6) (Medical summary: systemic lupus erythematosus. https://rheumatology.org/api/asset/bltcf37b94f17591f8f).
Una herramienta clave en el proceso de transición es una entrevista a solas con el adolescente, para abordar diferentes aspectos
Aunque no se trata de una herramienta como tal, incluir en la consulta de transición una entrevista a solas con el adolescente puede resultar de gran utilidad a la hora de abordar diferentes aspectos, y está reconocido en la literatura como un elemento clave del proceso(5, 6,11).
Aspectos a tener en cuenta de la salud psicoafectiva, psicosexual y de conductas de riesgo en el adolescente
La consulta de profesionales de referencia es una oportunidad para hacer promoción y prevención de la salud e identificar las necesidades individuales, factores de riesgo y de protección
Para una transición adecuada se recomienda un abordaje holístico del adolescente y su familia, teniendo en cuenta diferentes aspectos. Entre ellos están los aspectos médicos clave, como el conocimiento de su enfermedad, la adherencia terapéutica y el conocimiento de la unidad de reumatología de adultos para mantener un adecuado seguimiento, pero también psicosociales, dado que vive un momento vital de desarrollo que plantea retos muy diferentes al resto de edades, como las conductas de riesgo, el consumo de sustancias, la actividad deportiva, la nutrición o la sexualidad(11). La consulta con profesionales de referencia es una excelente oportunidad para hacer promoción y prevención de la salud e identificar las necesidades individuales, factores de riesgo y de protección. En numerosas ocasiones, la limitación más importante para esto es el tiempo en consulta y la formación adecuada de los especialistas.
Salud psicosexual
- Prevención de embarazos no deseados e información sobre métodos anticonceptivos:
algunos fármacos utilizados en reumatología pediátrica son considerados teratógenos, o no se dispone de información suficiente sobre su seguridad en el embarazo, por lo que estaría indicado tomar medidas anticonceptivas y evitar un embarazo. Se debe informar al paciente sobre este hecho y de las opciones anticonceptivas disponibles, o derivar a una consulta de ginecología del adolescente en caso necesario. - Prevención de enfermedades de transmisión sexual (ETS): al igual que en adolescentes sanos, en adolescentes con enfermedades reumáticas debe informarse y asesorar sobre el riesgo y prevención de ETS, así como derivar a consultas específicas e iniciar tratamiento en caso de presentarlas. La vacuna frente al virus del papiloma humano está indicada y recomendada en adolescentes en tratamiento inmunosupresor al igual que en adolescentes sanos.
Gestión de conductas de riesgo
Conviene hacer un despistaje en consulta sobre posibles conductas de riesgo. Concretamente, se tratarán el posible abuso de sustancias como el alcohol u otras drogas. Debido al riesgo cardiovascular y posible riesgo de trombosis presente en algunas enfermedades reumáticas crónicas, se desaconseja el uso del tabaco en estos pacientes.
Salud mental
La adolescencia es un periodo especialmente vulnerable para la salud mental, especialmente en pacientes con enfermedades crónicas. Se recomienda una atención a este aspecto con derivación a consulta de salud mental en caso de sospecha de patología psiquiátrica o identificación de ideas de suicidio.
Adherencia al tratamiento
Por distintos factores la adolescencia es un periodo de riesgo para una baja adherencia a los tratamientos
Por distintos factores psicosociales, la adolescencia es un periodo de especial riesgo para una baja adherencia. Un seguimiento estrecho, la adecuada conciencia de enfermedad y una adecuada relación médico-paciente son claves para un adecuado cumplimiento terapéutico.
Resumen de aspectos a abordar durante la consulta de transición
Durante la transición se abordarán aspectos médicos, psicosociales, educativos y profesionales
Aspectos médicos
- Identificación de las necesidades médicas y de los tratamientos.
- Garantizar la continuidad de la prestación de cuidados de alta calidad.
- Proporcionar información genérica y específica sobre las enfermedades, conocimiento de su propia enfermedad y de los tratamientos.
- Promoción de la salud, orientación anticipatoria, estilo de vida, actividad deportiva y de hábitos saludables.
- Evaluar el comportamiento en materia de salud, negociando las formas más adecuadas de garantizar la adherencia al tratamiento y canales para obtención de ayuda en caso de brote.
- Promocionar los conocimientos y competencias en los ámbitos enumerados anteriormente.
Aspectos psicosociales
- Identificar las necesidades individuales, factores de riesgo y de protección. Proporcionar apoyo o remitir a los jóvenes a organismos específicos en caso necesario. Un ejemplo es el acrónimo HEADSS: siglas en inglés para Hogar, Educación, Actividades, Drogas, Sexo, Suicidio(15).
- Garantizar una vida social equivalente a la de sus compañeros.
- Garantizar apoyo para hacer frente a la enfermedad y el tratamiento.
- Proporcionar asesoramiento y/o fuentes adicionales de apoyo.
- Fomentar las capacidades de asertividad, resiliencia, autocuidado, autodeterminación y autodefensa.
Aspectos educativos y profesionales
- Abordar las perspectivas profesionales futuras.
- Apoyar en la preparación para el trabajo y dónde obtener información.
- Abordar la experiencia laboral y animar a los jóvenes a adquirir una experiencia pertinente.
- Ofrecer información, apoyo y asesoramiento adecuados (grupos de apoyo, servicios de voluntariado).
- Servir de enlace con las instituciones educativas.
- Aportar información sobre derechos y obligaciones, ventajas y oportunidades para adaptar el trabajo.
Conclusiones
Un programa de transición eficaz permitirá mejoras en la calidad de vida, en la actividad académica y laboral, mayor satisfacción con la atención y una menor morbilidad y mortalidad
Sólo una estrecha colaboración por parte de los equipos de reumatología pediátrica y de adultos puede garantizar un proceso exitoso de transición. Este proceso debe ser planificado a tiempo, coordinado y llevado a cabo por un equipo multidisciplinario. A nivel práctico, los puntos más importantes a implementar en las consultas de transición incluyen: introducir de forma temprana el concepto de transición, desarrollar una política de transición, utilizar herramientas de evaluación de preparación para la transición, y proporcionar un resumen médico para compartir con el reumatólogo de adultos. Un programa de transición eficaz podría permitir una mejora en términos de calidad de vida, en la actividad académica y laboral, en la satisfacción con la atención y en los resultados a largo plazo, con una menor morbilidad y mortalidad.
Tablas y figuras
Tabla I. Diferencias en los sistemas médicos de reumatología pediátrica y reumatología de adultos
|
REUMATOLOGÍA PEDIÁTRICA |
REUMATOLOGÍA DE ADULTOS |
|
Interacción centrada en la familia |
Interacción centrada en el adolescente |
|
Padres presentes en la mayor parte o toda la visita clínica |
Paciente evaluado habitualmente sin la presencia de los padres en las visitas clínicas |
|
Visitas clínicas más prolongadas y más frecuentes |
Visitas clínicas más cortas y más infrecuentes |
|
Mayor facilidad para consultas urgentes |
Menor facilidad para consultas urgentes |
|
Mayor atención a necesidades psicosociales, educacionales o laborales |
Menor atención a necesidades psicosociales, educacionales o laborales |
|
Entorno físico de las consultas más amigable |
Entorno físico de las consultas más frío |
Modificado de: Sadun RE, Covert LT, Lawson EF. Transitioning to Adulthood with a Rheumatic Disease: A Case-Based Approach for Rheumatology Care Teams. Rheum Dis Clin North Am. 2022 Feb;48(1):141-156. doi: 10.1016/j.rdc.2021.09.011. PMID: 34798943.
Tabla II. Principales indicadores de una
transición exitosa
|
|
|
|
|
|
Elaboración propia.
Tabla III. Recomendaciones en la transición
|
|
|
|
|
|
|
|
|
|
|
Modificada de: Calvo I, Antón J, Bustabad S, Camacho M, de Inocencio J, Gamir ML, et al. Consensus of the Spanish society of pediatric rheumatology for transition management from pediatric to adult care in rheumatic patients with childhood onset. Rheumatol Int 2015;35:1615–24.
Figura 1. Modelos de transición
- Transferencia pura
- Cuidado compartido entre reumatología de adultos y reumatología pediátrica.
- Consultas conjuntas ubicadas en pediatría, con participación de pediatras y reumatólogos de adultos.
- Consultas alternantes en consultas de reumatología de adultos y consultas de pediatría, previas a realización de la transferencia.
- Seguimiento por una misma persona que actúa de reumatólogo pediátrico y reumatólogo de adultos.
- Seguimiento en una unidad específica de reumatología del adolescente.
Modificada de: Calvo I, Antón J, Bustabad S, Camacho M, de Inocencio J, Gamir ML, et al. Consensus of the Spanish society of pediatric rheumatology for transition management from pediatric to adult care in rheumatic patients with childhood onset. Rheumatol Int 2015;35:1615–24.
Bibliografía
1. Stringer E, Scott R, Mosher D, MacNeill I, Huber AM, Ramsey S, et al. Evaluation of a Rheumatology Transition Clinic. Pediatr Rheumatol Online J. 2015 Jun 11;13:22. doi: 10.1186/s12969-015-0016-x. PMID: 26063057; PMCID: PMC4462188.
2. Sadun RE, Covert LT, Lawson EF. Transitioning to Adulthood with a Rheumatic Disease: A Case-Based Approach for Rheumatology Care Teams. Rheum Dis Clin North Am. 2022 Feb;48(1):141-156. doi: 10.1016/j.rdc.2021.09.011. PMID: 34798943.
3. Blum RW, Garell D, Hodgman CH, Jorissen TW, Okinow NA, Orr DP, et al. Transition from child-centered to adult health-care systems for adolescents with chronic conditions. A position paper of the Society for Adolescent Medicine. J Adolesc Health. 1993 Nov;14(7):570-6. doi: 10.1016/1054-139x(93)90143-d. PMID: 8312295.
4. Clemente D, Leon L, Foster H, Minden K, Carmona L. Systematic review and critical appraisal of transitional care programmes in rheumatology. Semin Arthritis Rheum. 2016 Dec;46(3):372-379. doi: 10.1016/j.semarthrit.2016.06.003. Epub 2016 Jun 9. PMID: 27496195.
5. Expósito Pérez L, Bethencourt Baute JJ, Bustabad Reyes S. Unidades de transición. Protoc diagn ter pediatr. 2020;2:413-418.
6. Calvo I, Antón J, Bustabad S, Camacho M, de Inocencio J, Gamir ML, et al. Consensus of the Spanish society of pediatric rheumatology for transition management from pediatric to adult care in rheumatic patients with childhood onset. Rheumatol Int. 2015 Oct;35(10):1615-24. doi: 10.1007/s00296-015-3273-6. Epub 2015 Apr 28. PMID: 25917856.
7. Chira P, Ronis T, Ardoin S, White P. Transitioning youth with rheumatic conditions: perspectives of pediatric rheumatology providers in the United States and Canada. J Rheumatol. 2014 Apr;41(4):768-79. doi: 10.3899/jrheum.130615. Epub 2014 Mar 1. PMID: 24584912.
8. Jiang I, Major G, Singh-Grewal D, Teng C, Kelly A, Niddrie F, et al. Patient and parent perspectives on transition from paediatric to adult healthcare in rheumatic diseases: an interview study. BMJ Open. 2021 Jan 4;11(1):e039670. doi: 10.1136/bmjopen-2020-039670. PMID: 33397662; PMCID: PMC7783517.
9. Suris JC, Akre C. Key elements for, and indicators of, a successful transition: an international Delphi study. J Adolesc Health. 2015 Jun;56(6):612-8. doi: 10.1016/j.jadohealth.2015.02.007. PMID: 26003575.
10. McManus M, White P, Barbour A, Downing B, Hawkins K, Quion N, et al. Pediatric to adult transition: a quality improvement model for primary care. J Adolesc Health. 2015 Jan;56(1):73-8. doi: 10.1016/j.jadohealth.2014.08.006. Epub 2014 Oct 3. PMID: 25287984.
11. Foster HE, Minden K, Clemente D, Leon L, McDonagh JE, Kamphuis S, et al. EULAR/PReS standards and recommendations for the transitional care of young people with juvenile-onset rheumatic diseases. Ann Rheum Dis. 2017 Apr;76(4):639-646. doi: 10.1136/annrheumdis-2016-210112. Epub 2016 Nov 1. Erratum in: Ann Rheum Dis. 2018 Jun;77(6):960. PMID: 27802961.
12. Wood DL, Sawicki GS, Miller MD, Smotherman C, Lukens-Bull K, Livingood WC, et al. The Transition Readiness Assessment Questionnaire (TRAQ): its factor structure, reliability, and validity. Acad Pediatr. 2014 Jul-Aug;14(4):415-22. doi: 10.1016/j.acap.2014.03.008. PMID: 24976354.
13. Klassen AF, Grant C, Barr R, Brill H, Kraus de Camargo O, Ronen GM, et al. Development and validation of a generic scale for use in transition programmes to measure self-management skills in adolescents with chronic health conditions: the TRANSITION-Q. Child Care Health Dev. 2015 Jul;41(4):547-58. doi: 10.1111/cch.12207. Epub 2014 Oct 28. PMID: 25351414.
14. Nazareth M, Hart L, Ferris M, Rak E, Hooper S, van Tilburg MAL. A Parental Report of Youth Transition Readiness: The Parent STARx Questionnaire (STARx-P) and Re-evaluation of the STARx Child Report. J Pediatr Nurs. 2018 Jan-Feb;38:122-126. doi: 10.1016/j.pedn.2017.08.033. Epub 2017 Sep 21. PMID: 28941954.
15. Klein DA, Goldenring JM, Adelman WP. HEEADSSS 3.0: The psychosocial interview for adolescents updated for a new century fueled by media. Contemp Pediatr2014;31:16–28.
Lecturas recomendadas
- Calvo I, Antón J, Bustabad S, Camacho M, de Inocencio J, Gamir ML, et al. Consensus of the Spanish society of pediatric rheumatology for transition management from pediatric to adult care in rheumatic patients with childhood onset. Rheumatol Int 2015;35:1615–24.
- Foster HE, Minden K, Clemente D, Leon L, McDonagh JE, Kamphuis S, et al. EULAR/PreS standards and recommendations for the transitional care of young people with juvenile-onset rheumatic diseases Ann Rheum Dis 2017;76:
639–646. - Expósito Pérez L, Bethencourt Baute JJ, Bustabad Reyes S. Unidades de transición. Protoc diagn ter pediatr. 2020;2:413-418.
No existen conflictos de interés en la realización de este artículo.