Infecciones de las vías respiratorias
M.A. Zafra Anta.
Área de Neumología Pediátrica. Servicio de Pediatría, Hospital de Fuenlabrada, Madrid
Fecha de recepción: 21-09-2023
Fecha de publicación: 31-10-2023
Adolescere 2023; XI(3): 6-28
Resumen
|
La etiología más frecuente de las infecciones respiratorias de vías altas es la vírica. También son habituales en infecciones de vías bajas. Las infecciones de vías altas son la causa más frecuente de prescripción antibiótica en las consultas de Pediatría. Para guiar el tratamiento de faringoamigdalitis, otitis media aguda, sinusitis aguda, bronquitis y neumonía y sus complicaciones se recomienda tener en cuenta los protocolos de sociedades científicas y locales. La pandemia COVID ha ocasionado cambios en el predominio de ciertos virus, así como en su presentación estacional. La bronquitis aguda es casi siempre autolimitada, y de causa viral. La neumonía aguda de la comunidad (NAC) es una entidad frecuente en el adolescente, la mayoría de los casos se pueden tratar de forma ambulatoria. Los principales agentes bacterianos son S. pneumoniae (neumonía típica) y Mycoplasma p. y Chamydia p. (neumonía atípica bacteriana). Puede considerarse no realizar radiografía simple para el diagnóstico de NAC en el caso de manejo ambulatorio, sin complicaciones, en el adolescente sano. El tratamiento de elección de la NAC será monoterapia con amoxicilina, o bien un macrólido si hay datos de neumonía atípica. La decisión de hospitalizar a un adolescente con neumonía se basará en sus problemas médicos subyacentes y factores clínicos, incluyendo la severidad de la enfermedad. En el adolescente resultan claves: una vacunación adecuada y promover estilos de vida saludable, considerar y controlar las comorbilidades..
Palabras clave: Infecciones respiratorias altas; Bronquitis; Neumonía; Adolescente.
|
Abstract
|
Viruses are the most common etiologic agents of upper respiratory tract infections. They are also frequent in lower respiratory tract infections. Upper respiratory tract infections are the most frequent cause of antibiotic prescription in pediatric practices. It is recommended to take into account the protocols of scientific and local societies to guide the treatment of pharyngotonsillitis, acute otitis media, acute sinusitis, bronchitis, pneumonia, and their complications. The COVID pandemic has caused changes in the predominance of certain viruses, as well as changes in their seasonal presentation. Acute bronchitis is almost always viral and self-limited. Acute community-acquired pneumonia (CAP) is a frequent entity in adolescents; most cases can be treated on an outpatient basis. The main bacterial agents are S. pneumoniae (typical pneumonia) as well as Mycoplasma p. and Chlamydia p. (atypical bacterial pneumonia). Plain radiography may not be considered for the diagnosis of CAP in the case of uncomplicated outpatient management in the healthy adolescent. The treatment of choice for CAP will be amoxicillin monotherapy or a macrolide if there is evidence of atypical pneumonia. The decision to hospitalize an adolescent with pneumonia will be based on the underlying medical problems and clinical factors, including the severity of the disease. In adolescents, the following are key: adequate vaccination and promotion of healthy lifestyle, and consideration and control of comorbidities.
Key words: Upper respiratory infections; Bronchitis; Pneumonia; Adolescent.
|
Introducción
El futuro puede aportar diagnósticos virológicos rápidos y ecografía en Atención Primaria y en Urgencias, así como la mejora en el diagnóstico rápido etiológico en pacientes hospitalizados y en el diagnóstico de neumonía complicada
Las infecciones respiratorias agudas constituyen la patología infecciosa más frecuente tanto en el medio extrahospitalario como en el hospitalario. Globalmente constituyen el principal motivo de consulta en Atención Primaria, declarándose anualmente en nuestro país más de 18 millones de casos. La mayoría de los niños mayores y adolescentes tienen varias infecciones respiratorias al año. Asimismo, motivan un importante número de consultas en Urgencias e ingresos en nuestros hospitales(1-5).
Las infecciones respiratorias son un conjunto de enfermedades producidas por virus o bacterias que afectan a la estructura del aparato respiratorio a nivel alto o bajo. En este capítulo revisaremos los aspectos diferenciales o de mayor significación en la población adolescente, de 10 años en adelante. Según predomine la afectación, se habla de:
- Infecciones de Vías respiratorias altas: faringoamigdalitis, rinofaringitis, laringitis, sinusitis, otitis media aguda, otitis externa, mastoiditis, síndrome pertusoide, adenitis cervical. También se revisan: parotiditis aguda y recurrente.
- Infecciones de Vías respiratorias bajas: bronquitis y neumonías.
La pandemia COVID ha impulsado cambios en la actividad de los virus respiratorios comunes(6) y la necesidad de implantar un sistema para la vigilancia sindrómica de las infecciones respiratorias agudas con la finalidad de detectar y monitorizar la incidencia y características epidemiológicas y microbiológicas de la infección respiratoria producida por los patógenos circulantes en la comunidad (gripe, COVID-19 y virus respiratorio sincitial –VRS-) (véanse los informes epidemiológicos semanales de las Comunidades Autónomas).
La adolescencia es considerada frecuentemente como una etapa de buena salud; pero hay condicionantes sociales, sanitarios como comorbilidades, enfermedades crónicas y conductas grupales y personales que pueden incidir en la carga de enfermedad de las infecciones respiratorias en esta edad y posteriormente en la edad adulta. Sin embargo, se han investigado relativamente poco de forma diferenciada en este grupo etario. Son enfermedades de alta morbilidad, cierto impacto escolar, lúdico, deportivo y laboral, y no hay que olvidar que incluso tienen cierto porcentaje de mortalidad en países en desarrollo o áreas de pobreza y deprivación infantil; allí la carditis reumática todavía existe, y la neumonía puede tener importantes complicaciones si no es tratada y controlada adecuadamente(1,4,7,8).
En nuestro medio, debemos prestar especial atención a adolescentes migrantes, su conducta social, lúdica, deportiva, actividad con grupos de iguales, adicciones, posibilidades de supervisión médica y en Atención Primaria, vacunaciones, comorbilidades (no olvidemos los menores no acompañados)(1,7).
Los Estados deben conocer las necesidades de salud y de desarrollo específico de los adolescentes y las personas jóvenes, así como sus derechos. Es importante el fortalecimiento de los programas de educación en salud, programas de vacunación, el uso adecuado de antimicrobianos, la actividad física, la nutrición y la atención a la salud mental; todo ello ayuda a mejorar la salud global del adolescente, y de toda la población en general(1-8).
Rinofaringitis
El catarro de vías altas, rinofaringitis aguda o resfriado común es la enfermedad infecciosa más frecuente en Pediatría, especialmente en menores de 3 años. Su benignidad es aparente, por cuanto la mayoría son leves y autolimitadas, si bien pueden favorecer la aparición de infecciones bacterianas en vías respiratorias(1-4).
Los virus más frecuentes son rinovirus, y actualmente también coronavirus comunes y el SARS CoV-2. Además: VRS, adenovirus, influenza, parainfluenza, bocavirus, y otros. También provocan infección respiratoria de vías bajas.
En el tratamiento, en general, no son relevantes los anticatarrales(5) (antitusivos, antihistamínicos, descongestivos, mucolíticos), aunque por encima de los 12 años los antitusígenos están aprobados para su uso en el alivio de los cuadros no complicados más molestos. La miel podría utilizarse para mejorar la tos.
Faringoamigdalitis
El estreptococo β-hemolítico del grupo A es el principal agente etiológico de las faringoamigdalitis (FAA) bacterianas. En los casos en los que no se pueden realizar los test de diagnóstico rápido de detección del estreptococo, se sobrediagnostican las faringoamig-dalitis como causadas por este germen y por consiguiente son sobretratadas con antibióticos
La causa más frecuente de la faringoamigdalitis aguda (FAA) es vírica. La bacteria más frecuente es el estreptococo betahemolítico grupo A (EBHGA, o GAS en sus siglas en inglés) o estreptococo pyogenes. El interés diagnóstico principal es identificar las faringitis causadas por GAS para optimizar el uso de antibióticos, y por el riesgo de complicaciones supurativas y no supurativas(9-10), así como limitar su contagio a la comunidad.
La FAA por EBHGA afecta con incidencia máxima entre los 5 a 15 años (entre 10,3-40 % de las FAA). Más frecuente en invierno y primavera, y según zonas geográficas incluso.
Tiene importancia saber que hay infecciones por otras bacterias que pueden estar relacionadas con faringitis o infecciones y complicaciones locales en adolescentes y adultos jóvenes, aunque mucho menos frecuentes que la FAA por EBHGA(11):
- Estreptococos grupos C y D. No relacionados con la fiebre reumática, sí con infecciones periamigdalinas.
- Mycoplasma pneumoniae y Chlamydia pneumoniae. Suelen estar asociados a bronquitis y neumonía además.
- Arcanobacterium haemolyticum. El 50 % presenta un exantema escarlatiniforme; responde a macrólidos.
- Fusobacterium necrophorum. Gram negativo, anaerobia, en ocasiones involucrada en amigdalitis recurrente, puede progresar a absceso periamigdalino, infecciones profundas y tromboflebitis séptica de la vena yugular interna.
- Neisseria gonorrhoeae. En adolescentes sexualmente activos.
- Otras: Francisella tularensis y Corynebacterium diphtheriae.
- No considerados patógenos en faringe: Hib, S. pneumoniae, S. viridans, S. aureus, M. catarrhalis.
Virus: Adenovirus, coronavirus, incluido el SARS-CoV2 en la actual pandemia desde 2020, rinovirus, VRS, coxackie, Epstein-Barr, influenza y parainfluenza, metapneumovirus, VIH.
La mononucleosis infecciosa causada por el virus de Epstein-Barr, enfermedad clásica por sus síntomas en la adolescencia, se caracteriza por fiebre, faringoamigdalitis, adenopatías laterocervicales (75 %) y hepatoesplenomegalia (35 %)(9-10). En ocasiones, también se asocia a astenia y edema periorbitario, que se presenta casi exclusivamente en niños. Otros síntomas asociados son tos, mialgias, artralgias y náuseas. Puede llegar a requerir hospitalización (complicaciones, dificultad para ingesta, respiratoria, etc.).
Clínica
Como la presentación clínica de la FAA no predice el agente etiológico, cuando se sospeche una infección por EBHGA, el diagnóstico debería estar basado en un test rápido de detección de antígenos
Los síntomas de la FAA varían mucho, desde muy leves hasta intensos. En los niños mayores y adolescentes, el inicio es súbito con fiebre e inflamación faríngea, acompañadas de cefalea y malestar.
Los signos físicos: fiebre, crecimiento amigdalino con exudados, edema, eritema, hiperplasia linfoide de la faringe, ganglios linfáticos cervicales anteriores sensibles y petequias en paladar blando(5,9,10).
Diagnóstico
Como la presentación clínica de la FAA no predice el agente etiológico, cuando se sospeche una infección por EBHGA, el diagnóstico debería estar basado en un test rápido de detección de antígenos si se dispone de él, lo más frecuente en nuestras consultas y servicios de Urgencias, o en un cultivo de exudado faríngeo(5,9,10).
La utilización de los test rápidos debe ser según intención de tratar.
Las escalas de predicción clínica, según el protocolo actual de la sociedad de Infectología de la AEP(10) no permiten obviar la necesidad de estudios microbiológicos por su baja sensibilidad (64-94 %) y especificidad (40-88 %). Si bien, el algoritmo de decisión que plantea esta sociedad incluye niños de 3 a 15 años, y propone utilizar la escala de Mc Isaac en caso de no disponer de test rápido.
Diagnóstico diferencial
Entre los virus: Epstein-Barr (analítica de sangre con linfomonocitois, elevación de transaminasas, Paul Bunnell, disponible en urgencias), adenovirus, herpes simple, enterovirus, influenza y parainfluenza.
Se dispone de test rápido para VRS, Gripe y COVID; PCR: Reacción en cadena de la polimerasa para un panel de virus progresivamente disponible en algunos hospitales (adenovirus, enterovirus…).
En diagnóstico diferencial o cuadros de afectación del estado general puede ser útil la realización de hemograma y PCR (EBHGA eleva los reactantes de fase aguda, también el adenovirus).
Tratamiento
EBHGA sigue siendo universalmente sensible a la penicilina. De elección en niños es la penicilina V oral, administrada dos o tres veces al día durante 7-10 días
EBHGA sigue siendo universalmente sensible a la penicilina. De elección en niños es la penicilina V oral, administrada dos o tres veces al día durante 7-10 días.
Pautas cortas de siete días se consideran efectivas en la mayoría de los casos si no existen factores de riesgo, en países con baja incidencia de fiebre reumática y cuando la erradicación bacteriológica no sea prioritaria(5,8,10).
Penicilina V oral 250 mg/12 h en niños < 30 kg 7-10 días
500 mg/12 h en niños > 30 kg 7-10 días
Penicilina benzatina IM dosis única (600.000 U niños <30 kg, 1,2 MU en >30Kg o niños mayores y adultos). Es doloroso pero garantiza el cumplimiento.
Amoxicilina oral: una dosis al día (50 mg/kg, máximo para esta indicación 1 g) 7-10 días. Para algunos autores es también primera opción por su posología, palatabilidad y absorción más predecible.
En alérgicos a la penicilina: Cefalosporinas de 1ª generación: (cefalexina o cefadroxilo). Son una primera alternativa en caso de alergia retardada no grave a penicilina.
En caso de alergia inmediata o grave: Macrólidos (josamicina, máximo 1 gramo en 24h; o bien diacetildimecamicina, máximo 1,8 g cada 24h; o azitromicina, máximo 500 mg c/24h).
Ante fracaso terapéutico bacteriológico y en el estado de portador se utilizarán: clindamicina (el más erradicador, máximo 1,8 g en 24h), o bien fenoximetilpenicilina más rifampicina, o amoxicilina/clavulánico o cefadroxilo (máximo 2 g en 24h).
El cotrimoxazol no erradica el estreptococo betahemolitico del grupo A. Hay cerca de 20 % de resistencias de neumococo y haemophilus.
Para indicaciones del tratamiento de portadores de EBHGA, indicaciones para solicitar cultivo, dosis de otros antibióticos o fármacos, véase protocolo AEP y otros(5,9,10).
Complicaciones
Las complicaciones supurativas: celulitis, absceso periamigdalino, retrofaríngeo, linfadenitis cervical supurativa, otitis media aguda y sinusitis aguda. Fascitis necrotizante. Sistémicas: meningitis, sepsis, shock séptico estreptocócico.
Las complicaciones no supurativas tardías de la faringitis estreptocócica son: fiebre reumática aguda (se previene con antibioterapia iniciada en los 9 días desde el inicio) y glomerulonefritis aguda (no se previene con el tratamiento antibiótico).
PANDAS. Pediatric Autoinmune Neuropsychiatric Disorders Associated with streptococcal infection
Hace unos años se propuso la posible relación de EBHGA y trastornos autoinmunes neuropsiquiátricos: Tics y trastornos obsesivo-compulsivos (TOC) de presentación brusca, con posterioridad ampliado a hiperactividad, anorexia, déficit de atención. Sobre todo en la edad de 3-12 años. Desde 2010 hay publicaciones que no encuentran esta asociación en la mayoría de los casos.
El diagnóstico de PANDAS no está aún aceptado como una entidad independiente y tampoco se contempla en la CIE-10, ni en el DSM-IV. En DSM 5 lo cita en “TOC relacionados a otra condición médica”, pero dice que es “controvertido, aunque hay un cuerpo de evidencia”.
Adenitis cervical
En adolescentes con adenopatía cervical, la frecuencia de tumores es superior respecto a edades inferiores
Las adenopatías en niños pequeños se deben mayoritariamente a procesos infecciosos, la mayoría autolimitados, como una infección viral. En algunos casos, como la adenitis cervical supurativa por S. aureus o estreptococo pyogenes requieren tratamiento antibiótico(12).
En adolescentes con adenopatía cervical, la frecuencia de tumores es superior respecto a edades inferiores.
Por otro lado, en un paciente con adenopatías subagudas/crónicas, especialmente en adolescentes, hay que considerar la posibilidad de infección por VIH.
Abscesos cervicales profundos del cuello
En la mayoría de los casos existe un antecedente de infección a nivel de vía respiratoria alta (hasta en el 50 % de los casos) u odontógena. Las cadenas linfáticas cervicales profundas reciben el drenaje de los territorios nasofaríngeo, adenoideo, nasal posterior y de oído medio. Suele tratarse de una infección polimicrobiana(5,12), y participan sobre todo Gram positivos EBHGA y S. aureus, con anaerobios e incluso Gram negativos y, de forma más rara, micobacterias.
Las infecciones cervicales profundas se originan en la mayoría de ocasiones en Pediatría en ganglios de estos territorios, que pueden evolucionar a la abscesificación, como los abscesos parafaríngeos y retrofaríngeos. También su origen pueden ser lesiones benignas o malformaciones, como quistes cervicales y fístulas del seno piriforme. (Véase Figura 1).
Los ganglios del espacio retrofaríngeo comienzan su involución a partir de los cinco años y se atrofian hacia la adolescencia
Los ganglios del espacio retrofaríngeo comienzan su involución a partir de los cinco años y se atrofian hacia la adolescencia, lo cual explica el predominio de estos cuadros en preescolares. La infección retrofaríngea en niños mayores y adultos puede ser el resultado de un traumatismo faríngeo posterior y no por extensión linfática.
El espacio parafaríngeo se divide en compartimento anterior y posterior. El síndrome de Lemierre (tromboflebitis séptica de la vena yugular interna) es una complicación por contigüidad derivada de la infección en el compartimento posterior tras una faringoamigdalitis complicada.
La infección en el espacio submandibular es conocida como angina de Ludwig, que es bilateral y se origina en el suelo de la boca.
PFAPA. Periodic Fever with Aphthous stomatitis, Pharyngitis and Adenitis (PFAPA syndrome)
Inicio entre los 2 y los 5 años, generalmente desaparece a los 10 años. Desaparecen las recurrencias. Aunque hay algún caso descrito en mayores de 10 años e incluso en adultos.
En el PFAPA de etiología desconocida, la respuesta a prednisona sugiere una disregulación de citoquinas
Etiología es desconocida. La respuesta a prednisona sugiere una disregulación de citoquinas. Es una enfermedad autoinflamatoria, un cuadro de fiebre periódica.
Tratamiento: depende de la frecuencia e intensidad de los brotes. La prednisona baja rápidamente la fiebre (1-2 mg/kg/día, 1-3-4 días). Se ha propuesto incluso como criterio diagnóstico. Aunque en 25 % de pacientes acorta el intervalo entre episodios.
Cimetidina, ensayarla si no responde a prednisona o hay muchas recurrencias (20 a 40 mg/kg/día, en 2 dosis c/12 h). Si hay respuesta, mantenerla al menos 6 meses.
Colchicina es otra opción. Amigdalectomía en los que no responden.
Otitis media aguda
Es una enfermedad más frecuente en lactantes y preescolares. Si hay sintomatología aguda se habla de otitis media aguda (OMA); si no hay síntomas, se conoce como otitis media secretora, con derrame o con efusión (OME las siglas en inglés)(3,5,13). Antiguamente se usaba el término “serosa”.
Para la anatomía del oído, véase la Figura 2.
Los síntomas de otitis media en adolescentes son dolor, hipoacusia, membrana timpánica abultada y eritematosa y puede haber otorrea
Los signos y síntomas clásicos de otitis media aguda en adolescente son: dolor en uno o ambos oídos (otalgia, a veces intensa), hipoacusia, membrana timpánica abultada y eritematosa. Puede haber otorrea (secreción). La fiebre generalmente no se produce; será más probable por el cuadro catarral o gripal acompañante o si hay complicaciones.
Signos y síntomas de la otitis media crónica incluyen daño auditivo (hipoacusia), perforación de la membrana timpánica y otorrea prolongada.
Etiología
Las bacterias son los principales agentes:
Las más frecuentes en todos los grupos de edad son S pneumoniae (25-40 %), H influenzae no tipable (15-25 %) y Moraxella catarrhalis (12-20 %). Han disminuido la frecuencia de sinusitis y otitis tras la extensión de la vacuna neumocócica conjugada.
Las menos frecuentes: Streptococcus pyogenes (forma aguda), S aureus, P aeruginosa o micobacterias (forma crónica).
Otros: 1-3 %. Anaerobios. E. coli, colibacilos, proteus. Pseudomonas aeruginosa. Alloiococcus otitidis (Alloiococcus parece implicado en la otitis media serosa, forma biofilms con facilidad) y Turicella otitidis (en debate).
En la miringitis bullosa, particularmente dolorosa, se citaba la partipación de M. pneumoniae, pero no es un agente predominante(3,5,13,14).
Los virus no son causas directas importantes de otitis media; pueden afectar en coinfección con bacterias. Las infecciones virales de la vía respiratoria superior a menudo causan obstrucción de la trompa de Eustaquio, lo que facilita que las bacterias se multipliquen en el espacio del oído medio.
Factores predisponentes en la edad adolescente, de OMA y de OME: exposición a humo de tabaco, alergia, barotrauma, inmunodeficiencia, síndrome de Down, defectos estructurales que afecten a la trompa de Eustaquio (paladar hendido por ej.), o disfunción ototubárica (tejido adenoideo hipertrófico, tumores), infecciones respiratorias altas, gripe, sinusitis, no vacunación de neumococo(13,14).
Diagnóstico
El diagnóstico de OMA se realiza con la otoscopia y timpanometría. La movilidad reducida o alterada de la membrana timpánica puede valorarse con un otoscopio neumático
El diagnóstico se basa en síntomas y otoscopia: inicio rápido, signos y síntomas de inflamación del oído medio, y derrame.
Causas de otalgia no debidas a OMA: otitis externa, faringitis, flemón dentario, ototubaritis, miringitis.
La otoscopia y timpanometría se usan para establecer una base para el diagnóstico. La movilidad reducida o alterada de la membrana puede valorarse con un otoscopio neumático; aunque no se suele hacer en nuestra pediatría asistencial habitual, ni siquiera por los especialistas ORL.
Para imagen de otitis media, véase la figura 3.
La distensibilidad de la membrana timpánica puede confirmarse de manera objetiva con un timpanómetro. Aunque no se suele hacer en pediatría asistencial habitual, muchos autores abogan por la timpanometría en caso de dudas, especialmente en Primaria o en Urgencias. Objetiva la presencia de derrame, no permite diferenciar OME y OMA. No es dolorosa y muy bien aceptada por los pacientes(3).
La aspiración con aguja y cultivo del contenido del oído medio es el método más seguro para confirmar la presencia de infección, puede usarse para identificar el germen causal. Este procedimiento sólo es necesario en raras ocasiones (no respuesta a tratamiento, inmunidad alterada)(3,14).
Tratamiento
Los antibióticos no se utilizan para el tratamiento de enfermedades virales y no alteran su curso. El uso innecesario de antibióticos expone indivi-dualmente a reacciones alérgicas, erupción cutánea y efectos secundarios, además de alterar la flora microbiana; y a nivel comunitario ello fomenta la frecuencia de resistencias bacterianas
Se recomienda un manejo según protocolos. Hay importantes similitudes en el manejo de la OMA en Europa(15). Las directrices elaboradas a nivel central y adaptadas a los pacientes, así como a los patrones locales de resistencia a los antimicrobianos, pueden ofrecer recomendaciones más específicas, reducir la administración innecesaria de antibióticos y contribuir a reducir la propagación de la resistencia a los antibióticos.
La observación sin antibacterianos y con control analgésico es una opción cuando no hay certeza diagnóstica, hay garantía de seguimiento, no hay síntomas de intensidad-gravedad y en paciente pediátrico de > 6 meses de edad(3,5,13).
Se recomienda el tratamiento antibiótico inmediato si hay síntomas intensos, si el cuadro es bilateral, si es supurada, si es recurrente, o hay inmunodepresión, con un antecedente de tratamiento antibiótico reciente, hospitalización previa o en ciertas comorbilidades. Esto especialmente en niños <24 meses; pero también por encima de los 12 años en algunos protocolos. De hecho, algunos autores recomiendan tratar con antibioterapia a todos los adultos(14).
Por tanto, tratar según protocolos. No a todas las OMA.
En niños y adolescentes hasta los 15 años, la primera elección en caso de precisar antibioterapia sería amoxicilina oral, 5-7 días, 500 mg cada 8 horas.
En adultos, y adolescentes mayores, en caso de antibioterapia puede optarse por amoxicilina-clavulánico como primera opción(14) a dosis 875 mg amoxicilina/125 mg de clavulánico, dos veces al día. O bien, si el riesgo es más alto, se puede plantear dosis más altas, dos veces al día: 1000/62,5 o hasta 2 g/125 mg(14).
Si no hay respuesta a la amoxicilina, se emplean regímenes antibióticos alternativos que incluyen amoxicilina-clavulánico (80-90 mg/Kg/día), cefuroxima axetil (30 mg/kg/día), cefpodoxima o cefdinir. En alérgicos puede usarse azitromicina o claritromiciana o eritromicina-sulfisoxazol o levofloxacino. El levofloxacino no cubre H. influenzae no tipable. Una sola inyección IM de ceftriaxona también es adecuada para el tratamiento de la OMA.
Duración del tratamiento de OMA: 5 a 7 días en niños > 2 años; 10 días en niños < 2 años y casos especiales a otras edades. La OME no requiere antibióticos. El tratamiento puede estar indicado si el derrame persiste 3 meses o más.
La profilaxis antibiótica, durante 3 a 6 meses, se reserva según indicación del especialista ORL, para la OMA recurrente.
En OMA supurada no parece haber mejoría añadiendo al tratamiento oral, gotas antibióticas tópicas. En caso de su uso, es recomendable evitar antibióticos ototóxicos
En OMA supurada no parece haber mejoría añadiendo al tratamiento oral, gotas antibióticas tópicas. En caso de uso de antibiótico tópico en gotas, puede ser recomendable evitar antibióticos ototóxicos.
Como complicaciones de la otitis estaría la mastoiditis, otras se han reducido drásticamente en la actualidad desde el uso de antibióticos(3,13,14,16). Pero no hay que olvidarlas: petrositis, laberintitis, parálisis facial, meningitis, absceso cerebral.
La mastoiditis debe sospecharse ante una OMA con dos o más de lo siguiente: desplazamiento del pabellón auricular, edema y borramiento del surco retroauricular, dolor a la palpación en zona mastoidea o fluctuación local.
Por su gravedad el diagnóstico y tratamiento debe ser hospitalario. Consultar con ORL y valorar estudio de imagen. El tratamiento será con amoxicilina-clavulánico, cefotaxima y valorar añadir metronidazol o clindamicina(13).
En una revisión sistemática reciente se considera que el tratamiento conservador tiene una alta eficacia como tratamiento de primera línea en los casos no complicados de mastoiditis aguda. La mastoidectomía puede ser el tratamiento más definitivo disponible, sobre todo en caso de absceso subperióstico(16).
Vigilar la evolución a otitis crónica (OME dura 1 mes en 40 %, y 3 meses en 10 %). Hay que asegurar un control evolutivo tras el tratamiento. Se recomienda evitar viajes en avión cuando hay derrame ótico, por el potencial barotrauma.
En OME recurrente o unilateral prolongada, se debe remitir al especialista ORL, para considerar descartar obstrucción ototubárica
En OME recurrente o unilateral prolongada, se debe remitir a especialista ORL, para considerar descartar obstrucción ototubárica (hipertrofia adenoidea o por carcinoma nasofaríngeo, otros tumores)(14).
Otitis externa
La otitis externa (oído de nadador) es la inflamación del conducto auditivo externo (CAE), casi siempre causada por S aureus. Otros agentes incluyen P aeruginosa y E coli. A menudo hay secreción purulenta por el conducto y dolor ligero. El tratamiento consiste en gotas antibióticas óticas(3).
Otitis externa necrotizante. Infección del cartílago y del hueso del CAE. Afecta a lactantes, diabéticos e inmunodeprimidos. Es causada habitualmente por Pseudomonas y se caracteriza por: fiebre, mal estado general, toxicidad, necrosis del conducto auditivo, extensión a oído medio e interno, parálisis facial y afectación del SNC. El tratamiento requiere hospitalización y tratamiento quirúrgico.
Sinusitis
La sinusitis puede ser aguda, según se resuelva antes de 30 días, o crónica, si tarda más de 3 meses en curarse. También hay una forma aguda recurrente
Es la inflamación de la mucosa que recubre los senos paranasales, puede ser aguda, según se resuelva antes de 30 días, o crónica, si tarda más de 3 meses en curarse. También hay una forma aguda recurrente(5,17).
Los factores predisponentes a una sinusitis aguda incluyen infección viral de vía respiratoria superior (hay componente de afectación sinusal hasta en el 0,5-2 % de cuadros catarrales), alergia (rinitis alérgica) y asma. Otros factores que contribuyen son enfermedad periodontal, cambios rápidos de altitud, natación, traumatismo, exposición al tabaco.
Factores predisponentes a sinusitis crónica incluyen: defectos anatómicos, alergia, pólipos nasales, déficits inmunológicos, FQ, disfunción ciliar, reflujo gastroesofágico, cocaína, cuerpos extraños, intubación nasotraqueal o sondas nasogástricas.
Etiología
AGUDA: Los microorganismos predominantes incluyen S pneumoniae (30 %), cepas no encapsuladas de H influenzae (20 %) y M catarrhalis (20 %).
CRÓNICA: H. influenzae, estreptococos α- y β-hemolíticos, M. catarrhalis, S. pneumoniae y estafilococos coagulasa negativos.
En los pacientes gravemente inmunodeprimidos, se deben tener en cuenta también las infecciones por hongos, como las causadas por Mucorales (mucormicosis) o Aspergillus ssp. (aspergilosis invasiva). Son infecciones graves y potencialmente letales.
Diagnóstico
La sinusitis se caracteriza por la presencia de dos o más síntomas, uno de los cuales debe ser congestión u obstrucción nasal, o rinorrea (anterior o posterior).
La clínica puede ser según tres patrones(5,17): persistencia de síntomas de cuadro catarral, síntomas intensos 3-4 días o empeoramiento mientras está en fase de mejoría. La persistencia de síntomas de infección respiratoria alta es la más frecuente, con rinorrea espesa y tos, durante > 10-14 días y menos de 30 días sin mejora. También debe plantearse ante un empeoramiento de los síntomas en la evolución de un catarro común, en especial si se produce a partir de los 6-7 días de evolución.
Además, puede cursar con dolor local, sensación de presión facial, tos y pérdida parcial o total del sentido del olfato. Los niños mayores y adolescentes presentan clínica más específica, con cefalea y dolor o presión facial en el área del seno paranasal afecto, que se incrementa al inclinar la cabeza hacia delante, pudiendo irradiar el dolor hacia la mandíbula. La rinorrea, la halitosis y la voz nasal o cambios en la voz pueden ser muy relevantes para el adolescente en su vida habitual.
Las radiografías (proyección de Waters para los senos maxilares), en general, no están indicadas para el diagnóstico de sinusitis aguda
Las radiografías (proyección de Waters para los senos maxilares), en general, no están indicadas para el diagnóstico de sinusitis aguda. No hay que solicitarlas si la sospecha es de sinusitis no complicada. Hay que interpretarlas con precaución, ya que incluso un resfriado común puede causar evidencia radiográfica de sinusitis. Una radiografía normal excluye el diagnóstico.
Actualmente es muy útil la valoración por especialista ORL, con rinoscopia y visualización de exudado en el meato.
La TC se reserva para pacientes en los que se considere la cirugía: no mejoría con tratamiento médico o sospecha de presencia de complicaciones
La tomografía computarizada (TC) se reserva para pacientes en los que se considere la cirugía: no mejoría con tratamiento médico o sospecha de presencia de complicaciones. Son imágenes de sinusitis con TC: opacificación, engrosamiento de la mucosa (> 4mm), o presencia de un nivel de líquido, además de las complicaciones. No diferencian entre bacterianas, virales, o alérgicas.
También, si está disponible, tiene utilidad una ecografía portátil de senos.
La aspiración sinusal y cultivo permiten identificar la causa microbiana específica de la sinusitis. Rara vez es necesaria para confirmar el diagnóstico en niños, salvo en inmunodeprimidos o circunstancias especiales.
Puede ser preciso el ingreso en niños con aspecto séptico, afectación del estado general, fracaso persistente del tratamiento por vía oral o con complicaciones (valorable en celulitis preseptal).
Tratamiento
El tratamiento de elección para la OMA y la sinusitis, salvo que existan factores de riesgo o alergia, es la amoxicilina. A menor edad, y menos intensidad del cuadro puede considerarse “observar y esperar”. Cerca de los 18 años, y en adultos, hay mayor recomendación de antibioterapia, y considerar amoxicilina-clavulánico de primera elección
Muchos autores recomiendan no comenzar con tratamiento antibiótico en aquellos niños que, a pesar de tener síntomas durante más de 10 días, no intensos, presenten una clara evolución favorable. Actitud expectante y vigilar la evolución(5,17).
Pueden ser adyuvantes los corticoides nasales y las irrigaciones con suero salino en los adolescentes, sobre todo de más edad.
La antibioterapia es similar al de la otitis, en elección y dosis:
Amoxicilina: 80 mg/kg/día, cada 8 h, 10 días (VO) (o 7 días más tras la mejoría de los síntomas).
En pacientes con factores de riesgo, o fallo terapéutico con amoxicilina se propone: Amoxicilina-clavulánico: 80 mg/kg/día, c/8h, 10 días (VO). Máximo 3-4 g al día.
Segunda línea(5,17): cefuroxima axetilo: 30 mg/Kg/día, o bien Ceftriaxona im o levofloxacino.
Constituyen factores de riesgo de evolución desfavorable: sinusitis frontales y esfenoidales, enfermedad moderada o severa, inmunodeprimidos o con enfermedades crónicas. Y también se debe tener en cuenta la antibioterapia previa reciente, la no vacunación de neumococo o residir en áreas con >10 % de resistencias del neumococo.
La irrigación sinusal o drenaje quirúrgico de los senos están indicados en pacientes que no responden al tratamiento antimicrobiano o en aquellos con complicaciones intraorbitarias o intracraneales, como celulitis orbitaria, trombosis del seno cavernoso, meningitis o absceso cerebral. Para el diagnóstico y tratamiento de complicaciones extra e intracraneales, véanse los protocolos de la AEP(17).
Complicación de sinusitis con absceso subperióstico
El absceso subperióstico secundario a sinusitis frontal se denomina tumor inflamatorio de Pott. Se presenta con fiebre, cefalea e inflamación fluctuante de la frente, y es característico en adolescentes
Aparece sobre todo en niños mayores, por afectación ósea (osteítis) de senos maxilares, etmoidales o frontales. Los abscesos subperiósticos de senos maxilares y etmoidales suelen afectar a la órbita, con desplazamiento del globo ocular hacia abajo y lateralmente, así como limitación de los movimientos oculares y de la agudeza visual. El absceso subperióstico secundario a sinusitis frontal se denomina tumor inflamatorio de Pott. Se presenta con fiebre, cefalea e inflamación fluctuante de la frente, y es característico en adolescentes. Requiere antibioterapia intravenosa y drenaje quirúrgico con desbridamiento del hueso necrótico. En muchos casos, existe asociación con complicaciones intracraneales simultáneas, especialmente absceso epidural. Es frecuente en estos casos el aislamiento de Streptococcus spp. (S. constellatus, S. intermedius o S. anginosus).
Laringitis infecciosa
La laringitis infecciosa, a menudo, se incluye como parte del síndrome de crup. En la práctica clínica, el término crup suele usarse para describir la laringotraqueítis aguda (crup viral) y la laringitis espasmódica aguda (crup espasmódico). Afecta más a menores de 5-8 años(5).
Las recurrencias disminuyen con la edad y el crecimiento de la vía aérea.
Etiología
La laringotraqueítis aguda se produce sobre todo por virus respiratorios, más a menudo virus parainfluenza, (75 % de los casos), en epidemias bianuales. En otro caso casi siempre se relaciona con el resfriado común e influenza.
Diagnóstico
El crup es un diagnóstico clínico y no requiere pruebas complementarias. La gravedad se valora con escalas de puntuación: Taussig o Westley, en números de menor a mayor, según el grado de afectación.
Su importancia radica en el diagnóstico diferencial del crup y el estridor: epiglotitis, traqueítis bacteriana, crup diftérico (el último caso de difteria en Cataluña fue en 2015), el crup sarampionoso puede ser fulminante, aspiración de cuerpo extraño, absceso cervical, angioedema, compresión de la vía aérea, daño en cuerdas vocales, neuropatía bulbar, angioma subglótico, etc.(5)
Tratamiento
En el tratamiento de la laringitis, los corticoides sistémicos: reducen la probabilidad de hospitalización y acorta la estancia
Para el crup viral sobre todo es de apoyo, buscando la mejoría del intercambio aéreo.
El aire frío de la noche parece beneficioso, pero la Cochrane no apoya el uso de vapor frío en el servicio de urgencias, y el frío puede empeorar el broncoespamo.
Los corticoides sistémicos reducen la probabilidad de hospitalización y acorta la estancia.
Dexametasona oral o i.m. dosis única de 0,6 mg/kg en moderado-grave; menor dosis en leve-moderada 0,15 mg/kg. Máximo 8-10 mg. La alternativa es Prednisolona oral: 1 mg/kg en dosis única diaria, hasta un total de 30-40 mg, durante 1-3 días(5,18).
Budesonida nebulizada en caso de vómitos, 2 mg parece tener un efecto clínico equivalente a dexamentasona, inicio de efecto rápido, pero más corto.
Adrenalina en laringitis moderada-grave, dosis L-adrenalina (0,5 ml/kg al 1‰, máximo 5 ml, se añadiría hasta 5 ml con SSF) 3 ml de SSF. La duración del efecto es < 2 h. Por lo tanto, la observación unas horas es obligatoria.
Los antibióticos no están indicados en el crup.
Medicamentos para la tos y el resfriado no deben utilizarse en niños <12 años de edad.
Laringotraqueobronquitis o traqueítis bacteriana
Es mucho menos frecuente que la laringotraqueítis o la laringitis espasmódica aguda, pero es más grave. A menudo se debe a una combinación de patógenos respiratorios bacterianos y virales. Es frecuente la obstrucción traqueal grave con secreción copiosa y espesa.
Causa. Virus parainfluenza o influenza y a menudo hay infección concomitante bacteriana que incluye S aureus, S penumoniae o H influenzae tipo b.
Clínica. Por lo general, el inicio es similar al de la laringotraqueítis, pero deriva en una enfermedad más grave.
Tratamiento. El tratamiento es semejante al de la laringotraqueítis aguda, excepto por los esteroides y la adrenalina racémica, con inclusión de antibióticos. Casi siempre es necesaria la intubación con aspiración vigorosa de la vía respiratoria para extraer secreciones.
Tos ferina
Se trata de una infección respiratoria aguda, de larga evolución, de etiología bacteriana, la bordetella. Caracterizada por inflamación traqueobronquial(4,5).
La clínica clásica es accesos típicos de tos violenta y paroxística, sensación de asfixia y “gallo inspiratorio”. A veces acompañado de vómitos y/o pausas de apnea más significativas en lactantes pequeños. Los accesos aparecen tras un periodo corto de síntomas como de resfriado común.
La sintomatología puede estar presente, más o menos modificada en el vacunado. Los adolescentes y los adultos suelen pasar la infección con síntomas leves, o peor cuadro de tos si no se vacunaron; pueden ser responsables de la transmisión intrafamiliar o comunitaria a lactantes o embarazadas no, o no adecuadamente, vacunados.
Pensar en ella ante: tos prolongada de 2 semanas de duración o más. La tos ferina entraría en el diagnóstico diferencial de tos prolongada: cuerpo extraño bronquial, FQ (desde finales de la década del 2000 se hace cribado en recién nacidos en España), reflujo gastroesofágico, tuberculosis, asma, otras infecciones con tos pertusoide, víricas o Mycoplasma pneumoniae, sobre todo(4,5,7).
Ni la infección ni la vacuna confieren inmunización de por vida. No hay portadores crónicos.
El tratamiento antibiótico se debe iniciar ante la sospecha diagnóstica tras recogida de cultivo y PCR, sin esperar a la confirmación del laboratorio. Se debe realizar quimioprofilaxis a todos los contactos de riesgo, independientemente de su estado de vacunación.
Asistimos en los últimos años a una re-emergencia de la tos ferina. La vacunación del adolescente y el adulto es una estrategia fundamental en la prevención antipertussis(7). La actual vacunación de la embarazada en el tercer trimestre (en la 28-38 semana de gestación) confiere protección a los neonatos y lactantes pequeños con una efectividad del 90 %.
Parotiditis aguda
La parotiditis aguda o “paperas” o sialoadenitis vírica es una enfermedad contagiosa producida por paramyxovirus (RNA). Tiene especial afinidad por los tejidos glandulares y sistema nervioso. Hay un serotipo y 13 genotipos(19).
En la mayoría de las regiones europeas la población infantil tiene un alto porcentaje de vacunación (https://www.ecdc.europa.eu/en/mumps). En regiones del mundo sin buena cobertura vacunal y con malnutrición puede haber, especialmente en niños pequeños, complicaciones como neumonía y diarrea, incluso mortalidad. Véase un brote en Pakistán, diciembre-2012, con más de 100 muertos.
Confiere inmunidad de por vida aunque pueden existir ataques posteriores: con los años se pierde cierto grado de inmunidad, es por esto que la mayoría de los casos sintomáticos actualmente sean en adolescentes o adultos jóvenes, especialmente si no recibieron dos dosis de vacuna. Las vacunas se incluyen en la triple vírica o tetravírica (con varicela); son de virus vivos. Puede aparecer en ondas epidémicas, cada 3-5 años.
Clínica
Con la parotiditis puede haber complicaciones. A mayor edad es más frecuente una orquitis en pospúberes, hasta 25-40 %; más frecuentemente unilateral
Hasta un 40 % son formas subclínicas. Tras un periodo de incubación aparecen síntomas seudogripales y luego el período de estado, con tumefacción glandular salival.
Puede haber complicaciones: meningitis, más raramente encefalitis, sordera neurosensorial unilateral, pancreatitis, neumonía. A mayor edad, es más frecuente una orquitis en pospúberes, hasta 25-40 %; más frecuentemente unilateral. Requiere aislamiento y cese de actividad deportiva. La ooforitis es mucho menos frecuente. Y otras complicaciones neurológicas, digestivas, cardiacas, hematológicas, etc.(5,19).
En el primer trimestre del embarazo hay abortos hasta en 30 % de casos.
Diagnóstico
El diagnóstico es clínico. Puesto que es una enfermedad de declaración obligatoria y que puede producir brotes en la comunidad, debe hacerse un diagnóstico etiológico-virológico en todos los casos esporádicos. La detección de anticuerpos IgM o seroconversión de IgG no se hace salvo estudios epidemiológicos. Se suele emplear, en Urgencias hospitalarias: detección en muestra de saliva de ARN viral por técnicas de biología molecular (PCR)(5,19).
El diagnóstico diferencial será con la parotiditis bacteriana (purulenta, unilateral) litiasis de parótida, adenopatías de diverso origen, infeccioso o no, otras causas virales parainfluenza 3, coxsackie, influenza A, Epstein-Barr, adenovirus, herpes simple y herpes virus 6, VIH, citomegalovirus.
Causas no infecciosas de inflamación local incluyen: cálculos, tumores (adenomas pleomórficos, hemangiomas, carcinoma, sarcoidosis, síndrome de Sjögren, uso de tiazidas, yoduros, fenotiacinas. Malnutrición, procesos metabólicos (diabetes, cirrosis, uremia), mucocele.
Anecdótico: neumoparotitidis (soplar globos). Sobre todo tiene interés la parotiditis crónica recidivante o recurrente juvenil.
Tratamiento de la parotitis epidémica: no tiene antiviral. Se debe guardar reposo, medidas de dieta que no estimule secreción salival excesiva, antiinflamatorios (no se usa aspirina, en general, en <18 años para enfermedades comunes).
Tratamiento de las complicaciones. Pueden requerir hospitalización.
Parotiditis crónica recidivante o recurrente juvenil
Parotiditis crónica juvenil: inflamación de la glándula parótida en forma de 2 o más episodios separados por periodos asintomáticos, con sialectasias no obstructivas, en ausencia de enfermedad sistémica
Tumefacción de la parótida unilateral o bilateral (más frecuente bilateral)(19). Se normaliza con o sin tratamiento pero vuelve a aparecer.
Se produce inflamación de la glándula parótida en forma de 2 o más episodios separados por periodos asintomáticos, con sialectasias no obstructivas, en ausencia de enfermedad sistémica. Edad: 2-6 años. Tiende a desaparecer en la adolescencia, no siempre. Los brotes ceden en 2-5 días, generalmente. Causa multifactorial: factores hereditarios, anomalías congénitas de los ductos y factores alérgicos, postinfecciosos, tanto víricos como bacterianos, e inmunológicos.
Se deben descartar procesos autoinmunes, inmunodeficiencias, infecciones (VIH), obstrucción de conductos salivales, incluso tumorales; debe ser valorado por especialista ORL.
El diagnóstico es clínico, apoyado por ecografía, a veces con resonancia. La sialografía puede ser diagnóstica y terapéutica.
Bronquitis aguda
Etiología
Los patógenos causales de la Bronquitis Aguda (BA), en la mayoría de los casos son virus (>90-95 %)(4). Los virus que causan infección respiratoria tanto de la vía aérea superior como inferior, lo hacen en picos epidémicos a lo largo del año, según la climatología, con variabilidad geográfica, según las zonas. Tras las primeras oleadas de la pandemia COVID-19 se han producido alteraciones epidemiológicas en la presencia y el predominio estacional de algunos de los agentes habituales en otras épocas(6): rinovirus, VRS, influenza A y B, adenovirus, coronavirus, otros.
Clínica. Diagnóstico
La BA se presenta con fiebre, tos, sensación de dolor o de opresión en el tórax, disnea y expectoración en el niño mayor y en el adulto. Puede haber espiración alargada o sibilancias. La duración es desde pocos días hasta una-tres semanas. La BA puede ir acompañando a un cuadro catarral o de infección de vías respiratorias altas, o bien sucederla. Se le ha dado poca relevancia al estudio de la BA en pediatría.
El diagnóstico es fundamentalmente clínico, no precisa estudios complementarios salvo que se requiera realizar diagnóstico diferencial o en el paciente ingresado, especialmente si tiene factores de riesgo o datos de gravedad. Si hay distrés respiratorio debe medirse la saturación pulsioximétrica de oxígeno (SpO2). En caso de evolución prolongada o sospecha de complicaciones, se puede realizar una radiografía de tórax para plantear diagnóstico diferencial con otras infecciones del tracto respiratorio inferior, incluida gripe, tos ferina, y sobre todo con la BA bacteriana, neumonía, tuberculosis. También con asma, y otras patologías pulmonares o cardiacas(4,20).
Tratamiento
Para la bronquitis aguda en el adolescente se recomienda evitar el uso de antibióticos y hacer un seguimiento clínico en Atención Primaria. Las medidas generales y sintomáticas serán: hidratación, analgésicos-antipiréticos; si hay broncoespasmo, broncodilatadores como salbutamol o terbutalina. No se usan, en general, antitusígenos, antihistamínicos, mucolíticos. Los antihistamínicos podrían tener valor en adolescentes con rinitis alérgica asociada.
Seguimiento evolutivo
Hay dos aspectos de importancia en la BA:
- La alteración de la microbiota de vías respiratorias altas.
- La posible evolución a tos prolongada.
Si la tos húmeda se prolonga más de 4 semanas hay que considerar posibilidad de complicaciones, la evolución a bronquitis bacteriana persistente (BBP), véase más adelante. La tos prolongada puede necesitar diagnóstico diferencial con la posible existencia de patología pulmonar de base: asma, aspiración, bronquiectasias, apnea obstructiva de sueño, traqueomalacia, bronquiolitis obliterante, cuerpo extraño, etc.
Bronquitis aguda bacteriana
La bronquitis aguda bacteriana en pacientes pediátricos y adolescentes es poco frecuente, excepto en fumadores, pacientes inmunodeprimidos o con FQ u otras anomalías del sistema respiratorio. En ellos, la diferenciación temprana de la bronquitis bacteriana puede ser importante para evitar la progresión a una condición más grave.
Si no hay enfermedad de base, las bacterias que pueden causar la BA bacteriana suelen ser Mycoplasma y Chlamydia.
Si se precisa diferenciar bronquitis bacteriana de neumonía, además de la radiografía, pueden ser de utilidad el hemograma con neutrofilia en sangre. No se alteran otros reactantes de fase aguda, véase en el apartado de neumonía.
Bronquitis bacteriana persistente
La bronquitis bacteriana persistente (BBP) se produce por infección persistente o prolongada de la vía aérea inferior por bacterias patógenas. Se planteará ante una tos húmeda crónica (superior a 4 semanas), especialmente en menores de 6 años, pero puede ocurrir a todas las edades
La bronquitis bacteriana persistente (BBP) se produce por infección persistente o prolongada de la vía aérea inferior por bacterias patógenas, principalmente Haemophillus influenzae, S. Pneumoniae, Moraxella catarrhalis, más raramente Staphilococcus. Se planteará ante una tos húmeda crónica (superior a 4 semanas), especialmente en menores de 6 años, pero puede ocurrir a todas las edades(4,20).
Hay estudios en menores de 17 años de edad, que hablan de la diferencia de la comunidad bacteriana presente en pulmones sanos o con BBP. Haempophilus, Neisseria y Moraxella dominan en las muestras. El predomino de Moraxella se asocia a pérdida de diversidad en la microbioma, sea causa o consecuencia de ello.
El diagnóstico requiere que no haya alteración específica en la radiografía simple, pruebas para descartar patología pulmonar de base: espirometría, un cultivo de esputo (aunque tiene poca sensibilidad) y estudio de inmunología basal. No responde al tratamiento del asma(4,20). Responde muy bien a antibioterapia adecuada.
Amoxicilina-clavulánico (amoxicilina en algunas publicaciones) oral, en 2 dosis al día. Al menos 2 semanas. Con ello debe haber no sólo una resolución de la tos, sino un cambio “dramático” en los síntomas y en la calidad de vida del niño.
El asma es la causa más frecuente de síntomas respiratorios recurrentes en la infancia, junto con infecciones respiratorias virales y hay que evitar tratar incorrectamente el asma con antibióticos, pues la mayoría de las exacerbaciones se deben a infecciones virales
Pero no hay que olvidar que el asma es la causa más frecuente de síntomas respiratorios recurrentes en la infancia, junto con infecciones respiratorias virales sucesivas (esto en < 5 años sobre todo), y hay que evitar tratar incorrectamente el asma con antibióticos, pues la mayoría de las exacerbaciones se deben a infecciones virales(4,20).
Neumonía
Nos referimos especialmente a la neumonía adquirida en la comunidad (NAC; siglas CAP en inglés)(4,5,20-22). Se trata de una infección aguda del parénquima pulmonar, que ocurre en un paciente que no ha sido hospitalizado en la última semana (o 14 días) o bien que aparece en las primeras 48 horas desde su hospitalización.
Se caracteriza por la presencia de tos y/o dificultad respiratoria, generalmente con fiebre, y con evidencia radiológica de infiltrado pulmonar agudo (en fase muy precoz, la radiografía puede ser normal).
La neumonía es una causa importante de morbilidad, de necesidad de atención sanitaria e ingresos hospitalarios. La mortalidad por neumonía en países del llamado mundo desarrollado es muy baja (0,28 % o <1 por 1000 casos/año, según estudios), salvo en pacientes con comorbilidades, neonatos o ancianos.
En países del llamado mundo desarrollado, la incidencia anual estimada es de unos 14,5 casos 10.000 niños de hasta 16 años. La incidencia de hospitalización por neumonía es un 15,6 a 23 % de pacientes, o 12 casos por 10.000 ingresos(22).
Predisponentes a presentar neumonía, así como pueden incrementar la gravedad: cardiopatía congénita, displasia broncopulmonar, FQ, asma, drepanocitosis, enfermedades neuromusculares (especialmente las asociadas a déficit cognitivo o disminución de conciencia), algunos trastornos gastrointestinales (reflujo gastroesofágico), inmunodeficiencias congénitas o adquiridas. El consumo de tabaco, alcohol y otras drogas aumentan el riesgo de neumonía, incluida la secundaria a aspiración, al alterar los mecanismos de la tos y los reflejos de la epiglotis.
Etiología
En niños mayores de 5 años se acepta que las causas, en orden de frecuencia son(4,5,20-22): El Mycoplasma pneumoniae es el más común, seguido de Streptococcus pneumoniae, el agente bacteriano típico más frecuentemente implicado en todas las edades. Por la vacunación parece estar disminuyendo en frecuencia el neumococo y aumentando S. pyogenes y S aureus. Después estarían los virus respiratorios (rinovirus, influenza, VRS, metapneumovirus, adenovirus, parainfluenza y coronavirus), la Chlamydia o Chalmydophila pneumoniae. Moraxella catarrhalis, H. influenzae no tipable, Legionella pneumophila, tuberculosis y otros. El SARS-CoV 2 produce neumonía con diferencias frente a otros virus, con menor porcentaje de sibilancias(22).
Sin embargo, en diversos estudios se destaca la implicación de los virus respiratorios, solos o en coinfección(21,22).
Hay diversas consideraciones geográficas y ambientales en algunos patógenos: sarampión, Coccidioides immitis, Blastomycosis, Histoplasma capsulatum, hantavirus, MERS (península arábiga), Chamydia psittaci, Coxiella burnetii (fiebre Q).
Véase la Tabla I para un diagnóstico diferencial de la NAC.
Clínica
Varía en función de la edad y del agente causal implicado. Para aproximar el diagnóstico se deben tener en cuenta los siguientes datos; fiebre, dificultad respiratoria, tos, rechazo de ingesta; junto con comorbilidades y factores de riesgo, las vacunaciones, el uso reciente de antibióticos (en los 3 meses previos), las actividades laborales o lúdicas, los viajes internacionales.
Clásicamente se establecía una diferencia entre NAC típica (lobar, alveolar) y atípica (infiltrado bilateral, intersticial) según la clínica y especialmente la radiografía simple. Pero ningún patrón es exclusivo de una etiología concreta
Clásicamente, se establecía una diferencia entre NAC típica (lobar, alveolar) y atípica (infiltrado bilateral, intersticial) según la clínica y especialmente la radiografía simple(4,20-22). Pero ningún patrón es exclusivo de una etiología concreta. En la auscultación se puede encontrar: hipoventilación, crepitantes, soplo tubárico (más en relación con condensación) o bien, sibilancias, crepitantes y roncus dispersos (más en relación con afectación peribroncovascular, difusa). Puede haber matidez a la percusión, disminución de movimientos en hemitórax o bien tiraje. En el adolescente sano, con buen estado general, en atención primaria, se puede hacer una aproximación diagnóstica por la clínica como probable NAC típica o atípica, véase más adelante, en la sección de diagnóstico radiológico.
En estudios con pacientes adolescentes sí se ha encontrado asociación de dolor torácico con el diagnóstico de NAC.
Radiología
En la actualidad las guías no recomiendan la realización sistemática de radiografía de tórax en aquellos niños estables con diagnóstico clínico de neumonía, previamente sanos, que se vayan a manejar de forma ambulatoria
Desde hace unos años, publicaciones nacionales, y muchas guías internacionales (BTS, guías NICE, ATS, OMS y otras) no recomiendan la realización sistemática de radiografía de tórax en aquellos niños estables con diagnóstico clínico de neumonía, previamente sanos, que se vayan a manejar de forma ambulatoria(20-23). Sí debe realizarse radiografía en los que requieran ingreso, tengan hipoxia o baja SpO2, o sospecha de complicaciones: sospecha de derrame pleural, mala evolución (no mejoría de fiebre y afectación respiratoria tras 48 h de inicio de antibioterapia), dudas diagnósticas, neumonías recurrentes(20-22). También en el diagnóstico de la fiebre sin foco con leucocitosis.
En la radiografía simple de tórax, los patrones principales son: neumonía lobar, bronconeumonía, neumonía con infiltrado parenquimatoso, intersticial y peribronquial, además de las complicaciones.
No se recomienda la sistemática de radiografía en dos proyecciones, PA y lateral. La radiografía lateral tendría interés para localizar la lesión (como podría ser el caso de neumonías recurrentes), haya dudas diagnósticas, se sospechen adenopatías o complicaciones. La radiación en el caso de una radiografía simple de tórax es muy baja realmente. No hay que olvidar que la sensibilidad y especificidad de la imagen radiológica es observador dependiente.
Incluso hay posibilidad de telerradiografía en países o medios donde no esté disponible el radiólogo.
La imagen por TC es más sensible que la radiología simple; pero es más costosa y tiene radiación importante. Se reserva para complicaciones
La imagen por TC es más sensible que la radiología simple; pero es más costosa y tiene radiación importante. Se reserva en pediatría y adolescencia para complicaciones (presencia de neumatocele, neumonía necrotizante, abscesos o dudas diagnósticas en neumonías de evolución inadecuada)(24).
Actualmente, se están desarrollando dos nuevas alternativas para aumentar la precisión diagnóstica(4,20-24): la ecografía de tórax y la secuencia rápida de resonancia.
- La ecografía en el “lugar de atención” (point of care): necesita personal adiestrado, con sondas adecuadas. Frente a la radiografía simple, el valor predictivo positivo de la ecografía es algo menor (0,6 frente a 0,71), si bien el valor predictivo negativo es algo superior (0,86 frente a 0,8).
- Secuencia rápida de resonancia magnética. En pacientes ingresados, la resonancia serviría para conseguir imágenes de mayor resolución en neumonías complicadas, sin tener que recurrir a la TC. Puede evidenciar la neumonía (imágenes de alta intensidad de señal en espacio alveolar, en secuencias T2), puede valorar derrames y abscesos.
Pruebas de laboratorio
En la mayor parte de las guías no se recomienda realizar estudios diagnósticos en pacientes ambulatorios, salvo sospecha de patógenos infrecuentes o circunstancias epidemiológicas especiales, como por ejemplo en sospecha de tos ferina.
El diagnóstico causal de la neumonía sigue siendo subóptimo (hemocultivo, serologías, PCR viral, técnicas moleculares…), aunque se han realizado grandes avances en los últimos años, como los test de detección viral rápida múltiple en muestras nasofaríngeas, diagnóstico de DNA por Reacción de Polimerasa en Cadena, sobre todo en muestras como derrame pleural.
Los biomarcadores más utilizados son la leucocitosis (>15.000 leucos/mcL)-neutrofilia, especialmente la proteína C reactiva (PCR) y la procalcitonina (PCT)
Biomarcadores. Los más utilizados son la leucocitosis (>15.000 leucos/mcL)-neutrofilia y especialmente la proteína C reactiva (PCR) y la procalcitonina (PCT). La PCR es de las más utilizadas, aunque ha mostrado tener una sensibilidad subóptima para identificar niños con neumonía bacteriana, en valores sobre 6-8 mg/dl. La PCT (≥1-2 ng/mL) ha mostrado tener una cierta sensibilidad y especificidad superiores, especialmente en pacientes graves. Son útiles, pero no como único factor determinante en el manejo y tratamiento(4,20-23).
El costo de la procalcitonina es alto. Otra utilidad de la PCR y sobre todo de la PCT es el seguimiento de pacientes críticos o que no presentan evolución favorable.
Otros biomarcadores están en estudio: interleucina 6 y otros.
Criterios de ingreso en la neumonía en adolescentes
En adultos, para valorar la gravedad de la neumonía se han desarrollado escalas pronósticas(23) como Fine, PSI, CURB65. La escala CURB-65 es muy utilizada en clínica e investigación en pacientes con neumonía desde los 18 años de edad. Se calcula asignando un punto a los apartados: confusión, uremia, FR ≥ 30, TA sistólica < 90 o diastólica ≤ 60, y edad ≥ 65 años. Esta escala indica mayor riesgo de mortalidad en los siguientes 30 días. Quizá esta escala infravalora la gravedad en el adulto joven(4,20). Además, no tiene en cuenta la SpO2, que es muy relevante para decidir el ingreso. El valor CURB-65 es orientador, la clínica, incluso la experiencia del clínico y su situación psicosocial del paciente son decisivos para ingresar a un paciente adulto con NAC.
En pediatría, se puede aplicar la escala PEWS (Pediatric Early Warning Score) sobre todo la SpO2 y el trabajo respiratorio. Valora la conducta, el componente cardiovascular y el respiratorio, con puntuación de 0 a 3 cada apartado, según incrementa la afectación.
Véase la Tabla II para criterios de hospitalización en Neumonía en el adolescente.
En estudios pediátricos sobre neumonías (todas las edades y comorbilidades o no), éstas resultan ser un 1-4 % de las consultas de Urgencias, y su porcentaje de ingreso es 14-25 %, precisan UCIP hasta 20 %. Para los criterios de ingreso en UCI y el manejo véase otras referencias y protocolos específicos(4,20-22,25).
Tratamiento antimicrobiano
El tratamiento de la neumonía en muchos casos se realiza en Atención Primaria. La afectación o gravedad, y las comorbilidades en el adolescente requieren adaptar el tratamiento empírico. Para la NAC típica en adolescente la primera indicación ambulatoria es la amoxicilina, en caso de ingreso, la ampicilina. En caso compatible con neumonía bacteriana atípica, un macrólido
Una vez realizado el diagnóstico de neumonía en el adolescente, se iniciará siempre tratamiento antibiótico, excepto si hubiera un diagnóstico cierto de enfermedad viral en paciente inmunocompetente y no grave (test viral positivo, PCT negativa), junto con posibilidad de un seguimiento estrecho.
El tratamiento es empírico, basado en la clínica, epidemiología, en la gravedad del caso, sospecha de coinfección gripal o COVID, el ámbito donde se va a realizar el tratamiento (ambulatorio, hospitalario) y comorbilidades (drepanocitosis, inmunodeficiencia, etc.). Exponemos los datos de más significación para la edad adolescente. Para los datos más específicos nos remitimos a protocolos especializados(4,5,22,25).
NAC de características típicas
1. Neumonía no complicada
Tratamiento ambulatorio: amoxicilina oral 80-90 mg/kg/día (máximo 6-8 g al día) en 3 dosis, 7-10 días.
Tratamiento hospitalario: podría ser oral en casos seleccionados, pero suele administrarse iv: ampicilina iv. 200-250 mg/kg/día (máximo 12 g al día) en 3-4 dosis, 2-4 días (> 24 h apirexia), seguida de amoxicilina oral a 80 mg/kg/día en 3 dosis de forma ambulatoria hasta completar 7-10 días. En caso de neumonía lobar no complicada, con gripe, la indicación es amoxicilina-clavulánico (100-150 mg/kg/día de amoxicilina (máximo, 6-8 g/día), formulación 5:1), además de oseltamivir.
Opción válida si NAC con etiología neumocócica sospechada o confirmada: Penicilina G sódica IV 250.000 U/kg/cada 4h. Máximo 24 millones U al día. Si derrame hasta 400.000 U/kg/día.
Si no hay respuesta a amoxicilina se añadirá un macrólido (claritromicina o azitromicina), o también si se sospecha la presencia de M. pneumoniae, Chlamydia pneumoniae o legionellosis o el paciente está grave o hipoxémico o hay sibilancias. La resistencia a los macrólidos del neumococo en España es <25 % actualmente, y no hay en bacterias atípicas.
La alternativa al macrólido puede ser doxiciclina en mayores de 8 años (4 mg/kg/día, en dos dosis, máximo 200 mg). Doxiciclina cubre bien a las bacterias atípicas, igual que las fluorquinolonas.
En caso de alergia y sospecha de resistencia a macrólido y a doxiciclina, se puede usar levofloxacino (quinolona, en ficha técnica en >18 años), a 10 mg/kg/día, dosis cada 24h, máxima 500-750 mg/día, moxifloxacino (quinolona, en ficha técnica en >18), a 7,5-10 mg/kg/día, dosis cada 24h, máxima 400 mg/día. Las quinolonas se usan preferentemente en adolescentes que hayan completado el desarrollo óseo. El uso de levofloxacino se puede considerar cuando ha habido tratamiento antibiótico los 3 meses previos. Levofloxacino debe evitarse si hay dudas sobre que la neumonía pueda ser por tuberculosis hasta realizar el estudio microbiológico, por ser un tratamiento de segunda línea.
Otros: linezolid (en ficha técnica >18 años); 600 mg/dosis. Cada 12 h, iv o vo. Ceftarolina en mayores de 18 años de edad, iv (cefalosporina de 5º generación).
2. Neumonía con derrame pleural
Opcional: Ampicilina iv. o bien Cefotaxima iv. Máximo 12 gramos al día.
3. Neumonía abscesificada (necrotizante)
Cefotaxima + clindamicina iv. Alternativa: meropenem iv.
NAC de características atípicas
Macrólido (claritromicina o azitromicina).
Alternativa en mayores de 8 años: doxiciclina.
NAC no clasificable
Macrólidos.
Grave (cualquier edad): cefotaxima/ceftriaxona iv. + macrólido iv.
Duración del tratamiento
En general 7 días, excepto la azitromicina (basta 3-5 días, según dosis), levofloxacino puede ser suficiente 5 días (hasta 10), o se prolonga en ciertos patógenos o complicaciones como derrame pleural, neumonía necrotizante.
Se ha descrito buena evolución con tratamientos de 5 días, en adultos, pero hacen falta más estudios en pediatría.
Neumonías graves: 10-14 días.
Neumonía atípica: 7-10 días (azitromicina 5 días).
Para complicaciones y casos especiales véase(4,5,20-22,25).
Antivirales
Oseltamivir en neumonía por o con gripe si el paciente está ingresado, concretamente si está hipoxémico, grave o presenta datos de riesgo. Dosis según peso del paciente y según protocolos locales: peso de 24-40 kg: 60 mg/12 h; > 40 kg (o de 13 años a 17): 75 mg/12 h, oral, 5 días (10 días si inmunodepresión).
En la neumonía COVID el tratamiento puede incluir dexametasona, remdesivir, tocilizumab, heparinización, otros. Pero se recomienda seguir los protocolos locales actualizados(25).
Tratamiento general
Las medidas a plantear en el manejo son(4,5,20-22):
Medidas generales
Antipiréticos, analgésicos, O2 terapia para SpO2 >92 o 95, según las guías y dificultad respiratoria, soporte respiratorio, hidratación, nutrición.
Riesgo de Secreción inadecuada de ADH (SIADH). Si hiponatremia con sospecha de SIADH, usar cierta restricción hídrica, y fluidos isotónicos en lugar de hipotónicos. La hiponatremia puede ser resultado de inflamación sistémica sin SIADH(22).
Monitorización de pulsioximetría si está inestable en cuanto a las necesidades de O2terapia. Considerar gasometría para valorar pCO2.
Antitusígenos: deben ser evitados.
Fisioterapia: no se debe realizar en proceso agudo. Es útil si bronquiectasias, FQ, atelectasias.
Para la prevención de trombosis, tromboembolismo pulmonar, considerar el uso de heparinas de bajo peso molecular. A valorar en adolescentes mayores inmovilizados si hay factores de riesgo asociado
Prevención de trombosis, tromboembolismo pulmonar. Considerar uso de heparinas de bajo peso molecular. A valorar en adolescentes mayores inmovilizados si hay factores de riesgo asociado: obesidad, síndrome metabólico, anticonceptivos orales, alteraciones hematológicas, oncológicas, traumatológicas, etc.
Muy importantes las medidas de aislamiento hospitalario según etiología.
Se puede valorar la consulta con un especialista en infecciosos en caso de alergia, comorbilidades, fallo de respuesta a tratamiento, y con neumólogo si neumonía recurrente.
El uso de corticoides en el tratamiento de las neumonías en adultos se ha visto que acorta el tiempo de hospitalización, disminuye la necesidad de ventilación mecánica y el riesgo de distrés respiratorio. Todavía las guías no lo recomiendan como uso rutinario. En niños aún está en estudio.
Seguimiento
Debe hacerse una revisión clínica en 48 horas de iniciado el tratamiento antibiótico.
En niños ingresados una vez comprobada la evolución favorable, desaparición de la fiebre y adecuada tolerancia oral, se puede sustituir la vía parenteral por la vía oral.
En la evolución sin complicaciones puede haber cierta astenia, cansancio o limitación al ejercicio y esfuerzo deportivo durante 1 mes, a veces hasta 3 meses.
Control radiológico
Si la evolución de síntomas respiratorios es favorable de la neumonía no se recomienda radiografía de control. Si se realizara, no antes de las 4-6 semanas si la clínica es favorable
Si la evolución de síntomas respiratorios es favorable no se recomienda radiografía de control. Si se realizara, no antes de las 4-6 semanas si la clínica es favorable.
La radiografía simple durante el tratamiento está indicada en casos de síntomas persistentes (tras 48-72 h de tratamiento antibiótico no existe mejoría clínica), neumonía redonda o con atelectasias, neumatocele, absceso pulmonar o derrame pleural.
Prevención
Promover un estilo de vida saludable en el y la adolescente, la prevención de enfermedades infecciosas con medidas generales adecuadas, con la vacunación según calendario vigente más sus indicaciones concretas en comorbilidades (antigripal incluida) puede evitar complicaciones y el desarrollo de enfermedad grave
Ya se mencionó la importancia decisiva de las vacunas conjugadas frente a Haemophillus influenzae, S. Pneumoniae conjugada 13 valente. En ciertas comorbilidades hay que tener presente la vacunación antineumocócica, incluida la polisacárida.
La vacuna antigripal, en sus indicaciones actuales, puede evitar gran parte de las formas graves de gripe en población infantil.
Las medidas preventivas de la infección por VRS (higiene de contacto, así como vacunación) serían muy útiles para aminorar el efecto de la neumonía en niños.
Conflicto de intereses
Ninguno para la elaboración de este trabajo. Miguel Zafra colaboró como investigador en el estudio Heracles, de Pfizer, epidemiológico sobre enfermedad neumocócica invasiva en Madrid entre 2009 y 2016.
Tablas y figuras
Tabla I. Diagnóstico diferencial de neumonía de la comunidad
|
NEUMONÍA DE CAUSA INFECCIOSA, POR AGENTE MENOS HABITUAL
|
- Tuberculosis
- Hongos
- Otros
|
|
NEUMONITIS O ALTERACIÓN RADIOLÓGICA PULMONAR DE CAUSA NO INFECCIOSA
|
- Aspiración. Anaerobios: Secundarios a aspiración. Frecuente en pacientes neurológicos.
También en disfagia o alteración esofágica
- Aspiración de cuerpo extraño, y sus complicaciones, como infección recurrente o persistente
- Inhalación (hidrocarburos, tabaco, opiáceos, otras)
- Radiación-Fármacos (citostáticos), que evoluciona a fibrosis pulmonar
- Hipersensibilidad a alérgenos
- Neumonitis por hipersensibilidad. Tras exposición de heno húmedo, excrementos
de aves o productos químicos inhalados
- Neumonitis por hipersensibilidad tras “vapear” (uso de un e-cigarrillo)
- Neumonía lipoidea, neumonía eosinofílica
|
|
ALTERACIONES ANATÓMICAS
|
- Secuestro pulmonar, enfisema lobar congénito, atelectasias, anillo vascular,
quiste broncogénico…
|
|
ENFERMEDADES PULMONARES CRÓNICAS
|
- Asma, bronquiectasias, FQ, fibrosis pulmonar, déficit de alfa-1antitripsina, sarcoidosis,
histiocitosis X
|
|
OTROS
|
- Vasculitis
- Neoplasias
- Infarto pulmonar, tromboembolismo pulmonar, edema pulmonar de origen cardiaco
|
Elaboración propia. Tomada de referencias de bibliografía(4,5,20-22).
Tabla II. Criterios de hospitalización en neumonía en el adolescente
|
CRITERIOS CLÍNICOS DE INGRESO
|
- Afectación del estado general.
- Signos de gravedad clínica inicial: Aspecto tóxico-séptico. Decaimiento-somnolencia, alteración de la conciencia, inestabilidad hemodinámica, deshidratación. Trabajo respiratorio incrementado: taquipnea o tiraje importantes; pulsioximetría con Sat O2 < 92 %, cianosis.
- Apnea o respiración entrecortada.
- Dificultad de la alimentación (vómitos, signos de deshidratación).
- Intolerancia a líquidos y a la medicación oral.
- Falta de respuesta al tratamiento empírico oral, correctamente utilizado, tras 48h del inicio.
- PEWS Pediatric Early Warning Score >6.
- Presencia de criterios de ingreso en UCI por neumonía grave o complicada.
- Alteraciones analíticas a considerar: leucocitosis muy elevada/leucopenia; o reactantes de fase aguda muy elevados acompañados de sintomatología moderada, hiponatremia importante.
|
|
CRITERIOS DE INGRESO RADIOLÓGICOS
|
- Afectación multifocal en neumonía de características típicas.
- Absceso pulmonar, neumatoceles.
- Afectación pleural significativa.
- Patrón intersticial grave.
- Imágenes radiológicas sospechosas de un microorganismo no habitual.
|
|
FACTORES DE RIESGO A TENER EN CUENTA
|
- Enfermedad de base: Cardiopatía, fibrosis quística, inmunodeficiencia, malnutrición, drepanocitosis, bronquiectasias, nefropatía, diabetes, displasia broncopulmonar asociada a prematuridad, encefalopatía, etc.
- Causas familiares y sociales: no sea posible garantizar una observación domiciliaria ni el cumplimiento terapéutico.
|
Elaboración propia. Tomada de referencias de bibliografía(4,5,20-22).
Figura 1. Infección periamigdalina derecha
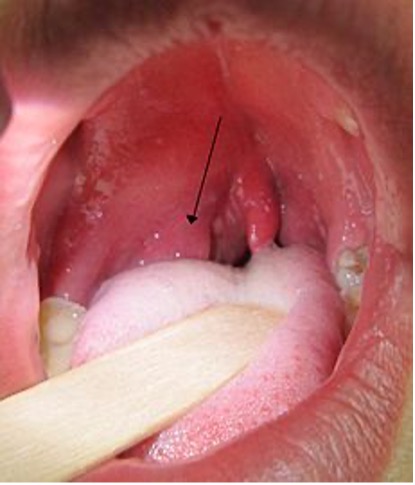
Tomado de Wikipedia. Heilman J. 2011
Figura 2. Anatomía esquemática del oído
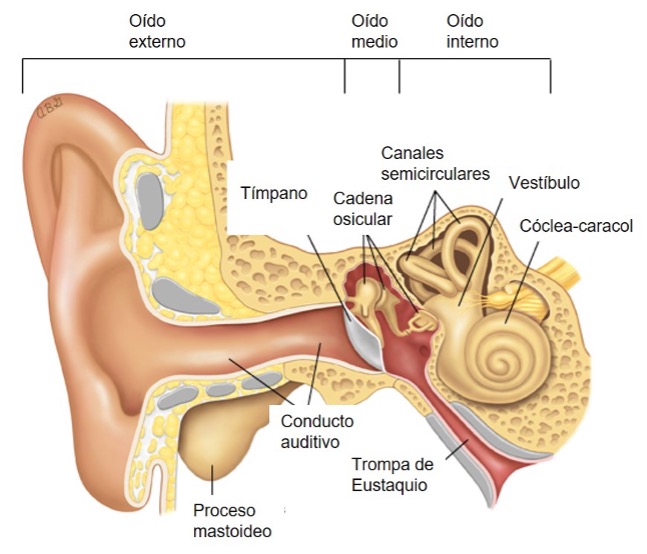
Tomado de Limb CJ. UpToDate. Traducido.
Figura 3. Imagen timpánica en otitis media aguda
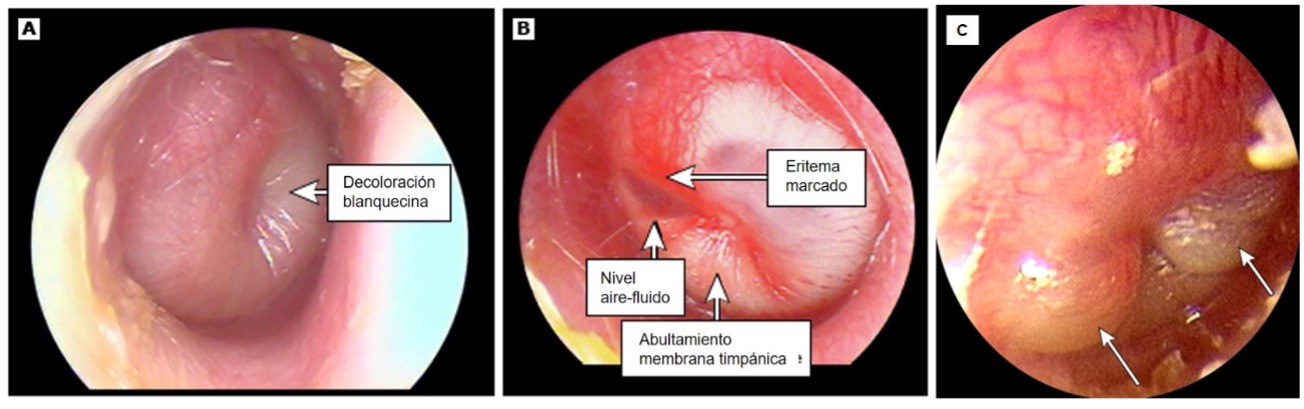
A. Otitis media aguda sin eritema.
B. Otitis media aguda con eritema y nivel.
C. Miringitis bullosa
Tomado de Limb CJ. UpToDate. Traducido.
Bibliografía
1. Arteaga-Acuria AM; Ruilova-Mera EC; Fernandez-Cedeño HA, Plaza-López JJ, Zambrano-Loor LY, Briones-Bermeo NP. Prevención frente la presencia de infecciones respiratorias que sufren los adolescentes. Pol. Con. 2019; 30 (4): 244-65.
2. Francisco González L, Calvo Rey C. Infecciones respiratorias virales. Protoc Diagn Ter Pediatr. 2023; 2:139-149.
3. De la Flor i Bru J. Infecciones de vías respiratorias altas-2: otitis media (etiología, clínica y diagnóstico; complicaciones y tratamiento); otitis media aguda de repetición y otitis media crónica; otitis externa. Pediatr Integral. 2022; XXVI (6): 353-68.
4. Andrés Martín A, Valverde Molina J eds. Tratado de Neumología pediátrica SENP-SEPAR. EIOSalud. Madrid. 2021.
5. Guía ABE. Infecciones en Pediatría. Disponible en: http://www.guia-abe.es/.
6. Chow EJ, Uyeki TM, Chu HY. The effects of the COVID-19 pandemic on community respiratory virus activity. Nat Rev Microbiol. 2023; 21 (3): 195-210.
7. Macina D, Evans KE. Bordetella pertussis in school-age children, adolescents and adults: a systematic review of epidemiology and mortality in Europe. Infect Dis Ther. 2021; 10: 2071-2118.
8. Zafra Anta MA, García Nieto VM. Carta a la Editora de Anales de Pediatría (Barc) sobre el trabajo de Salinas-Salvador y colaboradores «Estudio retrospectivo sobre la efectividad y seguridad de la pauta antibiótica reducida a 5-7 días en la faringoamigdalitis aguda estreptocócica comparada con la pauta clásica de 10 días». An Pediatr (Barc). 2023; 98 (3): 244-45.
9. De la Flor i Bru J. Infecciones de vías respiratorias altas-1: faringitis aguda y recurrente. Pediatr Integral 2022; XXVI (6): 340-47.
10. Otero Pérez L, Ares Álvarez J, Piñeiro Pérez R. Faringoamigdalitis aguda y sus complicaciones. Protoc Diagn Ter Pediatr. 2023; 2: 51-79.
11. De la Peña Gallo L, Zafra Anta MA, Quílez Calleja B, Galán del Río P, García García C. Infecciones periamigdalinas en adolescentes. También con cultivo diferente de estreptococo betahemolíticos, ingresos en un hospital (2021- 22). XXVI Congreso de la Sociedad Española de Medicina de Adolescencia (SEMA) 7-8 octubre de 2022. Girona. Publicado en la revista Adolescere. Adolescere. 2022; X (3), Septiembre-Octubre. P 148.
12. Del Rosal Rabes T, Fernández Cooke E, Muños Ramos A. Adenitis cervical superficial y abscesos cervicales profundos. Protoc Diagn Ter Pediatr. 2023; 2: 125-37.
13. Cruz Cañete M, López Martín D. Otitis media aguda y otitis externa. Mastoiditis. Protoc Diagn Ter Pediatr. 2023; 2: 97-110.
14. Limb CJ, Lustig LR, Durand ML. Acute otitis media in adults. UpToDate. 2023.
15. Suzuki HG, Dewez JE, Nijman RG, Yeung S. Clinical practice guidelines for acute otitis media in children: a systematic review and appraisal of European national guidelines. BMJ Open 2020; 10: e035343.
16. Loh R, M Phua M, Shaw CKL. Management of paediatric acute mastoiditis: systematic review. J Laryngol Otol. 2017: 1-9. Disponible en: https://www.cambridge.org/core.
17. Baquero Artigao F, Berghezan Suárez A, Bravo Queipo de Llano B. Sinusitis y sus complicaciones. Celulitis preseptal y orbitaria. Protoc Diagn Ter Pediatr. 2023; 2: 81-96.
18. Gates A, Gates M, Vandermeer B, Johnson C, Hartling L, Johnson DW, et al. Glucocorticoids for croup in children. Cochrane Database Syst Rev. 2018 Aug 22;8:CD001955.
19. Aguilera Alonso D, Lowy Benolie A. Patología de las glándulas salivales. Pediatr Integral. 2022; XXVI (7): 423-33.
20. Zafra Anta M, Merchán Morales C. Bronquitis y neumonía en el adolescente. Adolescere 2018; VI (3): 27-41.
21. Andrés Martín A, Escribano Montaner A, Figuerola Mulet J, García García ML, Korta Murua J, Moreno-Pérez D. et al. Documento de consenso sobre la neumonía adquirida en la comunidad en los niños. SENP-SEPAR-SEIP. Arch Bronconeumol. 2020; 56 (11): 725-41.
22. Manzanares Casteleiro A, Moraleda Redecilla C, Tagarro García A. Neumonía adquirida en la comunidad. Protoc Diagn Ter Pediatr. 2023; 2: 151-65.
23. NICE: National Institute for Health and Care Excellence. Pneumonia in adults: diagnosis and management.
https://www.nice.org.uk/guidance/cg191/resources/pneumonia-in-adults-diagnosis-and-management-35109868127173.
24. Zar HJ, Andronikou S, Nicol MP. Advances in the diagnosis of pneumonia in children. BMJ 2017;358:j2739.
25. Andrés Martín A, Asensio de la Cruz O, Pérez Pérez G. Complicaciones de la neumonía adquirida en la comunidad: derrame pleural, neumonía necrotizante, absceso pulmonar y pioneumotórax. Protoc Diagn Ter Pediatr. 2017; 1: 127-46.