Hepatitis en la adolescencia
Hepatitis en la adolescencia
M.D. Lledín Barbancho, A. de la Vega Bueno.
Servicio de Hepatología y Trasplante Hepático Infantil. Hospital Infantil La Paz. Madrid
Fecha de recepción: 02-07-2023
Fecha de publicación: 31-10-2023
Adolescere 2023; XI(3): 29-47
Resumen
|
Las hepatitis víricas son enfermedades muy prevalentes a nivel mundial. Las hepatitis A y E son de transmisión fecal–oral produciéndose brotes esporádicos en nuestro medio. Disponemos de vacuna frente a la hepatitis A pero sólo está incluida en el calendario en algunas Comunidades Autónomas. La inmunización universal en los lactantes con la vacuna de la hepatitis B previene la gran mayoría de los casos en niños y disminuye el riesgo de hepatocarcinoma en adultos jóvenes. La hepatitis B crónica se diagnostica principalmente en población inmigrante procedente de países de alta prevalencia, estos pacientes deben ser tratados por médicos expertos. Para el tratamiento de la hepatitis B crónica se están desarrollando nuevos fármacos más eficaces. Respecto a la hepatitis C, con la aparición de los nuevos fármacos de acción directa, la curación de esta enfermedad se aproxima casi al 100 % de los casos, por lo que se están elaborando nuevas guías para ampliar la edad de tratamiento en Pediatría. Otras causas infecciosas son menos frecuentes en nuestro medio y con frecuencia se producen en pacientes inmunodeprimidos. Es importante tener en cuenta entre los adolescentes las hepatitis causadas por fármacos, principalmente la intoxicación por paracetamol y las hepatitis de etiología autoinmune, dado que la adolescencia es un periodo de la vida con un elevado pico de incidencia de enfermedades autoinmunes. Palabras clave: Hepatitis víricas; Hepatitis tóxicas; Hepatitis autoinmune; Adolescente; Pediatría. |
Abstract
|
Viral hepatitis is a very prevalent disease worldwide. Hepatitis A and E have fecal-oral transmission sporadic outbreaks in our environment. We have a vaccine against hepatitis A, but it is only included in the schedule in some Autonomous Communities. Universal immunization of infants with hepatitis B vaccine prevents the vast majority of cases in children and decreases the risk of hepatocarcinoma in young adults. Chronic hepatitis B is diagnosed mainly in immigrant populations from high-prevalence countries, and these patients must be treated by expert doctors. New and more effective drugs are being developed for the treatment of chronic hepatitis B. Regarding hepatitis C, with the emergence of new direct-acting drugs, the cure of this disease is approaching almost 100 % of cases, with new guidelines being developed to extend the age of treatment in Pediatrics. Other infectious causes are less common in our environment and often occur in immunocompromised patients. It is important to take into account among adolescents hepatitis caused by drugs, mainly paracetamol intoxication and hepatitis of autoimmune etiology, since adolescence is a period of life with a peak incidence of autoimmune diseases. Key words: Viral hepatis; Toxic hepatitis; Autoimmune hepatitis; Adolescent; Pediatrics. |
Hepatitis A
Aunque la hepatitis A no evoluciona a la cronicidad debe ser estrechamente vigilada durante la fase inicial por la posibilidad de complicarse, excepcional en nuestro medio, con un fallo hepático agudo. Debe recomendarse vacunación a contactos familiares y escolares expuestos
La hepatitis A es una de las causas más frecuentes de hepatitis aguda a nivel mundial. La población susceptible en nuestro medio son los niños no vacunados que viajan a países endémicos, inmigrantes y brotes en guarderías. Es una enfermedad de declaración obligatoria. En España durante el año 2019 se notificaron 915 casos, con una incidencia acumulada de 2,01 casos por 100.000 habitantes(1).
La transmisión es fecal-oral. El contagio se produce por el contacto directo con personas que excretan el virus o por el consumo de alimentos y/o agua contaminada en zonas con deficientes condiciones higiénico-sanitarias. Se puede detectar el virus en las heces durante más de un mes. En países en vías de desarrollo la mayoría de los niños contraen la enfermedad antes de los 10 años de edad mientras que en los países desarrollados la seroprevalencia en la población infantil disminuye, lo que produce un desplazamiento de nuevos casos a la población adulta joven susceptible lo que implica mayor gravedad de los casos (<50 % de la población está inmune a los 30 años). España pertenece a un área de baja seroprevalencia(2).
El virus de la hepatitis A (VHA) es un virus pequeño sin cubierta, formado por una única cadena de ARN. Pertenece a la familia de los Picornaviridae. Están descritos seis genotipos y un solo serotipo lo que ha hecho posible la elaboración de una vacuna efectiva. El daño hepático no se produce por efecto citopático directo del virus sino por la reacción inmune que genera el huésped a través de las células T y las células natural-killer. En un pequeño porcentaje de individuos se genera una respuesta inmune exagerada produciendo un fallo hepático fulminante. No existe infección crónica asociada a este virus. La infección confiere inmunidad permanente(3).
La sintomatología varía en función de la edad, los niños pequeños generalmente son asintomáticos mientras que los adolescentes y adultos, más de un 70 %, pueden presentar ictericia e hipertransaminasemia. El período de incubación es de 2-6 semanas. El comienzo se caracteriza por un cuadro de anorexia, nauseas, vómitos, diarrea y fiebre seguido de coluria, hipocolia e ictericia, dolor en hipocondrio derecho con hepatomegalia y en ocasiones esplenomegalia y adenopatías asociadas. A veces pueden presentarse manifestaciones extrahepáticas como artritis y vasculitis. En la analítica se aprecia en las fases iniciales un aumento rápido de las transaminasas (>1000 UI/ml) y posteriormente hiperbilirrubinemia. El grado de alteración de estos parámetros no guarda relación con la gravedad de la enfermedad. La ictericia persiste alrededor de dos semanas y la normalización de todos los parámetros analíticos puede necesitar hasta varios meses. La contagiosidad disminuye a partir del inicio de la ictericia y se considera que no son contagiosos una semana después(3).
Entre las manifestaciones atípicas se encuentran:
- Colestasis prolongada.
- Hepatitis fulminante: es una complicación rara, con una incidencia alrededor de 0,015 %-0,5 %. Se asocia con viremia baja y altos niveles de bilirrubina.
- Recaída: se caracteriza por un patrón bifásico, con repunte de la cifra de transaminasas. Se produce hasta en un 25 % de los casos sintomáticos, teniendo una evolución favorable.
- Otras: anemia hemolítica autoinmune, anemia aplásica, artritis reactiva, pancreatitis aguda, colecistitis acalculosa, síndrome de Guillain- Barré, glomerulonefritis mesangioproliferativa, fallo renal agudo, derrame pleural y ascitis.
El diagnóstico de hepatitis aguda se realiza mediante la detección de anticuerpos IgM anti-VHA específicos que pueden persistir hasta 4-6 meses
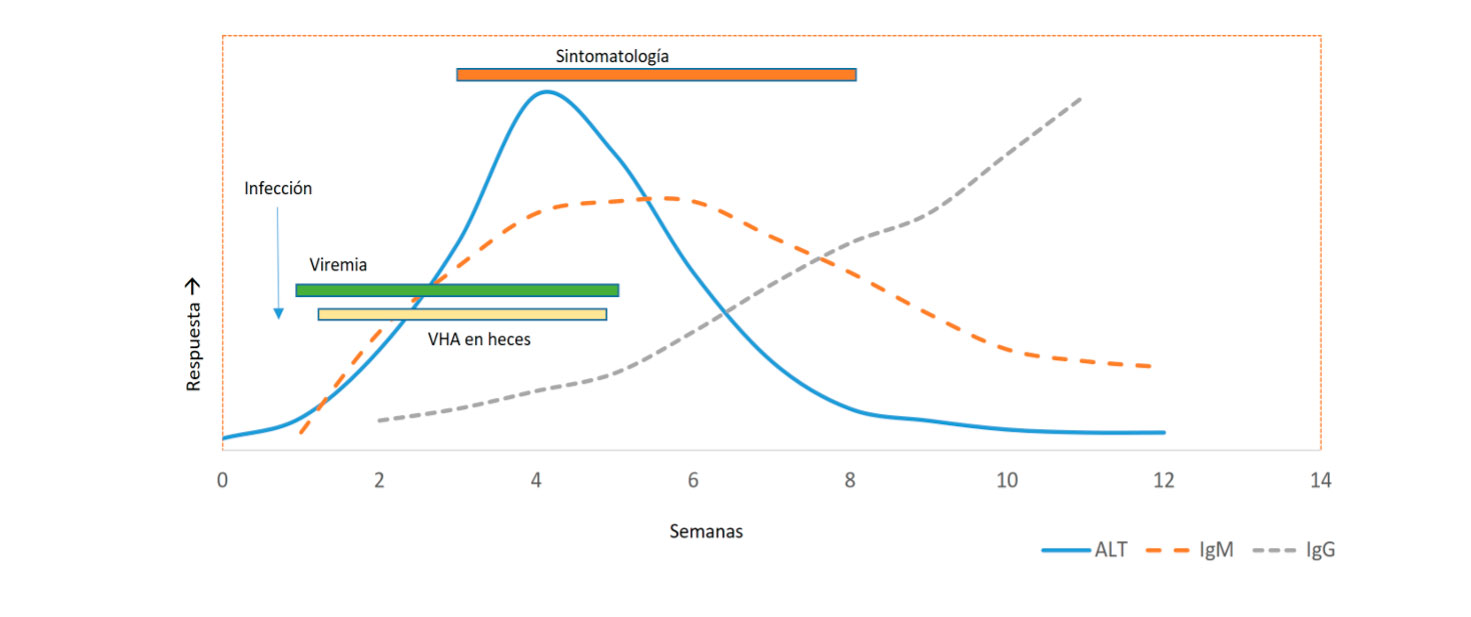
El diagnóstico de la infección aguda se realiza mediante la detección de anticuerpos (Acs) IgM anti-VHA específicos que pueden persistir hasta 4-6 meses. Los Acs IgG anti-VHA aparecen en la fase de convalecencia y pueden permanecer positivos durante décadas. También se puede estudiar el ARN del virus aunque no está disponible en la mayoría de los laboratorios. (Ver Figura 1).
No existe tratamiento específico. Se debe realizar tratamiento de sostén con una adecuada hidratación, reposo y antitérmicos. En los casos de colestasis prolongada puede ser necesario administrar vitaminas liposolubles. Si la presentación o evolución es hacia un fallo hepático fulminante (Índice Internacional Normalizado (INR) INR >1,5 con encefalopatía o INR 2 sin encefalopatía que no responde a la administración de vitamina K) debe ser transferido con prontitud a un centro de referencia de trasplante hepático infantil.
Las medidas generales para su prevención incluyen las mejoras en las condiciones socio-sanitarias de la población general (potabilización del agua y saneamiento). El virus se inactiva con cloro, con formol y a altas temperaturas.
Las vacunas de hepatitis A actualmente autorizadas son preparados de VHA inactivados. Los anticuerpos protectores aparecen a los 14 días de su administración
Existen medidas de inmunización pasiva y activa(4):
- Inmunización pasiva: mediante la administración de gammaglobulina polivalente en los primeros 14 días post-exposición. Protege durante 3-6 meses. Cada vez es menos utilizada debido a la eficacia que ofrece la vacuna post-exposición.
- Inmunización activa: las vacunas actualmente autorizadas son preparados de VHA inactivados. Se puede combinar con otras vacunas (VAH+VHB). La pauta de administración es una dosis y un recuerdo 6 meses después (0 y 6 o 12 meses) intramuscular en niños mayores de 12 meses. En el caso de la vacuna combinada A+B se administran 3 dosis (0,1 y 6 meses). Los Acs protectores aparecen 14 días después de la administración de la vacuna. Se recomienda dos dosis para alcanzar Acs protectores a largo plazo (>10 años). No es necesario realizar serologías post-vacunación.
En el caso de la profilaxis pre-exposición, numerosos países la incluyen en su calendario vacunal (Argentina, Estados Unidos, Grecia, Turquía,…). En España está incluida en algunas zonas como Cataluña, Ceuta y Melilla. La vacunación está indicada en pacientes con enfermedades hepáticas crónicas, inmunodeprimidos (debido a la mayor gravedad del cuadro que pueden presentar estos pacientes), personal con riesgo ocupacional, viajeros a áreas endémicas (al menos 1 mes antes) y familiares de familia originaria de zonas de alta endemia(4). La profilaxis post-exposición se debe realizar en los primeros 14 días tras la exposición con la administración de las 2 dosis de la vacuna. En pacientes inmunodeprimidos o con hepatopatía crónica debe administrarse conjuntamente con inmunoglobulina polivalente(4).
Hepatitis E
La hepatitis E en nuestro medio es infrecuente y se contrae por consumo de carne contaminada (cerdo, caza…). En fase aguda los síntomas son similares a la hepatitis A
La transmisión del virus de hepatitis E (VHE) es fundamentalmente fecal-oral. El VHE es un pequeño virus ARN monocatenario y sin cápsula de envoltura. Pertenece a la familia de los hepavirus. Se han aislado cuatro genotipos diferentes según las áreas geográficas. Los genotipos 1 y 2 se relacionan con casos endémicos en zonas en desarrollo (Asia, África y América Central) y ocasionalmente se producen brotes por agua contaminada, ambos afectan a seres humanos siendo el más frecuente el genotipo 1. Los genotipos 3 y 4 infectan a animales (cerdo, jabalí, carne de caza…), estos casos se relacionan con el consumo de carnes o alimentos contaminados (zoonosis). Para evitarlo, la carne debe ser cocinada a más de 70ºC y no menos de 20 minutos(5).
Es difícil estimar la frecuencia de la hepatitis E, la Organización Mundial de la Salud (OMS) calcula que cada año se producen unos 20 millones de casos, de los cuales 3,3 millones presentan los síntomas típicos de la enfermedad. Igualmente, se estima que en 2015 la hepatitis E provocó aproximadamente 44.000 defunciones, una cifra que representa el 3,3 % de la mortalidad debida a las hepatitis víricas. La mayoría de publicaciones sobre hepatitis E están realizadas en grupos de adultos y hay escasos en población infantil. En 2018, se publicó una revisión de hepatitis E en niños por el Comité de Hepatología de la ESPGHAN, que muestra sus conclusiones y recomendaciones en niños(6). La prevalencia de Acs se incrementa con la edad y es muy variable en los distintos países. En algunas zonas de Asia esta tasa llega hasta el 80 % en adultos. En nuestro país se ha realizado una publicación en 2008 sobre 1.249 niños sanos, entre 6 y 15 años, y mediante determinación de IgG se obtiene una prevalencia de 4,6 % (57 pacientes) y de ellos sólo 4 casos presentaron clínica de la hepatitis aguda(7). Aunque la vía de transmisión fundamental es fecal-oral, también se han descrito casos de transmisión vertical, sobre todo en países endémicos, o incluso por transfusiones procedentes de pacientes infectados en fase presintomática o asintomática.
La clínica de la hepatitis E generalmente es aguda y autolimitada, puede haber formas graves y crónicas en pacientes inmuno-comprometidos
La clínica generalmente es aguda y autolimitada, puede haber formas graves y crónicas en pacientes inmunocomprometidos. El período de incubación varía entre 15 y 60 días con una media de 40. La presentación clínica aguda es similar a la hepatitis A (febrícula, vómitos, anorexia, dolor abdominal, ictericia…), aunque en muchos casos es asintomática. En la mayoría de pacientes, la evolución es autolimitada. Puede haber formas graves con fallo hepático agudo con elevada tasa de mortalidad, más frecuente en embarazadas en el último trimestre de gestación, en países de alta incidencia como la India y por genotipo 1 y 2, siendo muy poco frecuente esta evolución en nuestro medio. En pacientes inmunocomprometidos (trasplantados de órgano sólido y progenitores hematopoyéticos) se ha comprobado la existencia de casos con evolución crónica, en los que además de elevación de transaminasas, pueden presentar afectación extrahepática: trombocitopenia, pancreatitis, alteración neurológica y renal, entre otras. Estas manifestaciones pueden darse de forma menos frecuente en la presentación aguda. En estos pacientes hay viremia prolongada y disfunción hepática durante más de 6 meses. En nuestro medio se relacionan, fundamentalmente, con el genotipo 3 (zoonosis) y pueden llegar a producir daño hepático severo. Debe sospecharse en alteraciones crónicas de la función hepática en niños trasplantados (frente al diagnóstico de rechazo, trastornos autoinmunes u otros). Los casos de reactivación del VHE post-trasplante con títulos bajos de IgG son poco probables, pero sí se ha comprobado ocasionalmente reinfección post-trasplante con inmunosupresión alta.
El diagnóstico se realiza mediante la detección de Acs (IgG e IgM), cuya sensibilidad es variable. La IgM presenta un pico de elevación a las 4 semanas y permanece positiva durante varios meses. En casos de alta sospecha diagnóstica y en pacientes inmunosuprimidos, aunque los Acs sean negativos, se debe realizar PCR en sangre ya que muestra mayor sensibilidad. En la presentación aguda, es posible detectar PCR en heces desde unos días antes de los síntomas hasta casi 2 meses después. Esta eliminación es aún más prolongada en pacientes inmunocomprometidos y facilita la detección de portadores crónicos.
No está indicado el tratamiento de las formas agudas de hepatitis E sin factores de riesgo.En formas crónicas o graves con manifestaciones extrahepáticas y en pacientes con hepatopatía de base, se recomienda un ciclo de ribavirina durante, al menos, 3 meses a 15 mg/kg/día
El tratamiento de las formas agudas y sin factores de riesgo no está indicado. En formas crónicas o graves con manifestaciones extrahepáticas y en pacientes con hepatopatía de base, basándose en las recomendaciones de la EPSGHAN, se recomienda tratamiento con un ciclo de ribavirina durante, al menos, 3 meses a 15 mg/kg/día. Se debe vigilar la función renal y la posible aparición de anemia, realizar control mensual de PCR y a los 3-6 meses tras finalizar el tratamiento para comprobar la respuesta viral sostenida. Estas recomendaciones se basan en datos obtenidos de grupos de adultos que demuestran una elevada eficacia de este antiviral en la eliminación del virus E(8). En pacientes trasplantados, es necesario disminuir el tratamiento inmunosupresor y si con ello no es suficiente o si ésta disminución no es posible, se debe indicar el tratamiento antiviral. En algunas publicaciones, se señala la eficacia del tratamiento con ribavirina en el fallo hepático agudo, evitando la necesidad de trasplante hepático(9).
La prevención se basa en medidas higiénico-sanitarias en países endémicos, evitar el consumo de alimentos que pueden estar contaminados, por la población de riesgo (inmunosuprimidos). Se debe realizar detección universal del virus en plasma y derivados. Se está desarrollando en China una vacuna pangenómica para proteger a la población de riesgo(10).
Hepatitis B
La hepatitis B ha disminuido mucho su incidencia en nuestro país por la implantación de vacunación generalizada. Debe investigarse en niños adoptados de países con altas tasas (China, Rusia…) y deben recibir educación sexual adecuada sobre vías de transmisión
La hepatitis B (HB) es una de las principales causas de hepatopatía crónica a nivel mundial. En 2019, la OMS estimó de 1 a 5 millones de casos nuevos y 820.000 muertes relacionadas. A pesar de disponer de una vacuna altamente eficaz para la inmunización universal, la prevalencia es aproximadamente de 3-5 % a nivel de la población general y de 1.3 % a nivel pediátrico (menores de 5 años). Se consideran zonas de alta endemicidad (>6 %) África, China, el Sureste Asiático y algunos países del Este de Europa(11). España es un país de baja prevalencia.
La transmisión es intravenosa o por la exposición mucosa a material biológico infectado como sangre, saliva o semen. En Pediatría la vía más frecuente es la transmisión vertical de madre HBsAg+. Otras vías a tener en cuenta en el grupo de adolescentes y adultos jóvenes son la transmisión horizontal por contacto con otra persona infectada a través de pequeños cortes y erosiones en la piel (compartir utensilios familiares como peines y cepillos de dientes), la exposición parenteral (pinchazos, tatuajes, piercing, exposición a sangre) y la transmisión sexual (líquidos corporales como saliva, semen y flujo vaginal). En nuestro medio, los principales grupos de riesgo son los hijos de emigrantes y las adopciones de países con alta endemia. En adultos, otros grupos de riesgo son: las personas adictas a drogas vía parenteral, pacientes HIV+, varones que mantienen relaciones sexuales con varones y familiares no inmunizados de personas HBsAg +(11).
El virus de la hepatitis B (VHB) pertenece a la familia de los Hepadnaviridae. En humanos se conocen hasta 10 genotipos distintos (A-J) con distinta distribución geográfica. En los países mediterráneos predomina el A y D. Cada genotipo tiene distinto comportamiento, evolución a la cronicidad y respuesta al tratamiento, así el genotipo C se asocia a mayor riesgo de hepatocarcinoma (HCC) y el genotipo A con un mayor aclaramiento del HBsAg después del tratamiento con interferón-alfa.
El virus de la hepatitis B (VHB) es una estructura esférica con una envoltura lipoproteíca externa que contiene el antígeno de superficie (HBsAg) y una capa interna denominada nucleocápside o núcleo (core) donde se localiza el antígeno core (HBcAg). En el interior del núcleo se localiza el genoma del virus que consiste en una doble cadena de ADN y una enzima ADN-polimerasa inversa responsable de la síntesis del ADN viral en las células infectadas. El genoma del virus codifica varias proteínas: HBsAg (región preS-S), HBcAg y HBeAg (región preC-C), la polimerasa viral (región P) y proteína X. Pueden aparecer distintas mutaciones que cambian la evolución de la enfermedad y la respuesta al tratamiento. Las mutaciones en la región precore y core bloquean y disminuyen la secreción del HBeAg respectivamente. En el proceso de seroconversión las cepas mutantes escapan del control inmunológico dando lugar a una hepatitis crónica HBeAg negativa y además asocia un riesgo incrementado de HCC. También existen mutaciones en el gen S que produce una alteración en el HBsAg produciendo una respuesta inmune deficiente y mutaciones en el gen de la polimerasa que produce alteración en la respuesta a los fármacos(12).
El VHB no es directamente citopático, la necroinflamación se produce por la respuesta inmune que genera el huésped
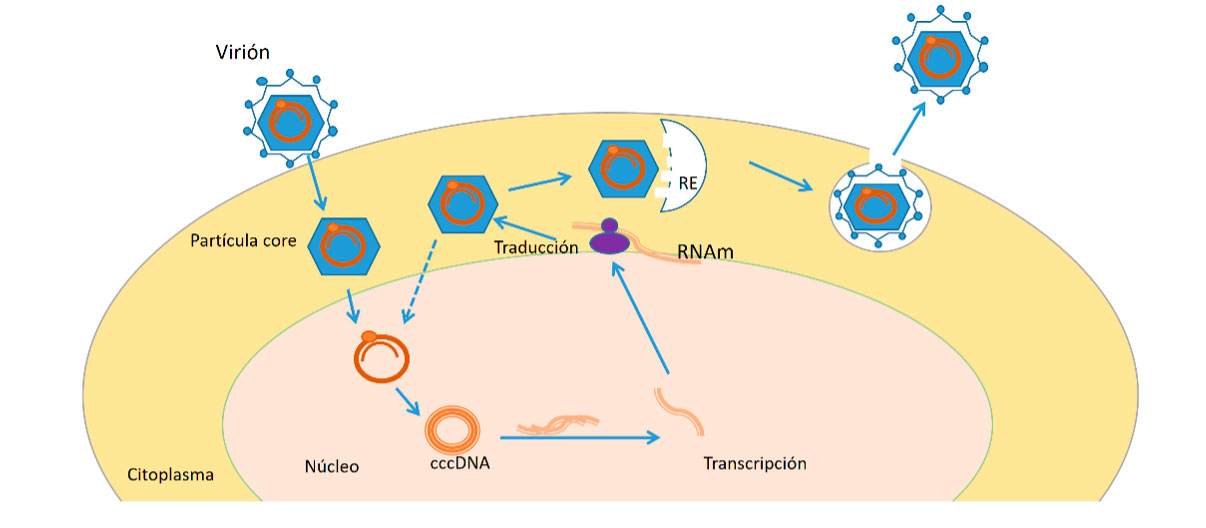
El VHB no es directamente citopático, la necroinflamación se produce por la respuesta inmune que genera el huésped. El virus penetra en el hepatocito y en el núcleo, el ADN del virión se convierte en un ADN circular covalente cerrado (cccADN) que posteriormente se va a transcribir en un ARNm para la síntesis de proteínas virales. La persistencia del cccADN en el hígado hace que la erradicación del virus sea muy difícil y que en situaciones de inmunosupresión el virus se reactive. El ADN del virus también se puede integrar en el genoma humano contribuyendo al desarrollo de un HCC. (Ver Figura 2).
La infección aguda tiene un periodo de incubación de 1-6 meses, generalmente es asintomática y anictérica pero un pequeño porcentaje pueden presentar cansancio, ictericia y vómitos. Analíticamente se caracteriza por niveles elevados de ALT (alanina transaminasa) y por la detección del HBsAg y ADN-VHB en sangre. En la fase de convalecencia y resolución de la enfermedad, el HBsAg se aclara y el ADN-VHB desaparece. Si el paciente presenta escasa sintomatología tiene más probabilidad de progresión hacia la cronicidad. En menos de un 1 % de los casos se puede producir un fallo hepático agudo por una repuesta inmune exagerada del huésped.
La hepatitis crónica B se define por la persistencia del HBsAg durante más de 6 meses. El riesgo de cronicidad es inversamente proporcional a la edad del paciente, siendo > 90 % en el periodo neonatal, 35 % en niños y menos del 5 % en adolescentes y adultos
La hepatitis crónica se define por la persistencia del HBsAg durante más de 6 meses. El riesgo de cronicidad es inversamente proporcional a la edad del paciente, siendo > 90 % en el periodo neonatal, 35 % en niños y menos del 5 % en adolescentes y adultos. Generalmente los pacientes en esta fase suelen estar asintomáticos, en pocos casos se asocia fatiga y anorexia. Alrededor del 1-10 % pueden presentar manifestaciones extrahepáticas como enfermedad del suero, artritis, vasculitis (principalmente la panarteritis nodosa), afectación renal (glomerulonefritis membranosa) y acrodermatitis papular de la infancia (Síndrome de Gianotti-Crosti). Las complicaciones a largo plazo más temidas son el desarrollo de cirrosis (1-5 % de los niños HBeAg+) y HCC (<1 %). Se consideran factores de riesgo para el desarrollo de cirrosis: la seroconversión antiHBe temprana (antes de los 3 años de edad) con una importante actividad necroinflamatoria y una fase de inmunoeliminación prolongada(13).
La progresión de la hepatitis B depende de la interacción entre el virus y el sistema inmune del huésped. Actualmente se utiliza la clasificación propuesta en guías EAS 2017 que se basan en la cifra de ALT para hablar de infección o hepatitis y en el estado HBeAg que puede ser positivo o negativo
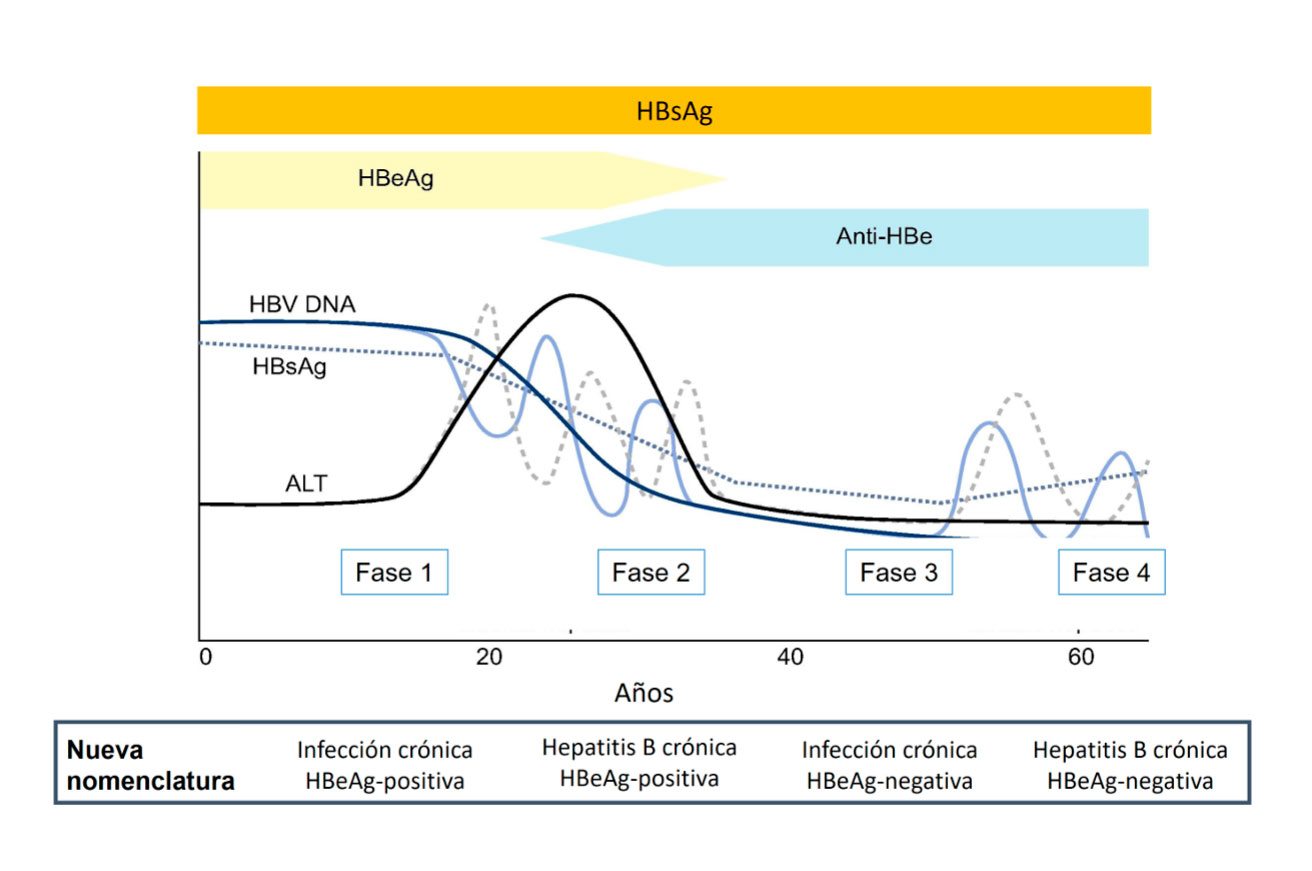
La historia natural de la HB es un proceso complejo y dinámico que se caracteriza por varias fases de duración variable que no tienen un curso lineal. La progresión de la enfermedad depende de la interacción entre el virus y el sistema inmune del huésped. Actualmente se utiliza la clasificación propuesta en guías EASL (European Association for Study of the Liver) del 2017 que se basan en la cifra de ALT para hablar de infección o hepatitis y en el estado HBeAg que puede ser positivo o negativo. (Ver Figura 3).
- Infección crónica HBeAg positivo antiguamente denominada fase de inmunotolerancia: se caracteriza por la presencia de HBeAg, HBsAg y carga viral elevada (ADN-VHB>10e5 cop/ml aproximadamente a > 20.000 UI/ml), con ALT normal o ligeramente elevada. Son altamente contagiosos. Esta fase puede durar varias décadas en los casos de transmisión perinatal debido a que el paso transplacentario del HBeAg induce una tolerancia inmunológica en el RN.
- Hepatitis crónica HBeAg positivo o fase de inmunoeliminación o inmunoactividad: se caracteriza por el aclaramiento de HBeAg y seroconversión a anti-HBe. La media en pediatría es aproximadamente de 2-5 %/año, menor que en adultos (5-16 %).El genotipo C se asocia con mayor retraso en la seroconversión. Generalmente los valores de ALT se elevan previo a la aparición de anti-HBe, lo que refleja la actividad necroinflamatoria en el parénquima hepático por la actividad inmunológica del huésped. Al final de esta fase se produce un descenso de la carga viral con valores inferiores a 2.000 UI/ml, normalización de ALT y aparición de anti-HBe. Si esta fase se prolonga en el tiempo se asocia con más riesgo de cirrosis y HCC. Algunos pacientes no consiguen controlar el virus en esta fase y progresan hacia una hepatitis B crónica HBeAg negativa. En otras ocasiones se puede producir una resolución espontánea con aclaramiento del HBsAg.
- Infección crónica HBeAg negativo o fase de baja replicación o portador inactivo: tiene HBeAg negativo con presencia de anti-HBe y baja o indetectable carga viral (< 2.000 UI/ml) de forma mantenida. La función hepática es normal o con mínimas alteraciones. Un pequeño porcentaje (1-3 % anual) puede eliminar el HBsAg en esta fase.
- Hepatitis crónica HBeAg negativo o reactivación: algunos pacientes pueden progresar a una fase de actividad inmune con HBeAg – (5 %), debido al desarrollo de mutaciones en el virus (raro en niños) o volver al estado HBeAg +. Presentan elevación del ADN-VHB (>10e5 cop/ml) y niveles altos de ALT. La reactivación puede ocurrir en cualquier momento de forma espontánea o en situaciones de inmunosupresión.
- Hepatitis B resuelta o fase HBsAg-negativa o hepatitis en remisión: se caracteriza por la pérdida del HBsAg con antiHBs y anti-HBc positivos, niveles de ALT normales y DNA VHB indetectable en suero, aunque es posible detectar el ccc-DNA en los hepatocitos (infección oculta). En situaciones de inmunosupresión se puede activar la replicación. Si el genoma viral se integra en el hepatocito aumenta el riesgo de HCC aunque el paciente haya aclarado el HBsAg.
Los Acs anti-HBc nunca aparecen como respuesta a la vacunación, indican siempre una infección natural
El diagnóstico se basa en la determinación de Acs y la carga viral. Los primeros marcadores que se detectan en la fase aguda son HBsAg y HBeAg en suero, incluso antes del inicio de la sintomatología. Posteriormente aparecen los anticuerpos anti-HBc IgM. Si la infección se resuelve, el HBsAg desaparece y se detectan Acs anti-HBs. Los Acs anti-HBc nunca aparecen como respuesta a la vacunación, indican siempre una infección natural. (Ver Tabla I).
Si evoluciona hacia la cronicidad, el HBsAg se mantiene positivo durante más de 6 meses y la carga viral es positiva. La determinación y cuantificación del ADN-VHB se realiza mediante técnicas de PCR. Se considera una replicación muy elevada cifras mayores de 10e5 copias/ml o 20.000 UI/ml. Recientemente se han puesto en marcha otros test (cuantificación del HBsAg, ARN VHB y HBcrAg: antígeno relacionado con el core) que ayudan a diferenciar las distintas fases de la enfermedad y predecir la evolución y respuesta al tratamiento pero todavía no se emplean de manera rutinaria.
En la edad pediátrica se aconseja la realización de biopsia hepática en la mayoría de los casos antes de indicar el tratamiento para evaluar el grado de inflamación o fibrosis. Las pruebas no invasivas como la elastografía de transición no están todavía validadas en niños y adolescentes con hepatitis B crónica, aunque es una herramienta utilizada en el manejo de los pacientes adultos. Se deben realizar revisiones periódicas en todos los niños con hepatitis crónica por pediatras expertos(14).
El objetivo del tratamiento de hepatitis B crónica es alcanzar la seroconversión anti-HBe mantenida con supresión de la carga viral para disminuir la inflamación hepática y reducir el riesgo de fibrosis, cirrosis y hepatocarcinoma
El objetivo del tratamiento es alcanzar la seroconversión anti-HBe mantenida con supresión de la carga viral para disminuir la inflamación hepática y reducir el riesgo de fibrosis, cirrosis y HCC. En un 1 %-6 % se logra la seroconversión antiHBs (<1 % en adultos). Con los fármacos disponibles en la actualidad, la infección por el VHB no llega a ser erradicada al no eliminar el cccDNA del núcleo de los hepatocitos. Se deben estudiar varios factores antes de iniciar tratamiento en un niño: edad, cifra ALT, carga viral, genotipo, lesión histológica, otras enfermedades asociadas y la historia familiar de HCC. En cada caso se deben valorar las ventajas e inconvenientes de iniciar un tratamiento antiviral muy prolongado en el tiempo con la posible aparición de resistencias, la necesidad de un buen cumplimiento y la posibilidad de reactivación de la enfermedad al interrumpir el tratamiento y desarrollar una hepatitis grave.
Los pacientes candidatos a recibir tratamiento son los pacientes con hepatitis crónica HBsAg+ con elevación de la cifra de transaminasas (ALT>60 UI/L) y alta carga viral (DNA-VHB>10e5 cop/ml) mantenida durante varios meses (6-12 meses). Una mayor inflamación periportal y portal en la biopsia hepática se correlacionan con mayor probabilidad de seroconversión. Las Indicaciones de tratamiento en pediatría(14, 15) se exponen en la Tabla II.
Los fármacos disponibles en la actualidad para el tratamiento de la hepatitis B crónica son el interferón α y los análogos de los nucleós(t)idos
Los fármacos disponibles en la actualidad son el interferón α y los análogos de los nucleós(t)idos. (Ver Tabla III). La respuesta al tratamiento se define por niveles de DNA indetectables y pérdida del HBeAg o normalización de ALT o ambos. Los factores que favorecen una buena respuesta son: actividad inflamatoria alta en la biopsia, concentraciones elevadas de ALT y niveles bajos de DNA-VHB.
- El interferón α y su fórmula pegilada tienen un efecto inmunomodulador. El tratamiento tiene una duración finita (24-48 semanas) y asocia numerosos efectos adversos: fiebre, fatiga, neutropenia, pérdida de peso, retraso de crecimiento, tiroiditis autoinmune y depresión. Está contraindicado en caso de enfermedad hepática descompensada y en menores de 1- 2 años de edad. No genera resistencias. Su eficacia (seroconversión antiHBe) es de un 30 % en los 12 meses siguientes y consiguen un aclaramiento de HBsAg en un 3- 7 % a los 6 meses del tratamiento, obteniendo mejores resultados el genotipo A(16).
- Análogos de nucleós(t)idos orales: actúan inhibiendo la síntesis del ADN-VHB, pero no actúan a nivel de DNAccc con lo cual no logran eliminar el virus de los hepatocitos infectados. Tienen la ventaja de la administración oral con menos efectos adversos. El tratamiento no tiene una duración definida, se recomienda continuarlo un mínimo de 12 meses después de conseguir la seroconversión (HBeAg – y Acs antiHBe +) y carga viral indetectable. Un 40 % de estos pacientes se mantendrán como portadores inactivos aunque otros pueden volver a positivizar el Age o incluso progresar a una hepatitis crónica HBe negativa.
Los nuevos análogos entecavir, tenofovir disoproxil fumarato (TDF) y tenofovir alafenamida (TAF) tienen una alta potencia antiviral y una alta barrera genética (número de mutaciones necesarias para el desarrollo de resistencias farmacológicas) con un riesgo de desarrollo de resistencias mínimo, por lo que son los fármacos indicados en la mayoría de los casos. TDF y TAF están indicados en pacientes que previamente han recibido lamivudina o telbivudina. En caso de insuficiencia renal u osteoporosis se indica entecavir o TAF. Con estos tratamientos sólo un 27-38 % de los pacientes HBeAg + aclaran el HBeAg y sólo un 3-5 % seroconvierten a HBsAg-, por lo que generalmente estos tratamientos son muy prolongados en el tiempo. En caso de pacientes con cirrosis se mantiene indefinidamente para evitar las recaídas(17). El genotipo del virus no influye en la respuesta al tratamiento con estos fármacos.
Se están desarrollando nuevas estrategias terapéuticas para obtener la curación funcional (HBsAg y DNA indetectable mantenido tras un tratamiento finito) con nuevos antivirales de acción directa que actúan en las distintas fases del ciclo del virus (inhibiendo la entrada del virus, destruyendo el cccDNA, impidiendo el ensamblaje de la cápside,…) y terapias inmunomoduladoras(16, 18).
La vacunación universal de la hepatitis B ha demostrado gran eficacia al disminuir la prevalencia de la infección y la incidencia de Hepatocarcinoma en adolescentes y adultos
La vacunación universal de la hepatitis B ha demostrado gran eficacia al disminuir la prevalencia de la infección y la incidencia de HCC en adolescentes y adultos. La vacuna actual es una vacuna inactivada desarrollada por ingeniería genética. Induce una respuesta seroprotectora (antiHBs>10 mIU/ml) en el 95 % de los vacunados con la administración de 3 dosis. Los pacientes en hemodiálisis y los inmunodeprimidos pueden presentar títulos menores de anticuerpos protectores lo que obliga a aumentar la dosis de antígeno o aplicar mayor número de dosis. En adultos se ha aprobado para estos pacientes dos nuevas vacunas recombinantes (HepB-CpG con un adyuvante más potente y PreHevbrio que contienen todos los tipos del antígeno) que producen una mayor y más rápida respuesta inmune(19). A lo largo del tiempo se produce una disminución del título de Acs antiHBs pero persiste una memoria inmunológica por lo que no es necesario la administración de dosis de recuerdo en niños inmunocompetentes correctamente vacunados(20). La titulación de los Acs antiHBs postvacunación sólo está indicada en población con riesgo de una repuesta menor o con una exposición de alto riesgo (hijos de madres HBsAg positivo, pacientes en diálisis, parejas sexuales de personas HBs-Ag+)(21).
Las vacunas comercializadas en España son monocomponente o combinadas (DTPa+Hib+VPI+VHB y VHA+VHB). La pauta actual recomendada en lactantes son 3 dosis a los 2, 4 y 11 meses. En niños mayores y adolescentes no vacunados se debe administrar la pauta 0, 1 y 6 meses(22).
La inmunoglobulina frente a la hepatitis B (IGHB) se emplea junto con la administración de la primera dosis de la vacuna en personas no inmunes con un contacto de riesgo (sexual, pinchazo accidental, salpicadura cutáneo-mucosa) y en RN hijos de madre HBsAg positivo
La inmunoglobulina frente a la hepatitis B (IGHB) se emplea junto con la administración de la primera dosis de la vacuna en personas no inmunes con un contacto de riesgo (sexual, pinchazo accidental, salpicadura cutáneo-mucosa) y en RN hijos de madre HBsAg positivo. En este último caso, si la madre tiene una alta carga viral (>200.000 UI/mL) el riesgo de la trasmisión es del 2 %-10 % a pesar de las medidas profilácticas descritas, para minimizarlo se recomienda el tratamiento con tenofovir en el último trimestre del embarazo(23).
Hepatitis D
El virus de la hepatitis D o virus delta es un virus defectuoso que precisa del VHB para la producción de las proteínas de su envoltura. Es un virus con una única cadena circular de ARN y con una envoltura constituida por la proteína HBsAg. La vía de transmisión es parenteral, puede ocurrir conjuntamente con la hepatitis B (coinfección) o después (sobreinfección). La transmisión perinatal es rara y se puede prevenir con la vacuna del VHB.
En el caso de coinfección del VHD tiende a empeorar el curso agudo de la hepatitis B
En el caso de la coinfección el VHD tiende a empeorar el curso agudo de la hepatitis B. El riesgo de cronicidad es similar al de la hepatitis B. En la sobreinfección se caracteriza por una forma más grave de hepatitis B crónica, con rápida evolución a cirrosis en pocos años y un riesgo incrementado de HCC.
Se diagnostica por la determinación de anti-VHD IgG. La cuantificación de RNA viral es la mejor determinación para conocer la actividad del virus.
Los tratamientos de la hepatitis B que eliminen el HBsAg conducirían a la resolución de la hepatitis D asociada. En el caso de la hepatitis D crónica el tratamiento aprobado es el INF-α o el PEG-INF- α. Hay estudios con buenos resultados con los nuevos fármacos que bloquean la entrada del VHB en el hepatocito (Bulevirtide) en combinación con INF-alfa.(24). Se previene con las medidas de prevención de la hepatitis B.
Hepatitis C
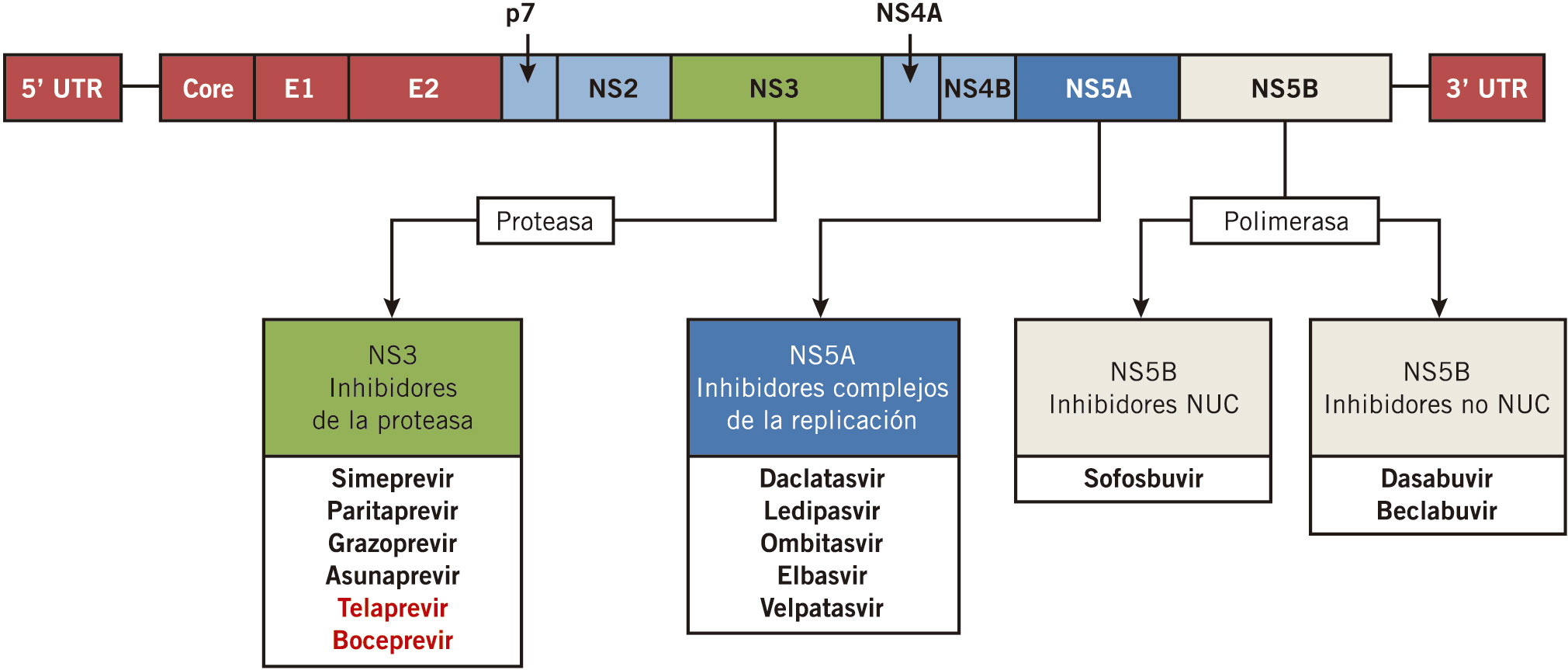
El virus C es un pequeño virus RNA monocatenario de la familia de flaviviridae. Su estructura la forman proteínas estructurales (núcleocápside y proteínas de envoltura) y otras 7 proteínas no estructurales (NS1, NS2, NS3, NS4A, NS4B, NS5A y NS5B); todas ellas participan en el proceso de replicación y le confieren una gran variabilidad y potencial capacidad de mutación.
Todavía no se dispone de vacuna frente al virus de la hepatitis C, por lo que el grupo de población adolescente puede estar expuesto. Es muy importante realizar campañas de información en esta población y realizar cribado en población de riesgo
Existen 6 genotipos y varios subtipos con diferentes localizaciones geográficas y respuesta al tratamiento. El más común es el genotipo 1 y también es el más frecuente en España.
No existen datos exactos de la población infectada por el virus C en todo el mundo y menos si nos referimos a población infantil pero la OMS estima en el año 2019 que hay 71 millones de personas con infección crónica por el virus C, de ellas cada año mueren 399.000 por cirrosis y HCC. A pesar de que desde 2011 se dispone de antivirales muy eficaces en su curación >95 %, no todos los pacientes pueden acceder al diagnóstico y tratamiento.
En adultos la vía fundamental de transmisión es parenteral: sangre y hemoderivados, drogadictos por vía intravenosa, tatuajes y menos frecuente por vía sexual. En niños la vía fundamental es la trasmisión vertical. Existen varias revisiones recientes de la tasa de transmisión por esta vía. En 2018 en niños checos de 244 madres con infección VHC hay 11 niños con transmisión (4,6 %) de éstos 2 eliminan el virus. De los niños, que adquieren la infección por vía vertical, aproximadamente el 20 % la curan de forma espontánea en los primeros 3-4 años de vida y persisten los Acs durante toda la vida. Excepcionalmente, la curación puede ser más tardía hasta los 6-7 años(25).
Cuando no se produce infección en el niño sólo se detectan Acs IgG (anti-VHC) que se transmiten de la madre y son eliminados hasta desaparecer, generalmente, antes de los 2 años(26). (Tabla IV).
En los niños cuya madre tiene hepatitis C se recomendaba realizarse un control al 3º y 18º mes para comprobar si existe infección o solo transmisión de Acs que van a ser eliminados. (Actualmente se recomienda esperar al control de los 18 meses para la excluir la posible transmisión de anticuerpos maternos que a esa edad ya estarán eliminados). ESPHGAN 2019.
La mayor tasa de transmisión de hepatitis C se relaciona con coexistencia en la madre de infección por HIV, en estos casos puede llegar al 25 %
La mayor tasa de transmisión se relaciona con coexistencia en la madre de infección por HIV(27) en estos casos puede llegar al 25 %. No está autorizado el tratamiento con antivirales de acción directa en el embarazo para intentar disminuir la viremia. No existe diferencia en la transmisión según el tipo de parto (no está indicada la cesárea programada) ni la prohibición de lactancia materna, salvo grietas importantes en la madre(28). La presencia de un hijo infectado no indica que en los siguientes ocurra también. En algunas publicaciones se relaciona la tasa de transmisión con la viremia materna elevada y también con maniobras instrumentales durante el parto (rotura bolsa> de 6 horas y monitorización fetal invasiva)(28).
La hepatitis por VHC en niños, generalmente, es asintomática y sólo presenta elevación fluctuante de transaminasas. Las manifestaciones extrahepáticas, frecuentes en adultos, son raras en pacientes pediátricos. Entre el 5-10 % pueden presentar alteraciones tiroideas, autoinmunidad positiva, crioglobulinemia… La hepatitis por virus C se cronifica en casi el 80 % de los casos y esto significa, en adultos, persistencia de RNA-VHC en sangre más de 6 meses. En niños con VHC vertical es necesario esperar más tiempo (al menos 3-4 años ) para hablar de cronicidad. Puede haber eliminación espontánea hasta esa edad e incluso, excepcionalmente, más tardía.
El diagnóstico se realiza por la detección de anticuerpos Ac antiVHC y con PCR-VHC positivos. Para comprobar el grado de fibrosis del hígado se dispone de técnicas no invasivas como la elastografía de transición (ET) o Fibroscan. La velocidad de propagación de la onda elástica es proporcional a la rigidez. Se mide en Kilopascal (kPa) y se describen cuatro grados F0: no fibrosis (menos de 7 kPa). F1 Fibrosis leve (entre 7-9,4). F2: Fibrosis moderada (9,4-9,6) F3 (9,6 a 12,4) y F4 (12,5 a 14,6) que indica fibrosis severa/cirrosis. Aunque la experiencia en niños es aún limitada parece existir (al igual que en adultos) una buena correspondencia con los resultados obtenidos por biopsia hepática (Escala METAVIR) evitando las posibles complicaciones de esta. Solamente en algunos casos de esteatosis importante o ascitis puede ser menos fiable(29).
La detección de Anticuerpos (Anti-VHC) nos indica que ha habido contacto con el virus pero para demostrar infección actual es necesario detectar PCR-VHC. Es posible estudiar el genotipo y cuantificar la viremia, importante para diseñar la pauta de tratamiento y pronóstico de respuesta.
Desde la aparición de los Antivirales de Acción Directa (AAD) en 2011 para el tratamiento de la hepatitis C, el pronóstico de esta enfermedad ha cambiado de forma significativa. Las tasas de curación en adultos y niños mayores de 12 años son muy altas. Estos fármacos se dirigen frente a diferentes partes del virus C impidiendo su replicación. Los primeros son inhibidores de las proteasas NS3/NS4A (Boceprevir, telaprevir) En 2014 y 2015 se incluyen los inhibidores de la polimerasa NS5B (Sofosvubir, Dasabuvir) y posteriormente frente a proteínas del core y polimerasa NS5A (Ledipasvir, Daclatasvir,…). (Ver Figura 5). En los últimos años en que se dispone de estos nuevos antivirales ha disminuido el uso de los primeros (menor eficacia terapéutica y más efectos adversos, sobre todo, en pacientes cirróticos).
En esos años los esquemas de tratamiento variaban en función del genotipo viral y la presencia o ausencia de cirrosis, asociando 2 o 3 AAD, con o sin Ribavirina y/o PegIFN. También puede variar la duración de 8, 12, 16 o 24 semanas. Globalmente, la proporción de pacientes que alcanza la respuesta viral sostenida (RVS: negatividad de viremia a las 12 semanas de finalizar el tratamiento) utilizando estos fármacos se encuentra en torno al 80-95 %; esta respuesta puede estar influenciada por distintos factores, como el genotipo viral, la presencia de cirrosis, la co-infección por otros virus (como el de la inmunodeficiencia humana (VIH) y los factores tóxicos (alcohol) y esteatosis (obesidad)(30).
Los pacientes diagnosticados de hepatitis VHC deben ser estudiados para otros virus como VHA, VHB recibiendo vacunación frente a ellos si su serología es negativa. También deben ser asesorados para minimizar riesgos potenciales (alcohol, sobrepeso…).
En la hepatitis crónica por VHC está autorizado el tratamiento (altamente eficaz) con AAD en niños mayores de 12 años (ó 35 kg). Se están desarrollando estudios para su autorización en niños menores de esta edad (6-11 años) e incluso en niños a partir de los 3 años
Desde 2017 los tratamientos con AAD están autorizados en niños mayores de 12 años y peso mayor de 35 Kg (EMA y FDA). La terapia DAA se recomienda para todos los adolescentes de 12 a 17 años con infección crónica por el virus de la hepatitis C, independientemente del historial de tratamiento y la gravedad de la enfermedad. Si los DAA se aprueban para cohortes de edades más jóvenes, todos los niños mayores de 3 años infectados con hepatitis C se beneficiarán de la terapia antiviral(30).
Se espera que en un futuro próximo se autorice este tratamiento en niños mayores de 3 años y con pautas más cortas. En este sentido se ha realizado un estudio multicéntrico (Australia, Nueva Zelanda, UK y EE.UU.) entre Agosto de 2015 y Febrero de 2018, en 92 pacientes de entre 6 y 12 años (rango 6-11). Mayoritariamente presentan genotipo 1 (87 niños). Se incluyen pacientes que han sido tratados previamente con interferón y pacientes sin tratamiento previo. La pauta asocia Sofosbuvir-Ledipasvir con o sin Rivabirina (solo en 2 pacientes con genotipo 3). Duración entre 12 y 24 semanas(31).
Recientemente en el Congreso ESPGHAN 2023 se plantea el tratamiento desde los 3 años (Dr. Indolfi – Italia) puesto que se obtiene RVS a las 12 semanas del 99 % (estos resultados son similares a los obtenidos en adultos y adolescentes). Se puede utilizar DAA pangenómico o específico para cada genotipo y debe comprobarse que el niño pueda ingerirlo sin dificultad. En algunos países en desarrollo la combinación de genéricos de Sofosbubir y Daclastavir con menor coste y buena eficacia pueden ser los más recomendables.
En cuanto a efectos secundarios del tratamiento se observa buena tolerancia (18 % cefalea, 17 % fiebre y 15 % con fatiga, dolor abdominal… de intensidad leve-moderada).
Infecciones hepáticas no víricas
El hígado se puede ver afectado por infecciones bacterianas sistémicas presentando datos de hepatitis y/o colangitis. En los cuadros de sepsis bacteria, la desregulación inmunológica produce una inflamación sistémica y un fallo multiorgánico, y como consecuencia una situación de bajo gasto que conduce a una hepatitis hipóxica. Otras infecciones por bacterias, micobacterias, parásitos, etc., pueden tener afectación hepática durante su evolución. Se producen principalmente en sujetos con factores de riesgo como los pacientes inmunodeprimidos. Las manifestaciones pueden ser desde hepatitis, abscesos hepáticos, colangitis o fallo hepático agudo. Los principales organismos se recogen en la Tabla V. El tratamiento debe ir dirigido según los cultivos y el estudio de sensibilidad en cada caso(32).
Enfermedad hepática autoinmune
Las hepatitis autoinmune tiene un pico de incidencia en la adolescencia. En ocasiones puede ser silente y sólo manifestarse por astenia y síntomas leves. Debemos tener en cuenta este diagnóstico en los adolescentes que padezcan otras enfermedades autoinmunes o si tienen una historia familiar de autoinmunidad
La hepatitis autoinmune tiene una incidencia anual en la población pediátrica caucásica alrededor de 0,23/100.000 niños, con predominio en el sexo femenino. Según estudios en distintos Centros europeos la incidencia ha aumentado de 2-6 veces, lo que sugiere un mayor conocimiento de esta entidad y/o un aumento real de la incidencia de enfermedades autoinmune.
Se clasifica en 2 subtipos en función de la presencia de los Acs séricos: hepatitis autoinmune tipo I (HAI-1) con Acs antinucleares (ANA) y/o Acs antimúsculo liso (AML) positivos y hepatitis autoinmune tipo II (HAI-2) con Acs antimicrosomal hígado- riñón (LKM-1) y/o anti citosol hepático (LC-1) positivos. Además de la positividad de los Acs se caracterizan por una hipergammaglobulinemia IgG y por la histología, donde lo más característico es la presencia de un infiltrado inflamatorio de linfocitos y células plasmáticas que sobrepasa la limitante (hepatitis de interfase).
La HAI-1 tiene dos picos de edad, en la infancia/ adolescencia y en la edad adulta, alrededor de los 40 años, y la HAI-2 afecta a niños y adultos jóvenes. Puede debutar de distintas formas: aguda semejante a una hepatitis viral o tener un comienzo insidioso con cirrosis y complicaciones de la hipertensión portal asociada. En raras ocasiones puede debutar con fallo hepático y encefalopatía. Las formas de HAI-2 tienen más tendencia a presentarse como un fallo hepático y ser más refractarias a la retirada de la medicación. En las dos formas hasta un 40 % tienen historia familiar de enfermedades autoinmunes y/o asocian enfermedades autoinmunes al debut o durante la evolución (tiroiditis, enfermedad inflamatoria intestinal, anemia hemolítica, vitíligo, enfermedad celiaca, diabetes insulino-dependiente, enfermedad de Bechet, síndrome de Sjögren, hipoparatiroidismo, síndrome de Adison, este último asociado principalmente a las HAI-2 formando parte del síndrome poliendocrinopatía autoinmune-candidiasis-distrofia ectodérmica que se hereda de forma autosómica recesiva).
El diagnóstico se basa en una combinación de criterios clínicos, bioquímicos, inmunológicos e histológicos y en la exclusión de otras enfermedades que pueden tener características similares: enfermedad de Wilson, esteatohepatitis no alcohólica, hepatitis B, C y E y hepatitis inducida por fármacos. La biopsia hepática es necesaria para confirmar el diagnóstico y evaluar la gravedad. Además de la hepatitis interfase son típicos la formación de rosetas, la emperopolesis y las gotas de hialina en las células de Kupffer. En las formas de solapamiento se pueden observar cambios inflamatorios alrededor de los conductos biliares. Si presenta fallo hepático agudo, la lesión tiene un predominio centrolobular con necrosis masiva y colapso multilobular indistinguible de otras formas de fallo hepático.
El score publicado por el Grupo de Hepatitis Internacional Autoinmune (IAIHG) y el score simplificado no es útil para las formas en Pediatría. Se debe tener en cuenta que en Pediatría se consideran títulos positivos de Acs con diluciones distintas a las los adultos (ANA y ML>1: 20 y LKM>1:10). La presencia de otros Acs como el anti-SLA (anti antígeno soluble hepático) es muy específico e indica formas más graves y de peor pronóstico.
El tratamiento ha de instaurarse con prontitud y en la mayoría de las ocasiones tienen una respuesta favorable al tratamiento inmunosupresor. La remisión se define como la normalización de las cifras de transaminasas, normalización de las cifras de IgG, Acs negativos o a título muy bajo. Las recaídas se caracterizan por un aumento de la cifra de transaminasas tras la normalización de las mismas lo que conlleva un aumento de la dosis de esteroides. En las recaídas juega un papel fundamental la no adherencia al tratamiento, muy común entre los adolescentes.
El tratamiento de la hepatitis autoinmune ha de instaurarse con prontitud y en la mayoría de las ocasiones tienen una respuesta favorable al tratamiento inmunosupresor
El tratamiento se inicia con prednisona (o prednisolona) a 2 mg/K/día, máximo 60 mg. Se desciende gradualmente en un periodo de 4-8 semanas paralelamente a la mejoría de la cifra de transaminasas, hasta una dosis de mantenimiento de 2,5 mg-5 mg/día. Según los protocolos de los distintos centros se puede añadir Azatioprina (para disminuir la dosis de corticoides, si se detiene la bajada en la cifra de transaminasas sólo con los corticoides o por protocolo a las 2 semanas del inicio del tratamiento). La dosis inicial es de 0.5 mg/K/día hasta un máximo de 2-2.5 mg/K/día. Se debe realizar un control seriado por el riesgo de hepatotoxicidad principalmente en sujetos con cirrosis y en los que cursa con importante ictericia.
Los tratamientos alternativos se utilizan si presentan importantes efectos adversos con el tratamiento con corticoides en la inducción y en los casos refractarios al tratamiento estándar. Los fármacos empleados son: ciclosporina, tacrolimus, micofenolato y rituximab, infliximab, TNF-alfa y sirolimus.
Las actuales recomendaciones son mantener el tratamiento al menos 2-3 años y sólo intentar la retirada si en el año previo los niveles de transaminasas y la cifra de IgG están normalizadas y los Acs son negativos. Se aconseja realizar una biopsia hepática previa para confirmar la ausencia de inflamación. Sólo alrededor del 20 % de los pacientes con AIH-1 logran mantener la remisión tras la retirada del tratamiento, mientras que en AIH-2 la recaída es casi la regla. La interrupción del tratamiento no debe realizarse en torno a la pubertad porque las recaídas son más frecuentes(33).
La colangitis esclerosante es una inflamación crónica de las vías biliares intra y extrahepáticas que produce un daño biliar y fibrosis progresiva. Su diagnóstico se basa en la visualización del árbol biliar mediante colangiografía
La colangitis esclerosante es una inflamación crónica de las vías biliares intra y extrahepáticas que produce un daño biliar y fibrosis progresiva. Su diagnóstico se basa en la visualización del árbol biliar mediante colangiografía. La colangitis esclerosante autoinmune (CEA) es un término todavía universalmente no aceptado, aunque cada vez se está empleando más en el campo pediátrico y en adultos. La clínica y la serología son similares a la HAI-1 pero presenta lesión en los conductos biliares sólo demostrables mediante colangiografía. Afecta a varones en un 50 % y se caracteriza por pérdida de peso, dolor abdominal e ictericia intermitente. Un 90 % de los casos presentan elevación de los niveles de IgG y la mayoría son seropositivos ANA+ y/o músculo liso. Los p-ANCA pueden ser positivos en el 75 %. Se asocia con enfermedad inflamatoria intestinal (EII) en el 45 % de los casos. El síndrome de “overlap” o superposición hace referencia cuando comparten características de HAI y CEA, siendo más frecuente en niños que en adultos.
Si se inicia el tratamiento de forma precoz, la lesión del parénquima hepático puede responder bien en términos de normalización de los parámetros bioquímicos e inmunológicos con el mismo tratamiento empleado para las HAI. En un 50 % de los casos la lesión es progresiva a pesar del tratamiento, principalmente son aquellos asociados a EII de difícil control. El tratamiento inmunosupresor es efectivo en un 50 % de los casos, consiguiéndose controlar la enfermedad parenquimatosa y biliar.
Hepatitis tóxicas
Para el diagnóstico de las hepatitis tóxicas es necesario un alto índice de sospecha. Entre los adolescentes el consumo voluntario de altas dosis de paracetamol es una causa muy frecuente de fallo hepático. Debemos estar alerta para abordar los problemas psicológicos y sociales que empujan al adolescente a esta situación
La lesión hepática producida por fármacos conocida como DILI (de las siglas en inglés Drug-Induced Liver Injury) es la causa más frecuente identificable de fallo hepático agudo en adolescentes. La ingesta de ciertos fármacos como el paracetamol, de forma accidental o con fines autolíticos, y de otras sustancias como productos de herbolario y suplementos dietéticos, utilizados con el fin de ganar masa muscular, supone una causa importante de hepatitis en los países desarrollados, siendo la población adolescente proclive al consumo de estas sustancias.
El mecanismo patogénico puede ser por una hepatotoxicidad intrínseca del fármaco relacionada con la dosis y/o exposición prolongada, como ocurre con la intoxicación por paracetamol, o por una reacción idiosincrásica no dependiente de la dosis administrada que cursa con un periodo de latencia variable. Además algunos fármacos pueden desencadenar una reacción autoinmune(34).
La clínica es variable. Pueden presentarse con una elevación aislada de GGT (fenobarbital, fenitoína) o con datos de necrosis hepatocelular (elevación de transaminasas) y clínica semejante a una hepatitis vírica (fiebre, naúseas, vómitos, dolor en hipocondrio derecho). Los casos más graves pueden evolucionar a un fallo hepático agudo. En ocasiones se puede desencadenar una reacción alérgica con eosinofilia, rash, fiebre y adenopatías (Síndrome de DRESS) e incluso un fallo multiorgánico.
Otras formas de presentación menos frecuentes son:
- Los cuadros principalmente colestáticos
- La aparición de granulomas (carbamacepina)
- La presentación como hepatitis crónica
- Las que asocian lesiones del endotelio vascular (enfermedad veno-oclusiva, principalmente por tratamientos quimioterápicos) y
- Desarrollo de síndrome de Reye (ácido valproico)
El diagnóstico conlleva un alto índice de sospecha mediante una anamnesis detallada de todos los fármacos y sustancias que se han ingerido 3 meses antes, las dosis recibidas y excluir otras causas de afectación hepática (hepatitis víricas, autoinmunidad…). La mejoría tras la suspensión del fármaco apoya el diagnóstico. En hasta dos tercios de los casos pueden presentar autoanticuerpos positivos (ANA, AML) lo que plantea el diagnóstico diferencial con las hepatitis autoinmunes. En esta situación puede ser útil la realización de una biopsia hepática. Para el tratamiento, además de la retirada del fármaco, se pueden considerar los corticoides en caso de hepatitis graves con datos de hipersensibilidad y en los casos de hepatitis autoinmune inducida por drogas(35).
En el caso de la intoxicación por paracetamol se debe iniciar lo más precozmente el tratamiento con N-acetilcisteina y la derivación precoz a un centro de trasplante hepático si presenta acidosis, elevación importante de transaminasas y/o coagulopatía.
Tablas y figuras
Tabla I. Características de la serología de la hepatitis B
|
SITUACIONES |
HBsAg |
Anti HBs |
Anti HBc |
HBeAg |
Anti HBe |
Carga viral |
ALT |
|
Vacunación |
– |
+ |
– |
– |
– |
– |
N |
|
Hepatitis B aguda |
+ |
– |
+ |
+ |
– |
> 105 cop/ml |
↑ ↑ ↑ |
|
Hepatitis B resuelta |
– |
+ |
+ |
– |
+/- |
– |
N |
|
Infección crónica |
+ |
– |
+ |
+ |
– |
> 105 cop/ml |
N |
|
Hepatitis crónica |
+ |
– |
+ |
+ |
– |
> 105 cop/ml |
↑ ↑ |
|
Infección crónica |
+ |
– |
+ |
– |
+ |
<105 cop/ml |
N/leve ↑ |
|
Hepatitis crónica |
+ |
– |
+ |
– |
+ |
> 105 cop/ml |
↑ ↑ |
Elaboración propia.
Tabla II. Tratamiento de la hepatitis B crónica(14)
|
INDICACIONES DEL TRATAMIENTO DE LA HEPATITIS B EN NIÑOS |
|
Tabla III. Fármacos empleados en el tratamiento de la hepatis B crónica
|
FÁRMACO |
DOSIS |
VENTAJAS |
DESVENTAJAS |
|
IFN-α |
5-10M unid/m² sc tres veces a la semana |
No resistencias Duración 48 sem Niños > 1año |
Efectos adversos: síntomas gripales, neutropenia, plaquetopenia, depresión, exarcebación de procesos autoinmunes Via parenteral No en cirrosis descompensada |
|
PegIFN-α-2a |
180 µg/1,73 m2 sc |
No resistencias Semanal Niños >2 años |
Las mismas que el IFN- α |
|
Lamivudina |
3 mg/K/día oral. Max 100 mg/día |
Pocos efectos adversos Niños >3 años |
Elevado riesgo de resistencias con el tiempo (>80 % a los 2 años) Favorece las resistencias a otros fármacos: telbivudina y entecavir |
|
Adefovir |
10 mg/día |
Eficaz en pacientes con resistencias a lamivudina Niños >12 años |
Elevado riesgo de resistencias con el tiempo (30 % a los 5 años) Nefrotoxicidad Reducción de la masa ósea |
|
Entecavir |
0,015 mg/K/día. Max 0,5 mg/día |
Oral Niños >2 años Pocos efectos adversos Alta potencia Baja resistencias (alta barrera genética) |
Menos eficaz frente VHB resistente a lamivudina |
|
Tenofovir (Disoproxil fumarato) |
8 mg/K/día. Max 300 mg |
Oral Niños >2 años Mínimos efectos adversos Alta potencia No resistencias Eficaz en casos de resistencia a lamivudina |
Leve toxicidad renal y reducción de la densidad ósea |
|
Tenofovir alafenamida |
25 mg día |
En casos de >12 años, enfermedad ósea e IRC |
sc: superficie corporal, IRC: insuficiencia renal crónica. IFN: interferón; M: millón; unid: unidades; m2: metro cuadrado, µg: microgramo, mg: miligramos, K: kilo; Max: máximo.
Tomada de: Vega A, Lledín M. Hepatitis víricas. Pediatr Integral 2020.
Tabla IV. Pauta de tratamiento frente a la hepatitis C
|
Guías ESPGHAN 2019 Pacientes entre 12-17 años ó > 35 Kg GENOTIPO 1,4 (5,6) Sofosbuvir/Ledispavir (HARVONI) 12s. (8s si viremia < 6x 10) RVS 98-100 % GENOTIPO 2 y 3: sofosbuvir + Ribavirina 12s (G2) o 24s (G3). RVS 97-100 % GENOTIPOS 1-6: Glecaprevir + Pibrentasvir ( Maviret) 8 s excepto cirrosis (12 s) y GENOTIPO3 : 16 semanas (Estudio Dora) RVS 100 % (incluido VIH) |
|
Recomendación ESPGHAN 2023 Pendiente aprobación para todos los niños > de 3 años ADD Pangenómico o específico |
s: semanas; RVS: respuesta viral sostenida; G2: genotipo 2; G3: genotipo 3.
Tabla V. Hepatitis no víricas(32)
|
GÉRMEN |
CARACTERÍSTICAS |
|
Listeria Monocytogenes |
Riesgo en pacientes inmunodeprimidos y recién nacidos |
|
Salmonella typhi |
Fiebre tifoidea. Poco frecuente: colecistitis, hepatitis fulminante y abscesos |
|
Yersinia enterocolitica |
Causa enteritis e infección sistémica Ascitis y abscesos hepáticos |
|
Actinomyces spp. |
Pacientes inmunodeprimidos Abscesos hepáticos |
|
Legionella pneumophila |
Pacientes inmunodeprimidos |
|
Mycobacterias |
Vacunación con BCG en inmunodeprimidos puede producir hepatitis granulomatosa Diseminación hematógena con +/- afectación pulmonar. Manifestaciones: hepatitis, granulomas, abscesos o tuberculoma Vigilar hepatotoxicidad con el tratamiento: (isoniacida, rifampicina, entre otros) |
|
Bartonella henselae |
Enfermedad por arañazo de gato. 1-2 % hepatitis como complicación. Granulomas necrotizantes |
|
Brucellosis |
Ingestión de leche no pasteurizada. Cuadro de fiebre, malestar, linfadenopatias, dolor abdominal y artralgias |
|
Leptospirosis |
En personas con contacto con animales: veterinarios, ganaderos, baño en aguas contaminadas |
|
Treponema pallidum |
En caso de sífilis congénita y por transmisión sexual |
|
Rickettsia |
Fiebre Q: fiebre, síntomas GI, rash, hepatitis |
|
Malaria |
Ictericia por hemólisis. Se puede presentar también leve disfunción hepática hasta fallo hepático |
|
Toxoplasmosis |
Ingestión de comida contaminada o transmisión prenatal Infección adquirida: fiebre, cansancio, adenopatías, hepatitis |
|
Quistes hidatídicos |
Echinococcus granulosus: quistes hepáticos y pulmonares |
|
Ascaris lumbricoides |
Migración del intestino a la vía biliar: colangitis y abscesos |
|
Toxocara canis y catis |
Contacto con animales |
|
Leishmaniasis visceral |
Hepatoesplenomegalia con disfunción hepática. Afectación de la médula ósea (pancitopenia) |
|
Fasciola hepática |
Invade la vía biliar. Produce síntomas alérgicos (urticaria, eosinofilia) |
|
Candida |
Infecciones en inmunodeprimidos (neutropenia, trasplantes). Vía intestinal o vía hematógena. Cursa con hepatoesplenomegalia, fiebre, abscesos… |
|
Aspergillus |
En inmunodeprimidos. Alta mortalidad |
|
Histoplamosis |
Inmunocomprometidos. Infección pulmonar inicial, se puede diseminar produciendo hepatoesplenomegalia |
|
Cryptococci |
En inmunocomprometidos. Puede producir infección diseminada o afectación de la vía biliar como colangitis y obstrucción |
Elaboración propia.
Figura 1. Fases de la hepatitis A
VHA : virus hepatitis A; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; IgG: inmununoglobulina G, IgM: inmununoglobulina M.
Elaboración propia.
Figura 2. Fases de la hepatitis B crónica
Tomada de: EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection.
Figura 3. Esquema del ciclo de replicación del VHB(12)
El VHB se internaliza en el hepatocito por la unión de las proteínas de la superficie a receptores de la célula y la cápside (partícula core) se libera en el citoplasma y migra hacia el núcleo; allí, su genoma se recompone en una forma circular cerrada de enlaces covalentes de DNA (ccc DNA) que se transcribe a un RNA. Sale al citoplasma y comienza la síntesis de las proteínas virales: de superficie, core, polimerasa y proteína X que se acabarán ensamblando formando las cápsides y en el interior se incluirá una cadena de ARN, que mediante la transcriptasa inversa, sintetizará el ADN viral. Algunas de estas partículas se exportarán al exterior y otras volverán al núcleo del hepatocito para dar lugar de nuevo a cccDNA, constituyendo un reservorio del virus. En ocasiones, se produce la integración del genoma del virus en el cromosoma del hepatocito, lo que puede favorecer el desarrollo de hepatocarcinoma (HCC).
Figura 4. Esquema del VHC y acción de los Antivirales de Acción Directa (AAD)
Tomada de: Vega A, Lledín M. Hepatitis víricas. Pediatr Integral 2020.
Bibliografía
1. Epidemiológica RNdV. Informe epidemiológico sobre la situación de la hepatitis A en España. 2019-2020.
2. Moraga Llop F. Calendario de vacunaciones del adolescente. Adolescere. 2021;9:17-27.
3. Lemon SM, Ott JJ, Van Damme P, Shouval D. Type A viral hepatitis: A summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J Hepatol. 2017.
4. Comité Asesor de Vacunas (CAV-AEP). Hepatitis A. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; abr/2023. Disponible en: http://vacunasaep.org/documentos/manual/cap-28.
5. Barnaud E, Rogee S, Garry P, Rose N, Pavio N. Thermal inactivation of infectious hepatitis E virus in experimentally contaminated food. Appl Environ Microbiol. 2012;78(15):5153-9.
6. Fischler B, Baumann U, Dezsofi A, Hadzic N, Hierro L, Jahnel J, et al. Hepatitis E in Children: A Position Paper by the ESPGHAN Hepatology Committee. J Pediatr Gastroenterol Nutr. 2016;63(2):288-94.
7. Buti M, Plans P, Dominguez A, Jardi R, Rodriguez Frias F, Esteban R, et al. Prevalence of hepatitis E virus infection in children in the northeast of Spain. Clin Vaccine Immunol. 2008;15(4):732-4.
8. Kamar N, Mallet V, Izopet J. Ribavirin for chronic hepatitis E virus infection. N Engl J Med. 2014;370(25):2447-8.
9. Gerolami R, Borentain P, Raissouni F, Motte A, Solas C, Colson P. Treatment of severe acute hepatitis E by ribavirin. J Clin Virol. 2011;52(1):60-2.
10. Zhang J, Zhang XF, Huang SJ, Wu T, Hu YM, Wang ZZ, et al. Long-term efficacy of a hepatitis E vaccine. N Engl J Med. 2015;372(10):914-22.
11. Indolfi G, Easterbrook P, Dusheiko G, Siberry G, Chang MH, Thorne C, et al. Hepatitis B virus infection in children and adolescents. Lancet Gastroenterol Hepatol. 2019;4(6):466-76.
12. Lledín M. Hepatitis víricas. Pediatr Integral 2020; XXIV (1): 15 – 27.
13. Bortolotti F, Guido M, Bartolacci S, Cadrobbi P, Crivellaro C, Noventa F, et al. Chronic hepatitis B in children after e antigen seroclearance: final report of a 29-year longitudinal study. Hepatology. 2006;43(3):556-62.
14. Sokal EM, Paganelli M, Wirth S, Socha P, Vajro P, Lacaille F, et al. Management of chronic hepatitis B in childhood: ESPGHAN clinical practice guidelines: consensus of an expert panel on behalf of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Hepatol. 2013;59(4):814-29.
15. Hierro Lanillo L. En: SEGHNP. Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica. Madrid: Ergon S.A ; 2021.p.423-4322021.
16. Jeng WJ, Papatheodoridis GV, Lok ASF. Hepatitis B. Lancet. 2023;401(10381):1039-52.
17. Hou JL, Zhao W, Lee C, Hann HW, Peng CY, Tanwandee T, et al. Outcomes of Long-term Treatment of Chronic HBV Infection With Entecavir or Other Agents From a Randomized Trial in 24 Countries. Clin Gastroenterol Hepatol. 2020;18(2):457-67 e21.
18. Stinco M, Rubino C, Trapani S, Indolfi G. Treatment of hepatitis B virus infection in children and adolescents. World J Gastroenterol. 2021;27(36):6053-63.
19. Jackson S, Lentino J, Kopp J, Murray L, Ellison W, Rhee M, et al. Immunogenicity of a two-dose investigational hepatitis B vaccine, HBsAg-1018, using a toll-like receptor 9 agonist adjuvant compared with a licensed hepatitis B vaccine in adults. Vaccine. 2018;36(5):668-74.
20. Pattyn J, Hendrickx G, Vorsters A, Van Damme P. Hepatitis B Vaccines. J Infect Dis. 2021;224(12 Suppl 2):S343-S51.
21. World Health O. Hepatitis B vaccines: WHO position paper, July 2017 – Recommendations. Vaccine. 2019;37(2):223-5.
22. Comité Asesor de Vacunas (CAV-AEP). Hepatitis B. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2023. Disponible en: http://vacunasaep.org/documentos/manual/cap-29.
23. Dusheiko G. A Shift in Thinking to Reduce Mother-to-Infant Transmission of Hepatitis B. N Engl J Med. 2018;378(10):952-3.
24. Loglio A, Ferenci P, Uceda Renteria SC, Tham CYL, Scholtes C, Holzmann H, et al. Safety and effectiveness of up to 3 years’ bulevirtide monotherapy in patients with HDV-related cirrhosis. J Hepatol. 2022;76(2):464-9.
25. Roznovsky L, Kabieszova L, Mrazek J, Kloudova A, Petrousova L, Orsagova I, et al. [Vertical hepatitis C transmission – authors’ experiences]. Klin Mikrobiol Infekc Lek. 2018;24(4):105-10.
26. Camarena C. Camarena C. Hepatitis crónica. Pediatr Integral 2015; XIX (3): 205-213.
27. Fauteux-Daniel S, Larouche A, Calderon V, Boulais J, Beland C, Ransy DG, et al. Vertical Transmission of Hepatitis C Virus: Variable Transmission Bottleneck and Evidence of Midgestation In Utero Infection. J Virol. 2017;91(23).
28. Indolfi G, Resti M. Perinatal transmission of hepatitis C virus infection. J Med Virol. 2009;81(5):836-43.
29. de Ledinghen V, Le Bail B, Rebouissoux L, Fournier C, Foucher J, Miette V, et al. Liver stiffness measurement in children using FibroScan: feasibility study and comparison with Fibrotest, aspartate transaminase to platelets ratio index, and liver biopsy. J Pediatr Gastroenterol Nutr. 2007;45(4):443-50.
30. Indolfi G, Hierro L, Dezsofi A, Jahnel J, Debray D, Hadzic N, et al. Treatment of Chronic Hepatitis C Virus Infection in Children: A Position Paper by the Hepatology Committee of European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018;66(3):505-15.
31. Murray KF, Balistreri WF, Bansal S, Whitworth S, Evans HM, González-Peralta RP, et al. Safety and Efficacy of Ledipasvir-Sofosbuvir With or Without Ribavirin for Chronic Hepatitis C in Children Ages 6-11. Hepatology. 2018;68(6):2158-66.
32. Lissauer SR, S. Non-viral infectious liver disease. En:Deirdre A.Kelly,eds. Disease of the liver and biliary system in children.U.K. John Wiley &Sons Ltd.;2017.p259-270.
33. Terziroli Beretta-Piccoli B, Mieli-Vergani G, Vergani D. Autoimmmune hepatitis. Cell Mol Immunol. 2022;19(2):158-76.
34. Codoñer Franch PdlRF, L. Hepatitis agudas (virales y tóxicas).En: Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica.eds SEGHNP. Madrid:Ergon S.A.; 2021.p.409-421.
35. Ebel N, Murray,KF. Drug-induced liver disease. En:Deirdre A.Kelly,eds. Disease of the liver and biliary system in children.U.K. John Wiley &Sons Ltd.;2017.p169-190.
Bibliografía recomendada
- Lemon SM, Ott JJ, Van Damme P, Shouval D. Type A viral hepatitis: A summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J Hepatol. 2017.
- Fischler B, Baumann U, Dezsofi A, Hadzic N, Hierro L, Jahnel J, et al. Hepatitis E in Children: A Position Paper by the ESPGHAN Hepatology Committee. J Pediatr Gastroenterol Nutr. 2016;63(2):288-94.
- Sokal EM, Paganelli M, Wirth S, Socha P, Vajro P, Lacaille F, et al. Management of chronic hepatitis B in childhood: ESPGHAN clinical practice guidelines: consensus of an expert panel on behalf of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Hepatol. 2013;59(4):814-29.
- Indolfi G, Hierro L, Dezsofi A, Jahnel J, Debray D, Hadzic N, et al. Treatment of Chronic Hepatitis C Virus Infection in Children: A Position Paper by the Hepatology Committee of European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018;66(3):505-15.
- Vega A, Lledín M. Hepatitis viricas. Pediatr Integral 2020; XXIV (1): 15 – 27.