Infecciones óseas: artritis, osteomielitis, piomiositis, espondilodiscitis
Infecciones óseas: artritis, osteomielitis, piomiositis, espondilodiscitis
J. Cabello Blanco(1), M. Cuesta Rodríguez(2), P. Manzarbeitia Arroba(3), H. Garlito Díaz(4)
(1)Hospital Universitario La Paz. Sección Traumatología Infantil. Madrid. (2)Pediatría Centro Salud Colmenar Viejo Sur, Colmenar Viejo. Madrid. (3,4)Servicio de Traumatología Infantil Hospital Infantil Niño Jesús, Madrid
Fecha de recepción: 17-07-2023
Fecha de publicación: 31-10-2023
Adolescere 2023; XI(3): 64-72
Resumen
|
Las infecciones musculoesqueléticas en la adolescencia varían en su forma de presentación ya que cualquier articulación, músculo o hueso puede afectarse. Las pruebas de imagen son necesarias para limitar el alcance de la afectación especialmente en casos no respondedores a antibioterapia. El tratamiento será multidisciplinar entre cirujanos y pediatras, especialmente en casos no respondedores y pacientes con implantes. El tratamiento precoz y el diagnóstico diferencial con otras entidades puede suponer un reto diagnóstico y terapéutico, debiendo descartar patología oncológica. Palabras clave: Osteomielitis; Artritis séptica; Piomiositis; Infección musculoesquelética. |
Abstract
|
Pediatric musculoskeletal infections vary in presentation as any joint, muscle or bone may be affected. Advanced imaging tests are needed to further delimit extension of cases resistant to antibiotherapy. Multidisciplinary teams between surgeons and paediatricians are needed, especially for those cases with metallic implants or those non-responders. Prompt treatment and differential diagnosis are sometimes challenging, and effort must be taken to rule out oncologic pathology. Key words: Osteomyelitis; Septic arthritis; Pyomyositis; Musculoskeletal infection. |
Introducción
Las infecciones musculoesqueléticas en la adolescencia son particulares por su menor frecuencia y por los, en ocasiones, difíciles diagnósticos diferenciales. El espectro de presentación es amplio, desde pequeños abscesos intraóseos con poca clínica respondedores a antibiótico hasta grandes pandiafisitis, complicadas en casos de material de osteosíntesis.
La presencia de fisis abiertas condiciona el tratamiento en ciertos casos con afectación cerca de la fisis. En ocasiones es necesario cirugía ortopédica compleja para tratar las secuelas de la infección.
Es necesario trabajo multidisciplinar de pediatría, cirugía ortopédica, radiología, microbiología y anatomía patológica para ofrecer los mejores resultados
El tratamiento precoz y dirigido será el objetivo del facultativo, que actuará en la medida de lo posible en equipos multidisciplinares con pediatras, cirujanos ortopédicos, radiólogos, microbiólogos y patólogos.
No es el objetivo de este tema el tratamiento de las infecciones en lactantes ni menores de 5 años, sino en adolescentes. Son conceptos similares, pero variarán ciertos detalles del manejo antibiótico y quirúrgico.
Osteomielitis
El pus en la articulación daña de manera irreversible el cartílago. El hueso en la osteomielitis regenera mejor
La osteomielitis en adolescentes puede originarse por vía hematógena o bien por infección postraumática o bien postquirúrgica. La magnitud de la afectación dependerá de la agresividad del patógeno y del tiempo hasta tratamiento, siendo en general infecciones lentas, de evolución en semanas, algunas incluso meses.
En casos agudos piensa en S.aureus. En infecciones crónicas amplía el espectro, incluso piensa en M.tuberculosis en afectación vertebral
El patógeno más frecuentemente implicado es el Staphylococcus aureus en las hematógenas (cepas sensibles SAMS), pero otros organismos deben ser sospechados según el origen de la infección. De este modo una infección postquirúrgica suele venir asociada a S. epidermidis o aureus y una infección postraumática dependerá del medio donde se produzca la herida. En casos de origen en zonas con alta tasa de S. aureus resistente a meticilina (SARM) como Estados Unidos, Latinoamérica o Europa del este habrá que valorar este agente etiológico. La variante de S. Aureus productor de toxinas PVL (proteína pantón-valentine) es infrecuente en nuestro medio pero se debe considerar en casos de “metástasis” sépticas a otros huesos, donde resulta especialmente osteolítico(1).
Exploración física
El síntoma característico es el dolor. Cuanto más cerca del periostio suelen cursar con más dolor, que se exacerba si rompe cortical e irrita periostio directamente. A mayor magnitud de afectación ósea, hay mayor respuesta de partes blandas y aparecerá edema, aumento de temperatura y tumoración local. Cuando la articulación está libre de infección, no debería ser especialmente doloroso el rango articular, que sí que es típicamente sintomático en casos de artritis séptica.
En infecciones de curso lento no siempre está presente la fiebre, o si está no cursa con fiebre alta. El mal estado general y fiebre alta nos debe hacer sospechar en una infección que se ha pasado a tejidos blandos o a la articulación.
Si no hay buena evolución tras los primeros días de antibiótico, vuelve a pensar, vuelve a hacer imagen, vuelve a biopsiar o vuelve a abrir
Diagnóstico
La primera aproximación a un dolor óseo localizado es una radiografía. La imagen lítica geográfica y la reacción perióstica nos pueden hacer sospechar. Imágenes apolilladas, permeativas, con grandes reacciones periósticas nos plantearán diagnóstico oncológico.
Mientras que en una articulación debemos ser rápidos en tratar la infección por deterioro del cartílago articular, en el caso de una osteomielitis el tiempo apremia menos y podemos esperar unos días si fuera necesario para tener una resonancia magnética (RM). La RM con y sin contraste es la prueba de elección para delimitar la extensión de la osteomielitis y realizar el diagnóstico diferencial con los tumores.
La gammagrafía muestra aumento captación local, con buena sensibilidad pero baja especificidad. Se emplea cuando es más rápida su disponibilidad que la RM o se sospecha afectación multifocal u oncológica.
Los hemocultivos solo son positivos en 30-50 % de los casos mientras que el rendimiento del cultivo de material de biopsia es mayor(1). Por ello, si hay dudas diagnósticas o la evolución con un tratamiento empírico inicial no es buena, se debe indicar biopsia guiada por TAC o bien por ecografía si hay absceso subperióstico localizable en la ecografía. En caso de biopsia, debemos retirar tratamiento antibiótico con la suficiente antelación para no bajar rendimiento del cultivo, o incluso planear la biopsia antes de iniciar el tratamiento antibiótico.
Los reactantes de fase aguda proteína C reactiva (PCR) y velocidad de sedimentación están generalmente aumentados, pero hay en torno a un tercio de osteomielitis que no aumentan sus valores (los casos más crónicos), o bien en las fases iniciales no aumentan los valores. Usaremos el valor de la PCR en esos casos en los que sí aumente para monitorizar la evolución del tratamiento, disminuyendo sus niveles hasta normalizarse a los 7-10 días de tratamiento antibiótico (si hay cirugía el efecto de la cirugía tamiza la bajada de PCR).
Tratamiento
En ausencia de absceso en pruebas de imagen, el tratamiento antibiótico se inicia, de acuerdo con el equipo de infecciosas, en función de la sospecha etiológica. Para osteomielitis es de elección el tratamiento intravenoso, aunque se ha descrito éxito en casos de Brodie sin afectación sistémica con tratamiento exclusivamente oral(2).
La duración del tratamiento varía según los protocolos. En el contexto histórico de malos resultados se optaba por tratamientos prolongados de meses. Desde el empleo de la RM para descartar los casos con colecciones drenables (y que no evolucionaban bien con tratamiento antibiótico) podemos optar por terapias menos largas y vigiladas según parámetros analíticos (PCR, VSG), clínicos (dolor, rango articular) y de imagen (controles con RM y radiografía). Se describen distintas pautas que combinan en torno a una semana de antibiótico intravenoso con 2-5 semanas más de tratamiento oral(3,4). Microorganismos más resistentes o productores de toxinas necesitan duraciones más largas(1).
La elección del antibiótico en ausencia de antibiograma será de manera empírica con cefalosporinas de primera generación (mucha experiencia en nuestro medio con cefadroxilo oral) o cloxacilina en casos de staphylococos sensibles (MSSA) o bien clindamicina o vancomicina en sospecha de staphylococo resistente (MRSA) (Tabla I). El enfoque del tratamiento empírico será en función de las recomendaciones del centro según el porcentaje de resistencias detectadas en microbiología y de la sospecha etiológica, por ejemplo, el conocimiento de infecciones en la familia del paciente por tener un portador de bacterias resistentes por comorbilidades o originarse de una zona endémica de patógenos menos frecuentes en nuestro medio(1,5).
El tratamiento adyuvante con antiinflamatorios y analgésicos está recomendado, no así el uso de corticoides. El consenso actual contempla usar corticoides solo en casos de infecciones confirmadas con gran componente inflamatorio(1).
El papel de la radiología intervencionista está en la biopsia de aquellos casos con imagen dudosa en RM o de cara a cultivo para antibioterapia dirigida. La cirugía está indicada en casos con abscesos formados, para drenaje, como es el caso de abscesos subperiósticos o bien en artritis sépticas que se complican a abscesos óseos por proximidad. Se estima en el 90 % de casos tratables solo con antibioterapia(1,3).
Absceso Brodie
La duración del tratamiento para infecciones musculoes-queléticas es de semanas. Una intravenoso y dos o más orales
Se trata de una osteomielitis subaguda en la zona metafisaria de huesos largos, típicamente en fémur y tibia y en regiones alrededor de la fisis, pasando a ambos lados en ocasiones. Son infecciones muy larvadas, de meses de evolución y que no siempre cursan con elevación de reactantes ni fiebre. Es típico el dolor leve, con el estiramiento de musculatura perilesional. En ocasiones cojera e inflamación local(2).
A nivel radiológico se presenta como una lesión lítica geográfica metafisaria, con imágenes características en la RM (Figura 1).
El tratamiento clásico es el drenaje quirúrgico, seguido de tratamiento antibiótico intravenoso y posteriormente oral en ciclos y elección de antibiótico como las osteomielitis agudas. El riesgo de lesión fisaria en el tratamiento quirúrgico cuando el absceso está en contacto con la fisis es muy alto y se intenta una primera fase de tratamiento con antibiótico.
Pandiafisitis
Se hace referencia aquí a un estadío avanzado de la osteomielitis, cuando se cronifica y afecta a una gran longitud de la diáfisis de los huesos largos. Es, por tanto, una osteomielitis crónica que cursa con cambios anatómicos óseos. Hay grandes reacciones periósticas que forman hueso nuevo (involucro) alrededor de zonas de hueso muerto (secuestro óseo).
Las partes blandas están afectadas, con tumoración en todo el miembro, eritema y presencia habitualmente de fístulas (Figura 2).
Cuando están muy evolucionadas, el diagnóstico radiológico y clínico es evidente, pero en una fase sin fístulas las imágenes radiológicas son muy parecidas a las de un sarcoma de Ewing diafisario. La biopsia se vuelve entonces necesaria, incluso repitiendo biopsia unas semanas más tarde. Los autores cuentan con experiencia de casos diagnosticados de osteomielitis que en una segunda biopsia semanas más tarde se realiza cambio de diagnóstico a sarcoma de Ewing.
Las infecciones muy crónicas con necrosis necesitan tratamientos con resecciones casi tumorales del hueso necrótico ya que allí no llegaría el antibiótico
Hay que entender que las zonas de hueso muerto tienen carga bacteriana pero no tienen biodisponibilidad de antibiótico ya que no tienen vascularización. Por esta razón, se asocia tratamiento antibiótico intravenoso y oral prolongado (ya no semanas como en las osteomielitis agudas sino meses) junto con cirugía de resección de zonas necróticas. En ocasiones, se tratan de manera casi oncológica, haciendo resecciones completas de grandes segmentos óseos (Figura 2) que generan defectos segmentarios subsidiarios de complejas reconstrucciones de injertos óseos.
Diagnóstico diferencial
Merece un apartado especial el diagnóstico diferencial, siendo común la confusión entre ciertas entidades de distinto pronóstico y tratamiento.
La clínica es característica de que algo está ocurriendo pero no nos vale para el diagnóstico ya que no es constante la presencia de fiebre en la infección ósea. Asimismo, no todas las infecciones óseas cursan con parámetros analíticos VSG y PCR elevadas.
Hay dos entidades típicas que hay que tener en mente en el diagnóstico diferencial: sarcoma de Ewing y la osteomielitis crónica multifocal recurrente (el primer episodio, cuando aún no sabes que es multifocal ni recurrente). La RM no siempre es capaz de diferenciarlas y la biopsia se hace necesaria (Figura 3).
Ciertas osteomielitis son realmente confusas con el sarcoma de Ewing así que cultiva lo que biopsies y biopsia lo que cultives
En los procedimientos de biopsia se realiza una toma de muestra con aguja gruesa para mandar un cilindro a anatomía patológica y otro a microbiología. Según la zona de la biopsia, en un caso de sarcoma (punción no arrastra centro sarcoma y se queda en hueso periférico) podemos encontrar cambios óseos reactivos y por lo tanto obtener un informe de infiltrado mononuclear inflamatorio crónico. En esos casos la microbiología será negativa, pero también es negativa en la osteomielitis aséptica recurrente y en alguna infección, bien por ser muy crónica o por haber estado “contaminada” con antibiótico antes de la toma de muestra.
Artritis séptica
Las infecciones articulares son una urgencia ortopédica ya que la presencia de material purulento (y las proteasas secretadas por los macrófagos) dañan de manera irreversible el cartílago articular. Lo hacen de manera aguda y a distancia en el tiempo. Tras infecciones graves articulares son típicas las osteocondritis disecantes múltiples en el primer año de la infección. La diseminación por contigüidad de una artritis séptica genera abscesos intraóseos periarticulares e incluso puede progresar a piomiositis con grave afectación del estado general (Figura 4).
Las artritis sépticas son típicas en niños pequeños más que en adolescentes, sin embargo, los casos que vemos en adolescentes suelen responder menos a tratamiento antibiótico exclusivo y necesitan drenaje quirúrgico(5). El patógeno más frecuentemente implicado en artritis sépticas en adolescentes es S. aureus(6).
Las artritis sépticas en adolescentes suelen responder menos al tratamiento antibiótico exclusivo, y necesitan drenaje quirúrgico
El diagnóstico viene dado por la clínica (dolor al mover la articulación, derrame articular, fiebre), el aumento de reactantes de fase aguda, la ecografía articular con derrame presente y la artrocentesis de material purulento. El análisis del líquido articular verá elevadas las proteínas y células. La presencia de cocos grampositivos es detectable rápidamente en la urgencia, sin embargo el cultivo tardará unos días, en los que el paciente debería estar en tratamiento activo ya.
El primer pilar del tratamiento es evacuar el material purulento de la articulación. Hay tres métodos con una misma filosofía de lavado: la artroscopia articular, la artrotomía y el lavado por artrocentesis. Los dos primeros necesitan de un quirófano y cirujano ortopédico. El lavado por artrocentesis puede hacerse por un pediatra en sala de sedaciones. Los dos primeros son lavados más definitivos, con grandes cantidades de suero que arrastran el material purulento. El lavado por artrocentesis elimina el material presente que sea capaz de salir a través de la aguja. Necesita varias sedaciones para ir eliminando el derrame articular según se va produciendo. A este respecto técnico existen discrepancias entre la perspectiva del cirujano ortopédico y del pediatra. En el caso de optar por lavados con artrocentesis, si los reactantes no bajan y la clínica no mejora se debe ampliar estudio con RM para valorar la presencia de abscesos periarticulares óseos o a musculatura (Figura 4). Tras el estudio, la cirugía con artrotomía o artroscopia no debería demorarse. Incluso en casos tratados inicialmente con cirugía abierta, la ausencia de buena evolución en 2-3 días será indicación de hacer RM y en ciertos casos nueva cirugía.
El segundo pilar es el tratamiento antibiótico. Será empírico dirigido contra Staphylococos, hasta disponer de antibiograma. Idealmente la artrocentesis será previa a la introducción del antibiótico. Hay consenso en iniciar tratamiento intravenoso y pasar a oral cuando quede probada la buena evolución clínica, hasta completar 2-3 semanas. En casos de asociación a osteomielitis se prolonga hasta las 4-8 semanas(6).
Espondilodiscitis
La espondilodiscitis en adolescentes cursa con dolor local con fiebre, elevación de reactantes y pruebas complementarias de imagen. El agente etiológico más frecuente es el S.aureus
En las infecciones vertebrales, hay un espectro de infecciones entre la osteomielitis vertebral (“espóndilo”) y la infección del disco (“discitis”). Nos referimos a espondilodiscitis, asumiendo que vértebra y disco pueden estar implicadas.
Son infecciones propias de la edad infantil más que la adolescencia. En niños pequeños el diagnóstico necesita cierta sospecha por dificultades en comunicar los síntomas y nos fijamos en cosas como dificultad para sentarse, cojera o malestar general. En adolescentes la comunicación del dolor local con fiebre, elevación de reactantes y pruebas complementarias de imagen compatibles hacen menos difícil el diagnóstico, pero en casos menos agudos pueden pasar semanas hasta el diagnóstico.
El tratamiento sigue los mismos principios explicados en el tema: introducción precoz de antibiótico, toma de muestra y/o drenaje si hay absceso evidente en pruebas de imagen. Mantenimiento de antibioterapia semanas, oral cuando haya buena evolución.
Las infecciones más frecuentes son agudas o subagudas, con S.aureus como agente etiológico más frecuente y contra quién se dirigirá la antibioterapia empírica. Los casos crónicos pueden estar causados por M.tuberculosis(7).
Piomiositis
Las piomiositis son infecciones infrecuentes. El diagnóstico es clínico, analítico y pruebas de imagen (RM o ecografía o tomografía axial)
Tras haber comprendido el funcionamiento patológico y terapeútico del resto de las infecciones esqueléticas, es fácil comprender el esquema terapeútico y diagnóstico de las infecciones de planos profundos.
Son infecciones infrecuentes de manera aislada, pero sí pueden estar presentes acompañando a artritis sépticas complicadas.
El diagnóstico es clínico (dolor, aumento temperatura, impotencia funcional), analítico (aumento de reactantes) y basado en pruebas de imagen (RM preferido pero si no hay disponibilidad se emplea ecografía o tomografía axial).
Es deseable obtener muestra antes de iniciar tratamiento empírico. En ausencia de colecciones el tratamiento se inicia con antibioterapia intravenosa dirigida contra staphylococos(8). Si hay colecciones, de nuevo, primero drenaje quirúrgico y luego continuar con antibioterapia (Figura 5). Cuando llegue el resultado del cultivo se cambia a antibiótico dirigido. La duración intravenosa dependerá de la evolución clínica. Continuaremos 2-3 semanas oral.
Tablas y figuras
Tabla I. Tratamiento antibiótico en la osteomielitis aguda
|
ANTIBIÓTICO EMPÍRICO |
EPIDEMIOLOGÍA |
DOSIS |
MÁXIMO DIARIO |
PENETRACIÓN |
|
Cefalosporina |
Prevalencia MSSA en la comunidad > 90% |
> 150 en |
2-4g |
6-7 |
|
Cloxacilina |
Prevalencia MSSA en la comunidad > 90% |
< 200 en |
8-12g |
15-17 |
|
Clindamicina |
Prevalencia MRSA en la comunidad > 10% y resistencias a S. Aureus < 10% |
> 40 en |
3g |
65-78 |
|
Vancomicina |
Prevalencia MRSA en la comunidad > 10% y resistencias a S. Aureus > 10% |
> 40 en |
Ajuste niveles 15-20 microg/ml |
5-67 |
|
Linezolid |
No respuesta a |
30 en |
1,2g |
40-51 |
Modificada de Peltola H, Pääkkönen M. Acute osteomyelitis in children. N Engl J Med(3).
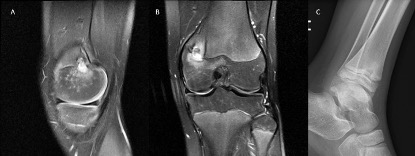
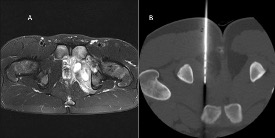
Figura 1.
A) Corte sagital RM en T2 con lesión hiperintensa atravesando fisis femoral compatible con absceso de Brodie. B) Mismo absceso de Brodie visto en corte coronal T2. C) Absceso de Brodie en tibia distal visible en radiografía simple como lesión lítica geográfica.
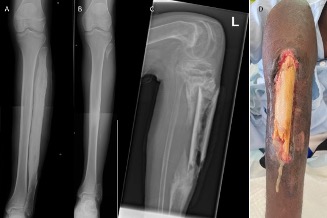
Figura 2.
A) Osteomielitis crónica de peroné con gran engrosamiento por reacción perióstica crónica. B) Mismo caso tratado con resección de peroné. C) Osteomielitis crónica con gran secuestro óseo. D) Aspecto clínico del caso de la radiografía C con drenaje espontáneo de hueso muerto a través de defecto cutáneo.
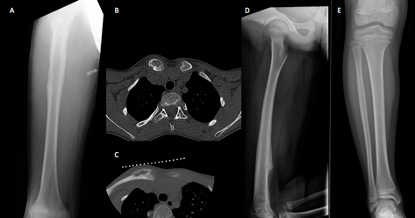
Figura 3.
A) Sarcoma de Ewing diafisario de fémur confundido pese a RM como infección y drenado (y contaminado) quirúrgicamente. B y C) Osteomielitis crónica multifocal recurrente (OCMR) con típico debut esternoclavicular, biopsiada con TAC. D) Osteomielitis con gran reacción perióstica asemejando a un sarcoma. E) Reacción perióstica en peroné tercio proximal, con RM informada como osteomielitis o sarcoma, biopsiada con resultado inflamatorio crónico y tratada con antibióticos sin mejoría. Una segunda biopsia semanas más tarde demostró que era un sarcoma de Ewing.
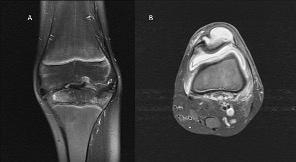
Figura 4.
A) RM, corte coronal en T2 realizado 12 meses tras artritis séptica por herida con madera en la rodilla, desarrollo de osteocondritis y grave destrucción del cartílago. En la imagen coronal ha desaparecido el cóndilo lateral y parte de la zona de carga medial. B) Artritis séptica por pseudomona en una gran quemada, mala evolución y realización de RM que evidencia comunicación de pus intrarticular a bursa prepatellar y extensión a rótula con osteolisis de rótula.
Figura 5.
A) Piomiositis en obturador interno, absceso visible en corte coronal T2 de RM. B) Toma de muestra guiado con TAC y colocación de drenaje guiado con TAC.
Bibliografía
1. Saavedra-Lozano J, Calvo C, Huguet Carol R, Rodrigo C, Núñez E, Obando I, et al. Documento de consenso SEIP-SERPE-SEOP sobre el tratamiento de la osteomielitis aguda y artritis séptica no complicadas. An Pediatría. 2015;82(4):273.e1-273.e10.
2. Quintana-Ortega C, Rimbau Serrano I, Remesal A, Murias S, Cabello J, Calvo C. Exclusively oral antibiotic therapy for Brodie’s abscess in a pediatric patient. Rev Colomb Reumatol. 2021;(x x):2–5.
3. Peltola H, Pääkkönen M. Acute osteomyelitis in children. N Engl J Med [Internet]. 2014 Jan 23;370(4):352–60. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24450893.
4. Pääkkönen M, Peltola H. Bone and Joint Infections. Pediatr Clin North Am [Internet]. Elsevier Inc; 2013;60(2):425–36. Disponible en: http://dx.doi.org/10.1016/j.pcl.2012.12.006.
5. Molina Amores C ARB. Artritis séptica. En Guía-ABE Infecc en Pediatría Guía rápida para la selección del Trat Antimicrob empírico. 2022.
6. DePaola K, Fernicola J, Collins C. Pediatric Musculoskeletal Infections. Pediatr Clin North Am [Internet]. Elsevier Inc; 2020;67(1):59–69. Available from: https://doi.org/10.1016/j.pcl.2019.09.001.
7. Cavalieri S, Pessina B, Indolfi G, Galli L, Trapani S. Spondylodiscitis in Pediatric Age: A Retrospective Cohort Study. Pediatr Infect Dis J. 2022;41(7):530–6.
8. Hannon M, Lyons T. Pediatric musculoskeletal infections. Curr Opin Pediatr. 2023;Publish Ah:309–15.