Infecciones del sistema nervioso central: meningitis, encefalitis y absceso cerebral
Infecciones del sistema nervioso central: meningitis, encefalitis y absceso cerebral
C. Regojo(1), S. Cortizo(2), R. Piñeiro(3).
(1)Facultativo Especialista en Análisis Clínicos del Complejo Hospitalario Universitario de Vigo. Pontevedra. Presidenta de la Asociación Española contra la Meningitis. (2)Facultativo Especialista en Microbiología Clínica y Parasitología del Complejo Hospitalario Universitario de Vigo. Pontevedra. Miembro del Comité Científico de la Asociación Española contra la Meningitis.(3)Doctora en Enfermería. Presidenta de ADNenfermero. Miembro del Comité Científico de la Asociación Española contra la Meningitis.
Fecha de recepción: 29-08-2023
Fecha de publicación: 31-10-2023
Adolescere 2023; XI(3): 48-63
Resumen
|
Las meningitis, encefalitis y abscesos cerebrales son infecciones del sistema nervioso central que causan alta morbilidad y mortalidad en niños y adolescentes. Debido a que en ocasiones debutan con síntomas inespecíficos que conllevan un retraso en el diagnóstico y su alto riesgo de secuelas, hace que sean de las enfermedades infecciosas más temidas tanto por los sanitarios como por la comunidad. Mejorar su diagnóstico precoz además de investigar sobre nuevos tratamientos y vacunas es una prioridad para profesionales sanitarios, asociaciones de pacientes e instituciones como la Organización Mundial de la Salud (OMS) cuyo objetivo, entre otros, es la vacunación universal. Este documento tiene el objetivo de resumir el diagnóstico, tratamiento y prevención de estas infecciones.. Palabras clave: Meningitis; Encefalitis; Abscesos cerebrales; Vacunas; Enfermedad meningocócica invasiva. |
Abstract
|
Meningitis, encephalitis and brain abscesses are infections of the central nervous system that cause high morbidity and mortality in children and adolescents. Because they sometimes present with nonspecific symptoms that lead to a delay in diagnosis and their high risk of sequelae, they are the most feared infectious diseases by both health workers and the community. Improving their early diagnosis in addition to researching new treatments and vaccines is a priority for health professionals, patient associations and institutions such as the World Health Organization (WHO) whose objective, among others, is universal vaccination. This document aims to summarize the diagnosis, treatment, and prevention of these infections. Key words: Meningitis; Encephalitis; Brain abscesses; Vaccines; Invasive meningococcal disease. |
Fisiopatología
Debido a que en muchas ocasiones las infecciones del SNC debutan con síntomas inespecíficos que conllevan un retraso en el diagnóstico y su alto riesgo de secuelas hace que sean de las enfermedades infecciosas más temidas tanto por los profesionales como por la comunidad
Históricamente las infecciones del sistema nervioso central (SNC) han sido clasificadas según el tejido afectado. Una meningitis afecta a las meninges y una encefalitis al parénquima cerebral. Sin embargo, estos límites anatómicos son en ocasiones indistinguibles y los pacientes muestran signos tanto de afectación meníngea como parenquimatosa. El término meningoencefalitis pues, resulta adecuado y puede representar mejor las infecciones difusas del SNC como sucede con los virus. En contrapartida, el absceso cerebral sería el ejemplo más habitual de afectación focal del SNC(1).
Las infecciones a nivel del SNC pueden afectar a múltiples órganos y son muy importantes debido a su gravedad. Pueden afectar al encéfalo, a la médula, a las meninges y a la corteza cerebral. El SNC aloja a los centros vitales cuya afectación puede provocar graves alteraciones incluso la muerte. Estas estructuras cerebrales se encuentran en una cavidad ósea que lo protege, pero al mismo tiempo esto puede suponer un gran problema ya que esta lo comprime suponiendo un gran riesgo al no poderse expandir el encéfalo. La barrera hematoencefálica protege el SNC al limitar el paso de sustancias y el líquido cefalorraquídeo (LCR) que “baña” el encéfalo y la médula espinal, se encuentra en el espacio subaracnoideo y puede llegar a cualquier parte del SNC.
El análisis del LCR es fundamental para el diagnóstico de los procesos patológicos relacionados con el encéfalo, la médula y las meninges, así como con los procesos hemorrágicos producidos en las cavidades que los contienen.
Clínica y diagnóstico diferencial
De forma habitual, las infecciones agudas del SNC, ya sea meningitis, encefalitis o absceso cerebral tienen unas manifestaciones clínicas similares. Los síntomas más frecuentes incluyen cefalea, náuseas, vómitos, anorexia, fotofobia, inquietud, alteración del nivel de conciencia e irritabilidad. Los síntomas más habituales incluyen fiebre, dolor y rigidez cervical, signos neurológicos focales, crisis epilépticas, obnubilación y coma. Otros síntomas inespecíficos que podemos encontrar son dolor muscular o articular, síntomas respiratorios, dolor de garganta, dolor abdominal y diarrea.
La inflamación de los nervios y raíces espinales producen los signos meníngeos. La irritación meníngea se manifiesta con rigidez de nuca, dolor de espalda, signo de Kernig (flexión de la cadera 90º seguida de dolor al extender la pierna) y signo de Brudzinski (flexión involuntaria de las rodillas y las caderas tras la flexión pasiva del cuello en posición decúbito supino). Estos signos no están presentes de forma constante, de hecho, en los adultos solo el 40 % de los casos de meningitis bacteriana presenta fiebre, cefalea y rigidez de nuca(1).
En ocasiones la meningitis puede evolucionar a un shock súbito y progresivo con púrpura, coagulación vascular diseminada y disminución del nivel de conciencia que a menudo progresa a un coma o la muerte las primeras 24 horas
En ocasiones la meningitis puede evolucionar a un shock súbito y progresivo con púrpura, coagulación vascular diseminada y disminución del nivel de conciencia que a menudo progresa a un coma o la muerte las primeras 24 horas(1).
La Enfermedad Meningocócica Invasiva (EMI) puede presentarse como sepsis (con/sin meningitis asociada) en aproximadamente el 20-30 % de los pacientes y como meningitis aislada en un 40 %. En todo paciente pediátrico febril, particularmente en los que presentan factores de riesgo como los lactantes, adolescentes, déficit del complemento o asplenia, se deben buscar activamente los signos y síntomas de EMI y no bajar la guardia ante los signos inespecíficos propios de las infecciones víricas inespecíficas, la faringoamigdalitis o gastroenteritis aguda. En pacientes adolescentes y jóvenes con cefalea, convulsiones o alteración del nivel de conciencia deben descartarse otras causas de hipertensión intracraneal y el consumo de alcohol y drogas(2).
A lo largo de los años se han ideado escalas que combinan datos clínicos y de laboratorio para diferenciar entre la etiología vírica y bacteriana en niños con meningitis y buen estado general. Estas guías intentan descartar aquellos pacientes que tienen poco riesgo de padecer una meningitis bacteriana y se pueda por tanto evitar el tratamiento antibiótico incluso el ingreso hospitalario. La escala de Boyer es la más utilizada, aunque existe una Escala de Boyer modificada que añade tres parámetros biológicos más, que son proteína C reactiva, porcentaje de cayados en sangre y porcentaje de polimorfonucleares en LCR. En Francia y EE. UU. se usa más la Bacterial Meningitis Score que utiliza un parámetro clínico como las convulsiones, combinado con cuatro parámetros biológicos entre los que se incluyen la Proteína C reactiva y la procalcitonina. Estos dos son los marcadores biológicos más utilizados y de mayor sensibilidad y especificidad para el diagnóstico de infecciones bacterianas graves, especialmente la procalcitonina(3).
Epidemiología
Cualquier cuadro infeccioso del Sistema Nervioso Central (SNC) puede coexistir con meningitis
Dentro de las infecciones que afectan a SNC, las entidades principales son la meningitis y la encefalitis, que son el resultado de la inflamación de las meninges y el parénquima cerebral, respectivamente. Cualquier cuadro infeccioso del SNC puede coexistir con meningitis.
El 80 % de las meningitis son de probable origen vírico. Constituye la primera causa de neuro infección con una incidencia global de 10,9 casos por cien mil habitantes/año. El 90 % de las meningoencefalitis víricas son producidas por los enterovirus y suelen producirse en verano y al final del otoño porque estas épocas se asocian con una incidencia más alta en la circulación de enterovirus(1).
La incidencia de meningitis aguda bacteriana ha ido descendiendo progresivamente en nuestro medio por el desarrollo de la vacunación como es el caso de la meningitis por Haemophilus Influenza tipo B. Neisseria meningitidis y Streptococo pneumoniae siguen siendo las bacterias más frecuentes en los menores de 10 años. Con respecto a la enfermedad neumocócica invasora, su incidencia es mayor en los menores de 5 años y los serotipos más frecuentes son 8,3,9N,19A y 22F (3 y 19A están incluidos en la vacuna 13-valente)(5). El uso de la nueva vacuna conjugada VCN-20 que abarca más serotipos puede usarse en los mayores de 18 años, mientras que su uso en niños está pendiente de aprobación por la Agencia Europea del Medicamento.
Tras la disminución de los casos en las dos primeras temporadas coincidentes con la pandemia COVID, se ha iniciado y se mantiene una tendencia creciente de la Enfermedad Meningocócica Invasiva a la par de la disminución de los casos de COVID y de las medidas higiénico sanitarias impuestas por este motivo
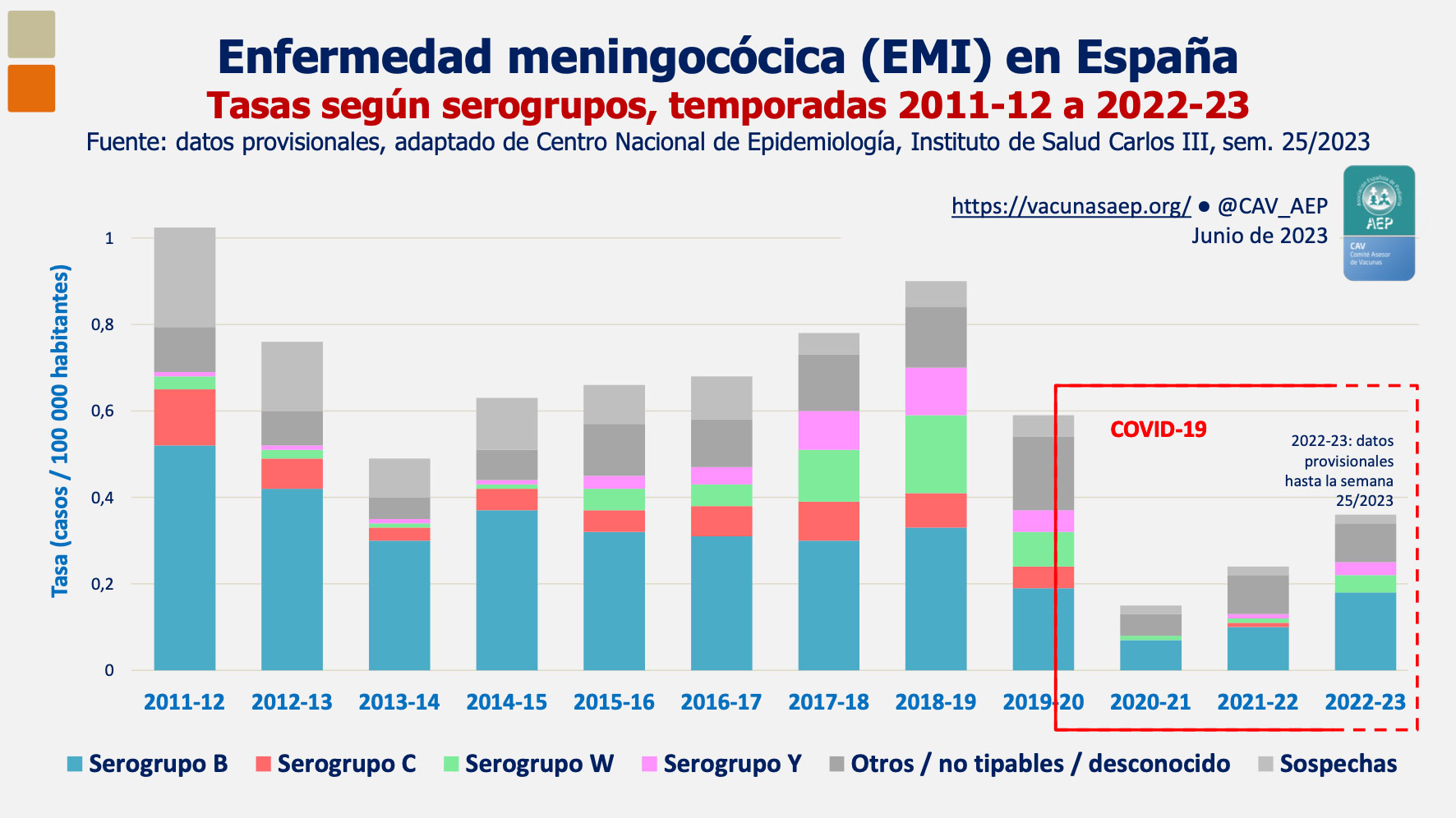
Durante la pandemia se ha observado un descenso significativo de casos de enfermedad meningocócica (ver Figura 1) que se ha constatado en muchos países de nuestro entorno como el Reino Unido, Holanda y Francia. Esto se explica dada las estrictas medidas de contención puestas en marcha en todo el mundo. Tras la disminución de los casos en las dos primeras temporadas coincidentes con la pandemia COVID, se mantiene una tendencia creciente de la EMI a la par de la disminución de los casos de COVID y de las medidas higiénico sanitarias impuestas por este motivo. A nivel nacional hasta la semana 25/2023 la tasa general ha sido 0,38 casos por 100.000 habitantes cuando por estas mismas fechas en la temporada anterior fue 0,18 /100.000 habitantes. La etiología más frecuente del grupo de edad de 10 a 19 años es Neisseria meningitidis tipo B. Así mismo se observa un ligero aumento de los serogrupos W e Y y serogrupo C se ha mantenido estable siendo excepcional en menores de 15 años(5).
Se estima que hasta un 20-30 % de los adolescentes pueden ser portadores asintomáticos de meningococo. El ser humano es el único portador conocido en el ciclo de colonización del meningococo. La transmisión de la infección se realiza de persona a persona por vía respiratoria mediante las gotitas de Flügge ya sea desde portadores asintomáticos o pacientes con enfermedad activa. Ciertas conductas (besos, fumar, habitar varios individuos en espacios cerrados, compartir bebidas) propias de la adolescencia y adultos jóvenes favorecen el contacto cercano e intercambio de saliva facilitando la transmisión de la bacteria e incrementándose el riesgo de la EMI y también para sus contactos susceptibles(1).
Los abscesos cerebrales, que son infecciones focales del parénquima cerebral, son infrecuentes y muy graves. Se estima una incidencia de entre 0,34 y 1,3 casos por 100.000 personas al año. Su aparición normalmente está asociada a patología subyacente como diseminación de infecciones como una meningitis, otitis media, mastoiditis, sinusitis, infecciones de las partes blandas de la cara o el cuero cabelludo, celulitis orbitaria o infecciones dentales. Igualmente, cuando hay compromiso de la barrera hematoencefálica por traumatismos craneales penetrantes o procedimientos quirúrgicos. En niños pueden ser en ambos hemisferios, en los adultos son más frecuentes en el hemisferio izquierdo y hasta un 80 % se localizan en los lóbulos frontal, parietal y temporal(1).
Diagnóstico
La celeridad en el diagnóstico es fundamental cuando hablamos de infecciones del SNC, ya que la mortalidad y secuelas asociadas son mucho mayores y más frecuentes que en otro tipo de infecciones
La celeridad en el diagnóstico es fundamental cuando hablamos de infecciones del SNC, ya que la mortalidad y secuelas asociadas son mucho mayores y más frecuentes que en otro tipo de infecciones.
Esto no es fácil en países en vías de desarrollo donde incluso, con frecuencia, ni se recogen muestras adecuadas (líquido cefalorraquídeo) y la capacidad de los laboratorios es limitada.
La clave para el diagnóstico de los abscesos cerebrales es la neuroimagen siendo la resonancia magnética con contraste la prueba de elección
El diagnóstico de una infección del SNC normalmente va precedido de la realización de una historia clínica y exploración física completa, así como una combinación de neuroimagen y análisis. Entre los exámenes generales de laboratorio se solicitará un hemograma, coagulación y un perfil bioquímico básico que incluya glucosa, urea, creatinina, sodio, potasio, proteína C reactiva y procalcitonina. Estos dos últimos parámetros estarán elevados en suero en caso de una meningitis bacteriana(7). La clave para el diagnóstico de los abscesos cerebrales es la neuroimagen siendo la resonancia magnética con contraste la prueba de elección. Como alternativa el TAC craneal puede dar resultados más rápidos, pero no con el detalle tisular de la resonancia(1).
La punción lumbar con el fin de obtener LCR es el paso más importante para obtener resultados de su análisis, cultivo y Gram. Se realiza a nivel de las vértebras L4-L5 o más abajo para evitar lesionar la médula espinal, ya que esta acaba entre la D12 y la L1. Las contraindicaciones para su realización son principalmente la evidencia del aumento de la presión intracraneal. Sin embargo, esto puede retrasar el diagnóstico de una meningitis bacteriana y el inicio del tratamiento antimicrobiano. Salvo que el paciente tenga signos clínicos como papiledema, coma, hidrocefalia, historia previa de procedimiento neuroquirúrgico, incluido derivación de LCR, no se recomienda retrasar diagnóstico de infección del SNC. Incluso en caso de realizar TC cerebral se recomienda no retrasar el inicio de la pauta antimicrobiana(1).
No se debe realizar punción lumbar en los pacientes con sospecha de absceso cerebral debido a las complicaciones derivadas de la hipertensión craneal. En caso necesario se realizará previamente TC craneal para descartar HTIC(8).
Meningitis aguda
Las manifestaciones y gravedad del cuadro dependen directamente del agente etiológico(8,9). Los microorganismos principales son los virus seguidos de las bacterias y mucho menos comunes son las infecciones por micobacterias, hongos y parásitos. Por tanto, es habitual hablar de dos subcategorías principales: la meningitis vírica (también llamada aséptica o linfocitaria) y la meningitis bacteriana (séptica). La meningitis aséptica o vírica causa aproximadamente el 72 % de las meningitis en adultos y niños. Dentro de las mismas los Enterovirus son los responsables de la mayor parte de los casos que suelen ser cuadros de curso más benigno(10,11).
Muestras a recoger y estudios a realizar
El diagnóstico de certeza de la meningitis pasa por el examen del LCR. Este examen a pesar de tratarse de una muestra de escaso volumen debe incluir análisis de múltiples parámetros analíticos tanto citoquímicos y microbiológicos(7).
La recogida de las muestras adecuadas es parte troncal del diagnóstico. Debemos seleccionar las muestras apropiadas y de mayor rentabilidad diagnóstica y recogerlas en el momento idóneo ya que de este primer paso depende el diagnóstico
LCR: El análisis citológico y bioquímico del LCR son los primeros datos iniciales que nos pueden ayudar a diferenciar una meningitis bacteriana de una vírica. Es una muestra imprescindible en los casos de meningitis y ha de ser recolectada con máxima asepsia por punción lumbar. Se deben recoger a ser posible 3-4 tubos con 1-2 ml (mínimo 10 gotas/tubo). Los exámenes a realizar son:
Citoquímica: su resultado nos permite discriminar de un modo más preciso meningitis vírica (MV) de bacteriana (MB). La desviación de los valores habituales de proteinorraquia, glucorraquia junto con la presencia de leucocitos, su recuento y el predominio de las poblaciones leucocitarias es de gran valor orientativo sobre todo si lo asociamos con la clínica (Tabla I).
El perfil típico de una meningitis bacteriana es un recuento de >1000 leucocitos/μl, predominio de >50 % de neutrófilos, proteinorraquia elevada de >100 mg/dl e hipoglucorraquia < 30 mg/dl.(14).
El examen citoquímico en la MB, tiene la ventaja de que no se ve afectado por el inicio del tratamiento empírico, al menos los primeros días, efecto que sí ocurre con la tinción de Gram y en mayor medida con el cultivo(8,10,11). El recuento de leucocitos puede verse disminuido por determinadas condiciones: inmunodepresión, fases muy iniciales de infección o el shock séptico(8,12).
Puede existir pleocitosis de linfocitos en una meningitis bacteriana y también podemos observar una pleocitosis neutrofílica inicial en una meningitis vírica. El viraje hacia un predominio linfo-monocitario en la meningitis vírica se observa invariablemente en un plazo de 8-24 horas tras la punción lumbar inicial (Tabla I).
En todos los pacientes en los que se estudia un cuadro de meningitis es mandatorio el cultivo y la tinción de Gram en el LCR independiente-mente de los resultados de la citoquímica
Una dificultad diagnóstica en la evolución de una meningitis bacteriana es la interpretación del análisis del LCR cuando se ha tomado previamente tratamiento antibiótico. Es un escenario clínico bastante frecuente debido al comienzo inespecífico de la meningitis, se puede confundir fácilmente con otros cuadros infecciosos. Se calcula que un 25-50 % de los niños que son evaluados por meningitis bacteriana han tomado antibióticos previamente. En estos casos el LCR puede ser negativo para la tinción gram y el cultivo tan solo 2-4 horas después de la administración de antibióticos. Sin embargo, la pleocitosis por neutrófilos, la proteinorraquia elevada y la disminución de la glucosa en LCR pueden permanecer alterados tras varios días de tratamiento antibiótico(1). Es imprescindible descartar la contaminación de la muestra de LCR con sangre periférica ya que puede alterar los parámetros citoquímicos, en particular la proteinorraquia. En todos los pacientes en los que se estudia un cuadro de meningitis es mandatorio el cultivo y la tinción de Gram en el LCR, independientemente de los resultados de la citoquímica.
La tinción de Gram es positiva en el 75-90 % de los casos de MB sin antibioterapia previa(7). Los porcentajes varían del 90 % si es una meningitis neumocócica, el 70 % en la meningocócica, 50 % si el agente causal es H. influenzae y baja a un 20-35 % en el caso de Listeria monocytogenes(9).
El cultivo es imprescindible en el diagnóstico microbiológico en las MB. El principal valor del cultivo es el aislamiento de la bacteria patógena para poder realizar estudios de sensibilidad antibiótica y pruebas complementarias como el serotipado y/o caracterización molecular, necesarios para estudios epidemiológicos. En contra, el cultivo, tiene una baja sensibilidad sobre todo si ya existe antibioterapia empírica que, en el caso de las cefalosporinas de tercera generación, puede traducirse en cultivo estéril con una sola dosis(8). El cultivo puede permanecer positivo al menos durante la primera hora siguiente a la administración de antibiótico endovenoso(9).
Existe otro tipo de tinciones (auramina-rodamina y/o Zielh-Neelsen) y cultivos (migit, coletsos, lowestein-jensen) y técnicas de amplificación de ácidos nucleicos específicas para microorganismos como las micobacterias que representan <1 % de las meningitis, excepto en países endémicos donde son más frecuentes. La tinción tiene una muy limitada sensibilidad, el cultivo en medio líquido es sensible y necesario para realizar pruebas de sensibilidad a antibióticos(11).
Las técnicas de detección de antígeno en LCR. La detección de antígenos directamente en LCR es un procedimiento simple, barato y rápido, que está al alcance de cualquier laboratorio y por tanto es un método complementario interesante. La desventaja principal es la baja sensibilidad respecto al cultivo y, por supuesto, frente a las técnicas de amplificación de ácidos nucleicos(11).
Los test más conocidos son el antígeno de Neumococo: inmunocromatografía validada para muestras de orina en el diagnóstico de la neumonía, se puede realizar en LCR y orina. Otro ejemplo de este tipo de prueba es la detección de antígeno del hongo C. neoformans/gatti que es una aglutinación directa y puede realizarse en paralelo en muestra de sangre (en pacientes de riesgo, inmunosupresión).
Las técnicas de amplificación de ácidos nucleicos (TAAN). Diversos estudios han constatado la elevada sensibilidad y especificidad de las TAAN. Son técnicas de especial utilidad en el contexto de una meningitis vírica pues se presentan como única herramienta útil de diagnóstico microbiológico. En el caso de las MB decapitadas, cuando ni el Gram ni el cultivo resultan de ayuda, las TAAN representan la única alternativa. En todos los casos ante una sospecha de meningitis es interesante realizar una prueba de este tipo ya que podemos adelantar resultados. Las TAAN pueden darnos resultados en cuestión de una o dos horas para la mayoría de las PCR que hay en el mercado. La sensibilidad es para Neumococo del 79-100 %, 91-100 % para Meningococo y 67-100 % para H. influenzae. La especificidad para todas ellas es del 95-100 %(7,9).
En el caso de las meningitis bacterianas decapitadas, cuando ni el Gram ni el cultivo resultan de ayuda, las TAAN representan la única alternativa
Teniendo en cuenta la variedad de patógenos implicados en la infección del SNC, la aplicación de paneles moleculares integrales con múltiples objetivos bacterianos y virales ha mejorado la eficiencia diagnóstica. Son ejemplos de estas técnicas el panel Meningoencefalitis QIAstat-Dx y Filmarray ME. Éste nos ofrece resultados en una hora y tiene 14 dianas: Enterovirus, Parechovirus, Herpesvirus 1 y 2, Virus varicela zóster, Citomegalovirus y Herpesvirus 6; dentro de las bacterias: N. meningitidis, S. pneumoniae, H. influenzae, L. monocytogenes, S. agalactaie y E. coli, además de C. neoformans/gatti. Meningoencefalitis QIAstat-Dx, a mayores, puede detectar S. pyogenes, Mycoplasma pneumoniae y varias especies del género Candida(9).
Hemocultivos: se pueden obtener tempranamente, antes de la punción lumbar. En muchos casos son el único modo de aislar a la bacteria responsable de una MB sobre todo cuando no es posible realizar la punción lumbar (hipertensión endocraneana grave, coagulopatía grave o datos de focalización o infección en el lugar de la punción), se retrasa demasiado o cuando el cultivo de LCR puede ser negativo como tras el comienzo de la antibioterapia.
La extracción debe hacerse lo antes posible y previo a la primera dosis de antibiótico. La rentabilidad en MB es del 50-75 % incluso cuando el LCR es negativo. Son positivos en el 75 % de los casos de meningitis neumocócica, 50-90 % de meningitis por H. influenzae y el 40-60 % de la meningitis meningocócica(7,9).
Serología: se recomienda recoger muestra de sangre en tubo de serología. Especialmente útil para ciertas infecciones víricas: VVZ, EBV, virus de la parotiditis o Arbovirus; determinadas infecciones por bacterias que no crecen en el cultivo o no se aíslan en medios habituales como enfermedad de Lyme, Lúes, Brucella spp. Se puede realizar determinación de IgM en LCR ya que ésta no difunde fácilmente a través de la barrera hemato-encefálica, por tanto, la presencia en LCR indica infección SNC(9).
Complicaciones y secuelas
Se estima que entre un 10-15 % de los pacientes con EMI fallecerán y hasta un 30 % de los sobrevivientes quedarán con graves secuelas (neurológicas, sordera, amputaciones de miembros…)
Se estima que entre un 10-15 % de los pacientes con EMI fallecerán y hasta un 30 % de los sobrevivientes quedarán con graves secuelas (neurológicas, sordera, amputaciones de miembros…)(2).
Durante el tratamiento de una meningitis puede haber complicaciones agudas del SNC como crisis epilépticas, aumento de la presión intracraneal, parálisis de nervios craneales, ictus, herniación cerebral o cerebelosa y trombosis de los senos venosos durales. Puede aparecer en cualquier momento en el curso de la enfermedad edema cerebral (suele ocurrir en las primeras 24-48 horas), SIADH, déficits motores (hemiparesias, cuadriparesias) que pueden mejorar o pueden producir discapacidad a largo plazo(5).
En niños, adolescentes y adultos con MB están indicados los estudios para descartar la pérdida auditiva lo antes posible, para evitar la osificacion coclear postinfecciosa y derivar en caso positivo al centro de referencia de implantes cocleares
Hasta un 20 % de los pacientes que superan una meningitis bacteriana pueden sufrir secuelas muy graves y hasta un 50 % tiene algún tipo de secuela neurológica. Las secuelas neurológicas más frecuentes incluyen la hipoacusia, deterioro cognitivo, crisis epilépticas recurrentes, retraso en la adquisición del lenguaje, defectos visuales, problemas de conducta, etc. La hipoacusia neurosensorial es la secuela asociada más frecuentemente a una meningitis bacteriana, se produce al inicio del proceso debido a una laberintitis tras una infección coclear o una inflamación del nervio acústico que puede suceder en hasta un 30 % de los pacientes con meningitis neumocócica. En niños, adolescentes y adultos con meningitis bacteriana están indicados los estudios para descartar o confirmar la pérdida auditiva lo antes posible, para así en caso de pérdida auditiva severa profunda, derivar cuanto antes al centro de referencia de implantes cocleares. Es altamente recomendable no demorarlo para evitar la osificación coclear postinfecciosa(5,12).
Hasta un 60 % de los afectados con meningitis y sus familiares precisan apoyo afectivo y personal
En el caso de secuelas neuropsicológicas no se recomienda valoración rutinaria sino que las recomendaciones son informar al paciente y familiares de la posibilidad y hacer los estudios y tratamientos en caso de que aparezcan(12). Sin embargo, en un estudio realizado por IDIVAL (Instituto de Investigación Sanitaria de Valdecilla) promovido por la asociación de pacientes AEM (Asociación Española contra la meningitis) se constata que hasta un 60 % de los afectados y sus familiares precisan apoyo afectivo y personal. Para la unidad familiar la carga económica de la enfermedad meningocócica con secuelas podría llegar a ser 921.901 euros durante toda la vida. Conocer la realidad de estos pacientes puede ayudar a acometer políticas sanitarias que ayuden a afrontar estas necesidades(13).
Tratamiento
La meningitis bacteriana aguda es una emergencia médica, sin tratamiento, la mortalidad es del 100 %. El pronóstico depende del inicio precoz de antibioterapia y de la aplicación de medidas de soporte y del tratamiento de las complicaciones. Cada hora que se retrasa el inicio del antibiótico aumenta la mortalidad y la probabilidad de secuelas neurológicas
La meningitis bacteriana aguda es una emergencia médica, sin tratamiento, la mortalidad es del 100 %. El pronóstico depende del inicio precoz de antibioterapia y de la aplicación de medidas de soporte y del tratamiento de las complicaciones. Cada hora que se retrasa el inicio del antibiótico aumenta la mortalidad y la probabilidad de secuelas neurológicas(5).
La antibioterapia empírica ante un caso de meningitis, idealmente, ha de instaurarse dentro de los 30 minutos siguiente al diagnóstico. Cuando se llega a este diagnóstico fuera del hospital y se sospecha meningitis meningocócica debe administrarse una primera dosis de ceftriaxona in situ o durante el traslado al hospital(9).
El tratamiento antibiótico empírico debe comenzar en cuanto se sospeche una meningitis bacteriana, y continuar si los hallazgos citoquímicos en el LCR, las pruebas de biología molecular, la tinción de Gram y/o el cultivo lo apoyan. Un retraso de más de 6h en su inicio, está asociado a un incremento de riesgo de mortalidad del 6 % al 45 % así como de secuelas neurológicas del 10 % al 70 %(10).
Se recomienda el empleo de antibióticos bactericidas que atraviesen la barrera hematoencefálica y alcancen concentraciones adecuadas en LCR. Se realizará terapia dirigida en cuanto se disponga de la identificación del microorganismo que, gracias a la biología molecular, puede ser cuestión de horas.
En el caso de la meningitis el tratamiento empírico se ve condicionado por la edad del paciente y factores de riesgo como traumatismos, inmunosupresión. Además de todos estos datos debemos tener en cuenta los perfiles locales de susceptibilidad a antibióticos como las penicilinas y cefalosporinas, en particular para S. pneumoniae.
A esta complejidad de factores para la correcta cobertura empírica se suma la complejidad, en algunos casos, para discernir entre una meningitis vírica o bacteriana.
Las MV, como hemos dicho, son en su mayoría causadas por Enterovirus para los que no hay tratamiento antiviral específico. La familia Herpesviridae, en particular virus VHS son los siguientes en frecuencia y para ellos sí existe terapia antiviral específica y eficaz.
Tratamiento según las características de LCR (citoquímica)(9)
Si el LCR tiene características de MV el tratamiento es sintomático y si no se puede descartar como responsable virus herpes simplex:
Aciclovir 10mg/kg/8h iv que puede continuarse vía oral con Famciclovir o Valaciclovir hasta los 7-14 días de tratamiento.
Si el LCR tiene características de MB: la elección, en este caso se hará según edad, inmunidad y comorbilidades:
Paciente de cualquier edad entre 3 meses y 50 años, inmunocompetente y sin comorbilidad significativa: Cefotaxima o Ceftriaxona + Vancomicina o Linezolid.
Paciente menor de 3 meses, embarazada, > 50 años, o clínica sugestiva de rombencefalitis u otros factores de riesgo para Listeria monocytogenes: añadir ampicilina o amoxicilina: Ampicilina + Cefotaxima o Ceftriaxona + Vancomicina o Linezolid.
Por último, si hay indicios de MB secundaria a mastoiditis o sinusitis debemos garantizar cobertura de anaerobios y añadir metronidazol.
Dosis y duración del tratamiento(7,9): Dosis: Cefotaxima 200-300 mg/kg/día iv en 4-6 dosis; ceftriaxona 2g/12h, en niños 50mg/kg/12h; ampicilina 2g/4h iv; vancomicina 15-20mg/kg/8h iv; linezolid 600mg/8-12h iv u oral; metronidazol 500 mg/6h iv.
El tratamiento debe mantenerse: 7 días para meningitis meningocócica o por H. influenzae; 10-14 días si se trata de S.pneumonie, S.agalactiae o bacilos gram negativos. Al menos 14 días para la meningitis por S.aureus y 21 días si Listeria es el microorganismo responsable. Si se desconoce el agente y hay datos de MB, continuar el tratamiento empírico durante al menos 2 semanas.
Tratamiento dirigido en la meningitis bacteriana se resume en la Tabla II de la Guía ESCMID para diagnóstico y tratamiento de la meningitis bacteriana aguda(7).
Quimioprofilaxis
En caso de enfermedad meningocócica, la quimioprofilaxis estará indicada a todas las personas que convivan con el caso índice. También las que hayan pernoctado con el caso índice en los 10 días anteriores al ingreso
Así como en la meningitis neumocócica no está indicada la quimioprofilaxis. En caso de enfermedad meningocócica, la quimioprofilaxis estará indicada a todas las personas que convivan con el caso índice. También las que hayan pernoctado con el caso índice en los 10 días anteriores al ingreso. Si aparece más de un caso en la misma aula del instituto se protegerá a todos los compañeros de la clase y se valorarán los compañeros de otras actividades sociales, recreativas y deportivas. Las pautas más utilizadas son 1 dosis única de 500 mg vía oral de Ciprofloxacino en los mayores de 18 años. En los menores de 15 años 1 dosis intramuscular de 125mg de Ceftriaxona y los jóvenes entre 15-18 años una dosis intramuscular de 250 mg de ceftriaxona(2,5).
Encefalitis aguda (EA)
La encefalitis y la meningoencefalitis son cuadros con suficiente entidad dada la mortalidad, morbilidad y secuelas asociadas (graves secuelas neurológicas en mitad de los pacientes (30-60 %). Es importante monitorizar estrechamente a los pacientes con encefalitis grave por riesgo de crisis epiléptica, edema cerebral, trastornos del equilibrio hidroelectrolítico, insuficiencia respiratoria y paro cardiaco(1). Para la mayoría de las causas de meningoencefalitis víricas, el tratamiento es fundamentalmente de soporte con administración de líquidos intravenosos cuando falla la ingesta oral y tratamiento con AINES para el alivio sintomático de la cefalea. En su manejo terapéutico se recomienda el inicio del aciclovir intravenoso hasta el despistaje de encefalitis por virus herpes simple(8). En este documento se hará especial mención a las recomendaciones del Consorcio Internacional de Encefalitis que publicó en 2013 un documento de consenso donde se definieron los criterios y algoritmos diagnósticos(14).
Criterios diagnósticos para encefalitis y encefalopatía de presunta etiología infecciosa o autoinmune (Tabla III).
La etiología más frecuente de las encefalitis es viral, principalmente Herpesvirus seguido de Enterovirus
Dentro de las EA las que tienen origen infeccioso son aproximadamente la mitad (un 20-30 %, de causa inmune; y el 20-30 % desconocida). La etiología puede ser viral, bacteriana o también ser originadas por parásitos y hongos. La etiología viral es la más frecuente, principalmente Herpesvirus seguido de Enterovirus. Se han descrito brotes de EA con parálisis flácida y rombencefalitis producidos por Enterovirus serotipos A71 y D68(9).
La etiología más probable varía según el estado inmune del paciente y demás factores de riesgo. (Tabla IV).
Gran parte del diagnóstico de las encefalitis es igual al diagnóstico de las meningitis agudas. Se debe realizar la punción lumbar y los estudios realizados en el LCR son casi los mismos salvo la elección de determinadas pruebas de biología molecular o el orden en que se realizan las mismas. Dada la etiología, se elegirán como primer paso TAAN para detección de herpesvirus y enterovirus.
En la Tabla V aparecen las recomendaciones y algoritmo diagnóstico para la evaluación inicial de la encefalitis(14).
En determinados casos de encefalitis, en los que no se llega al diagnóstico tras el procesamiento de las muestras comentadas, es posible que sea necesario realizar una biopsia cerebral(8).
Tratamiento de las encefalitis
Aunque en aproximadamente el 50 % de los casos se llega al agente etiológico, la mayor parte son producidas por virus y principalmente herpesvirus. En el paciente inmunocompetente la reactivación del virus herpes simplex es, con diferencia, la causa más frecuente y por ello el tratamiento empírico debe cubrirlo y debe comenzar antes de confirmar el diagnóstico e incluso antes de la punción lumbar y las pruebas de imagen(9,15).
La pauta habitual hasta obtener resultados es: Aciclovir 10mg/kg/8h iv, se debe continuar 14-21 días en caso de que las pruebas de biología molecular confirmen infección por este virus. Si por el contrario no se confirma, puede retirarse a los 10 días o antes en caso de haber otro agente etiológico.
En muchos casos es conveniente cubrir bacterias sobre todo Listeria con Ampicilina 2g/4h iv + Doxiclina 100mg/12h iv, para cubrir otras bacterias como espiroquetas(9).
Otras causas de encefalitis son los virus transmitidos por artrópodos: como el virus de la encefalitis japonesa, virus del Nilo occidental, encefalitis equina, encefalitis de California, entre otros, para los cuales no existen antivirales específicos.
Abscesos cerebrales
El absceso cerebral es poco frecuente y suele ser la complicación o consecuencia de una infección mal controlada
Es una entidad clínica poco frecuente y suele ser la complicación o consecuencia de una infección mal controlada. En el manejo de los abscesos cerebrales es importante la asociación de drenaje quirúrgico y tratamiento antibiótico. El tratamiento médico va a precisar la combinación de al menos dos antibióticos durante 6-8 semanas(8).
Hablamos de absceso cerebral cuando el parénquima cerebral presenta lesiones focales únicas o múltiples, rodeada de una cápsula vascularizada. De etiología infecciosa, en el 95 % de los casos las bacterias son las responsables(8,9).
Absceso único: en cuyo caso es habitualmente la extensión del foco contiguo y suelen ser polimicrobianas:
- Secundario a infecciones locales: dentarias, sinusitis, otitis u otomastoiditis. Responsables frecuentemente: Streptococcus fundamentalmente grupo anginosus, S. aureus, anaerobios, patógenos implicados en infecciones del tracto respiratorio como Haemophilus o Neumococo.
- Secundario a meningitis: suele estar implicadas ciertas bacterias como Listeria.
- Tras traumatismos craneoencefálico o neurocirugía suelen participar: distintas especies de Streptococcus, Staphylococcus, incluido S. aureus, bacterias anaerobia, hongos o no fermentadores como Pseudomonas.
Abscesos múltiples: suelen originarse por propagación hematógena de un foco más o menos lejano y suelen ser monomicrobianas:
- Secundario a bacteriemia: puede ser por: Listeria, S.aureus, Streptococcus grupo änginosus, determinadas enterobactaerias como Klebsiella pneumoniae serotipo K1.
- Secundario a endocarditis: no es muy frecuente en niños y son responsables habituales Streptococcus spp y S.aureus.
- Secundario a infecciones pulmonares como empiemas o abscesos pulmonares: suele tratarse de patógenos respiratorios como: S.aureus, Haemophilus spp, Nocardia, Streptococcus spp.
Muestras recomendadas para el diagnóstico microbiológico:
Hemocultivo: debe obtenerse antes de iniciar tratamiento antibiótico. Su rentabilidad diagnóstica es baja (10-28 %), aunque si el absceso es por diseminación hematógena es más rentable.
Muestra del absceso: la sensibilidad del cultivo suele ser del 60-80 %. En el caso de existir sospecha de tuberculosis debe realizarse tinción/cultivos específicos.
LCR no tiene la rentabilidad que presentaba en las meningitis y encefalitis.
Serología: Serología de Toxoplasma (en pacientes con VIH) y Taenia solium (en caso de sospecha de neurocisticercosis).
Además de los cultivos, se pueden llevar a cabo TAAN: PCR múltiplex de sangre, LCR o material purulento.
Abordaje y tratamiento de los abscesos cerebrales(8,9)
Si es posible debe retirarse el contenido del absceso ya sea por punción-aspiración percutánea estereotáxica o escisión quirúrgica. Esta última tiene mayor riesgo de secuelas y se reserva a determinadas situaciones como los abscesos de etiología fúngica o los de origen traumático en los que hay que retirar cuerpos extraños.
Debe considerarse siempre drenaje en las situaciones de abscesos de gran tamaño: mayores de 2.5 cm; persistencia radiológica tras 3-4 semanas de tratamiento; abscesos con gas o si se encuentran en determinadas localizaciones anatómicas como el tronco cerebral o cercano a un ventrículo por los riesgos de compresión o colapso.
Debido a la localización y gravedad de los abscesos cerebrales el tratamiento antibiótico debe mantenerse un mínimo de 4-8 semanas y debe ser controlado mediante pruebas de imagen TC cada 2-3 semanas
Debido a la localización y gravedad de estas infecciones el tratamiento antibiótico debe mantenerse un mínimo de 4-8 semanas y debe ser controlado mediante pruebas de imagen TC cada 2-3 semanas. Existen determinados patógenos (hongos o Nocardia spp) para los que el tratamiento antibiótico o antifúngico debe prolongarse.
El tratamiento antibiótico empírico se basa en la etiología más frecuente según el origen del absceso. Origen: pueden producirse por traumatismo craneoencefálico penetrante o neurocirugía, o debido a infecciones tanto próximas (sinusitis, infecciones dentarias, meningitis) como distantes anatómicamente: infecciones pulmonares o endocarditis. La etiología en el caso de que el paciente sea inmunodeprimido multiplica el abanico de microorganismos que podemos barajar.
Según las características del absceso podemos inferir el origen del mismo(9).
Por último, debemos recordar que existe un porcentaje no desdeñable de abscesos criptogénicos en los que no podemos localizar el origen de la infección.
La terapia empírica se basará en el posible foco u origen del AC(9).
Absceso de origen sinusal, ótico, dental, pulmonar o desconocido
Cefotaxima 200mg/kg/día iv en 4-6 dosis o ceftriaxona 2g/12h iv con metronidazol 30mg/kg/día iv u oral en 3 dosis.
Considerar adicionar a la pauta:
- Linezolid 600mg/12h iv u oral en caso de absceso criptogénico para cubrir S.aureus.
- Ampicilina 2g/4h iv si hay indicios o riesgo de infección por Listeria.
- Meropenem 2g/8h iv, en lugar de la cefalosporina, si existe indicio o riesgo de infección por Pseudomonas como antecedente de otitis crónica o mastoiditis.
- Cotrimoxazol 5mg/kg/8h o Linezolid 600mg/12h iv u oral; si sospecha o hallazgos de infección pulmonar por Nocardia spp.
Absceso por traumatismo craneoencefálico penetrante o neurocirugía
Meropenem o ceftazidima 2g/8h iv más linezolid 600mg/12h o vancomicina 15-20mg/kg/
8-12h iv.
Absceso en el paciente inmunodeprimido
Meropenem 2g/8h iv más linezolid 600mg/12h iv más cotrimoxazol 5mg/kg/8h oral o iv. Considerar adición de Voriconazol (dosis inicial 6mg/kg/12h.
Prevención de la meningitis en los adolescentes
La adolescencia es una etapa madurativa que implica unos cambios que dificultan el abordaje y cumplimiento del calendario vacunal para este grupo de edad
La adolescencia es una etapa madurativa que implica unos cambios que dificultan el abordaje y cumplimiento del calendario vacunal para este grupo de edad. Es una época que por el propio proceso madurativo los adolescentes pueden conocer los riesgos, pero también pueden actuar como si no existieran, donde puede haber un mayor desapego de los padres y afectar a la comunicación entre ellos; una etapa donde van adquiriendo su independencia y se hacen más habituales los viajes e intercambios que implican mayores necesidades de protección. Además, entre los 14-16 años, ocurre una transición de la atención pediátrica a la atención del adulto que si además hay una organización deficiente empeora el abordaje de estos pacientes y hace que la cobertura vacunal sea subóptima(16). Puede haber grandes lagunas de información y tanto padres como adolescentes desconocen menos sus necesidades por lo que acuden menos a la consulta. Durante la reciente pandemia COVID las cifras de cobertura de vacunación adolescentes de 11 a 18 años en los Estados Unidos se han resentido y se han intentado normalizarlas con diferentes estrategias de catch-up. Un 21 % de los padres no han estado informados ni tomado medidas para proteger a sus hijos. Es crucial comunicar instrucciones claras a los trabajadores sanitarios y población para recuperar y mejorar coberturas para enfrentarnos a posibles epidemias con la vuelta a la realidad post-COVID(17).
La enfermedad meningocócica continúa siendo un problema de salud pública. Muchos de los factores de riesgo que tiene la EMI tienen lugar en la adolescencia, que es el periodo de la vida donde hay más portadores de meningococo en nasofaringe. El diagnóstico tarda más tiempo en la adolescencia ensombreciendo el pronóstico(18). La similitud de la Enfermedad meningocócica invasiva (EMI) con otras enfermedades banales en sus fases iniciales y su rápida progresión dificultan el diagnóstico clínico y provocan un posible retraso en la instauración del tratamiento antibiótico y medidas de soporte que puedan mejorar la supervivencia. La inmunización activa es la mejor estrategia para abordar la letalidad, dificultad diagnóstica y curso tórpido de la EMI(2).
Las estrategias de vacunación realizadas de forma masiva con cobertura a todos los cinco serogrupos son la ruta a seguir para el logro del objetivo de la OMS de vencer la meningitis para 2030
Las estrategias de vacunación realizadas de forma masiva con cobertura a todos los cinco serogrupos son la ruta a seguir para el logro del objetivo de la OMS de vencer la meningitis para 2030(6). En noviembre del 2020 la Organización Mundial de la Salud aprobó dicha hoja de ruta mundial para derrotar la Meningitis (Defeating Meningitis by 2030). Esta hoja de ruta marca tres objetivos :1) Eliminar las epidemias de meningitis bacteriana. 2) Reducir los casos prevenibles de meningitis bacteriana en un 50 % mediante vacunación y las muertes en un 70 % y 3) Reducir la discapacidad y mejorar la calidad de vida tras la meningitis(19).
Es por ello por lo que distintas sociedades científicas y asociaciones de pacientes reclaman políticas de mejor abordaje para llegar a estos pacientes y conseguir mayor cumplimiento del calendario vacunal a lo largo de toda la vida y de las recomendaciones. Distintas sociedades pediátricas proponen que se valore de forma individual a cada adolescente según sus circunstancias y necesidades y recomiendan una serie adicional de vacunas entre las que se incluye la del Meningococo B. Esta última vacuna que está incluida en el calendario vacunal solo para los menores de 1 año es altamente recomendada para los adolescentes. Además logrando una cobertura vacunal adecuada en la adolescencia frente al meningococo B, se lograría una protección directa frente al meningococo B, una protección cruzada frente a otros serogrupos no B y una protección directa y cruzada frente a meningococos no encapsulados causantes de uretritis multirresistentes y protección cruzada frente a Neisseria Gonorrea. Por otro lado, las conductas sexuales de riesgo como los jóvenes que tienen sexo con otros hombres (MSM men sex men) que hasta un 30 % pueden tener el meningococo en su nasofaringe, con mayor riesgo de brotes epidémicos de enfermedad meningocócica, como el que ha sucedido recientemente en Florida de ahí la importancia de las políticas sanitarias de vacunación en estos grupos de riesgo.
Es esencial aprovechar cualquier oportunidad para la información, educación y la vacunación individualizada del adolescente
Es esencial aprovechar cualquier oportunidad para la información, educación y la vacunación individualizada del adolescente(16). Campañas informativas utilizando redes sociales son adecuadas para informar a jóvenes y adolescentes, así como herramientas didácticas apropiadas como un videojuego sobre meningitis que este 2023 ha lanzado www.contralameningitis.org. Cualquier visita de un adolescente a la consulta de pediatría y atención primaria es buen momento para recordarle las medidas preventivas y recomendar un calendario de vacunación de máximos como el aprobado recientemente con el consenso de la Asociación Española de Vacunología (AEV), el Comité Asesor de Vacunas de Asociación Española de Pediatría (CAV-AEP) y La Sociedad Española de Medicina de la Adolescencia (SEMA)(20).
Tablas y figuras
Tabla I. Características del líquido cefalorraquídeo según la etiología(5)
|
VÍRICO |
BACTERIANO |
TUBERCULOSIS |
HONGOS |
PARCIALMENTE TRATADO |
|
|
Leucocitos/μl |
< 1000 |
>1000 |
< 300 |
< 500 |
>1000 |
|
Neutrófilos (%) |
20-40** |
> 85 |
< 10-20** |
<10 |
>80 |
|
Proteínas (mg/dl) |
Normal o < 100 |
>100-150 |
>200-300 |
>100-200 |
>100 |
|
Glucosa (mg/dl) |
Normal/dismin*** |
< 40 |
< 40 |
< 40 |
< 40 |
|
Relación glucosa |
Normal |
< 0,4 |
< 0,4 |
< 0,4 |
< 0,4 |
**Predominio de polimorfonucleares si la muestra se toma en etapas tempranas de la infección.
***En infecciones por herpesvirus o virus de la parotiditis.
Tabla II. Tratamiento dirigido de las meningitis bacterianas(7)
|
MICROORGANISMO |
TRATAMIENTO ESTÁNDAR |
ALTERNATIVAS |
DURACIÓN |
|
Streptococcus pneumoniae |
|||
|
Susceptible a la penicilina (CMI <0,1 μg/ml) |
Penicilina o amoxicilina/ampicilina |
Ceftriaxona, cefotaxima, cloranfenicol |
10–14 días |
|
Resistente a la penicilina (CMI >0,1 μg/ml), susceptible a la cefalosporina de tercera generación |
Ceftriaxona o cefotaxima |
Cefepima, meropenem, moxifloxacino |
10–14 días |
|
Resistente a cefalosporinas (CMI ≥2 μg/ml) |
Vancomicina más rifampicina, o vancomicina más ceftriaxona o cefotaxima, o rifampicina más ceftriaxona o cefotaxima |
Vancomicina más moxifloxacino, linezolid |
10–14 días |
|
Neisseria meningitidis |
|||
|
Susceptible a la penicilina (CMI <0,1 μg/ml) |
Penicilina o amoxicilina/ampicilina |
Ceftriaxona, cefotaxima, cloranfenicol |
7 días |
|
Resistente a la penicilina (CMI ≥0,1 μg/ml) |
Ceftriaxona o cefotaxima |
Cefipime, meropenem, ciprofloxacino o cloranfenicol |
7 días |
|
Listeria monocytogenes |
|||
|
Amoxicilina o ampicilina, penicilina G |
Trimetoprima-sulfametoxazol, moxifloxacino,meropenem, linezolid |
Al menos 21 días |
|
|
Haemophilus influenzae |
|||
|
β-lactamasa negativa |
Amoxicilina o ampicilina |
Ceftriaxona, cefotaxima o cloranfenicol |
7–10 días |
|
β-lactamasa positiva |
Ceftriaxona o cefotaxima |
Cefepima, ciprofloxacina, cloranfenicol |
7–10 días |
|
β-lactamasa negativa resistente a la ampicilina |
Ceftriaxona o cefotaxima más meropenem |
Ciprofloxacino |
7–10 días |
|
Staphylococcus aureus |
|||
|
Sensible a la meticilina |
Flucloxacilina, nafcilina, oxacilina |
Vancomicina, linezolid, rifampicina, fosfomicina, daptomicina |
Al menos 14 días |
|
Resistente a la meticilina |
Vancomicina |
Trimetoprima/sulfametoxazol, linezolid, rifampicina, fosfomicina, daptomicina |
Al menos 14 días |
|
Resistente a la vancomicina (CMI >2,0 μg/ml) |
Linezolid |
Rifampicinae fosfomicina, daptomicina |
Al menos 14 días |
Tabla III. Criterios diagnósticos de encefalitis del Doc. Consorcio internacional de encefalitis(14)
|
CRITERIO PRINCIPAL (REQUERIDO): |
|
Alteración del estado mental (definido como disminución o alteración del nivel de conciencia, letargo o cambio de personalidad) que dura ≥24 h sin que se identifique una causa alternativa. |
|
CRITERIOS MENORES: 2 REQUERIDOS PARA UNA POSIBLE ENCEFALITIS |
|
Tabla IV. Etiología de las encefalitis de origen infeccioso(9)
|
SITUACIÓN CLÍNICA |
FRECUENTES |
MENOS FRECUENTES O RAROS |
|
Paciente inmunocompetente |
VHS y otros Herpesvirus |
Listeria, Rickettsia, Tropheryma, Mycoplasma pneumoniae, Bartonella, Naegleria fowleri, Trichinella, etc. |
|
Paciente inmunodeprimido |
Lo mismo que inmunocompetente más: |
Nocardia, CMV, virus JC, virus de la coriomeningitis linfocitaria, Acanthamoenba y Balamuthia |
|
Procedencia de determinadas zonas endémicas |
Plasmodium falciparum |
Trypanososma, Schistosoma, Balamuthia, Micosis endémicas |
|
Encefalomielitis desmielinizante aguda diseminada (encefalitis postinfecciosa o postvacunal) |
Sarampión |
Virus parotiditis, Dengue, Rabia, Enterovirus, EBV, CMV, VHB |
Tabla V. Estudios recomendados para el diagnóstico de encefalitis(14)
|
LCR: recoger al menos en adultos 20 ml (congelar 5-10ml si es posible) /5 ml en caso de niños, congelar sobrante. |
|
|
|
|
|
|
|
Hemocultivos de rutina |
|
Suero |
|
Conservar suero agudo y recoger suero de convalecencia 10-14 días más tarde para la prueba de anticuerpos emparejada: confirmar por seroconversión. |
|
Serología del VIH y Lúes, VEB (VCA IgG e IgM y EBNA IgG), Mycoplasma pneumoniae IgM e IgG. |
|
Otros tejidos/fluidos |
|
Mycoplasma pneumoniae PCR de muestra de garganta |
|
Enterovirus PCR y/o cultivo de garganta y heces |
Figura 1. Enfermedad meningocócica en España temporada 2022-2023(4)
Bibliografía
1. Kliegman RM, Geme JS, Blum N, Shah SS, Tasker RC. Capítulos 621 y 622. Tratado Nelson Pediatría. Edición 21, año 2020.
2. Goycochea Valdivia WA. Situación actual del Meningococo en España. Adolescere 2019; VII(3): 52-64.
3. Novoa Carballal R. Utilidad de las escalas diagnósticas de meningitis en niños en los servicios de urgencias. Tesis Doctoral. Universidad Autónoma de Madrid 2014. https://dialnet.unirioja.es.
4. Comité Asesor de Vacunas de la AEP. Enfermedad meningocócica en España temporada 2022-2023. Enfermedad meningocócica en España: evolución de la temporada 2022-23. (vacunasaep.org).
5. Sanchiz Cárdenas S, Collado Caparrós JF, Tellez García C, Reyes Domínguez SB. Meningitis bacteriana aguda. Protoc diagn ter pediatric. 2021 ;1: 611-25.
6. World Health Organization. Defeating Meningitis by 2030: A Global Road Map. Published June 24, 2021. Accessed June 24, 2021. https://www.who.int/publications/i/item/9789240026407.
7. Navarro Marí JM, Pérez Ruiz M, Vicente Anza D. Diagnóstico de laboratorio de las meningitis linfocitarias. Enferm Infecc Microbiol Clin. 2010;28 (Supl 1):56-61.
8. Carazo Gallego B, Cardelo Autero N, Moreno Pérez D. Meningitis. Absceso cerebral. Encefalitis aguda. Protoc diagn ter pediatr.2023;2:309-328.
9. Soriano Viladomiu V, Mensa Pueyo J., López Suñé, E., Zboromyrska, Y., Llinares Mondejar, P., & Barberán López, J. (2022). Guía de terapéutica antimicrobiana 2022: Mensa Gatell. Editorial Antares. ISBN 9788488825315.
10. Hasbun R. Progress and challenges in bacterial meningitis: a review. JAMA. 2022;328(21):2147-2154. doi:10.1001/jama.2022.20521.
11. Prats G, Codina MG, Cueto M, Echevarría JE, Vicente D. Diagnóstico microbiológico de las infecciones del sistema nervioso central. 36. En: Cercenado E, Cantón R, editores. Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Madrid: SEIMC; 2010.
12. Van de Beek D, Cabellos C, Dzupova O, Exposito S, Klein M, Kloek AT et al. ESCMID guideline:diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect 2016 ;22:S37-S62.
13. Cantanero D, Blázquez C, Lanza P, Pascual M, Pérez F, González I. Estudio de Evaluación de la carga de la enfermedad meningocócica frente a la no vacunación. Grupo de I+D+I en economía de la salud y gestión de servicios sanitarios UC-IDIVAL 2020. Los costes de la meningitis – Asociación Española contra la Meningitis.
14. Venkatesan A, Tunkel AR, Bloch KC, Lauring AS, Sejvar J, Bitnun A, et al; International Encephalitis Consortium. Case definitions, diagnostic algorithms, and priorities in encephalitis: consensus statement of the International Encephalitis Consortium. Clin Infect Dis 2013; 57:1114–28. Consensus Document on Encephalitis • CID 2013:57.
15. Tunkel AR, Glaser CA, Bloch KC, Sejvar JJ, Marra CM, Roos KL, et al. The management of encephalitis: Clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2008; 47:303–27.
16. Oiz Urriza I, Rivero Calle I. Vacunación en el adolescente ¿Hacia un calendario de máximos? Adolescere 2023; XI(2):47-57).
17. Tan LLJ, Safadi MA P, Horn M, Regojo Balboa C, Moya E, Schanbaum J et al. Pandemic´s influence on parents´ attitudes and behaviors toward meningococcal vaccination. Human Vaccines&inmunotherapeutics 2023, vol 19. NO,12179840.
18. Álvarez García FJ. La adolescencia y la enfermedad meningocócica. Situación actual y nuevas vacunas. Adolescere 2018;VI(2):48-52.
19. Moraga-Llop F. ¿La enfermedad meningocócica eclipsada por la pandemia de Covid -19? Puesta al día de la vacunación antimenigococica. Adolescere 2022; 10: 3; 60-69.
20. Calendario de vacunaciones del adolescente (Consenso AEP, AEV y SEMA) Julio 2023. www.vacunasaep.org.
Bibliografía recomendada
- Carazo Gallego B, Cardelo Autero N, Moreno Pérez D. Meningitis. Absceso cerebral. Encefalitis aguda. Protoc diagn ter pediatr.2023;2:309-328.
- Kliegman RM, Geme JS, Blum N, Shah SS, Tasker RC. Capítulos 621 y 622. Tratado Nelson Pediatría. Edición 21 año 2020.
- Oiz Urriza I, Rivero Calle I. Vacunación en el adolescente ¿Hacia un calendario de máximos? Adolescere 2023; XI(2):47-57.
- Tan LLJ, Safadi MA P, Horn M, Regojo Balboa C, Moya E, Schanbaum J et al. Pandemic´s influence on parents´ attitudes and behaviors toward meningococcal vaccination.. Human Vaccines&inmunotherapeutics 2023, vol 19. NO,12179840.
- Cantanero D, Blázquez C, Lanza P, Pascual M, Pérez F, González I. Estudio de Evaluación de la carga de la enfermedad meningocócica frente a la no vacunación. Grupo de I+D+I en economía de la salud y gestión de servicios sanitarios UC-IDIVAL 2020. Los costes de la meningitis – Asociación Española contra la Meningitis.