Anorexia
C. Imaz Roncero* y J.M. Martínez Rodríguez.
*Psiquiatra. Equipo de Salud Mental del Niño y Adolescente.
Hospital Universitario Río Hortega de Valladolid. Profesor asociado de Psiquiatría, Facultad de Medicina. Universidad de Valladolid.
Adolescere 2016; IV (2): 71-80
Resumen
|
Se presenta un caso de trastorno del comportamiento alimentario en un preadolescente que nos sirve para abordar y reflexionar sobre los problemas asistenciales que se generan desde su detección hasta su abordaje psiquiátrico. Dichos problemas tienen relación, en muchas ocasiones, con el estigma que la enfermedad mental tiene especialmente cuando afecta a niños y adolescentes y provoca importantes dificultades para su manejo.
Nuestro paciente fue diagnosticado de una anorexia prepuberal, y en base al caso, se reflexiona sobre los mitos asociados a la atención de estos cuadros, aprovechando lo referido por el paciente y su familia en una única y primera consulta.
Palabras clave: Anorexia, Prepuberal, Mitos, Estigma
|
Abstract
|
A case of eating behavior disorder in a pre-teen is presented to address and reflect on the medical care problems that arise since the time of detection until psychiatric intervention. In many cases these problems are related to the stigma that accompanies mental illness, especially when it affects children and adolescents, leading to significant difficulties in its management. We present a patient with prepubertal anorexia, and elaborate on the myths associated with this diagnosis, as reported by the patient and his family in the first and only consultation.
Key words: Anorexia, Prepubertal, Myths, Stigma
|
Caso clínico
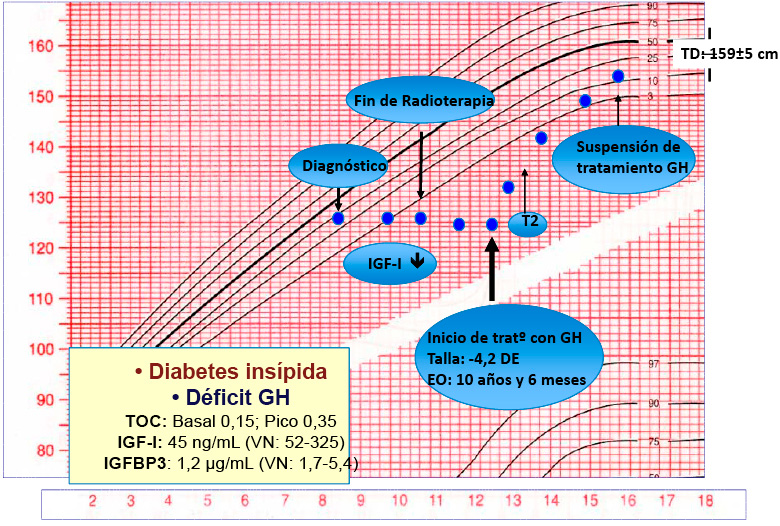
Mujer de 10 años 4 meses que acude a consulta privada de Psiquiatría del Niño y Adolescente de forma urgente.
En un primer abordaje de forma individual con la paciente, dice reconocer que el motivo por el que acude a consulta es por haber perdido peso, en torno a 1 kilo y medio en los últimos 9 meses. Aunque luego los padres refieren que todo se detecta por una pérdida de peso hace 9 meses en el que pasa de un peso en Pc 25 a un Pc 15. A partir de ahí se convierte en un motivo de preocupación para la Pediatra que lo detecta, comenzando un seguimiento y control del peso. Durante ese seguimiento se había seguido produciendo una pérdida progresiva, mucho mayor a la referida por la paciente, y tras otros 9 meses de control, presentaba un peso de 25,8 Kgr (Pc 2-3) y 141,5cm (Pc 50) de altura con un IMC de 12,9 (<Pc 2). En ese momento la Pediatra decide la derivación a Salud Mental y tiene una cita programada con el Trabajador Social del mismo para 20 días después. Los padres alarmados, tanto por la pérdida de peso como por los problemas comportamentales que estaban detectando en su hija, deciden acudir a consulta privada de Psiquiatría del Niño y Adolescente por la angustia que les genera la mala evolución y dada la espera que tiene el Sistema Nacional de Salud.
El MITO de la analítica normal
A esta paciente durante el seguimiento se la hicieron analíticas hemáticas. Y todas ellas normales o con alteraciones no significativas. ¿Pero qué alteraciones puede producir una desnutrición? ¿Hay signos de detección precoz de desnutrición en sangre?
Una analítica normal no descarta nunca un TCA. En estos casos, puede ser contraproducente ya que puede favorecer una “falsa tranquilidad” al paciente, a la familia y al profesional no experto; puede convertirse en un refuerzo positivo para la actitud de la persona afectada; o, incluso, la persona afectada puede ver al profesional como un aliado de su familia.(1)
Una analítica normal no descarta nunca un Trastorno del comportamiento alimentario
En este caso solo había un aumento del colesterol inespecífico. Dicha alteración ha sido descrita como una alteración típica en los procesos de desnutrición grave fruto de la ruptura celular y el aumento del componente de colesterol de las membranas de las células.
El MITO de la alimentación saludable
El objetivo de los tratamientos psicológicos es la reducción del riesgo, lograr un aumento de peso a base de una alimentación saludable, reducir otros síntomas relacionados con el TCA y facilitar la recuperación física y psicológica
El objetivo de los tratamientos psicológicos es la reducción del riesgo, lograr un aumento de peso a base de una alimentación saludable, reducir otros síntomas relacionados con el TCA y facilitar la recuperación física y psicológica, tal como refleja la guía NICE(2) o la propia guía española.
Pero para nuestro paciente la alimentación saludable es otra cosa. La existencia de alimentos buenos y malos. En el que los dulces y las grasas son identificados como malos, ya es algo que forma parte de la cultura popular. La preocupación de la paciente de alimentarse de forma sana, evitando alimentos de alto contenido energético, como los dulces y todos los alimentos que contienen grasas, haciendo una alimentación de dieta controlada y restrictiva. Hacer dieta saludable (una de las creencias erróneas más habitual como el peso y la salud)(3), es defendido por la paciente, y la familia carece de argumentos para contrarrestar tanto los pensamientos, como las actuaciones en esta línea.
Saben que algo no está funcionando, saben que está retirando muchos alimentos que antes la gustaban, pero comer sano es defendido a capa y espada, y ¿qué se puede hacer? ¿Cómo podría la familia o su Pediatra contrarrestar esa distorsión?
En este caso había días que comía en el comedor escolar reconociendo la paciente que ahí era ella mucho más lenta que su hermano, por cierto diagnosticado de TDAH y en tratamiento. Lentitud que la paciente no justifica con nada, salvo que la hacían tomar fruta, porque no suele comer un tercer plato en la comida. La fruta la gusta, pero en el comedor la solían poner una manzana y ella siente que la va fatal porque es un poco estreñida. Sin embargo sabemos que la manzana es uno de los alimentos preferidos en las pacientes con anorexia por su bajo contenido calórico, aspecto que posiblemente por su baja edad todavía posiblemente no es conocedora y, por lo tanto, no es muy consciente como otros pacientes de mayor evolución.
El MITO de lo saludable que es el deporte o la actividad física
La realización de actividad física es otro de los grandes principios de la vida saludable y como en el punto anterior forma parte del problema y de la solución.
Así el programa ATHENA(4), entre otros, ha demostrado eficacia en prevención primaria que se basa en promocionar la alimentación saludable y el ejercicio físico como alternativas para eliminar conductas nocivas.
La paciente se lo toma a pecho. Participa en un grupo de atletismo pero es que además hasta para ponerse el pijama la viene bien correr. Aunque esto es descrito en ocasiones como la hiperactividad involuntaria secundaria a la desnutrición.
Pero es que además correr, como dice la paciente, la ayuda a controlar la ansiedad. Y tiene razón, la actividad física no solo ayuda a mantener un cuerpo sano también ayuda a la descarga de tensión emocional. Y la paciente decide subir y bajar escaleras y no para de moverse. Eso si el padre salía a correr con ella y de momento lo habían suspendido conscientes de que para que el cuerpo aguante una actividad física precisa de una nutrición adecuada, que en esos momentos claramente era incapaz de alcanzar.
Curiosamente la percepción de la paciente en este punto es que no puede dejar la actividad física porque el ejercicio le da la vida.
El MITO de si no me veo gorda no tengo anorexia
La distorsión de la imagen corporal ha sido un criterio diagnóstico sobredimensionado. Es verdad que es muy llamativa la presencia de este síntoma en un adolescente, cuando son chicas inteligentes y brillantes, como en nuestro caso. Quizás es de los síntomas más mediáticos, siendo la iconografía de la delgada frente al espejo con una distorsión identificadora en muchos programas de anorexia.
En la clasificación DSM-5(5) establecen este criterio, criterio C, como: Alteración en la forma en que uno mismo percibe su propio peso o constitución, influencia impropia del peso o la constitución corporal en la autoevaluación, o falta persistente de reconocimiento de la gravedad del peso corporal bajo actual.
Desde luego en este caso la falta de reconocimiento de la gravedad del peso corporal, que como hemos indicado está en percentil de IMC menor de 2 es claramente significativo. Pero eso sí, la paciente era consciente de que podía tener “media anorexia” pero que no podía tener una anorexia porque ella se veía delgada, incluso muy delgada, y no quería perder peso.
El criterio B definido como: Miedo intenso a ganar peso o a engordar, o comportamiento persistente que interfiere en el aumento de peso, incluso con un peso significativamente bajo. Se pone de manifiesto de forma muy evidente al abordar la necesidad de control de actividad, en la que expresa “si dejo de correr en una semana puedo aumentar 1 kg de peso… y yo no quiero…no puedo…”
El MITO de que la enfermedad mental no existe
Todo lo que nos pasa nos pasa en el cuerpo o no existe. Es verdad que sin cuerpo no existiríamos, y que el cuerpo es la base de nuestra existencia. Pero los pensamientos, emociones y sentimientos, además de miedos, ilusiones, fantasías,… son parte de la existencia o vida humana. Y dichas experiencias presentan una potencia importante para movilizar y generar cambios de curación o de enfermar.
El miedo a crecer y el miedo al desarrollo que esta paciente expresa, y que además viene inducido y reconocido tanto por los padres como por la propia paciente, a raíz de ser atendida por inicio de vello pubiano precoz. Dicha situación fue valorada como normal en Endocrinología Pediátrica antes de iniciarse este problema. Pero dicha evaluación puso de manifiesto la realidad de que su cuerpo era un cuerpo que estaba en los inicios de un proceso puberal, posiblemente hoy cercenado, por la restricción alimentaria importantísima y que limita todo el desarrollo.
Al parecer los padres aprovecharon la asistencia a este signo de desarrollo para informar a su hija sobre el cambio puberal que se avecinaba. Aparentemente los abordan con normalidad, pero, al parecer, fue una forma de despertar fantasmas y miedos. Así ambos, paciente y padres, reconocen que esa realidad biológica la produce malestar y agobio. El temor a ese cambio de cuerpo de niña a cuerpo de mujer, y el rechazo y negación parecen influir, como un factor más añadido el inicio y desarrollo del cuadro actual.
No reconocer la enfermedad mental, no aceptarla, y, por tanto, no atenderla es un factor determinante en el proceso asistencial, que afecta a paciente, familia y también profesionales
No reconocer la enfermedad mental, no aceptarla, y, por tanto, no atenderla es un factor determinante en el proceso asistencial, que afecta a paciente, familia y también profesionales. Y no solo de Atención Primaria.
El MITO de que una niña inteligente no puede dejarse atrapar por la enfermedad mental
Como una niña definida como perfecta hasta ese verano, ese junio en el que se detecta el inicio de una pérdida de peso, pero en una niña con unas notas extraordinarias, y que además en una niña alegre, con iniciativa e incluso una líder para con sus iguales. Que es capaz de ganar premios en concursos de cuentos, por su capacidad expresiva y literaria, que es capaz de ayudar a su hermano menor adoptado afecto de Trastorno de Déficit de Atención para el que es como una segunda madre. Y, por tanto, una niña muy sana, una niña muy capaz, una niña muy envidiable ¿cómo puede someterse a la locura, a una locura, a esta locura?
Nadie está libre de padecer una enfermedad mental, bien en sus propias carnes o a través de un familiar.
El MITO de que la Psiquiatría actúa cuando los médicos de verdad ya no pueden hacer nada
Los médicos del cuerpo, los que miden y cuantifican, a los médicos del alma, del espíritu, que interpretan o evalúan lo etéreo e incuantificable.
Los unos y los otros, los que no quieren ver, no pueden o no saben ver más allá de unos datos, un peso, una analítica, etc. como los que demandan que todo proceso orgánico esté descartado para poderse dedicar a lo mental, sin temor a que nadie le pueda recordar que también es médico.
El ser considerado medio brujo, chamán o, simplemente, un cuentista donde va el que está desahuciado y sin remedio, porque ha caído en el mundo de lo psíquico como algo irrecuperable. Todavía es vivido así por muchos.
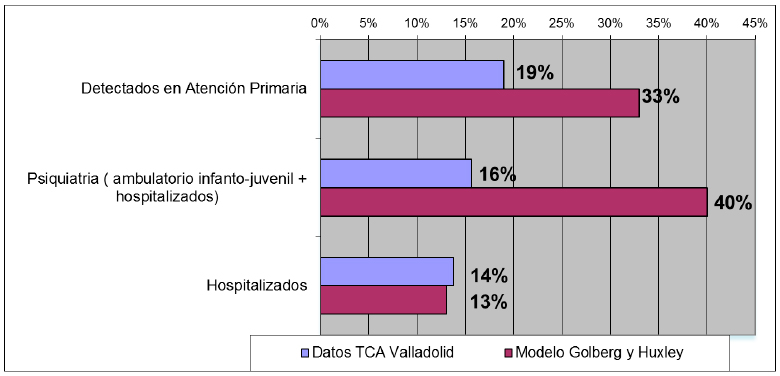
Si realizamos la comparativa entre el modelo teórico de asistencia de Golberg y Huxley y los datos de atención a los TCA en Valladolid se observa que se están infradetectando los TCA con respecto a lo esperable en la detección de patología mental por los médicos de Atención primaria según dicho modelo teórico, así, se detectan el 19% frente a un 33%. Pero quizás lo más llamativo en la comparativa es la falta de derivación de los casos detectados a los servicios de Psiquiatria infanto-juvenil, solo un 16% frente a un 40% teórico. Por otra parte, es similar el porcentaje de los cuadros atendidos en la Atención especializada que precisan de ingreso, un 16% frente a un 13% teórico.Y que se puede ver en la figura siguiente(6).
Los datos reflejan una realidad que se considera poco satisfactoria, con un porcentaje alto de casos que no son detectados por Atención Primaria y sobre todo con una baja derivación a los servicios ambulatorios de Psiquiatría Infantil
Los datos reflejan una realidad que se considera poco satisfactoria, con un porcentaje alto de casos que no son detectados por Atención Primaria y sobre todo con una baja derivación a los servicios ambulatorios de Psiquiatría Infantil.
El MITO de que el dolor tiene siempre causa orgánica mientras no se demuestre lo contrario
La existencia de dolor, y dolor más concretamente digestivo, es altamente frecuente en estos casos. Los psiquiatras los justificamos porque la función hace al órgano. Si cada vez utilizamos menos el aparato digestivo más perezoso se hace y más se queja. El estreñimiento también es un síntoma frecuente, asociado a la restricción alimentaria y puede aumentar el malestar digestivo.
Y el dolor digestivo es un factor de disminución de ingesta alimentaria, lo cual es un factor favorecedor para el inicio y/o desarrollo de un trastorno del comportamiento alimentario. El estudio de las causas asociadas al dolor gástrico o malestar digestivo es un elemento asistencial de primera magnitud pero ¿cuándo es causa o cuándo consecuencia?
La paciente presenta dolor al comer y es una de las razones esgrimidas para comer menos y para ese “no puedo comer más”. Y ¿qué padre/madre hacen comer a un hijo/a que les dice que le duele? Muy claro, muy seguro lo tiene que tener uno para que uno se imponga al dolor.
El MITO de que los problemas se controlan mirando solo una parte del problema
Si controlo el peso controlo el problema alimentario. El pensamiento de muchos profesionales se limita a valorar aspecto que saben y controlan, y aquello que se sabe sin conocer bien, me genera inseguridad y se deja a un lado. Y aunque el peso está descrito como el factor de recuperación en adolescentes más significativo no basta con un control del peso, dejando al que evoluciona mal la derivación a Psiquiatría.
La preparación nutricional es alta en Pediatría, sobre todo en los primeros años de la vida pero menor en la infancia y mucho menor en la adolescencia, al igual que tampoco suele haber una buena preparación en los médicos de Medicina Familiar y Comunitaria. ¿Y en Salud Mental? Los médicos de Atención Primaria al menos tienen una rotación obligatoria en Psiquiatría pero los Pediatras no.
Al final dichos especialistas intervienen, aunque otras veces también colabora Enfermería o unidades de Nutrición hospitalaria, pero es preciso tener una visión amplia y no limitada a la parte somática, en la que es preciso tomar conciencia de las distorsiones cognitivas tan frecuentemente asociadas así como los problemas comportamentales.
Para que un tratamiento sea eficaz tiene que tener desde el inicio una visión global del asunto e incluir aspectos psicoterapéuticos, psicoeducativos, tratamiento farmacológico y renutrición.
Para que un tratamiento sea eficaz tiene que tener desde el inicio una visión global del asunto e incluir aspectos psicoterapéuticos, psicoeducativos, tratamiento farmacológico y renutrición
Además en este caso además de ansiedad e insomnio había comenzado a presentar conductas agresivas con importante malestar en el entorno familiar. Y aunque un desencadenante para estos comportamientos era por comer, cualquier mínima contrariedad se convertía en un desencadenante agresivo.
El MITO de que lo físico y el peso es lo único importante
Como se planteaba previamente preocuparse del cuerpo y el físico y, por tanto, del peso es para lo que se prepara a los médicos hoy en día. Todos reconocemos que hay algo más. Pero ¿cuándo se pone de manifiesto? ¿Cuándo el peso o la conducta o los datos físicos toman un valor que motiva la alarma?
Quizá sigue siendo ese el problema, ver solo los datos como elemento único, sin ver el contexto personal, familiar y social. Cuando se ve a una niña brillante pero exigente, perfeccionista, con un nivel de tensión importante y que aumenta su competitividad, con cierta rigidez, con un cambio de carácter significativo, que se enfada, que se altera más en la familia cuando no es habitual, que cambia patrones alimentarios, que aumenta la actividad física, etc. ya no solo vemos un cuerpo y un peso.
¿Pero se escucha al adolescente? ¿Se escucha a la familia? ¿Se tienen en cuenta estos factores conductuales, emocionales, familiares?
El MITO de que solo desde la Psiquiatría se puede dar respuesta a un problema de Anorexia
Ser capaz de valorar lo que de falso o anormal en la evolución psíquica de un proceso y pensar en una afectación de otro tipo es una responsabilidad del Psiquiatra, pero que tampoco se quiere tener. No hay mayor agobio que tratar de anorexia a un tumor cerebral o a una patología tiroidea o un problema digestivo o cualquier otro. Estos casos nos provocan sonrojo y malestar. Esto también motiva que se den mensajes desde la Salud Mental que también calan para que no se envíe a nadie que pueda tener algo que no sea estrictamente psíquico. Esta falacia de la concepción errónea de Descartes del cuerpo y mente como entidades separadas.
Pero para la detección y derivación inicial así como para el seguimiento y control nutricional posterior el Psiquiatra precisa de otros profesionales que supervisen y que sea la referencia en las pautas nutricionales. No porque el psiquiatra no pueda formarse en esas áreas, si no por diferenciar funciones y abordajes que son complementarios y que van a ayudar a enfrentarse a un problema complejo.
La necesidad de coordinación con otros profesionales tanto del ámbito médico (médicos de Atención Primaria, como especialistas Endocrinos, Digestivo, etc.) que supervisen los aspectos nutricionales como en el ámbito psicológico (para complementar los aspectos personales o familiares) son condicionantes del proceso asistencial cuando este se produce
La necesidad de coordinación con otros profesionales tanto del ámbito médico (médicos de Atención Primaria, como especialistas Endocrinos, Digestivo, etc.) que supervisen los aspectos nutricionales como en el ámbito psicológico (para complementar los aspectos personales o familiares) son condicionantes del proceso asistencial cuando este se produce.
No es preciso un gran equipo ni una gran coordinación, sobre todo en las fases iniciales, pero si un reconocimiento del problema y de las dimensiones del mismo, trabajar coordinadamente y tener claro que hay fases en las que la recuperación de peso puede ser el objetivo prioritario pero que mientras lo psíquico no se sitúe adecuadamente no puede haber curación.
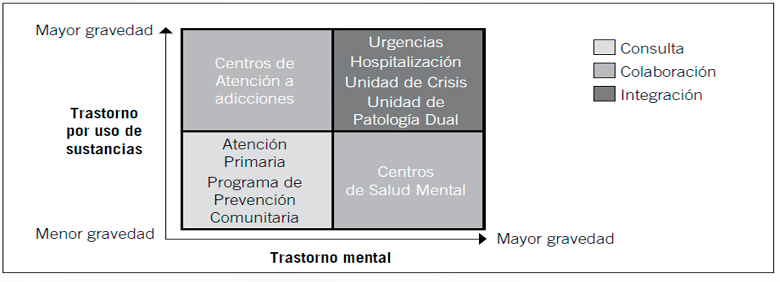
El modelo de asistencia a la patología dual en adolescentes, referido a los problemas de adicciones, es un modelo a seguir en otros modelos asistenciales que precisan coordinación, siendo mayor y más precisa a mayor gravedad de problema o a mayor complejidad de los cuadros, donde suele ser preciso Unidad integradas. (Figura 1)
El MITO de que la medicina natural es mejor
La paciente ha tomado melisa, pasiflora por aquello de relajarse y dormir mejor. Muy extendida dicha costumbre de tratar sin tratar o sin diagnosticar. Tratamiento es el conjunto de medios de cualquier clase (higiénicos, farmacológicos, quirúrgicos o físicos) cuya finalidad es la curación o el alivio (paliación) de las enfermedades o síntomas.
Si diéramos analgesia a un dolor abdominal con sospecha de apendicitis nos suspenderían en el Grado de Medicina. Somos conscientes todos de que encubrir síntomas puede ser un factor de retraso en diagnóstico y, por tanto, del reconocimiento del problema y, por tanto, de la búsqueda de soluciones reales.
Aliviar síntomas por tanto, se puede convertir es un elemento de retraso en la asistencia que aumenta cuando se recurre a esos preparados naturales que todo el mundo toma porque son mejor que la medicina tradicional y más saludables, para gente sana claro. Una ironía o una realidad.
El MITO de que no hay urgencia en Psiquiatría y que con psicología todo se puede resolver
Cuando digo psicología no me refiero a la buena psicología que ayuda a entender y comprender los mecanismos psíquicos subyacentes o las dinámicas relacionales patológicas. Si esa impresión que todo con “buenas palabras” se puede resolver. Y que, por tanto, no hay solución mágica ni pastillas que lo resuelven todo sino que es algo que solo uno puede descubrir y sanar, reduciendo al terapeuta o al tratamiento como la observación o la escucha del sujeto sin más.
Hay medidas que son urgentes y algunas vienen de fuera. Es verdad que eso no es curar, pero tampoco aportar oxígeno en la crisis asmática cura la crisis asmática, pero permite una supervivencia que puede ayudar a dar tiempo a que los tratamientos broncodilatadores o el tratamiento frente a la infección desencadenante de la crisis asmática hagan su efecto.
Aportar nutrientes o un manejo de consecuencias adecuado es una forma de curar. El mejor tratamiento en la anorexia, especialmente en la restrictiva pero no solo, es comer y comer bien. El no comer también se convierte en un conflicto permanente con los más cercanos, generalmente padres y especialmente madres. En ese conflicto hay muchos mecanismos psíquicos como la terquedad, agresión, rechazo, distancia y autoafirmación, y muchos más. A su vez dichos mecanismos generan unas dinámicas de dependencia y necesidad que es preciso corregir.
Así los padres se vuelcan en esos hijos y esto provoca un mayor conflicto o tensión pero también un mecanismo de refuerzo positivo para obtener mayor atención. Es pronto para valorar el caso y para poder determinar esos mecanismos subyacentes pero no sería osado aventurar que en una familia con un hijo menor adoptado, la enfermedad de la hija mayor y biológica, puede producir un aumento de la atención parental que podía haber perdido.
Romper con dichas dinámicas no es fácil y en ocasiones precisan de tomar distancia que puede motivar un ingreso hospitalario, o al menos la asistencia en hospital de día, para poder abordar la parte nutricia de la relación al margen de la dimensión emocional y resituar la relación materno-filial. Detectar y evitar así mismo posibles sentimientos de culpa y/o dinámicas de ni contigo ni sin ti.
El MITO de que no hay posibilidad de atender de forma rápida y preferente a ciertos cuadros graves
La red asistencial pública, tantas veces valorada, fracasa en muchos casos por la falta de flexibilidad de unos y otros. Y ahí se incluye a pacientes y sus familias pero también profesionales de Primaria o Especializada y Gerencias o responsables asistenciales.
La red asistencial pública, tantas veces valorada, fracasa en muchos casos por la falta de flexibilidad de unos y otros. Y ahí se incluye a pacientes y sus familias pero también profesionales de Primaria o Especia-lizada y Gerencias o responsables asistenciales
Nadie duda de que hay, y habrá, listas de espera para cirugía o para consultas. Pero que dichas listas de espera pueden y deben gestionarse con voluntad de contener demandas inapropiadas. En muchas de ellas subyace que todo problema es curable y todo, por tanto, se puede resolver; y si no se resuelve es porque alguien lo ha hecho mal y será el culpable de mi problema. Pero nunca las listas de espera pueden servir para retrasar la asistencia de lo que hay que atender. Nadie dejaría una apendicitis para una lista de espera porque todos conocemos que es un proceso urgente, que no admite esperas.
¿Un cuadro de pérdida de peso en una preadolescente que estaba iniciando proceso puberal y, por tanto, con un posible diagnóstico de anorexia nerviosa prepuberal es urgente? Yo no tengo ninguna duda ¿Ustedes?
La falta de métodos que permitan la gestión diferenciada de la demanda y evitar lo que sería una mala solución, colapsar urgencias, hoy son un factor de retraso en la asistencia. Y que aumenta el problema del estigma de la enfermedad mental que produce un retraso para la demanda tanto del paciente, su familia y del propio profesional.
El MITO de que la anorexia es una enfermedad crónica e incurable
La mayoría de los pacientes con inicio adolescente de anorexia nerviosa parecen remitir dentro de 3-10 años
Hay muchos datos para la esperanza y que refutan la incurabilidad y cronicidad de la Anorexia. Así hasta el 88% de los casos de Anorexia tratados en la comunidad recuperan el peso según este reciente estudio de Mustelin y cols(8) y en el estudio de Knoll y cols(9) se concluye que la mayoría de los pacientes con inicio adolescente de anorexia nerviosa parecen remitir dentro de 3-10 años.
Aunque los criterios para la recuperación no son siempre claros hay estudios(10) que manifiestan que el logro de un peso corporal de 95,2% del peso corporal esperado para finalizar el tratamiento es el mejor predictor de la recuperación de los adolescentes con anorexia nerviosa.
Es verdad que los tratamientos agresivos y precoces pueden ayudar a descender la cronicidad total, morbilidad y mortalidad, como recoge el estudio de Norrisy cols (11) especialmente cuando son pacientes jóvenes, como también concluye la revisión de Campbell y Peebles(12).
Es claro que los pacientes jóvenes están en fases más iniciales de la enfermedad, mientras que los pacientes mayores son más frecuentemente crónicos. Los pacientes mayores a veces son aquellos que no recibieron respuesta eficaz/agresiva y no fueron detectados cuando eran más jóvenes. Por ello la importancia en su detección y el tratamiento para evitar esas progresiones negativas y que motivan ese mito de enfermedad crónica e incurable.
Tablas y figuras
Figura 1. Atención y grado de coordinación entre los diferentes servicios en los casos de patología dual adolescente. Adaptación de SAMHSA, 20027
Bibliografía
1. Grupo de trabajo de la Guía de Práctica Clínica sobre Trastornos de la Conducta Alimentaria. Guía de Práctica Clínica sobre Trastornos de la Conducta Alimentaria. Madrid: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Consumo. Agència d’Avaluació de Tecnologia i Recerca Mèdiques de Cataluña; 2009. Guías de Práctica Clínica en el SNS: AATRM Núm. 2006/05-01.
2. Eating disorders: anorexia nervosa, bulimia nervosa and related eating disorders. Understanding NICE guidance: a guide for people with eating disorders, their advocates and carers, and the public. London (United Kingdom): National Institute for Clinical Excellence; 2004.
3. Guia per a l’abordatge dels trastorns de la conducta alimentària a Osona. Regió Sanitària Catalunya Central. Servei Català de la Salut. Departament de Salut. Generalitat de Catalunya; 2008.
4. Elliot DL, Moe EL, Goldberg L, DeFrancesco CA, Durham MB, Hix-Small H. Definition and outcome of a curriculum to prevent disordered eating and body-shaping drug use. J Sch Health. 2006;76(2):67-73
5. Asociación Americana de Psiquiatría, Guía de consulta de los criterios diagnósticos del DSM 5. Arlington, VA, Asociación Americana de Psiquiatría, 2013.
6. C. Imaz Roncero, M. C. Ballesteros Alcalde, M. B. N. Higuera González, V. J. M. Conde López Análisis asistencial en los trastornos del comportamiento alimentario en Valladolid. Actas Españolas de Psiquiatría 2008;36(2):63-122
7. Javier Goti Elejalde, Rosa Díaz Hurtado, Celso Arango.Patologia Dual. Protocolos de intervención. Adolescentes.. Edikamed, Barcelona 2014, Brainpharma.
8. Mustelin, Linda; Raevuori, Anu; Bulik, Cynthia M; Rissanen, Aila; Hoek, Hans W; Kaprio, Jaakko; Keski-Rahkonen, Anna. Long-term outcome in anorexia nervosa in the community. Int J Eat Disord. 2015 Nov;48(7):851-9.
9. Knoll, Susanne; Föcker, Manuel; Hebebrand, Johannes; Clinical problems encountered in the treatment of adolescents with anorexia nervosa. Z Kinder Jugendpsychiatr Psychother. 2013 Nov;41(6):433-46
10. Lock, James; Agras, W Stewart; Le Grange, Daniel; Couturier, Jennifer; Safer, Debra; Bryson, Susan W; Do end of treatment assessments predict outcome at follow-up in eating disorders? Int J Eat Disord. 2013 Dec;46(8):771-8.
11. Norris M, Strike M, Pinhas L, Gomez R, Elliott A, Ferguson P, Gusella J. The canadian eating disorder program survey – exploring intensive treatment programs for youth with eating disorders.J Can Acad Child Adolesc Psychiatry, 2013 Nov;22(4):310-6.
12. Kenisha Campbell and Rebecka Peebles. Eating Disorders in Children and Adolescents: State of the Art Review. Pediatrics 2014;134:582–592.