Maltrato de la población adolescente a través de las TICS (grooming, sexting, ciberbullying)
Maltrato de la población adolescente a través de las TICS (grooming, sexting, ciberbullying)
M.A. Salmerón Ruiz.
Pediatra. Unidad de adolescencia y pediatría. Hospital Ruber Internacional, Madrid.
Adolescere 2022; X (3): 103-110
Resumen
|
El ciberacoso constituye una entidad que afecta preferentemente a adolescentes. Su creciente incidencia y su repercusión clínica, con un alto riesgo de depresión y conductas suicidas, hace necesaria una adecuada formación de los pediatras, al ser los síntomas psicosomáticos, en muchos casos, el primer indicio. El objetivo es prevenir la aparición de nuevos casos y la detección precoz, para poder realizar un manejo adecuado de los pacientes. Sin embargo, las características especiales de esta entidad requerirán un trabajo coordinado y multidisciplinar en el ámbito familiar, escolar, policial y judicial. Palabras clave: Cyberbullying; Bullying; Grooming. |
Abstract
|
Cyberbullying is an entity that preferentially affects adolescents. Its growing incidence and its clinical repercussion, with a high risk of depression and suicidal behaviors, make it necessary to adequately train pediatricians, as psychosomatic symptoms are, in many cases, the first indication. The objective is to prevent the appearance of new cases and early detection, in order to carry out an adequate management of patients. However, the special characteristics of this entity will require coordinated and multidisciplinary work in the family, school, police and judicial spheres. Key words: Cyberbullying; Bullying; Grooming. |
¿Qué es la salud digital? (1)
La OMS(2) definió la salud como ausencia de enfermedad y completo bienestar a nivel físico, psicológico y social. Hay muchas definiciones posteriores de salud. Terris(3) en los años 80 suprimió de la definición la palabra “completo” por ser irreal e introdujo el término funcionalidad, dando cabida a la diversidad funcional. En la adolescencia además la salud sexual tiene una gran relevancia.
El mundo digital tiene riesgos y beneficios que repercuten en todas las esferas del individuo: a nivel físico, psicológico, social, sexual y funcional
El mundo digital tiene riesgos y beneficios que repercuten en todas las esferas del individuo: a nivel físico, psicológico, social, sexual y funcional. Es decir, el uso inadecuado del mundo digital impacta sobre la salud a cualquier edad, especialmente en niños y adolescentes, al estar en desarrollo(4,5). La salud digital promueve un uso saludable, seguro, crítico y responsable de las Tecnologías de la Información y la Comunicación (TIC).
Los objetivos de la salud digital son: 1) promoción de los hábitos saludables digitales; 2) Detección precoz de los riegos y de las patologías derivadas; 3) tratar de forma adecuada los casos y evitar las secuelas según el riesgo.
Es necesario que los padres sean conscientes del impacto del mundo digital sobre la salud de sus hijos y sean agentes activos en la educación digital a nivel familiar(4,5,6).
Se entiende como digital a todas aquellas herramientas que nos permiten almacenar y compartir información: televisión, tableta, teléfono inteligente, ordenador, pulseras de actividad…
¿Cuáles son los riesgos digitales que afectan a la salud de niños y adolescentes?(1)
Para entender los riesgos de las TIC hay que diferenciar dos etapas(4,5,6):
- En los menores de dos años. Es una etapa crucial en el desarrollo: el establecimiento del apego y del vínculo, el desarrollo de la psicomotricidad fina y gruesa, el inicio del lenguaje, el aprendizaje del control de las frustraciones y los tiempos. El uso de pantallas en esta edad de forma habitual interfiere directamente en el desarrollo psicosocial, en el sueño y aumenta el riesgo de obesidad al disminuir el tiempo de actividad física.
- En los preadolescentes y adolescentes. El riesgo más frecuente es el acceso a información inadecuada para la edad y el que entraña mayor riesgo es el ciberacoso, por la alta probabilidad de depresión grave y suicidio. Además, el mal uso, el abuso y las conductas adictivas en internet, los trastornos del sueño, el riesgo aumentado de obesidad y problemas atencionales que dificultan el rendimiento académico, en muchas ocasiones coexisten y están aumentando su prevalencia.
Por otro lado, es importante señalar los riesgos asociados al uso indiscriminado de pantallas por parte de los padres. El mayor impacto es sobre la educación digital de los hijos, debido a que los niños adquieren hábitos saludables o no reproduciendo lo que hacen sus padres. Otro riesgo frecuente es como afecta a la identidad digital de los niños cuando los padres comparten información privada, fotos, acontecimientos importantes para ellos tanto con fines comerciales como no y su potencial repercusión en el presente y en el futuro.
El rol de los profesionales de la salud es fundamental en: la prevención, educación para la salud de las familias y los pacientes, así como en la detección precoz y tratamiento de los riesgos.
En la última década se han publicado múltiples artículos científicos sobre el impacto del mundo digital en la salud en la infancia y adolescencia.
Definición de ciberacoso y subtipos(7)
El ciberacoso se define como el maltrato ejercido a través de internet, el cual tiene dos subtipos que afectan a la infancia: el ciberacoso escolar (ciberbullying) y el ciberacoso sexual (grooming).
Ciberacoso escolar o ciberbullying
Tanto el acoso escolar tradicional como el ciberbullying son formas de violencia o maltrato que generalmente coexisten, contra las que todos los niños y adolescentes tienen derecho a ser protegidos.
El ciberbullying es el daño repetido, intencional y consecuente ejercido por un niño o grupo de niños, contra otro mediante el uso de medios digitales
El ciberbullying se define como: “El daño repetido (no basta con un hecho aislado), intencional y consecuente ejercido por un niño o grupo de niños contra otro mediante el uso de medios digitales”(8). Sin embargo, no existe actualmente una definición única del concepto de ciberbullying a nivel internacional. Por ejemplo, para las Naciones Unidas, es necesario sólo un acto de manifestación de violencia en línea para determinar el acoso a través de internet.
Grooming
Grooming es ciberacoso ejercido deliberadamente por un adulto (o dos niños donde pueda establecerse una relación de poder y un control emocional) sobre un niño, siendo el contenido del acoso sexual
Ciberacoso ejercido deliberadamente por un adulto (o dos niños donde pueda establecerse una relación de poder y un control emocional) sobre un niño, siendo el contenido del acoso sexual. En la mayoría de los casos, el fin último es obtener imágenes de pornografía infantil o cometer abuso sexual. Por tanto, para considerarse grooming debe existir contenido sexual y obtenerse mediante coacción.
Epidemiología del ciberacoso(9)
Una encuesta publicada en 2021 por UNICEF(9), hace un análisis interesante a través de cuestionarios validados del uso y los riesgos de la tecnología en la adolescencia en España. El estudio es de ámbito nacional a través de un cuestionario on line. Muestreo bietápico con “n” total de 41.509 adolescentes de ambos sexos que están cursando estudios de Enseñanza Secundaria Obligatoria (ESO) en centros públicos, privados o concertados. La edad de los participantes está comprendida entre los 11 y los 18 años.
De los encuestados, el 19,8% consideran ser víctima de acoso escolar una o varias veces a la semana en los últimos 2 meses, y en un 12,2% para el ciberacoso. Las cifras son algo mayores entre las chicas y en la primera etapa de la ESO.
Respecto a los agresores un 3,2% lo son de acoso escolar y 5,4% de ciberacoso. El agresor de acoso escolar es más frecuente entre los chicos de 3º y 4º de la ESO, en el caso del ciberacoso la diferencia entre sexos es menor.
El 72,9% de las/os adolescentes que sufren acoso online también lo sufren offline. En otras palabras, en la mayoría de los casos que se detecten conductas de ciberacoso, es muy probable que dichas conductas persistan también fuera de los dispositivos tecnológicos o las redes sociales.
Quienes dicen sufrir o haber sufrido acoso señalan que les ha afectado bastante o mucho fundamentalmente a su autoestima, las ganas de ir al instituto y a su estado de ánimo. Tanto en el caso de acoso escolar como del ciberacoso, la tasa de ideación suicida se multiplica por 4
Respecto a las consecuencias percibidas:
- Quienes dicen sufrir o haber sufrido acoso señalan que les ha afectado bastante o mucho fundamentalmente a su autoestima (51%), en las ganas de ir al instituto (43%) y a su estado de ánimo (38,8%).
- Los niveles de bienestar emocional, integración social y satisfacción con la vida son sensiblemente menores entre quienes sufren acoso escolar. Las tasas de depresión grave llegan a multiplicarse por 5, si se compara con los no implicados.
- Tanto en el caso de acoso escolar como del ciberacoso, la tasa de ideación suicida se multiplica por 4.
Respecto a las características del acoso:
- Lo habitual es que el acoso se ejerza en grupo (entre 2 y 5 adolescentes) y, comparativamente, más por chicos.
- En la inmensa mayoría de los casos, el acoso es ejercido cara a cara y por adolescentes de la misma clase (70,2%).
- En más de la mitad de los casos la situación de acoso se prolonga meses, o incluso más de un año. Aunque lo habitual es que cuando los adolescentes sufren acoso lo comuniquen durante el primer mes, al menos 1 de cada 4 (27,3%) tarda más de un año, o no llega a contarlo nunca. Los padres son el principal interlocutor al que los adolescentes acuden, seguido de los amigos.
Respecto a las motivaciones del acoso: El físico constituye, a juicio de los propios adolescentes, el principal foco o motivo de acoso, Otras motivaciones son: que le tenían manía o envidia y el hecho de ser diferente
Respecto a las motivaciones del acoso:
- El físico constituye, a juicio de los propios adolescentes, el principal foco o motivo de acoso, aunque casi 1 de cada 3 alude a que simplemente se trataba de una broma.
- Otras motivaciones como que le tenían manía 29,7% o envidia 28,7% y un 21,9% el hecho de ser diferente.
- Aunque muy pocos se refieren de manera explícita a la orientación sexual, esta pasa a ser el primer argumento en el caso de adolescentes homosexuales (58,8%).
Diferencias entre el acoso escolar presencial y el ciberbullying(7)
El medio que utiliza el ciberacoso, las TICs, hacen que este tipo de maltrato presente algunas diferencias con respecto al acoso tradicional:
- Mayor victimización, la víctima está sometida al maltrato sin limitación de tiempo ni espacio, todos los días de la semana, las 24 horas del día, en cualquier lugar. Esto provoca un mayor daño psíquico en la víctima.
- Falsa sensación de anonimato, provocando que personas que no se atreverían a maltratar cara a cara lo hagan a través de la red.
- Mayor audiencia: cualquier persona que pueda acceder a Internet puede ser observadora potencial del maltrato.
Clínica(7)
La clínica más frecuente son los síntomas físicos de origen psicosomático, tanto en víctimas y agresores como observadores: dolor abdominal, trastornos del sueño, cefalea, fatiga, enuresis secundaria, pérdida de apetito, pérdida de peso, tics, mareos y vértigo. Los síntomas psicológicos de mayor prevalencia son: ansiedad, depresión, baja autoestima e ideación suicida. Algunas alteraciones de conducta pueden ser muy indicativas: dejar de conectarse a internet o conectarse con mayor frecuencia de lo habitual, mostrarse frustrado, triste o enfadado después de usar el ordenador o el teléfono móvil o no querer hablar sobre el tema si se le interroga. Ver Tabla I y Tabla II.
Historia clínica y exploración física(7)
En el maltrato los niños no suelen contar en la primera consulta lo ocurrido; para su detección es necesario abordar la historia social independientemente del motivo de consulta en todas las citas, incluyendo las revisiones de los Programas de Salud, siendo especialmente importante en el adolescente. La historia social debe incluir: el entorno familiar, escolar, aficiones, consumo de sustancias, círculo social y las TICs (Ver Tabla III). Preguntas sobre las TICs en la historia clínica), evaluando prácticas de riesgo en su uso y un eventual uso problemático o adictivo de estas.
A la hora de redactar la historia clínica, al igual que ante cualquier caso de maltrato hay que recoger textualmente el relato del niño o adolescente, entre comillas. El juicio clínico debe ser “sospecha de grooming o ciberbullying” y abstenerse de especificar el nombre de los agresores.
En el caso del ciberbullying recoger los siguientes datos: 1) tiempo de evolución; 2) nombre del centro escolar y curso de los supuestos niños que agreden; 3) nombre de la red social, web o juego donde lo acosan; 4) preguntar acerca de los lugares donde se ha sufrido el acoso: patio, comedor, extraescolares, a la salida del colegio (pues existe la posibilidad de estar sufriendo además un posible acoso cara a cara); 5) sintomatología (ver apartado 6, Clínica); 6) Evaluar trastornos del ánimo y presencia de ideación autolítica o intento suicida, por el alto riesgo que existe en estos pacientes.
En el caso específico de grooming: 1) tiempo de evolución del acoso; 2) nombre de la red social, web o juego a través de la cual se hizo envío de las imágenes o vídeos; 3) alias usado por el agresor (pues suelen utilizar un nombre falso); 4) especificar si se ha quedado en persona o no con el agresor; 5) sintomatología, incluir estado de ánimo e ideación suicida.
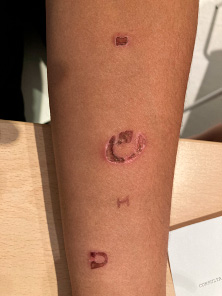
La exploración física debe ser completa por órganos y aparatos, buscando signos de maltrato tanto físico como sexual. En caso de encontrar algún tipo de lesión sugerente o sospechosa de maltrato se activará el protocolo de actuación según cada caso
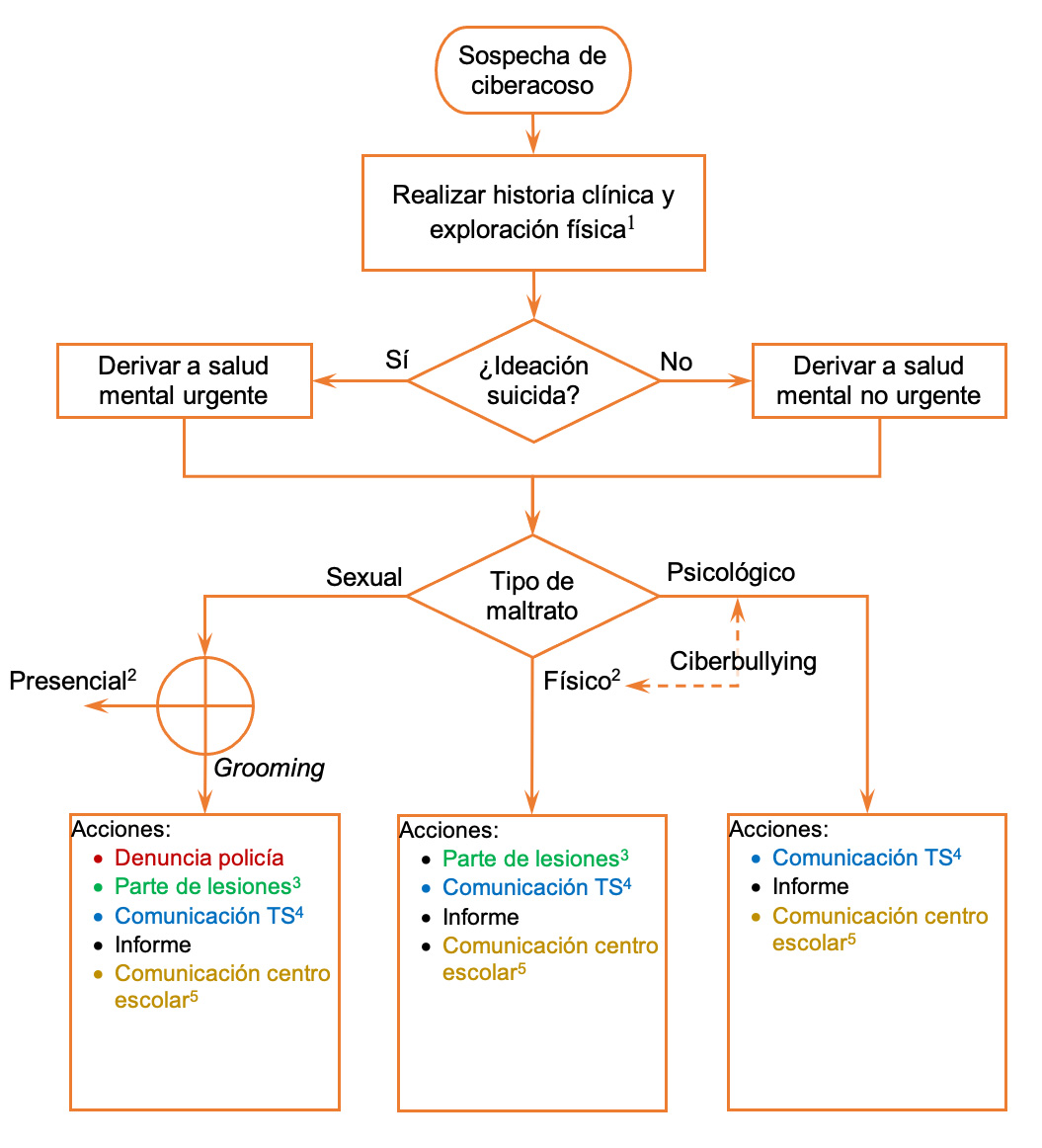
La exploración física debe ser completa por órganos y aparatos, buscando signos de maltrato tanto físico como sexual. En caso de encontrar algún tipo de lesión sugerente o sospechosa de maltrato se activará el protocolo de actuación según cada caso (ver Figura 1. Algoritmo de actuación).
Atención en consulta(7)
Es esencial, para un manejo adecuado de los pacientes, la detección precoz de los casos de ciberacoso, tanto a la víctima como al agresor. Los observadores deben ser evaluados y valorar si precisan atención.
La actuación debe ser coordinada con los distintos sectores involucrados, según cada caso (profesores, salud mental, fiscalía de menores, Fuerzas y Cuerpos de Seguridad del Estado, la familia y los niños), y se deben activar los mecanismos necesarios de protección a la víctima y detección y seguimiento del agresor (ver Figura 1. Algoritmo de actuación).
Además, es fundamental considerar que tanto víctima como agresor son niños y han de ser objetos de cuidado e intervención por los profesionales de salud y sectores involucrados en los casos de ciberacoso escolar.
Medidas ante un caso de ciberacoso(7)
Se debe realizar una historia clínica y exploración física completa no sólo orientada al ciberacoso, sino también para descartar otro tipo de maltrato, como abuso sexual o maltrato físico, que pueden estar presentes
Manejo del ciberacoso en consulta:
- Valorar a la víctima: Para lo cual será fundamental realizar una historia clínica y exploración física completa no sólo orientada al ciberacoso, sino también para descartar otro tipo de maltrato, como abuso sexual o maltrato físico, que pueden estar presentes (ver 5 Historia clínica y exploración física). Es imprescindible explorar la ideación autolítica para derivar a Salud Mental, en el caso de ideación activa la derivación debe ser urgente.
- Definir el tipo de acoso (sexual, físico o psicológico) y actuar según el tipo de maltrato (ver algoritmo de actuación).
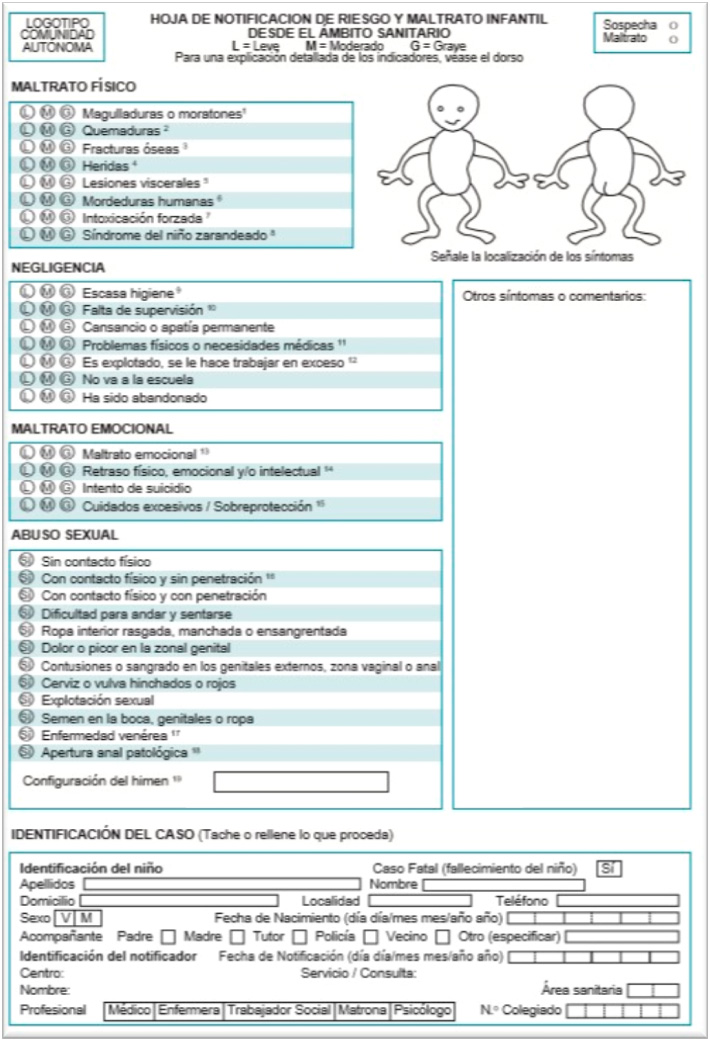
- Parte de lesiones, irá dirigido a fiscalía de menores si el agresor es menor de 18 años o al juzgado de guardia si el agresor es mayor de 18 años (Ver Figura 2 Parte de lesiones). Es necesario realizarlo en los siguientes casos:
- Grooming si se ha quedado con el agresor: actuar según protocolo abuso sexual.
- Grooming si no se ha quedado con agresor: es recomendable, aunque no haya lesiones, para describir el estado de la víctima por la alta sospecha de maltrato. Además, al ser un delito es necesario cumplimentar el parte de lesiones.
- Ciberacoso escolar con lesiones físicas o intento de suicidio.
En el caso del ciberacoso escolar sin lesiones: es necesario la investigación en el centro escolar para conocer exactamente lo que ocurrió. Si se considera la existencia de delito una vez investigado el caso, el centro escolar está obligado a ponerlo en conocimiento de fiscalía de menores
En el caso del ciberacoso escolar sin lesiones: no realizar parte de lesiones de entrada salvo en casos graves, es necesario la investigación en el centro escolar para conocer exactamente lo que ocurrió. Si se considera la existencia de delito una vez investigado el caso, el centro escolar está obligado a ponerlo en conocimiento de fiscalía de menores.
- Comunicación a Trabajo Social (Figura 3. Comunicación a Trabajo Social) hay que realizarlo ante cualquier sospecha de maltrato, tanto de ciberacoso escolar como de grooming o intento de suicidio.
- Denuncia inicial a la policía:
- En el caso de ciberbullying se aconseja inicialmente no denunciar ya que la investigación escolar es fundamental en el manejo inicial de los casos. Si el colegio no realiza la investigación hay que comunicarlo a trabajo social y aconsejar que la familia contacte con participación ciudadana de la policía nacional.
- En el caso de grooming hay que realizar denuncia inmediata dada la gravedad del delito.
- Contactar con el centro escolar (Figura 4. Hoja de comunicación con el centro escolar). En casos de acoso escolar presencial o de un ciberacoso escolar y en los casos de grooming cuyo agresor sea del centro escolar. Se recomienda realizar un comunicado al centro escolar con el diagnóstico específico de “sospecha de acoso escolar o ciberacoso”, dado que es imposible establecer un diagnóstico definitivo sin una adecuada evaluación de la situación por parte del centro escolar.
Seguimiento clínico(7)
Es necesario asegurarse de que se hayan puesto en marcha las medidas necesarias para detener el ciberacoso por parte del centro escolar y de todos los organismos que se requieran según el caso. Además, se debe acompañar a la víctima para que se sienta protegida, tome las medidas necesarias para realizar un uso seguro de las TICs y sepa cómo actuar en caso de sufrir un nuevo ciberacoso (prevención primaria). Se debe evaluar en cada control la sintomatología de ser víctima o agresor y derivación a salud mental si es necesario.
Prevención
La evidencia científica era tan abrumadora que en el año 2016 la Academia Americana de Pediatría(10) y, posteriormente, en el año 2017(11), la Sociedad Canadiense de Pediatría publicaron una revisión sobre los riesgos y recomendaciones que los pediatras debían conocer y transmitir a las familias en la consulta. Ambos artículos comparten mensajes comunes:
- Alertan de los riesgos desde edades tempranas, especialmente en los menores de dos años.
- Explican la importancia del juego tradicional para un adecuado neurodesarrollo y fomentar la interacción con otros niños y adultos.
- Desarrollan la necesidad de establecer límites digitales según edad en: tiempo de uso, tiempo de desconexión y lugares donde se utilizan los dispositivos.
- Refuerzan a los padres para ser el mejor ejemplo de sus hijos y los animan a realizar un “plan digital familiar”.
El “plan digital familiar” supone una revolución en la promoción de la salud digital, porque los padres en vez de ser agentes pasivos que establecen normas o no, se convierten en agentes activos y modelos que los hijos imitarán. Al entrar en el plan digital familiar se pueden seleccionar propuestas concretas o añadir aquellas que se estimen
El “plan digital familiar” supone una revolución en la promoción de la salud digital, porque los padres en vez de ser agentes pasivos que establecen normas o no, se convierten en agentes activos y modelos que los hijos imitarán. Las TIC son algo más en lo que educar y los padres tienen que implicarse y ser ejemplo.
La Academia Americana de Pediatría en su web dedicada a familias tiene una herramienta de ayuda para que los padres puedan crear su plan digital(12). Ha sido actualizado en 2022, con grandes cambios:
- Se puede agregar a un mismo plan a todos los miembros de la familia.
- Explicaciones razonadas de por qué las sugerencias que se hacen son importantes y algunos consejos de cómo llevarlas a cabo.
- Se pude compartir e imprimir. Aconsejan dejarlo en un lugar visible como el frigorífico.
- Se puede revisar y cambiar en cualquier momento al quedar almacenado el plan.
- Permite instalar el plan digital familiar en cualquier dispositivo como si fuese una aplicación.
Al entrar en el plan digital familiar se pueden seleccionar propuestas concretas o añadir aquellas que se estimen. Se agrupan en 13 puntos fundamentales: 1) inicio; que nos permite realizar un plan por primera vez, modificar uno existente o acceder a más información si necesitamos ayuda para comenzar; 2) tutorial; 3) mi familia: seleccionando la edad de cada miembro que vamos a incluir en el plan; 4) prioridades; 5) equilibrio entre el mundo on line y off line; 6) comunicación sobre las pantallas y dispositivos; 7) zonas libres de pantallas; 8) momentos libres de tecnología; 9) amabilidad y empatía; 10) privacidad y seguridad digital; 11) elección de contenido; 12) uso compartido de pantallas; 13) revisión e impresión(13).
Otro aspecto importante son los factores protectores. En los últimos años se publicaron varios artículos científicos para intentar identificar si existen factores de riesgos o protectores en el mal uso de las TIC. Aunque aún la evidencia es limitada, hay factores que están relacionados: el tipo de personalidad, los estilos educativos de los padres, el sentirse integrado en el grupo de iguales, la autoestima, las aficiones, entre otros(13).
Tablas y figuras
Tabla I. Sintomatología de ciberacoso en la víctima
|
CLÍNICA A CORTO Y MEDIO PLAZO |
CLÍNICA A LARGO PLAZO |
||
|
SÍNTOMAS FÍSICOS |
SÍNTOMAS PSICOLÓGICOS |
COMPORTAMENTALES |
SÍNTOMAS PSICOLÓGICOS |
|
Cefalea |
Cambios bruscos de comportamiento |
En el uso de internet |
Cambios permanentes en la personalidad en 3 patrones diferentes:
|
|
Dolor abdominal |
Ansiedad |
Ausencias escolares |
Hiperalerta y desconfianza |
|
Mareos |
Depresión |
Bajo rendimiento |
Trastorno por estrés post-traumático |
|
Hipotonía |
Baja autoestima |
Cambio/ausencia de amistades |
Dificultad en relaciones sociales |
|
Imposibilidad de caminar |
Indiferencia |
Falta defensa ante bromas |
Dificultades laborales |
|
Insomnio |
Respuestas agresivas |
Miedo a salir de casa |
Predisposición a desarrollar cualquier enfermedad mental |
|
Reservas en la comunicación |
Aumento de dependencia de los adultos |
||
|
Ideas autolíticas |
Elección de espacios escolares |
||
|
Suicidio |
Lesiones físicas inexplicables |
||
Tabla II. Sintomatología de ciberacoso en el agresor
|
CLÍNICA DEL AGRESOR |
|
Tabla III. Preguntas sobre las TIC en la historia clínica
|
Tiempo diario |
Dedicado a pantallas: ordenador, tableta, smartphone, televisión… |
|
Lugar de conexión |
Casa, centro escolar, otros. Solo o acompañado |
|
Momentos de conexión |
Cuando come, está en la cama, al hacer los deberes, en los tiempos de ocio… |
|
Tipos de aplicaciones |
Redes sociales, entretenimiento, email… |
|
Finalidad |
Comunicarse, compartir información, entretenerse, evadirse, liberarse… |
|
Contenidos a los que accede |
Información inadecuada para la edad, comunidades peligrosas… |
|
Contenidos que publica |
Privados o abiertos y tipo de contenido |
|
Redes sociales |
Perfil abierto o privado, número de seguidores, si son conocidos o no y si son o no de su misma edad o cercana |
Figura 1. Algoritmo de actuación
1Ver punto 5. 2Seguir protocolo abuso sexual. Ejemplo en Comunidad de Madrid http://www.madrid.org/dat_oeste/descargas/13_14/Protocolo_Abuso_y_Maltrato_Infantil_Mostoles_2013.pdf. 3Seguir modelo según centro sanitario. Ver modelo tipo en Anexo 1. 4 Ver hoja de Comunicación a Trabajo Social en Anexo 2. 5Ver hoja tipo en Anexo 3. En el caso de Grooming solo realizar si el agresor es compañero del centro escolar. En el caso de ciberbullying realizar en todos los casos.
Figura 2. Parte de lesiones
Figura 3. Comunicación a trabajo social
Figura 4. Hoja de comunicación a centro escolar
Bibliografía
- Salmerón Ruiz M.A. Salud digital en tiempos de coronavirus ¿qué cambió? Adolescere 2020;7(3):6-10.
- Official Records of the World Health Organization, Nº 2, p. 100. 1946. [Fecha de acceso 8 sep 2022]. Disponible en: https://www.who.int/es/about/who-we-are/frequently-asked-questions.
- Gavidia V, Talavera M. La construcción del concepto de salud. Didáctica de las ciencias experimentales y sociales. 2012; 26. 161-175.
- American Academy of Pediatrics. Media and Young Minds. Pediatrics. 2016;138(5). [Fecha de acceso 8 sep 2022]. Disponible en https://pediatrics.aappublications.org/content/138/5/e20162591.
- Canadian Paediatric Society, Digital Health Task Force. Screen time and young children: Promoting health and development in a digital world. Paediatr Child Health. 2017 Nov; 22(8): 461–468. [Fecha de acceso 8 sep 2022]. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5823000/.
- Canadian Paediatric Society, Digital Health Task Force. Digital media: Promoting healthy screen use in school-aged children and adolescents. Paediatr Child Health. 2019;24(6):402-417 [Fecha de acceso 8 sep 2022]. Disponible en https://pubmed.ncbi.nlm.nih.gov/31528113/.
- Salmerón Ruiz M.A. Ciberpatologías: ciberacoso y adicción a nuevas tecnologías. En M.I Hidalgo Vicario et al, compilador. Medicina de las adolescencia atención integral. 3º edición. Madrid: Ergon; 2021. P 1107-1116.
- Grupo de trabajo de la Guía Clínica de ciberacoso para profesionales de la salud. Guía clínica de ciberacoso para profesionales de la salud. Plan de confianza del ámbito digital del Ministerio de Industria, Energía y Turismo. Hospital Universitario La Paz, Sociedad Española de Medicina del Adolescente, Red.es. Madrid. 2015. [Fecha de acceso 8 sep 2022]. Disponible en: https://www.adolescenciasema.org//wp-content/uploads/2015/07/Gu%C3%ADa-de-ciberacoso-para-profesionales-de-la-salud-1.pdf.
- Andrade B, Guadix I, Rial A y Suárez F. UNICEF España. Impacto de la tecnología en la adolescencia. Relaciones, riesgos y oportunidades. 2021: [Fecha de acceso 8 sep 2022]. Disponible en: https://www.unicef.es/publicacion/impacto-de-la-tecnologia-en-la-adolescencia.
- Council on Communications and Media. American Academy of Pediatrics. Media and young minds. Pediatrics. 2016;138:e20162591.
- Canadian Paediatric Society, Digital Health Task Force. Screen time and young children: Promoting health and development in a digital world. Paediatr Child Health. 2017;22:461-8.
- American Academy of Pediatrics. Plan para el consumo mediático de su familia. [Fecha de acceso 5 sep 2022]. Disponible en: www.healthychildren.org/Spanish/media/Paginas/default.aspx.
- Fischer-Grote l, Kothgassner OD, Felnhofer A. Riskfactors for problematic smartphone use in children and adolescents: a review of existing Literature. Neuropsychiatr. 2019;33:179-90.