Talla baja. Pequeño para la edad gestacional: hipocrecimiento y alteraciones metabólicas
Talla baja. Pequeño para la edad gestacional: hipocrecimiento y alteraciones metabólicas
M.T. Muñoz Calvo.
Servicio de Endocrinología. Hospital Infantil Universitario Niño Jesús. Departamento de Pediatría. Universidad Autónoma. Madrid.
Adolescere 2015; III (2): 36-45
Resumen
|
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético. El patrón de crecimiento de los Recién Nacidos Pequeños para la Edad gestacional (RNPEG) suele ser bastante característico. El 80-90% experimentan un crecimiento de recuperación, parcial o total, durante el primer o segundo año de vida y alcanzan una talla dentro de la normalidad (entre ± 2 SDS). Desde el punto de vista etiopatogénico, una tercera parte de los RNPEG se deberían a factores fetales (cromosomopatías, anomalías congénitas y síndromes dismórficos) y las otras dos terceras partes a factores maternos (malnutrición, infecciones, tóxicos…) y uterino-placentarios (malformaciones uterinas, arteria umbilical única…); no obstante, hasta en un 40 % de los casos no se identifica ninguna causa patológica. Los RNPEG, en particular si se ha seguido de un rápido incremento del peso en los primeros meses de vida, se asocia a un mayor riesgo de resistencia a la insulina, diabetes mellitus tipo 2, hipertensión arterial y aterosclerosis en la vida adulta. Es posible que estas alteraciones metabólicas adaptativas sean las responsables de una especie de “impronta metabólica” que condicionaría en la edad adulta la mayor frecuencia observada de desarrollo del SM, con el consiguiente incremento de enfermedades cardiovasculares. Palabras clave: Hipocrecimiento; Resistencia a la insulina; Diabetes; Dislipemia; Obesidad. |
Abstract
|
Antenatal growth failure is usually the result of an assault to the fetal environment or a genetic defect. The growth pattern of these small for gestational age newborns (SGA) is quite characteristic. 80-90% of them experience catch-up growth, either partial or total, during the first or second year of life reaching a height within the normal range (± 2 SDS). From the etiopathogenesis point of view, a third of SGA newborns are caused by fetal factors (chromosomal abnormalities, congenital anomalies and dysmorphic syndromes) and two thirds to maternal factors (malnutrition, infection, toxics…) and uterine-placental factors (uterine malformations, single umbilical artery…); however, in up to 40% of the cases no pathological cause is identified. SGA newborns, especially those that experience a rapid weight gain in the first months of life, associate an increased risk of insulin resistance, type 2 diabetes mellitus, hypertension and atherosclerosis in adulthood. It is possible that these adaptive metabolic processes are responsible for a “metabolic imprinting” that would condition the frequently observed development of adult metabolic syndrome, with its subsequent increase of cardiovascular disease. Key words: Growth failure; Insulin resistance; Diabetes; Dyslipidemia; Obesity. |
Caso clínico
Motivo de consulta: adolescente de 15 años y 4 meses, de raza caucásica, que consulta por incremento de peso desde hace tres años.
Antecedentes familiares: Padre sobrepeso y diabetes tipo 2 (en tratamiento con dieta e hipoglucemiantes orales), talla 175 cm, desarrollo puberal normal. Madre talla 160 cm, menarquia a los 12 años. G-A-V: 3-0-3. Talla genética: 161±5 cm.
Antecedentes Personales: embarazo controlado, RCIU desde la semana 30. Parto vaginal, inducido a la semana 36,. PRN 1700 g (-2,2 DE), LRN: 41 cm (-2,7 DE). PC: 31,5 cm (-1,9 DE). Periodo neonatal sin incidencias. Pruebas metabólicas normales. Sin hipoglucemias ni ictericia. Desarrollo psicomotor normal. Inmunizaciones correctas. A la edad de 4 años inicia tratamiento con GH recombinante por no haber realizado el crecimiento de recuperación a los 4 años de edad, presentando un incremento del ritmo de crecimiento y un estirón puberal de aproximadamente 21 cm. No presentó en ningún momento efectos secundarios por la medicación. Talla adulta normal para la talla familiar. Menarquia 12 años y 6 meses. Ciclos menstruales regulares.
Exploración física: Edad: 15 años y 4 meses. Peso 78,500 kg (+ 3,4 DE), Talla 161 cm (P50-75), IMC: 29,4 (+3,1 DE). Perímetro de cintura: 95 cm (P>97). T.A.: 100/60 mmHg. Buen estado general. Coloración normal de piel y mucosas. Obesidad central. Estrías de distensión en abdomen y cara interna de muslos. Hirsutismo (escala de Ferriman 8). Acantosis en cuello. Cuello: no se palpa bocio. ACP: normal. Abdomen: blando, depresible, sin visceromegalias. Genitales femeninos normales. Tanner V (T5, P5,Ac). Resto de la exploración normal.
Estudios complementarios:
Hemograma: fórmula y recuentos normales. Bioquímica general: normal.
Lipidograma: CT 280 mg/dl (vn: 120-200), Triglicéridos: 220 mg/dl (vn: < 100), C-HDL: 35 mg/dl (vn: 35-75), C-LDL: 210 mg/dl, C-VLDL: 34 mg/dl.
Función tiroidea: TSH 4,5 mUI/ml (vn:0,5-6), T4 libre: 0,99 ng/dl (vn: 0,65-1,4).
Glucemia: 110 mg/dl (vn: 70-100).
Sobrecarga oral de glucosa: Glucemia basal: 110 mg/dl, a los 120 minutos: 188 mg/dl. Insulina basal: 38 µUI/ml, pico: 290 µUI/ml, a los 120 minutos: 180 µUI/ml HbA1c: 6,9%.
Cortisol libre en orina de 24 horas: 35 µg/24 h (vn: 30-243).
Ecografía hepática: signos de marcada esteatosis hepática.
Discusión
Hipocrecimiento
La talla y el ritmo madurativo de un sujeto concreto están determinados por una multitud de mecanismos genéticos y epigenéticos que interaccionan a lo largo de todo el proceso de crecimiento con factores ambientales intrínsecos y extrínsecos
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético.
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético. Se suele considerar a un recién nacido como RNPEG cuando su peso y/o su longitud al nacimiento se encuentran, al menos, 2 SDS por debajo de la media para su edad gestacional (≤ -2 SDS). En los países desarrollados, sólo el 4-7 % de los recién nacidos son RNPEG; sin embargo, es una de las causas más importantes de talla baja, ya que, el antecedente de RNPEG se encuentra en el 20% de los adultos con talla baja.
Desde el punto de vista etiopatogénico, una tercera parte de los RNPEG se deberían a factores fetales (cromosomopatías, anomalías congénitas y síndromes dismórficos) y las otras dos terceras partes a factores maternos (malnutrición, infecciones, tóxicos…) y uterino-placentarios (malformaciones uterinas, arteria umbilical única…); no obstante, hasta en un 40 % de los casos no se identifica ninguna causa patológica.
Se suele considerar a un recién nacido como RNPEG cuando su peso y/o su longitud al nacimiento se encuentran, al menos, 2 SDS por debajo de la media para su edad gestacional (≤ -2 SDS).
El patrón de crecimiento de los RNPEG suele ser bastante característico. El 80-90% experimentan un crecimiento de recuperación, parcial o total, durante el primer o segundo año de vida y alcanzan una talla dentro de la normalidad (entre ± 2 SDS). El 10-20 % restante mantienen la talla baja después de los 2 años y en, al menos, un 50 % de estos, la talla final será baja. La edad ósea suele estar retrasada, pese a lo cual la pubertad se inicia habitualmente a una edad normal o incluso ligeramente adelantada, corrigiéndose rápidamente el retraso en la maduración ósea y alcanzando una talla final baja, que, en la mayoría de los casos, es similar en SDS a la talla prepuberal. Cuando el RN presenta una disminución combinada del PRN y de la LRN (RNPEG armónico) el riesgo de alcanzar una talla adulta baja es mayor que cuando sólo se afecta el PRN (RNPEG disarmónico).
Cuando el RN presenta una disminución combinada del PRN y de la LRN (RNPEG armónico) el riesgo de alcanzar una talla adulta baja es mayor que cuando sólo se afecta el PRN (RNPEG disarmónico).
Alteraciones metabólicas
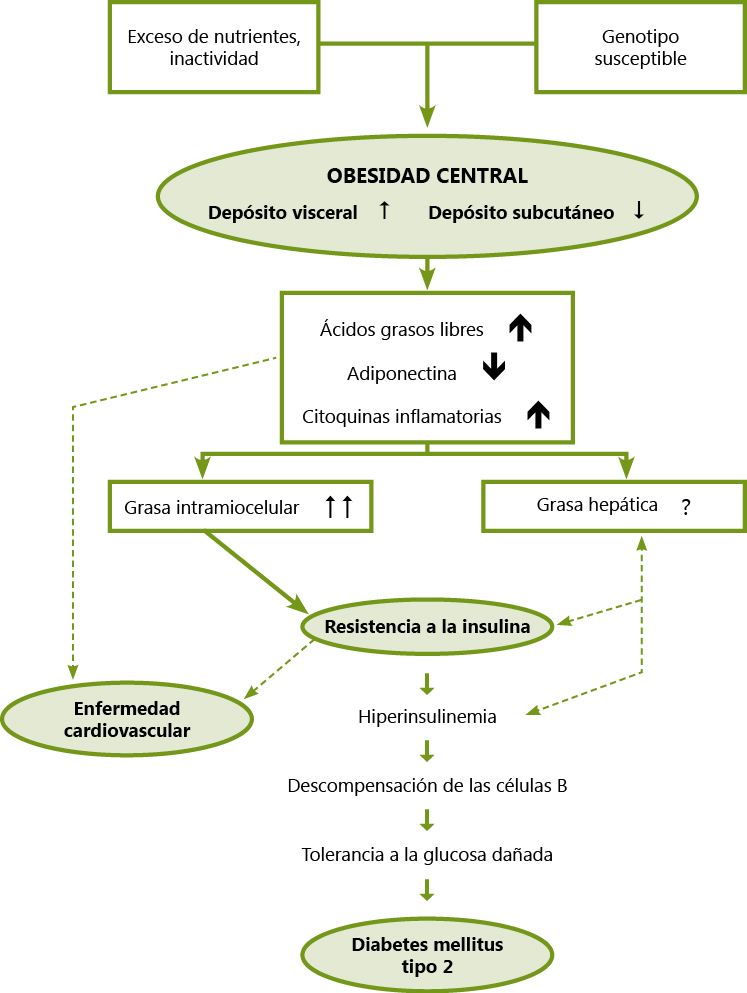
Los RNPEG, en particular si se ha seguido de un rápido incremento del peso en los primeros meses de vida, se asocia a un mayor riesgo de resistencia a la insulina, diabetes mellitus tipo 2, hipertensión arterial y aterosclerosis en la vida adulta. La reducción del aporte de oxígeno y nutrientes determina una respuesta adaptativa en el feto, que tiende a preservar la diferenciación y maduración de los órganos a expensas de un menor crecimiento y una menor acumulación de energía (glucógeno y grasa). Es posible que estas alteraciones metabólicas adaptativas sean las responsables de una especie de “impronta metabólica” que condicionaría en la edad adulta la mayor frecuencia observada de desarrollo del SM, con el consiguiente incremento de enfermedades cardiovasculares (figura 1).
Los criterios establecidos por la Internacional Diabetes Federation para definir el SM, especifican puntos de corte para el perímetro de la cintura propios de la población europea (y otras poblaciones). La nueva definición ha sido dividida en los siguientes grupos de edades: de 6 a 10, de 10 a 16 y ≥16 años. En la tabla 1 se exponen estos criterios diagnósticos.
Resistencia a la insulina
Uno de los principales factores implicados en el SM es la resistencia a la insulina (RI). Los valores de los índices de RI cambian a lo largo de la infancia, sobre todo en los diferentes estadios de la pubertad, ya que ésta contribuye a la insulinorresistencia. La cuantificación de la RI se puede realizar por métodos basados en la medida de los niveles de glucemia e insulina en ayunas o tras sobrecarga oral de glucosa. Es aconsejable incluir la determinación de insulinemia basal en la evaluación de los niños y adolescentes obesos, lo que a su vez permitirá el cálculo del índice HOMA (glucosa [mmol/l] x insulina [μU/ml] / 22,5), indicador de resistencia a insulina.
Es aconsejable incluir la determinación de insulinemia basal en la evaluación de los niños y adolescentes obesos, lo que a su vez permitirá el cálculo del índice HOMA (glucosa [mmol/l] x insulina [μU/ml] / 22,5), indicador de resistencia a insulina.
Diabetes mellitus tipo 2 (DM2)
Se define por: obesidad, resistencia y déficit insulínico y ausencia de autoinmunidad pancreática. Existen factores de riesgo para su desarrollo que incluyen la historia familiar de DM2, obesidad, inactividad física, rápido incremento de peso en el periodo neonatal, diabetes gestacional u obesidad materna, etnicidad, y situaciones que predisponen a la RI (pubertad y síndrome de ovario poliquístico).
El aumento de la incidencia de DM2 se ha producido de forma paralela al aumento de la frecuencia de obesidad infantil, que puede considerarse el factor de riesgo principal para su desarrollo.
Obesidad
Una vez establecida la presencia de obesidad, la mayoría de los casos son de base poligénica y secundarios a la existencia de un desequilibrio entre el ingreso y el consumo energético, pero existen otros casos secundarios a mutaciones monogénicas (principalmente del receptor de melanocortina número 4 [MC4R]), o enfermedades endocrinológicas.
El aumento de la incidencia de DM2 se ha producido de forma paralela al aumento de la frecuencia de obesidad infantil, que puede considerarse el factor de riesgo principal para su desarrollo.
En nuestro medio, la Guía de Práctica Clínica para la Prevención y Tratamiento de la Obesidad Infanto-juvenil postula como criterios para definir el sobrepeso y la obesidad los valores de los percentiles 90 y 97, respectivamente, específicos por edad y sexo de la distribución del IMC referido a los datos y curvas de Hernández y colaboradores del año 1988.
Dislipemia
La hipertrigliceridemia es la alteración más precoz en el SM, se debe al aumento de la síntesis hepática de partículas de lipoproteínas de muy baja densidad (C-VLDL) y a la alteración de su catabolismo por disminución de la actividad de la lipoproteínlipasa. Como consecuencia de estas alteraciones, se produce un aumento de las lipoproteínas ricas en triglicéridos y, por ello, de los triglicéridos plasmáticos.
Estado proinflamatorio y protrombótico
Los marcadores biológicos de la inflamación son predictores de enfermedad cardiovascular, siendo la elevación de los niveles séricos de la proteína C reactiva (PCR), la interleuquina 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α) los que presentan una mayor correlación con las alteraciones que constituyen el síndrome metabólico (Figura 1). Los niveles circulantes de adiponectina se correlacionan de forma negativa con el índice de masa corporal y con el contenido de masa grasa, en asociación con la grasa visceral.
Disfunción endotelial
Más recientemente, los métodos incruentos por la imagen han permitido el estudio del desarrollo de la aterosclerosis. Por un lado, la medición del grosor del complejo íntima-media en localizaciones estandarizadas de las arterias carótidas, como indicador de afectación vascular arteriosclerótica. Este grosor aumenta a medida que aumentan los factores de riesgo cardiovascular, y algunos autores han observado que el incremento de los niveles de LDL-C puede predecir el grosor del complejo íntima-media en jóvenes adultos. Por otro, la dilatación mediada por flujo, que permite establecer las propiedades funcionales de las arterias, incluyendo las propiedades mecánicas como la rigidez y la distensibilidad y las propiedades adaptativas como la vasodilatación en respuesta a un estímulo. Un estudio realizado en niños obesos en la arteria braquial, demostró una disminución de la distensibilidad arterial, aumento de las estrías grasas en la pared arterial, disfunción endotelial y aumento de la resistencia a la insulina cuando se compararon con niños normopeso.
Síndrome de ovario poliquístico (SOP)
Se asocia con hiperinsulinemia y resistencia a la insulina, y se acompaña con frecuencia de dislipemia, alteraciones de los marcadores de la inflamación, y aumento de la adiposidad central, siendo éstos factores de riesgo para el desarrollo de DM2 y enfermedad cardiovascular.
Esteatosis hepática
La prevalencia en niños obesos varía de un 13% a un 38%. Varios mecanismos fisiopatológicos parecen estar implicados en su patogénesis. Por un lado, la hiperinsulinemia asociada con la resistencia a la insulina, secundaria fundamentalmente adiposidad central. Por otro, el estrés oxidativo, debido a la acumulación excesiva de grasa a nivel hepático, especialmente de triglicéridos, que produce la liberación de adipocitocinas proinflamatorias que, a nivel del hepatocito causan apoptosis y necrosis por activación de la cascada inflamatoria, fundamentalmente del factor de necrosis tumoral alfa.
La GH produce un aceleramiento pronunciado del crecimiento, máximo durante el primer año de tratamiento, siendo esta respuesta el mejor predictor de crecimiento posterior. La respuesta a la GH es dosis dependiente durante los 3-4 primeros años, haciéndose menos dosis dependiente a largo plazo.
Tratamiento
Hormona de crecimiento (GH)
La GH produce un aceleramiento pronunciado del crecimiento, máximo durante el primer año de tratamiento, siendo esta respuesta el mejor predictor de crecimiento posterior. La respuesta a la GH es dosis dependiente durante los 3-4 primeros años, haciéndose menos dosis dependiente a largo plazo. El tratamiento debe mantenerse hasta que se alcance la talla final, definida como velocidad de crecimiento menor de 2 cm/año o edad ósea >14 años en las niñas y >16 años en niños, correspondiendo al cierre de las placas de crecimiento epifisarias. Los principales determinantes de respuesta a largo plazo son la edad de inicio del tratamiento (cuanto más joven mejor), la talla media de ambos padres (cuanto más alta mejor) y la talla DE al inicio del tratamiento (cuanto talla más baja mejor). Con el tratamiento con GH, el 85% de los PEG alcanzarán una talla adulta normal superior a 2 DE y un 98% alcanzarán una talla dentro de su rango de talla genética.
Con el tratamiento con GH, el 85% de los PEG alcanzarán una talla adulta normal superior a 2 DE y un 98% alcanzarán una talla dentro de su rango de talla genética.
Obesidad
Nutricional: La ingesta calórica debe ser adecuada con la suficiente actividad física, para conseguir un peso adecuado. Se deben consumir más frutas, verduras, pescados, cereales integrales y productos lácteos desnatados. Se recomienda la disminución de zumos de frutas, bebidas y alimentos edulcorados con azúcar y sal. Además, recomiendan una ingesta de ácidos grasos trans (alimentos procesados y preparados) de <1% de las calorías totales.
El ejercicio físico regular puede mejorar la sensibilidad a la insulina en un 40% y disminuir la lipogénesis. Además, mejora los niveles de C-HDL y la función endotelial.
Asimismo, los alimentos con bajo índice glucémico ayudarán a controlar la sensibilidad a la insulina y las alteraciones lipídicas, así como asegurar un aporte extra de fibra que producen mayor sensación de saciedad y que disminuye la ingesta energética.
Ejercicio físico: El ejercicio físico regular puede mejorar la sensibilidad a la insulina en un 40% y disminuir la lipogénesis. Además, mejora los niveles de C-HDL y la función endotelial.
Tratamiento conductual. Tanto el paciente como la familia deben tomar conciencia de las conductas que han conducido al exceso de peso, y deben ser capaces de introducir cambios en la alimentación y en los estilos de vida a medio y largo plazo. Se aconseja diseñar un plan de vida diario para toda la familia.
Tratamiento farmacológico. El Comité de Expertos para la Prevención y Tratamiento de la Obesidad Infantil de la Academia Americana de Pediatría plantea su uso en la adolescencia, cuando no se hayan alcanzado los objetivos de pérdida de peso con los cambios en los estilos de vida y presenten comorbilidad severa.
Disponemos de algunos fármacos, siendo aún su indicación limitada en la adolescencia. Actualmente, sólo está comercializado un fármaco con indicación aprobada para el tratamiento de la obesidad: el Orlistat en mayores de 12 años en EE.UU (agencia FDA). LA EMA, no recomienda su uso en niños o adolescentes menores de 18 años debido a la escasez de datos sobre seguridad y eficacia.
Actualmente hay numerosos ensayos clínicos dirigidos a establecer la eficacia y la seguridad de diferentes sustancias, fármacos y hormonas que participan de manera directa o indirecta en la regulación del peso corporal.
Diabetes tipo
Los pacientes sintomáticos en el momento del diagnóstico, especialmente si tienen cetosis, deben recibir tratamiento con insulina. Una vez controlada la hiperglucemia puede sustituirse progresivamente por Metformina, que es una biguanida cuya acción consiste en la disminución hepática de glucosa, incremento de la sensibilidad a la insulina, y mayor captación periférica de glucosa mediada por la insulina. Además del control glucémico, tiene el beneficio de producir una ligera pérdida de peso o al menos estabilizarlo. Aprobado a partir de los 10 años por la FDA y la Agencia Europea del Medicamento.
En los pacientes asintomáticos, cuando no son suficientes los controles glucémicos, debe iniciarse tratamiento con Metformina. Los niños y adolescentes que presenten una hiperglucemia moderada (glucemia en ayunas entre 126 y 199 mg/dl y una HBA1c <8,5%), se puede iniciar tratamiento con metformina, comenzando con dosis bajas (500 mg dos veces al día) e ir incrementando progresivamente según tolerancia (máximo 2000 mg/día) para alcanzar los objetivos glucémicos. En los casos que la metformina no consiga un control metabólico adecuado, en aquellos pacientes con hiperglucemia ≥ 200 mg/dl, HbA1c >8,5% o manifestaciones de deficiencia insulínica (cetosis o ceotoacidosis), debe iniciarse tratamiento con insulina.
La Metformina es una biguanida cuya acción consiste en la disminución hepática de glucosa, incremento de la sensibilidad a la insulina, y mayor captación periférica de glucosa mediada por la insulina. Además del control glucémico, tiene el beneficio de producir una ligera pérdida de peso o al menos estabilizarlo.
Dislipemias
Hipercolesterolemias: se recomienda el inicio del tratamiento a partir de los 10 años de edad o en varones al inicio de la pubertad (Tanner II) y en mujeres tras la primera menstruación, después de un tratamiento dietético adecuado de seis meses a un año, siempre que los niveles de C-LDL sean superiores a 190 mg/dl o a 160 mg/dl y existan antecedentes familiares de enfermedad cardiovascular o el niño tenga dos o más factores de riesgo asociados. Las estatinas deben ser incluidas entre los potenciales fármacos de primera línea por la experiencia adquirida en los últimos años y por su capacidad de disminuir los niveles de C-LDL en torno a 18-45%. Están contraindicadas en el embarazo, por lo que debe advertirse a las adolescentes y enviarlas, en caso necesario, a consejo ginecológico.
Hipercolesterole-mias: se recomienda el inicio del tratamiento a partir de los 10 años de edad o en varones al inicio de la pubertad (Tanner II) y en mujeres tras la primera menstruación, después de un tratamiento dietético adecuado de seis meses a un año, siempre que los niveles de C-LDL sean superiores a 190 mg/dl o a 160 mg/dl y existan antecedentes familiares de enfermedad cardiovascular o el niño tenga dos o más factores de riesgo asociados.
Hipertrigliceridemia: si los niveles de TG oscilan entre 200 y 499 mg/dl, se debe realizar tratamiento dietético, cambio de estilo de vida, aumento de ingesta de pescado, y valorar tratamiento con suplementos de aceite de pescado. En niños con hipertrigliceridemia primaria (TG ≥ 500mg/dl) y tras 6-12 meses de tratamiento dietético y cambio de estilo de vida, valorar tratamiento con fibratos.
Hipertensión arterial
En la fase de pre-hipertensión la recomendación es realizar cambios en los estilos de vida, principalmente si existe historia familiar de hipertensión arterial o enfermedad cardiovascular prematura, con pérdida de 1-2 kg de peso/mes. Si existieran niveles de tensión arterial superior al percentil 95, deberá iniciarse tratamiento farmacológico, siendo la primera opción terapéutica los inhibidores de la enzima convertidora de la angiotensina (IECA) o los bloqueantes de la angiotensina II (BsAT-II), siendo el objetivo reducir la morbi-mortalidad cardiovascular a largo plazo.
Tablas y figuras
Tabla 1. Síndrome metabólico: Criterios IDF (Zimmet P et al. (4)
|
6 – <10 años |
10-16 años |
>16 años |
|
|
P.C. |
≥P90 |
≥P90 |
≥90cm en varones ≥80cm en mujeres |
|
T.A. |
SD para SM |
TAS ≥130 mmHg TAD ≥85 mmHg |
TAS ≥130 mmHg TAD ≥85 mmHg |
|
Triglicéridos |
SD para SM |
≥150 mg/dl |
≥150 mg/dl |
|
C-HDL |
SD para SM |
≤40 mg/dl |
≤40 mg/dl |
|
Glucemia ayunas |
SD para SM |
≥100 mg/dl |
≥100 mg/dl |
SD: Sin definición,
PC= perímetro de cintura,
TA= tensión arterial,
C-HDL= lipoproteínas de alta densidad.
Figura 1. Mecanismos de influencia de la obesidad sobre la enfermedad cardiovascular y la diabetes tipo 2
Bibliografía
1. Ota E, Ganchimeg T, Morisaki N, Vogel JP, Pileggi C, Ortiz-Panozo E, Souza JP, Mori R; WHO Multi-Country Survey on Maternal and Newborn Health Research Network. Risk factors and adverse perinatal outcomes among term and preterm infants born small-for-gestational-age: secondary analyses of the WHO Multi-Country Survey on Maternal and Newborn Health. PLoS One. 2014 Aug 13;9(8):e105155.
2. Argente J, Mehls O, Barrios V. Growth and body composition in very young SGA children. Pediatr Nephrol. 2010; 25(4):679-85.
3. Saggese G, Fanos M, Simi F. SGA children: auxological and metabolic outcomes – the role of GH treatment. J Matern Fetal Neonatal Med. 2013; 26 Suppl 2:64-7.
4. Güemes Hidalgo M1, Fernández de Larrea Baz N, Muñoz Calvo MT, Argente J. Response to 3 years of growth hormone therapy in small for gestational age children: clinical, hormonal and metabolic parameters. An Pediatr (Barc). 2013;78:288-96.
5. Ojha S, Saroha V, Symonds ME, Budge H. Excess nutrient supply in early life and its later metabolic consequences. Clin Exp Pharmacol Physiol. 2013;40(11):817-23.
6. Zimmet P, Alberti KG, Kaufman F, Tajima N, Silink M, Arslanian S et al. The metabolic syndrome in children and adolescents – an IDF consensus report. Ped Diabetes. 2007; 8: 299-306.
7. Reinehr T. Type 2 diabetes mellitus in children and adolescents. World J Diabetes. 2013; 4: 270-281.
8. D’Adamo E, Santoro N, Caprio S. Metabolic syndrome in pediatrics: old concepts revised, new concepts discussed. Curr Probl Pediatr Adolesc Health Care. 2013; 43: 114-23.
9. Levy-Marchal C, Arslanian S, Cutfield W, Sinaiko A, Druet C, Marcovecchio ML, Chiarelli F; ESPE-LWPES-ISPAD-APPES-APEG-SLEP-JSPE Insulin Resistance in Children Consensus Conference Group. Insulin resistance in children: consensus, perspective, and future directions. J Clin Endocrinol Metab. 2010; 95: 5189-98.
10. Moreno LA. Obesity in children and adolescents. A critical review. Endocrinol Nutr. 2013; 60 Suppl 1: 7-9.
11. Grupo de trabajo de la guía sobre la prevención y el tratamiento de la obesidad infantojuvenil. Centro Cochrane Iberoamericano, coordinador. Guía de práctica clínica sobre la prevención y el tratamiento de la obesidad infantojuvenil. Madrid: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social.Agència d´Avaluació de Tecnologia i Recerca Mèdiques; 2009. Guía de práctica clínica: AATRM N.º 2007/25.
12. Kim Y, Park H. Does Regular Exercise without Weight Loss Reduce Insulin Resistance in Children and Adolescents? Int J Endocrinol. 2013; 2013: 402-592.
13. Yu CC, Li AM, Chan KO, Chook P, Kam JT, Au CT, et al. Orlistat improves endothelial function in obese adolescents: a randomised trial. J Paediatr Child Health. 2013; 49: 969-75.
14. Kendall DL, Amin R, Clayton PE. Metformin in the treatment of obese children and adolescents at risk of type 2 diabetes. Paediatr Drugs. 2014; 16:13-20.
15. Kwiterovich PO Jr. Recognition and management of dyslipidemia in children and adolescents. J Clin Endocrinol Metab. 2008; 93: 4200-9.
16. Anyaegbu EI, Dharnidharka VR. Hypertension in the teenager. Pediatr Clin North Am. 2014; 61:131-51.