Noticias.
Crítica de libros. Lo que se necesita saber para la autogestión de la diabetes
Lo que se necesita saber para la autogestión de la diabetes
Autoras: Dra. R. Barrio Castellanos, Dña. L. Cartaya Otamendi
Clínica D-Médical
Adolescere 2024; XII (2)
¿QUIERES SEGUIR OFRECIENDO LO MEJOR AL PACIENTE CON DIABETES Y A SUS FAMILIARES? Se acaba de publicar la Guía “DIABETES TIPO 1 EN LA EDAD PEDIÁTRICA. Lo que se necesita saber para la autogestión de la diabetes” (3º ed, 2024), de la Unidad de Diabetes Pediátrica de la Clínica D-Médical de Madrid. Es una guía completa, actualizada y cercana y está diseñada especialmente para adolescentes y para las familias de niños con diabetes tipo 1 (DM1). Contiene todo lo necesario para entender y convivir con la diabetes de una manera amigable y segura, cuidando todos los aspectos de la salud sin sentirse limitados.
La Dra. Raquel Barrio, experta en el cuidado de pacientes con diabetes y sus familiares, junto a Lourdes Cartaya, pedagoga y educadora en diabetes, han puesto al día su obra con el propósito de ofrecer un recurso actual, útil y accesible para todos los que se enfrentan al desafío de convivir con DM1. Con un enfoque cercano, a la vez que riguroso, la nueva edición ofrece un viaje en el que el paciente y su familia descubrirán el mundo de la diabetes y cómo afecta al organismo, encontrarán las mejores herramientas de autocuidado y entenderán la importancia de elegir alimentos saludables y hacer ejercicio físico. El libro también explica los beneficios de la tecnología en la determinación de glucosa y administración de insulina, comprendiendo el “gold standard” del tratamiento actual de la DM1 en la edad pediátrica, el “páncreas artificial híbrido avanzado”, sin olvidar el cuidado de los aspectos emocionales y sociales. Con estos nuevos conocimientos, los adolescentes y los cuidadores de niños con DM1 podrán ayudar al equipo diabetológico en la búsqueda de las estrategias que mejor se adaptan a sus circunstancias, con el objetivo de sentirse bien a la vez que su diabetes está controlada. La guía invita a APRENDER, CUIDARSE y VIVIR con DM1.
“DIABETES TIPO 1 EN LA EDAD PEDIÁTRICA” es más que un libro: es un compañero en el camino hacia una vida saludable y plena con diabetes. Ayudará no solo a pacientes y familiares, sino también a sus equipos diabetológicos en la gestión integrada de la diabetes. Gracias infinitas a las autoras por su pasión e implicación constante para ayudar a jóvenes y a sus familias a vivir con esta condición, por compartir tan generosamente su conocimiento y experiencia, por todas sus aportaciones, por su compromiso y por su calidez humana.
¡Únete al mejor cuidado de la DM1 guiado por la experiencia y excelencia de la Dra. Barrio!
María Martín Frías
Unidad de Diabetes y Endocrinología Pediátrica
Hospital Universitario Ramón y Cajal, Madrid.
Crítica de libros. Lo que se necesita saber para la autogestión de la diabetes
Calidad de vida de los adolescentes con enfermedades crónicas
Calidad de vida de los adolescentes con enfermedades crónicas
I. Riaño Galán(1), M. Tasso Cereceda(2).
(1) Unidad Endocrinología y Diabetes Infantil. AGC de Pediatría. Hospital Universitario Central de Asturias (Oviedo). Master en Bioética UCM. (2) Oncología pediátrica y del adolescente. Jefa de Sección de la Unidad de Oncohematología pediátrica del Hospital General Universitario Dr Balmis de Alicante. Máster en Bioética UCM.
Fecha de recepción: 21-04-2022
Fecha de publicación: 30-06-2022
Adolescere 2022; X (2): 34-44
Resumen
|
La calidad de vida relacionada con la salud se ha convertido en un objetivo central de la asistencia sanitaria y una medida de resultados en salud “centrada en el paciente”. Su evaluación en la adolescencia plantea retos específicos por la baja prevalencia de problemas graves de salud y de limitaciones funcionales en estas edades. El concepto de salud difiere según la edad, pues tanto las expectativas como las funciones y actividades son distintas. Por ello, la medición de la salud en los adolescentes tiene que contemplar la habilidad de participar plenamente en funciones y actividades físicas, sociales y psicosociales apropiadas para su edad. Introducir la valoración de la calidad de vida en la asistencia de los adolescentes, con patologías crónicas desde una visión psicosocial facilita la comunicación y promueve su autonomía y participación en el proceso de atención.. Palabras clave: Adolescencia; Calidad de vida; Enfermedades crónicas; Diabetes; Cáncer. |
Abstract
|
Health-related quality of life has become a central goal of healthcare and a “patient-centered” measure of health outcomes. Its evaluation in adolescence poses specific challenges due to the low prevalence of severe health problems and functional limitations in this age group. The concept of health differs according to age, since expectations as well as functions and activities are different. Therefore, the measurement of health in adolescents has to contemplate the ability to participate fully in functions and physical, social and psychosocial activities appropriate for their age. Introducing the assessment of quality of life in the care of adolescents with chronic pathologies from a psychosocial perspective facilitates communication and promotes their autonomy and participation in the care process. Key words: Adolescence; Quality of life; Chronic diseases; Diabetes; Cancer. |
Introducción
La calidad de vida relacionada con la salud (CVRS) ha pasado a ser un objetivo central de la asistencia sanitaria y una medida de resultados en salud “centrada en el paciente”. Ello se refleja en el creciente número de publicaciones referidas a adolescentes afectos de diversas patologías crónicas, así como su evolución en el tiempo, su estado de salud general y las discapacidades psico-sociales de esta población. Dichos estudios muestran que incluso dolencias como la obesidad pueden afectar su calidad de vida, lo cual justifica la evaluación de su salud percibida(1). Como denominador común, tanto en problemas de obesidad como en el espectro de enfermedades crónicas que afectan a los adolescentes, se detecta un deterioro del bienestar físico y de la calidad de vida global percibida, en relación con sus iguales sanos. La alteración de la imagen corporal, pérdida de habilidades físicas y dificultad para seguir con su ritmo normal de vida, pueden condicionar una baja autoestima y crear problemas de adaptación en el ambiente escolar.
En este artículo, partiendo del concepto de calidad de vida, revisaremos como evaluarla y los tipos de instrumentos utilizados, para finalmente centrarnos en dos modelos de patologías: la diabetes y el cáncer.
Concepto de calidad de vida
Las medidas de CVRS deben cumplir las siguientes características: ser subjetivas, multidimensionales, incluir sentimientos positivos y negativos y registrar la variabilidad en el tiempo, la etapa vital y el momento de la enfermedad puesto que suponen diferencias marcadas en los aspectos que se valoran
La CVRS deriva de la definición de salud de la Organización Mundial de la Salud (OMS) formulada en 1948, como “el estado de completo bienestar físico, mental y social y no solo la ausencia de enfermedad”. En 1994, la OMS definió la calidad de vida como “la percepción del individuo de su situación en la vida, dentro del contexto cultural y de valores en que vive, y en relación con sus objetivos, expectativas, valores e intereses”. Las tradiciones culturales modulan como se van construyendo los valores y las necesidades, y por tanto resultan esenciales. Así, el valor cultural atribuido a la independencia física o al dolor difiere mucho de unas culturas a otras. Por ello, en 1995, la OMS creó un grupo multicultural de expertos en Calidad de vida (Grupo WHOQOL) que estableció una serie de puntos de consenso globales(2).
La calidad de vida es un concepto valorativo con una doble perspectiva: la objetiva y la subjetiva. La determinación objetiva se centra en lo que el individuo puede hacer mientras que la valoración subjetiva incluye la percepción o estimación personal de las condiciones de vida y se traduce en sentimientos positivos o negativos.
Los modelos teóricos la definen como un continuum, donde se encuentran, por un lado, los factores biológicos y fisiológicos, más objetivos, y por otro la calidad de vida, relacionada con la percepción personal de salud y el apoyo psicológico y social. Los factores biológicos y fisiológicos se refieren a los síntomas, siendo determinantes fundamentales del estado de salud. Sin embargo, la relación entre los parámetros clínicos objetivos y los síntomas es compleja. Pueden ocurrir importantes alteraciones biológicas y fisiológicas sin que el paciente lo perciba como un deterioro de su bienestar o viceversa. Esto es muy patente en las fases terminales de enfermedades oncológicas, donde el enfermo asume limitaciones funcionales de forma progresiva, ajustando a ellas sus objetivos vitales.
Cada enfermo es uno y diferente, haciendo realidad el viejo aforismo de “no hay enfermedades sino enfermos”. Los pacientes son los que realmente existen como sujetos individuales y concretos, los que diagnosticamos y a veces curamos y siempre debemos cuidar, mientras que las enfermedades son categorías mentales derivadas del conocimiento de los enfermos que se tipifican como tales por las características comunes observadas en su etiología y fisiopatología.
La calidad de vida puede definirse como la evaluación subjetiva de la influencia del estado de salud, los cuidados sanitarios y la promoción de la salud, sobre la capacidad del individuo para mantener un nivel de funcionamiento que le permite realizar aquellas actividades que son importantes para él, y que afectan a su estado de bienestar, en su entorno socio-cultural.
Evaluación de calidad de vida en adolescentes con enfermedades crónicas
La evaluación de la CVRS en la adolescencia plantea retos específicos por la baja prevalencia de problemas graves de salud y de limitaciones funcionales en estas edades. El concepto de salud difiere según la edad, pues tanto las expectativas como las funciones y actividades son distintas. Por ello, la medición de la salud en los adolescentes tiene que contemplar la habilidad de participar plenamente en funciones y actividades físicas, sociales y psicosociales apropiadas para su edad.
La adolescencia es una época en la que se ponen a prueba los límites de la enfermedad y la adherencia a los tratamientos recomendados(3,4). Las enfermedades crónicas pueden perjudicar el desarrollo de la propia autonomía, de una mayor sensibilidad en el cuidado de sí mismo y de una intimidad creciente, así como los planes de futuro. Los problemas de salud que exigen la asistencia frecuente al hospital pueden obstaculizar su proceso de independencia. La enfermedad o su tratamiento son particularmente embarazosos a esta edad, y pueden afectar a la imagen corporal, clave en esta etapa. Así, por ejemplo, la pérdida del pelo por quimioterapia afecta más en la adolescencia que en niños más pequeños, pues en éstos la apariencia y las relaciones sociales no juegan un papel tan importante.
Es imprescindible la adaptación de los cuestionarios de CVRS según la madurez del menor y su grado de desarrollo, a la edad, no solo cronológica sino madurativa.
El trabajo en grupos multidisciplinares permite ofrecer pautas de actuación en relación con aspectos educativos y psicosociales que faciliten la toma de decisiones, tanto individual como poblacional, con el objetivo final de mejorar la calidad de vida y prestar una atención integral a estos adolescentes y a sus familias
Históricamente, para investigar la salud y conocer cómo el menor percibía su enfermedad se interrogaba a los adultos (padres, profesores, médicos). Hoy en día, resulta imprescindible escuchar a los menores. Solo el propio adolescente puede comunicar su calidad de vida y sus experiencias sobre su estado de salud, siendo su perspectiva la más exacta. No obstante, los padres son la fuente de información más apropiada cuando están muy enfermos y no pueden comunicar su propia vivencia. La perspectiva de los médicos suele estar determinada por el grado de compromiso de la salud y parece sobreestimar el impacto de la enfermedad sobre la CVRS, quizás por desconocimiento de la capacidad de las familias para aminorar ese impacto y de otros factores no relacionados con la salud(5). Debe evaluarse, asimismo, si el paciente sobreestima o subestima sus posibilidades reales. Por otro lado, a pesar de que el médico tiende a ver la calidad de vida como un reflejo del compromiso orgánico, este sesgo puede atenuarse gracias a un conocimiento mayor y más cercano del paciente y su familia a lo largo del tiempo.
Es importante señalar que los cuestionarios empleados para recabar información sobre la calidad de vida no deben de ningún modo, reemplazar el diálogo que ha de establecerse en la entrevista médico-paciente. Los aspectos que los adolescentes y sus padres consideran importantes en relación con la CVRS son tantos y tan variados, que en la práctica asistencial su evaluación no debe restringirse a un cuestionario cerrado.
Tipos de instrumentos de medición de CVRS y sus propiedades
La mayoría de los cuestionarios de CVRS se han desarrollado en países anglosajones, siendo necesaria su adaptación al contexto cultural para lograr versiones equivalentes y comparables al original. El método de adaptación incluye traducción al idioma diana, revisión por expertos, contar con muestras de dicha población diana y volver a traducir los resultados al idioma original.
El empleo de instrumentos de medición de la calidad de vida facilita la comunicación y explora las necesidades percibidas por los adolescentes afectos de enfermedades crónicas
El modelo más utilizado para medir la CVRS se basa en la teoría psicométrica. Las características o propiedades psicométricas más importantes de cualquier instrumento de CVRS son su fiabilidad, validez y sensibilidad al cambio. La Tabla I resume dichas características.
Los cuestionarios de medida de la CVRS se suelen clasificar en dos grandes grupos según el ámbito de salud que abarcan: genéricos y específicos. Los genéricos permiten evaluar la salud en general, siendo válidos para población sana y enferma. Los instrumentos específicos recogen síntomas físicos y/o psicológicos relacionados con la enfermedad analizada, el funcionamiento emocional y las limitaciones de actividad causadas por la enfermedad. En el ámbito de la adolescencia, se han desarrollado instrumentos específicos para el cáncer, el asma, la epilepsia y la diabetes, entre otros.
Los cuestionarios que valoran la calidad de vida percibida por el paciente pueden mejorar la atención integral a adolescentes con patologías crónicas
La selección de un instrumento u otro depende de los objetivos del estudio, del ámbito de uso y de las características propias del instrumento. Entre los cuestionarios genéricos más conocidos y utilizados destacan el CHIP y el CHQ. El KINDL, el PedsQL, el Kidscreen y el TACQOL son útiles en estudios clínicos en niños y adolescentes con problemas crónicos de salud. DISABKIDS® es un proyecto financiado por la Comisión Europea, para desarrollar instrumentos para evaluar la CVRS en niños y adolescentes con enfermedades crónicas. Tiene un módulo genérico común (DCGM-37) y siete módulos específicos de la enfermedad(6), incluyendo uno de Diabetes (DSM-10), que hemos traducido y validado en español(7). El DCGM-37 explora seis dimensiones: independencia, emoción, exclusión social, inclusión social, limitaciones físicas y tratamiento. El DSM-10 específico valora dos dimensiones: impacto de la enfermedad y tratamiento.
La Food and Drug Administration (FDA) ha propuesto el concepto “resultados percibidos por los pacientes” (Patient Reported Outcomes – PRO) para referirse de forma genérica a todos los cuestionarios, sin entrar en precisiones sobre su tipología: la medición de cualquier aspecto del estado de salud del paciente que proviene directamente del mismo, sin interpretación de las respuestas por parte del médico u otro evaluador.
El desarrollo de medidas de PRO y CVRS ha seguido una tendencia exponencial en las últimas décadas, incluyendo cuestionarios disponibles para adolescentes y se han convertido en uno de los principales indicadores de salud. Esto es especialmente importante en pacientes con enfermedades crónicas, pero también para estudios en patologías agudas, e incluso en población general.
La elección del instrumento debe ser acorde al objetivo que se pretende evaluar, siendo importante tanto la selección de la muestra como las condiciones de aplicación. BiblioPRO (http://www.bibliopro.org/) es una biblioteca virtual de cuestionarios en español de PRO y CVRS. Facilita identificar los cuestionarios disponibles para un uso concreto y escoger el más adecuado. Asimismo, indica cómo acceder al cuestionario e instrucciones de uso, garantizando el respeto al copyright.
Aportaciones de la medición de la calidad de vida
La medición de la CVRS permite valorar de forma más integral la repercusión de la enfermedad en la vida diaria de los adolescentes e identificar la necesidad de cuidados que apoyen los tratamientos biomédicos habituales, lo cual adquiere especial relevancia en los pacientes con enfermedades crónicas como la diabetes tipo 1 o el cáncer
En la práctica clínica la medición de la CVRS facilita el conocimiento del estado de salud y permite identificar diversos niveles de morbilidad. Otra aplicación de interés clínico es valorar el impacto sobre la salud de los tratamientos y facilitar la toma de decisiones clínicas. Se ha propuesto utilizar la CVRS como un indicador de resultado en los diseños de investigación clínica(8). De hecho, las compañías farmacéuticas han incorporado, como estrategia para el lanzamiento de nuevos fármacos, su efecto sobre la calidad de vida. Esto adquiere especial importancia cuando la efectividad del tratamiento se basa, sobre todo, en la propia percepción del paciente.
La medición de la CVRS permite, no solo la evaluación de los resultados en ensayos clínicos e investigaciones sanitarias, sino también la evaluación de las necesidades reales de una población y, por consiguiente, la planificación adecuada de medidas de intervención sanitaria y de distribución de recursos
En el nuevo paradigma de relación clínica, ya no es el profesional sanitario quien dictamina si el sujeto está sano o no y cuál es el tratamiento más adecuado. En este sentido, podríamos decir que no hay un concepto objetivo de salud y bienestar y por tanto estar sano o no, se ha convertido en una cuestión principalmente subjetiva.
A continuación, nos centraremos en dos patologías en las que parece tener especial interés la valoración de la CVRS como son la diabetes y el cáncer.
Calidad de vida y diabetes en la adolescencia
La diabetes mellitus tipo 1 (DM1) afecta a todos los aspectos de la vida y en especial, a la esfera psicológica y por lo tanto a la CVRS. Su gestión es compleja, requiriendo alta implicación en el autocontrol para lograr un adecuado control metabólico. La pubertad es un momento difícil con alta inestabilidad metabólica, y muchos adolescentes experimentan deterioro en el control metabólico(9).
Diversos estudios indican que la evaluación de la CVRS en adolescentes con DM1 mejora su bienestar psicosocial(10). Sin embargo, esto debe mantenerse como parte de un proceso continuo para que los efectos beneficiosos persistan(11).
En el estudio de Murillo et al(12) con participación de 136 pacientes con DM1 procedentes de 5 centros hospitalarios catalanes obtiene menor bienestar físico, siendo la edad, las familias monoparentales, la adherencia y la salud mental los factores que más influyen en la CVRS.
La calidad de vida es cada vez considerada un importante parámetro de resultado de salud por lo que se recomienda incorporar su evaluación de rutina en niños y adolescentes con DM1(13).
Calidad de vida y cáncer en la adolescencia
A día de hoy, hay pocos datos sobre cómo el cáncer y su tratamiento afectan la vida de un adolescente o adulto joven, no solo durante el tratamiento, sino también al continuar con su vida una vez superada la enfermedad.
La calidad de vida percibida por el paciente, puede ser un factor determinante en la toma de decisiones compartidas con adolescentes en fases avanzadas de enfermedad oncológica
Si el cáncer supone grandes desafíos a cualquier edad, en la adolescencia, etapa ya de por sí compleja por los grandes cambios y transiciones en el proceso evolutivo de la persona, añade un plus de retos que afectan directamente a la imagen corporal, relaciones interpersonales, interferencia con los estudios y proyecto vital, sexualidad, límites a la independencia familiar y otros.
Además, debido a que ciertas partes del cerebro siguen todavía en desarrollo a esta edad, los supervivientes pueden tener secuelas cognitivas a largo plazo, como problemas de atención, de cálculo o de memoria, derivadas de la quimioterapia y/o radioterapias recibidas, especialmente aquellos que padecieron algún tipo de tumor cerebral.
En España se estima que 150 de cada 100.000 adolescentes y adultos jóvenes entre 19 y 29 años son supervivientes de un cáncer en la infancia. Una cifra con entidad suficiente para poner el foco de atención en cómo se puede optimizar su calidad de vida, partiendo ya desde el mismo diagnóstico de la enfermedad.
El Dr. Roth (oncólogo pediatra y codirector del programa de adolescentes y adultos jóvenes en el Centro Oncológico MD Anderson de Texas) y la Dra. Parsons (directora médica del Programa Reid R. Sacco sobre cáncer en adolescentes y adultos jóvenes del Centro Médico Tufts), señalan que menos del 20 % de estudios clínicos realizados desde 2007 que engloban estos grupos de edad, incluyeron datos sobre CVRS. En los pocos estudios que sí los incluyeron, los cuestionarios no estaban estandarizados, lo que dificultó el análisis de resultados y por tanto, la implementación de intervenciones para mejorar su calidad de vida.
Estos doctores presiden una comisión cuyo objetivo es abordar estas carencias recopilando información directa de los adolescentes y adultos jóvenes sobre los efectos del cáncer y su tratamiento en la calidad de vida. Es decir, el desarrollo de medidas PRO, con la finalidad de estandarizar la recopilación de los datos comunicados por los pacientes en diversos estudios clínicos llevados a cabo por el Programa de Investigación Oncológica Comunitaria del NCI (NCORP) y la Red Nacional de Estudios Clínicos (NCTN) del NCI. A tal fin se creó, en 2020, la Comisión sobre Resultados Percibidos por Pacientes Adolescentes y Adultos Jóvenes, con fondos de la Iniciativa de Datos sobre el Cáncer Infantil (CCDI) del NCI(14).
Los adolescentes y adultos jóvenes pueden y deben participar de forma activa en su propia atención médica, por lo que es importante ofrecer una atención holística, que abarque todos los aspectos de su vida con el fin de optimizar su calidad de vida
Como ya hemos indicado, los adolescentes y adultos jóvenes pueden y deben participar de forma activa en su propia atención médica, por lo que es importante ofrecer una atención holística, que abarque todos los aspectos de su vida con el fin de optimizar su calidad de vida(15).
Cuestiones tales como la alteración de la imagen corporal, las relaciones sexuales, dificultades en los estudios de secundaria y acceso a puestos laborales, influyen de manera decisiva en la calidad de vida de esta población, constituyendo, sin duda, esferas que requieren atención especial en este grupo de edad.
La calidad de vida está reconocida como uno de los indicadores que deben utilizarse para implementar las nuevas estrategias en el abordaje del tratamiento integral del cáncer.
Un estudio realizado en España en 2008 para valorar comparativamente la calidad de vida de adolescentes supervivientes de un cáncer en la infancia frente al mismo grupo etario sin historia de cáncer, a través del cuestionario de salud SF-12v2, demostró que los supervivientes manifiestan una calidad de vida satisfactoria y similar a la observada en su grupo de referencia, incluso con mayor percepción de bienestar psicológico que su grupo control sin historia previa de cáncer(16). Esto podría explicarse por el hecho de que la experiencia de haber superado un cáncer puede contribuir a su mayor madurez moral, nueva jerarquía de prioridades, mayor capacidad de disfrute de actividades y relaciones socio-familiares, incluso mejor resiliencia a situaciones potencialmente amenazantes para la vida, con respuestas de afrontamiento más satisfactorias.
El mencionado estudio no incluye a los supervivientes de tumores del sistema nervioso central, por su mayor riesgo de alteraciones funcionales en los ámbitos educativo y psicosocial, derivadas tanto de la localización del tumor como de los tratamientos recibidos. Además, el cuestionario utilizado no considera aspectos derivados de la opinión personal de los pacientes, lo que imposibilita dimensionar la valoración subjetiva de la calidad de vida percibida.
Otros estudios, sin embargo, demuestran que los síntomas psicológicos tras superar una enfermedad oncológica, se presentan con mayor frecuencia de lo esperado en la población general(17).
Actualmente se estima que en Europa existen más de 500.000 supervivientes de un cáncer pediátrico, cifra que continúa creciendo. La intensidad de los tratamientos aplicados, el riesgo de efectos a largo plazo y las secuelas, condicionan que esta población requiera controles de salud más estrictos, y por tanto, que los médicos de familia adquieran conciencia del problema y conocimientos específicos sobre esta necesidad creciente.
El proyecto PanCareSurPass, financiado por la Unión Europea, trabaja en el desarrollo e implementación de un pasaporte digital europeo (SurPass) para supervivientes de cáncer infantil(18), proyecto liderado en España desde el Instituto de Investigación Sanitaria de La Fe (Valencia)(19). La finalidad del pasaporte es ofrecer a cada superviviente un plan de cuidados, seguimiento y recomendaciones personalizado, en soporte digital interoperable en toda Europa, aprovechando la transformación digital de la asistencia sanitaria para mejorar la atención centrada en la persona de este grupo de población.
Aspectos éticos
Para cuidar la calidad de vida de los adolescentes y adultos jóvenes durante su enfermedad, es importante tener en cuenta diversas cuestiones, reconocidas todas ellas como derechos individuales, recogidos en la Ley 41/2002, básica reguladora de la autonomía del paciente
Para cuidar la calidad de vida de los adolescentes y adultos jóvenes durante el proceso de su enfermedad, es importante tener en cuenta diversas cuestiones, reconocidas todas ellas como derechos individuales, recogidos en la Ley 41/2002, básica reguladora de la autonomía del paciente.
Derecho a la información sanitaria
Todos los pacientes tienen derecho a recibir toda la información concerniente a su enfermedad y a cualquier actuación en el ámbito de su salud. El titular de la información sanitaria es el paciente, y las personas allegadas que él mismo autorice. La Ley reconoce la autoridad del médico para, en caso de considerar al paciente incapaz, dar la información a sus representantes o personas vinculadas. Aquí podría plantearse la cuestión de si un médico es siempre objetivo al valorar la capacidad del adolescente o cuánto de sus propios miedos o prejuicios pueden influir en esta decisión(20).
Se reconoce también el derecho a no ser informado, derecho limitado a situaciones en las que la falta de información pudiera perjudicar a la propia salud o la de sus allegados, o en cuestiones fundamentales del tratamiento (p. ej. la necesidad de permanecer en posición horizontal tras la práctica de una punción lumbar). Una situación hipotética en que un paciente no quiera recibir toda la información, por temor al impacto emocional, obligaría al médico a encontrar ese difícil equilibrio entre ambos derechos (el de saber y no saber) y el concepto de “verdad tolerable y progresiva”, como herramienta de ayuda para el afrontamiento personal frente a la adversidad.
Es este sentido, es importante cuidar con gran esmero la relación médico-paciente, basada en la confianza y la empatía y fundamental, tanto para la adherencia terapéutica como para el acompañamiento en situaciones de fin de vida, si fuera el caso.
Derecho a la intimidad
La legislación actual reconoce la mayoría de edad sanitaria a los 16 años, y con ella, la titularidad del derecho a la información. Esto quiere decir que un adolescente mayor de 16 años puede exigir guardar secreto profesional de su diagnóstico incluso a sus familiares y el facultativo tiene obligación de cumplir su deseo.
Esta ley fue modificada por la más reciente Ley 26/2015 de modificación del sistema de protección a la infancia y adolescencia, en el sentido de restar autonomía al menor en favor de su representante legal en actuaciones que, a criterio del facultativo, supongan grave riesgo para la vida o la salud, entre las que se podría incluir el supuesto de la información sanitaria de una enfermedad grave.
Aun así, podría darse el escenario de un joven de 19 años que acude solo a la consulta para recibir un diagnóstico de cáncer y que decide afrontar él solo el proceso, dejando al margen a su familia. El respeto a la confidencialidad es básico para reforzar la confianza con el adolescente. Sin embargo, el oncólogo pediatra se enfrenta al reto de persuadir al joven de la importancia de contar con una red de apoyo, en la que la familia, además de los amigos más íntimos, puede tener un papel fundamental de soporte y acompañamiento.
Respeto a la autonomía
La citada Ley 41/2002 hace mención, en sus artículos 8 y 9, al requisito del consentimiento informado para cualquier procedimiento asistencial, una vez recibida la información pertinente y conocidas las distintas opciones de tratamiento. El consentimiento informado será por representación en el supuesto de menores, pacientes incapacitados, o situaciones de grave riesgo en menores de 18 años. Así pues, un adolescente con mayoría de edad y capaz, tiene derecho a rechazar procedimientos o tratamientos, incluso supuestamente beneficiosos para él.
Pero su decisión no puede ser unilateral: debe formar parte de un proceso de toma de decisiones compartida, de la mano del oncólogo pediatra, en el que la opinión del joven debe tenerse muy en cuenta desde la premisa de una información de calidad, conocimiento y entendimiento de las distintas opciones y sus consecuencias; así como la valoración de su capacidad para esta toma de decisión concreta. En la medida de lo posible, debe evitarse adoptar decisiones precipitadas, otorgando un tiempo para la reflexión, acorde a la necesidad de cada persona.
Ciertas situaciones pueden generar conflictos éticos en el profesional. Por ejemplo, discrepancias entre la opinión del adolescente y la de su familia y/o la del facultativo, en el supuesto de un rechazo a una quimioterapia de tercera línea. Es más: el médico podría estimar incapaz al paciente de tomar dicha decisión, argumentando una depresión sobrevenida por la reciente recaída y situándose así del lado de la familia. La reflexión aquí sería si la opinión del médico es verdaderamente objetiva o enmascara su propia resistencia a interrumpir un tratamiento, para lo que quizá aún no se siente preparado, bien por presión familiar o por sus propias inseguridades.
Testimonios personales
Gracias a las aportaciones de supervivientes tratados en la unidad de oncología pediátrica del Hospital General Universitario Dr Balmis (Alicante) en su etapa de adolescentes, hemos podido recoger algunos datos de interés.
Los adolescentes, en general, coinciden en el impacto inicial como elemento totalmente disruptor en sus vidas. Junto a ello, necesitan conservar normalidad entre sus iguales, siendo sensibles a las miradas y cuchicheos de los demás. Ellos mismos reconocen que su grupo de amigos o sus compañeros de instituto no saben cómo reaccionar y defienden que su mejor ayuda es que se acerquen a ellos con normalidad. Algunos adolescentes prefieren hablar de su enfermedad con sus allegados y se sienten capacitados para ello y, si lo hacen con franqueza, reducen su propio temor y el de los que le rodean, lo que les permite elaborar mejores habilidades de afrontamiento y superación.
En el ambiente hospitalario insisten en falta de intimidad y su necesidad de soledad. Muchas de las unidades de oncología pediátrica carecen de espacios adaptados para adolescentes, por lo que éstos ingresan en habitaciones compartidas y no cuentan con espacios apropiados para su esparcimiento.
Algo parecido ocurre con el equipo de voluntarios que nunca falta en el hospital. Los adolescentes esperan voluntarios jóvenes, con los que puedan tener sintonía emocional y hablar con confianza. Este objetivo difícilmente se alcanza con voluntarios de mayor edad, aún con su mejor intención.
La alteración de la imagen corporal marcada por la alopecia, edemas, ganancia o pérdida de peso, estrías, acné… en muchos casos reversible, les enfrenta a diario a “ese a quien no reconocen en el espejo” y estimula su deseo de que el tiempo pase rápido y “mi cuerpo vuelva a ser el que era”.
La vuelta a clase siempre es un reto, difícil para el adolescente, difícil para sus compañeros, difícil para el profesorado que juega un papel fundamental en el proceso de normalizar la incorporación al medio escolar.
Además, en la fase aguda de la enfermedad, es común el cansancio físico y falta de energía, que les obliga a abandonar muchos de su hobbies y actividades deportivas, no solo por la fatiga (fútbol), sino también por la susceptibilidad a infecciones (natación).
¿Te imaginas a una gimnasta rítmica postrada en una cama sin apenas poder mover las piernas? Pues volvió a su actividad deportiva y llegó a ser monitora de acrobacias aéreas en telas y entrenadora de gimnasia rítmica, además de codirigir su propia empresa.
Otra cuestión trascendente en el escenario del adolescente enfermo de cáncer es cómo viven la comunicación con sus médicos y su integración en el proceso de toma de decisiones compartidas. Los pediatras sabemos bien que la información a la población a la que atendemos, adaptada a la edad, necesidad de saber y capacidad de comprensión, es parte fundamental de nuestro trabajo. Si hablamos de cáncer y de adolescentes, la tarea es más desafiante si cabe. En establecer una relación empática de calidad con nuestros pacientes jóvenes, nos va ganarnos su confianza, tanto para la adherencia terapéutica como para anticipar sus problemas, y estar dispuestos a escucharles y ayudarles en lo que sea menester.
Ellos mismos reconocen que estar bien informados les tranquiliza y les da seguridad. Valoran en gran medida la sinceridad y honestidad de sus médicos, sin ocultarles información, sienten que son el centro de la atención y merecedores del respeto por sus valores, opiniones y deseos en cuestiones relativas a las opciones terapéuticas que se plantean. El hecho de manifestar su satisfacción en este campo supone un reconocimiento positivo a nuestro empeño de trabajar por el bienestar y el interés superior de nuestros pacientes.
La empatía hacia el adolescente y su familia, debe ser una constante por parte de todo el equipo, aceptando que el adolescente puede manifestarse huraño o enfadado, en ciertos momentos de su enfermedad, lo que no debe desalentar la buena disposición del equipo.
La figura del psicólogo es una de las más valoradas por el grupo de jóvenes y sin duda ha mejorado el manejo global en este grupo de edad.
Las asociaciones de ayuda al cáncer infantil y del adolescente (ASPANION, ACFAMUR, ASION, ANDEX, FUNDACIÓN ALADINA, por nombrar solo algunas), pretenden ayudar en todos estos procesos adaptativos con distintas estrategias: información nutricional y dietistas, apoyo específico dirigido al estilismo incluyendo uso de pañuelos o gorras, técnicas de maquillaje, tratamientos capilares, programas de rehabilitación adaptada, campamentos de adolescentes, soporte psicológico, además de ayudas económicas y otros recursos.
Conclusión
La CVRS es un concepto multidimensional que se refiere al impacto que la salud y la enfermedad o sus tratamientos, tienen sobre la calidad de vida de un individuo. Lo que caracteriza a este indicador es que incorpora la perspectiva del individuo, dando cuenta de una subjetividad no evaluada por la mayoría de los indicadores utilizados en salud. Esta característica única asigna a la CVRS un lugar que, junto con la información clínica, puede resultar muy útil en la toma de decisiones médicas.
La evaluación de la calidad de vida permite promover la autonomía de adolescente y su participación en el proceso de atención
La medida de la CVRS supone un avance para conocer las necesidades de los adolescentes con enfermedades crónicas y sus familias. Ayuda a promover la autonomía y participación de los adolescentes en el proceso de atención, lo cual facilita la comunicación y explora las necesidades percibidas.
En definitiva, la calidad de vida constituye una nueva vía para investigar la salud de los individuos y de comunidades y valorar las ventajas y desventajas de los nuevos fármacos o tecnologías. A través de la medición de la CVRS, incorporamos en la práctica clínica el punto de vista del paciente, no solo los datos biológicos sino sus valores, necesidades y expectativas. Los pacientes con enfermedades crónicas y un amplio historial clínico, fruto de innumerables actuaciones médicas, al realizar un cuestionario de calidad de vida, expresan que nunca, hasta ese momento, se había interesado por esas cuestiones y “como se sentía”. Por tanto, la evaluación de la CVRS podría mejorar el proceso de comunicación y ayudar a humanizar la asistencia sanitaria, a veces altamente tecnificada. Todo ello supone un cambio de estilo en el ejercicio asistencial, desde la escucha activa y dando voz a los adolescentes con enfermedades crónicas, para que sean realmente los protagonistas y el centro de la atención.
El adolescente afecto de una enfermedad crónica, siendo el cáncer un ejemplo palmario entre ellas, no es un paciente pediátrico, y tampoco es un adulto. Se merece un espacio propio, atento a sus necesidades especiales, condicionadas por la etapa de cambios múltiples que experimenta su cuerpo y su personalidad de forma natural, a lo que hay que añadir todos los condicionantes, limitaciones y frustraciones a ese nuevo despertar a la vida, que supone una enfermedad sobrevenida para la que un adolescente nunca está preparado.
Todavía nos queda mucho camino por recorrer, para atender a nuestros pacientes adolescentes y adultos jóvenes de manera más satisfactoria para ellos. Sigamos.
Agradecimientos
A Joaquín Capdepon y a David Tecles, supervivientes, por sus valiosas aportaciones.
Tablas y figuras
Tabla I. Características o propiedades psicométricas de los instrumentos de evaluación de la calidad de vida relacionada con la salud
|
PROPIEDADES PSICOMÉTRICAS |
|
|
FIABILIDAD |
Grado en que un instrumento proporciona la misma puntuación cada vez que se administra en condiciones similares |
|
Fiabilidad interna o consistencia interna |
Grado en que los ítems y subdimensiones miden el mismo concepto. Un coeficiente α de Cronbach superior a 0,70 indica un nivel aceptable a nivel grupal y superior a 0,90 si es aplicación individual. |
|
Fiabilidad test-retest o reproducibilidad |
Grado de estabilidad temporal si no ha habido cambios en el estado de salud del individuo. Un coeficiente de correlación intraclase o de Pearson superior a 0,60 es aceptable a nivel grupal pero debe ser superior a 0,95 a nivel individual. |
|
Fiabilidad entre observadores |
Indicador de estabilidad de las mediciones cuando el proceso es realizado por varios entrevistadores. |
|
VALIDEZ |
Grado en que proporciona información del fenómeno que pretende medir y no de otros. |
|
Validez de contenido |
Es el análisis lógico del concepto que se pretende medir y, en especial, la definición de las áreas o dimensiones que abarca y sus límites con otros conceptos relacionados. |
|
Validez de constructo o de concepto |
Se basa en el análisis factorial de los ítems y permite determinar si reflejan diferentes gradaciones de una sola dimensión o si se distribuyen en un espacio multidimensional. |
|
Validez de criterio |
Mide el acuerdo o la concordancia de las respuestas con patrones de referencia (por ejemplo, las respuestas de sus madres). |
|
Validez convergente- discriminante |
Analiza si una matriz de relaciones entre diferentes instrumentos es coherente con lo esperable desde el conocimiento teórico. Así, por ejemplo, dos instrumentos que midan el mismo concepto es probable que establezcan interrelaciones altas entre sus dimensiones o componentes, frente a interrelaciones bajas con las puntuaciones que evalúan otras dimensiones menos relacionadas |
|
SENSIBILIDAD AL CAMBIO |
Capacidad para detectar cambios en el estado de salud o CVRS en el tiempo, por lo general antes y después de una intervención sanitaria. Se considera aceptable cuando el cambio medido como tamaño del efecto de la intervención es de 0,2 o más. |
Fuente: Riaño Galán I, Chueca Guindulain MJ. Calidad de vida en niños con enfermedades crónicas. En: M de los Reyes López, M Sánchez Jacob (ed.). Bioética y pediatría. Proyectos de vida plena. Madrid: Ergón; 2010.
Bibliografía
- Michaud PA, Suris JC, Viner R. The adolescent with a chronic condition. Part II: healthcare provision. Arch Dis Child 2004;89:943-9
- WHOQOL Group. The World Health Organization Quality of life assessment (WHOQOL). Position paper from the World Health Organization. Soc Sci Med 1995; 41 (10): 1403-9.
- Berntsson L, Berg M, Brydolf M, Hellström AL. Adolescent´s experiences of well-being when living with a long-term illness or disability. Scand J Caring Sci 2007;21(4):419-25.
- Sawyer SM, Aroni RA. Self-management in adolescents with chronic illness. What does it mean and how can it be achieved? MJA 2005,183(8):405-9.
- Roizen M, Figueroa C, Salvia L y miembros del Comité de Calidad de Vida y Salud. Calidad de vida relacionada con la salud en niños con enfermedades crónicas: comparación de la visión de los niños, sus padres y sus médicos. Arch Argent Pediatr 2007; 105(4):305-13.
- Baars RM, Atherton CI, Koopman HM, Bullinger M, Power M. The European DISABKIDS project: development of seven condition-specific modules to measure health related quality of life in children and adolescents. Health Qual Life Outcomes. 2005;3:70.
- Alonso Rubio P, Riaño Galán I. Impacto del control glucémico en la calidad de vida relacionada con la salud en niños y adolescentes con Diabetes Mellitus Tipo 1. Universidad, Investigación y Conocimiento: El valor de la I+D+i para evolucionar hacia una sociedad sostenible y responsable. Oviedo: Universidad de Oviedo; 2020. p. 495-500.
- Starfield B, Forrest CB, Ryan SA, Riley AW, Ensminger ME, Green BF. Health status of well vs ill adolescents. Arch Pediatr Adolesc Med 1996; 150: 1249-56.
- King PS, Berg CA, Butner J, Drew LM, Foster C, Donaldson D, et al. Longitudinal trajectories of metabolic control across adolescence: associations with parental involvement, adolescents’ psychosocial maturity, and health care utilization. J Adolesc Health. 2012; 50:491–6.
- De Wit M, Delemarre-van De Waal HA, Bokma JA, Haasnoot K, Houdijk MC, Gemke RJ, et al. Monitoring and Discussing Health-Related Quality of Life in Adolescents With Type 1 Diabetes Improve Psychosocial Well-Being. Diabetes Care. 2008; 31:1521–6.
- De Wit M, Delemarre-van De Waal HA, Bokma JA, Haasnoot K, Houdijk MC, Gemke RJ, et al. Follow-up results on monitoring and discussing health related quality of life in adolescent diabetes care: benefits do not sustain in routine practice. Pediatr Diabetes. 2010; 11:175–81.
- Murillo M, Bel J, Pérez J, Corripio R, Carreras G, Herrero X, et al. Health-related quality of life (HRQOL) and its associated factors in children with Type 1 Diabetes Mellitus (T1DM). BMC Pediatrics 2017; 17:16-25.
- Delamater AM, de Wit M, McDarby V, Malik J, Acerini CL. Psychological care of children and adolescents with type 1 diabetes. Pediatr Diabetes. 2014; 15 Suppl 2:232–44.
- NCI: “una nueva comisión se centra en la calidad de vida de los adolescentes y adultos jóvenes con cáncer” 7 de octubre de 2021, por el equipo de NCI. Consultado en: https://www.cancer.gov/espanol/noticias/temas-y-relatos-blog/2021/adolescentes-adultos-jovenes-cancer-documentan-su-calidad-de-vida. 4 de abril de 2022.
- Aase AS, Ingebretsen TK, Hauken MA. “There Should Have Been a More Holistic Approach”-A Qualitative Study of Young Adult Cancer Survivors’ Experiences of Follow-up After Cancer Treatment. Cancer Nurs. 2022 Jan-Feb 01;45(1):E299-E308.
- Castellano C, Blasco T, Oller A, Pérez-Campdepadrós M, Sánchez De Toledo J, Capdevila L. Calidad de vida en adolescentes supervivientes de cáncer infantojuvenil. Med Clin (Barc). 2009;133:783-6.
- Berkman AM, Robert RS, Roth M, Askins MA. A review of psychological symptoms and post-traumatic growth among adolescent and young adult survivors of childhood cancer. J Health Psychol. 2022; 27:990-1005.
- https://www.pancaresurpass.eu/. Consultado el 14 de abril de 2022.
- https://www.pancaresurpass.eu/team/hulafe/. Consultado el 14 de abril de 2022.
- Morales García F. Aspectos éticos. En: Adolescentes y jóvenes con cáncer. Rosalía Lorenzo González et al. Tarragona: Publicaciones Altaria, 2014.
Bibliografía recomendada
- Drotar D (ed). Measuring health-related quality of life in children and adolescents. Implications for research and practice. New Jersey: Lawrence Erlbaum; 1998.
- Riaño Galán I, Chueca Guindulain MJ. Calidad de vida en niños con enfermedades crónicas. En: M de los Reyes López, M Sánchez Jacob (ed.). Bioética y pediatría. Proyectos de vida plena. Madrid: Ergón; 2010, pp. 265-274 (ISBN: 978-84-8473-859-6).
- Rosalía Lorenzo González y cols. Adolescentes y jóvenes con cáncer. Tarragona: Publicaciones Altaria, S.L; 2014 (ISBN: 978-84-942844-8-2).
- Comisión de Psicología de la Federación Española de padres de Niños con Cáncer. Intervención psicosocial en adolescentes con cáncer. Barcelona: Federación Española de Niños con Cáncer; 2009. Patrocinado por el Ministerio de Sanidad y Política Social (Depósito Legal: B-5445-2010).
Enfermedades renales más habituales en la adolescencia
Enfermedades renales más habituales en la adolescencia
V.M. García Nieto, T. Moraleda Mesa, P. Tejera Carreño, M.I. Luis Yanes.
Sección de Nefrología Pediátrica, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife.
Fecha de recepción: 29 de septiembre 2019
Fecha de publicación: 31 de octubre 2019
Adolescere 2019; VII (3): 6-21
Resumen
|
Algunas enfermedades renales pueden debutar en la adolescencia. Tal es el caso de la enfermedad de Gitelman, tubulopatía que cursa con hipomagnesemia e hipocalciuria. Las glomerulopatías que con más frecuencia requieren una biopsia renal en esa edad son las nefropatías lúpica e IgA y el síndrome nefrótico resistente a corticoides. En adolescentes mujeres pueden observarse casos de infecciones urinarias originadas por Staphylococcus saprophyticus. No deben olvidarse, asimismo, las infecciones de transmisión sexual. Respecto a las anomalías metabólicas causantes de cálculos, con cierta frecuencia los pacientes con hipercalciuria idiopática normalizan en la adolescencia la eliminación urinaria de calcio pero reducen, también, la de citrato. Los casos con diabetes tipo 1 que tienen un debut muy precoz, pueden presentar en esa edad los primeros datos de nefropatía, especialmente, si el control metabólico ha sido inadecuado durante la infancia. La diabetes tipo 2 puede debutar en la adolescencia asociada, en general, a obesidad. Palabras clave: Adolescencia; Enfermedad de Gitelman; Diabetes; Obesidad; Hipertensión Arterial. |
Abstract
|
Certain kidney diseases can present in adolescence. Such is the case of Gitelman disease, a tubulopathy with hypomagnesemia and hypocalciuria. The glomerulopathies that most frequently require a renal biopsy during that age are lupus and IgA nephropathies as well as steroid-resistant nephrotic syndrome. In female adolescents, urinary infection caused by Staphylococcus saprophyticus can be observed. Sexually transmitted infections should not be forgotten. Among the metabolic abnormalities that cause renal stones, patients with idiopathic hypercalciuria tend to normalize urinary calcium elimination during adolescence but also reduce that of citrate. Patients with type 1 diabetes with a very early onset, especially if the metabolic control has been inadequate during childhood, may manifest the first data of nephropathy during adolescence. Type 2 diabetes mellitus may present in adolescence, generally associated with obesity. Ambulatory blood pressure monitoring is useful because it addresses several of the limitations of casual blood pressure measurements in the office. Some patients with renal malformations who suffer parenchymal loss may show a worsening of glomerular filtration rate in adolescence. Key words: Adolescence; Gitelman disease; Diabetes; Obesity; Hypertension. |
Introducción
Escribir un texto sobre las nefropatías más frecuentes en la adolescencia es un reto, porque existen pocas publicaciones relacionadas con algo tan específico. Para seleccionar los temas a tratar hemos tenido que recurrir, básicamente, a las particularidades que hemos observado en nuestra práctica diaria. Así, hemos seleccionado entidades que debutan, en general, en la adolescencia como la enfermedad de Gitelman o algunas glomerulopatías. De algunos temas generales hemos intentado destacar sus características en la adolescencia como es el caso de las infecciones de vías urinarias y la urolitiasis. Otras enfermedades, en fin, empiezan a desplegar sus complicaciones en la adolescencia. Es el caso de la nefropatía diabética, la hipertensión arterial ligada, sobre todo, a la obesidad y las malformaciones que cursan con pérdida de parénquima renal.
Infección de vías urinarias
Definición. Factores de riesgo
La infección de vías urinarias (IVU) es la entidad clínica que se caracteriza por el crecimiento de microorganismos (generalmente bacterias) en las vías urinarias con síntomas compatibles.
La IVU se produce fundamentalmente por vía ascendente, como resultado de la colonización del área periuretral por microorganismos que suelen provenir de la flora fecal.
Se han descrito distintos factores que aumentan el riesgo de IVU. Entre ellos destacan:
Anomalías que ocasionan obstrucción del flujo urinario (estenosis pieloureteral, megauréter, vejiga neurógena…)
- Instrumentación de la vía urinaria
- Diabetes mellitus mal controlada
- Predisposición genética
- Varones no circuncidados
- Uso de espermicidas y/o diafragma como método anticonceptivo
- Actividad sexual
Por otra parte, se han identificado algunos factores que en los casos de IVU, incrementan la posibilidad de formar cicatrices renales secundarias. Dichos factores son la fiebre elevada (>39ºC), la presencia de alteraciones ecográficas, el retraso en la instauración del tratamiento antibiótico más allá de las primeras 72 horas tras el inicio de los síntomas y la etiología distinta a Escherichia coli(1).
Etiología
La bacteria que causa IVU con mayor frecuencia (75-95% de los casos) es Escherichia coli (Tabla I).
Diagnóstico
La orientación diagnóstica inicial se basa fundamentalmente en la clínica y en la exploración física del paciente. Si la clínica es compatible con una infección urinaria se recogerá una muestra de orina limpia de mitad del chorro miccional para realizar un análisis de orina en todos los casos y urocultivo.
En cuanto a la forma de recogida de la muestra, la técnica debe realizarse tras retracción prepucial o separación de los labios mayores y limpieza con suero o jabón suave de la zona, desechando la primera y última parte de la micción.
El resultado del análisis urinario y la sintomatología pueden ayudar a decidir si es necesario iniciar tratamiento antibiótico de manera empírica sin esperar el resultado del cultivo de orina (48 horas) (Tabla II).
El cultivo de orina no será necesario en mujeres sin patología de base en las que se sospeche una cistitis; en este caso, puede ser suficiente para iniciar el tratamiento antibiótico la presencia de leucocituria junto a síntomas clínicos compatibles. Debe recogerse urocultivo en todos los casos en los varones y en aquellos pacientes que presenten patología nefrourológica de base, independientemente del sexo, así como en personas con IVU recurrentes o en las que sospechemos por la clínica una pielonefritis.
El cultivo de orina se considera positivo cuando existan ≥ 100.000 UFC/campo.
Peculiaridades en la adolescencia
La adolescencia es una época de cambios constantes en cuya etapa se suelen iniciar las relaciones sexuales. Por este motivo, los pediatras no deben olvidarse de pensar en las enfermedades de transmisión sexual como diagnóstico diferencial de IVU en aquellos adolescentes sexualmente activos,
siendo imprescindible una anamnesis detallada y una exploración genital en busca de úlceras, secreción uretral o secreción cervical. En las adolescentes mujeres debemos también considerar la vulvovaginitis como parte del diagnóstico diferencial, pues pueden presentar una clínica similar a una IVU.
El aislamiento de algunos microorganismos en mujeres adolescentes como estafilococos coagulasa negativos distintos de Staphylococcus saprophyticus(2), estreptococos del grupo B y lactobacilos representa con mucha frecuencia la contaminación de la muestra de orina.
Particularmente, Staphylococcus saprophyticus es resistente a los medicamentos más utilizados para el tratamiento empírico de las IVU. En una revisión reciente, se observó que muchas IVU fueron tratadas con un antibiótico empírico que no fue efectivo contra esa bacteria, revelando que S. saprophyticus es una etiología que no se considera suficientemente(2). Afortunadamente, la fosfomicina, de uso habitual en nuestro país, tiene una buena actividad in vitro contra Staphylococcus saprophyticus y otros uropatógenos comunes, como Escherichia coli, Proteus mirabilis y Klebsiella pneumoniae(3). El 94% de las bacterias de nuestro hospital causantes de IVU en los años 2013 y 2014 fueron sensibles a fosfomicina (Can Pediatr 2016; 40:19-22).
La fosfomicina, de uso habitual en nuestro país, tiene una buena actividad in vitro contra Staphylococcus saprophyticus y otros uropatógenos comunes
Tratamiento de las infecciones urinarias en la adolescencia(4)
Cistitis
De elección: fosfomicina trometamol 3 g en dosis única. Puede repetirse a las 48 o 72 horas si persisten los síntomas.
Alternativas:
- Nitrofurantoína 100 mg/12 h durante 5 días.
- Cotrimoxazol 800/160 mg /12 h durante 3 días.
- Ciprofloxacino 250 mg/12 h durante 3 días.
Pielonefritis
De elección: Cefixima 400mg /24 h durante 7 días.
Alternativas:
- Ciprofloxacino 750 mg/12 h durante 7 días.
- Amoxicilina/clavulánico 875/125mg cada 8 horas durante 7 días.
Resistencias bacterianas
Las tasas de resistencia de E. coli han aumentado en todo el mundo, aunque varían mucho según la zona geográfica. Las tasas de resistencia para ampicilina en la mayoría de las zonas estudiadas son superiores al 20% y en otras muchas, también, para la trimetoprim (con o sin sulfametoxazol), por lo que deben evitarse como tratamiento inicial. La nitrofurantoína y la fosfomicina han demostrado una buena actividad in vitro en todos los países investigados. Las tasas de resistencia de las cefalosporinas orales de primera y segunda generación y de la amoxicilina-ácido clavulánico son variables regionalmente pero, generalmente, menores al 10%, por lo que son una buena opción de tratamiento.
Las tasas de resistencia de las fluoroquinolonas están también por debajo del 10% en Europa y América del Norte, aunque se ha observado una clara tendencia a su incremento en los últimos años.
La monitorización continua de las tasas de resistencia a nivel local es fundamental para poder optimizar el tratamiento empírico.
Litiasis renal
Introducción
La litiasis renal es una de las primeras enfermedades claramente identificadas en el ser humano.
Un estudio reciente, evidencia una prevalencia global de litiasis renal del 15,5% en población española de 40 a 65 años(5). Otros estudios demuestran que su prevalencia está en un claro incremento.
La composición de los cálculos, su ubicación en el tracto urinario y la prevalencia de la enfermedad varía en todo el mundo. La tasa de prevalencia en países de ingresos bajos a medios como Pakistán y Turquía es del 5% al 15%, en comparación con el 1% al 5% en los países de superior nivel económico. Los cálculos urinarios pueden ser localizados en cualquier parte del tracto urinario. Muchos cálculos encontrados en niños nacidos en países de ingresos bajos a medios se encuentran dentro de la vejiga urinaria.
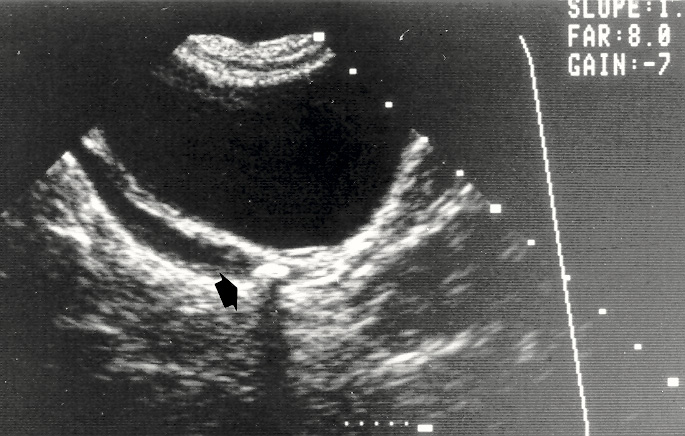
La manifestación y la presentación clínica de cálculos urinarios en niños difieren de la población adulta y puede variar con la edad. El 50% de los niños presentarán dolor abdominal, el 33% con hematuria y el 11% con infección. El dolor en niños con cálculos puede tener una distribución como apendicitis o gastroenteritis. En la práctica clínica, los ultrasonidos tienen una alta especificidad para detectar la nefrolitiasis en niños, pero con una sensibilidad moderada (Figura 1).
Fisiopatología
La litiasis renal puede definirse como una alteración de las condiciones naturales de cristalización de la orina. El tiempo que se requiere para generar un cristal depende fundamentalmente de la sobresaturación de la disolución (exceso de soluto en la disolución: fuerza impulsora de la cristalización), de la presencia de partículas sólidas preexistentes (los llamados nucleantes heterogéneos) y de la presencia de inhibidores de la cristalización. Estos últimos son sustancias que debido a su estructura química interaccionan con el núcleo o las caras del cristal, interfiriendo notablemente en su formación o/y desarrollo, reduciendo o previniendo los procesos de cristalización. Todas las orinas humanas están sobresaturadas con respecto al oxalato cálcico(6), de tal manera que el grado de sobresaturación resulta más elevado en los individuos hipercalciúricos o/y hiperoxalúricos. La orina humana puede contener además una amplia variedad de nucleantes heterogéneos tales como agregados proteicos, residuos celulares o bacterias. Además, en este aspecto, también debe considerarse la capacidad nucleante de los epitelios renales alterados. Es evidente que al aumentar el tiempo de permanencia de la orina en el tracto urinario (principalmente en las vías altas), se incrementa la posibilidad de que los procesos de cristalización conduzcan a la formación de cálculos renales. La existencia de cavidades renales de baja eficacia urodinámica constituye un importante factor de riesgo del desarrollo de cálculos. De hecho, se ha demostrado que los factores morfoanatómicos pueden jugar un importante papel en la calculogénesis. Así, se explicaría que un paciente recidivante en el que es de suponer que la orina tendrá la misma composición en los dos riñones, sólo forme cálculos en uno de ellos(7). Cuando el desarrollo de cristales se produce en la vejiga urinaria, normalmente se eliminan sin dificultad como cristaluria asintomática.
Clasificación de los cálculos renales
Independientemente de su composición química, los cálculos renales pueden clasificarse de manera amplia en dos grandes categorías: cálculos formados sobre las paredes renales (unidos a las papilas) en los que claramente se distingue la zona de unión al epitelio y cálculos desarrollados en las cavidades renales (sin zona de unión al epitelio)(6). Los cálculos más frecuentes son los de oxalato cálcico, fosfato (Figura 2), urato y cistina renales úricos. Existen otros cálculos poco frecuentes (Figura 3), la mayoría de los cuales están en relación con fármacos poco solubles como triamtereno, indinavir, sílice, glefamina o sulfamidas.
La infección bacteriana prolongada del tracto urinario suele ser la causa más común de este tipo de litiasis. Los gérmenes ureolíticos (Proteus, Klebsiella, Pseudomona, Ureaplasma…) suelen provocar una notable elevación del pH urinario (pH> 7) y de la concentración urinaria de amonio, que conjuntamente favorecen la precipitación de fosfato amónico magnésico y de hidroxiapatita (fosfato de calcio). Detalle de un cristal de estruvita en cuyas caras se observan las marcas en “Y” que permiten su rápida identificación junto pequeñas zonas de esferulitos de hidroxiapatita (cortesía del Dr. Félix Grases. Laboratorio de Investigación en Litiasis Renal, Instituto Universitario de Investigación en Ciencias de la Salud, Universidad de las Islas Baleares, Palma de Mallorca, España).
Paciente que a los 14 años expulsó tres cálculos. En el estudio metabólico se observó hipocitraturia. Vista general y detalle al microscopio electrónico de barrido del interior del “cálculo” de carbonato cálcico. La estructura no se corresponde con la típica de un cálculo renal con una morfología correspondiente a una estructura de origen vegetal, por lo que podría tratarse de una semilla (Dr. Grases).
Anomalías metabólicas causantes de cálculos
En la práctica clínica suelen determinarse calcio, ácido úrico, oxalato, cistina, citrato y magnesio.
Los cuatro primeros favorecen la formación de cálculos cuando su concentración es elevada en la orina (favorecedores). En cambio, citrato y magnesio propician su formación cuando sus cantidades urinarias son reducidas (inhibidores). Su cuantificación se realiza en orina de 24 horas. Al menos, en pediatría, se debe confirmar que la recogida horaria urinaria es correcta mediante el cálculo de la eliminación urinaria de creatinina (normal: 15-25 mg/kg/día). No obstante, en la actualidad, cada vez se usan más los cocientes urinarios por su facilidad en la recogida de las muestras, especialmente, en la infancia y porque la concentración, especialmente, de calcio y citrato pueden variar en distintos momentos del día. En todo caso, los cocientes urinarios son muy útiles, especialmente, en el seguimiento de los pacientes. En el diagnóstico y control de los pacientes litiásicos es muy útil el cociente calcio/citrato. La orina es particularmente litógena cuando existe un desequilibrio entre el componente favorecedor (calcio) y el protector (citrato). Valores de ese cociente superiores a 0,33 indican que la orina es potencialmente litógena, independientemente de la edad y del momento de la recogida. Nosotros, hemos observado que los cocientes urinarios calcio/creatinina, citrato/creatinina y calcio/citrato son distintos en dos momentos del día (orina de la noche recogida antes de la cena y primera de la mañana siguiente), de tal modo que las orinas más litógenas son las que se forman por la noche, es decir, las recogidas por la mañana (primera orina del día)(7). La consecuencia de todo ello es que estos datos tan sensibles no se pueden reproducir en la orina recogida durante 24 horas.
- Hipercalciuria
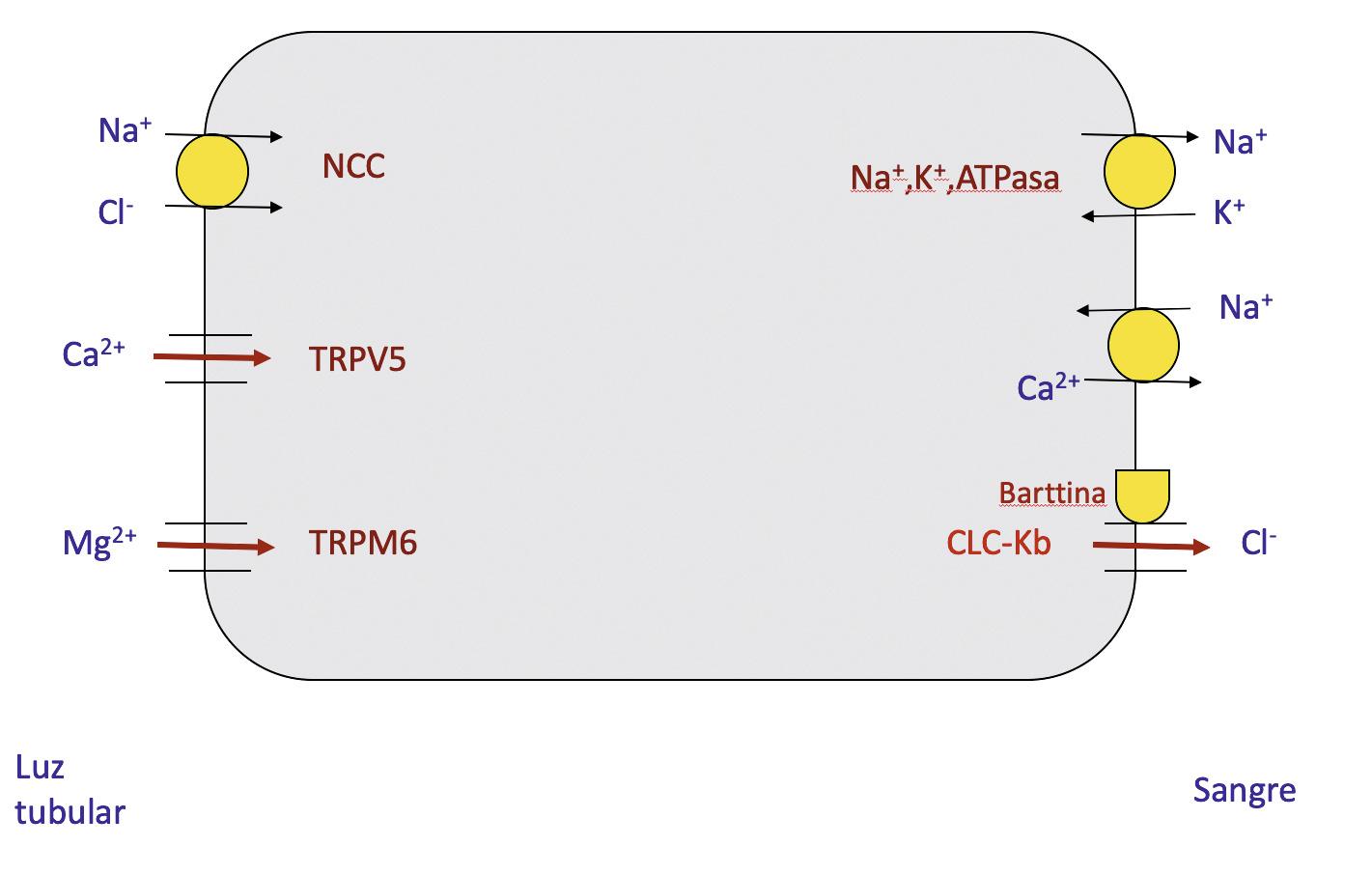
La causa más habitual de litiasis tanto en niños como en adultos es la hipercalciuria idiopática (HI). Se define por la ausencia de hipercalcemia y de otras causas identificables de hipercalciuria secundaria. La HI es de origen genético. No se considera una enfermedad en si misma sino una anomalía metabólica puesto que, en muchas ocasiones, no se asocia con clínica ni con formación de cálculos. El mecanismo fisiopatológico de la HI es muy complejo. La hipótesis más aceptada en la actualidad acerca de la causa de la HI está en relación con la existencia de un incremento del número de receptores para la vitamina D tanto en las células intestinales y óseas (osteoclastos) como en los monocitos periféricos.
- Hiperoxaluria. Oxalosis
- Hiperuricosuria
- Cistinuria
- Hipocitraturia
El citrato actúa como un inhibidor de la formación de cálculos de calcio al formar un complejo soluble, lo que disminuye la disponibilidad del calcio iónico libre, necesario para la cristalización de oxalato o de fosfato cálcicos. El citrato, también actúa como un inhibidor directo de la agregación de cristales de calcio y de su crecimiento. Por tanto, un citrato urinario reducido puede ser una causa importante de litiasis cálcica. En general, la acidosis metabólica se acompaña de hipocitraturia y la alcalosis de hipercitraturia. Por ello, las principales causas de eliminación urinaria reducida de citrato son la acidosis tubular renal y la insuficiencia renal crónica. Con cierta frecuencia, se observa hipocitraturia asociada a hipercalciuria idiopática, en ausencia de acidosis tubular renal. La ingesta excesiva de proteínas también favorece su aparición por la sobrecarga ácida que ocasiona.
- Hipomagnesuria
- Otros inhibidores de la formación de cálculos
Además del citrato y el magnesio, otras sustancias como pirofosfato, ciertos glicosaminoglicanos, nefrocalcina y fitato actúan inhibiendo la formación de cristales de oxalato de calcio y de fosfato de calcio. Por tanto, cuando sus niveles son bajos, se favorece la formación de cristales. El fitato, presente en la cáscara de los cereales y en legumbres, es un potente inhibidor de la cristalización. En este sentido, se recomienda el consumo frecuente de cereales integrales en pacientes con litiasis de repetición.
Prelitiasis
Desde principios de los 80, los pediatras hemos aprendido a identificar a los niños portadores de anomalías metabólicas causantes de cálculos en un momento en el que aún no les ha dado tiempo a fomarlos. Esto es particularmente cierto con las dos causas más frecuentes de los mismos, la hipercalciuria idiopática y la hipocitraturia. La hipercalciuria es de origen genético. Por tanto, uno de los dos padres es portador de la misma anomalía haya tenido o no síntomas de enfermedad litiásica. Los niños con HI pueden debutar con síntomas o signos como hematuria macro o microscópica, disuria estéril, polaquiuria, urgencia miccional, incontinencia urinaria, enuresis nocturna, orinas turbias, dolor abdominal recurrente “no típico de cólico renal” o leucocituria estéril(8). La hipocitraturia es una cuestión pendiente pues, si bien, en ocasiones se reconoce su causa en otras se desconoce y puede coincidir o no con la hipercalciuria.
Particularidades en la adolescencia
Los niños con prelitiasis pueden formar microcálculos que son difíciles de observar en la ecografía. Pueden crecer y aparecer en la vía urinaria produciendo un cólico nefrítico. Eso ocurre particularmente si en determinado momento no se toman las medidas dietéticas preventivas que figuran más abajo.
En nuestra práctica diaria hemos observado que este hecho es relativamente frecuente en adolescentes.
Con mucha asiduidad, se observa que los niños con hipercalciuria idiopática, al acercarse a la adolescencia, normalizan la eliminación urinaria de calcio y muestran, entonces, hipocitraturia. Parece, pues, por tanto, como si ambas anomalías metabólicas tuvieran un origen común. Una situación particular puede ocurrir, preferentemente, en la adolescencia cuando la citraturia puede estar reducida y la calciuria también, con lo que la orina no es litogena al mostrar una relación calcio/citrato normal.
Por esta razón, algunos adolescentes con prelitiasis que no se cuidan adecuadamente, pueden no formar cálculos durante esos años de crecimiento intenso y formación incrementada de hueso debido a una mayor actividad osteoblástica.
Con mucha asiduidad, se observa que los niños con hipercalciuria idiopática, al acercarse a la adolescencia, normalizan la eliminación urinaria de calcio y muestran, entonces, hipocitraturia
Algunos pacientes con enfermedades crónicas que cursan con predisposición a formar cálculos renales pueden manifestarse en la adolescencia con hematuria macroscópica o cólicos nefríticos. Son paradigmáticos los casos de la fibrosis quística y de la enfermedad inflamatoria intestinal en los que es frecuente la presencia de hipocitraturia.
Se han descrito casos de litiasis que han ofrecido los primeros síntomas en la adolescencia como expresión de riñón en esponja (enfermedad de Cacchi Ricci), riñón en herradura o hiperparatiroidismo primario. También, se ha descrito una asociación en esa edad entre nefrolitiasis e incremento del índice de masa corporal. Así, los adolescentes obesos tienen una mayor probabilidad de formar cálculos renales asociado, asimismo, con hipocitraturia.
Los adolescentes obesos tienen una mayor probabilidad de formar cálculos renales asociado a hipocitraturia
Tratamiento dietético preventivo
La mayoría de las anomalías metabólicas causantes de cálculos tienen un origen genético, por lo que la predisposición litiásica dura toda la vida. Por tanto, debe intentarse un control dietético y reservarse el tratamiento farmacológico para los casos complicados. El tratamiento dietético, a nivel general, incluye una ingesta elevada de agua (2000-3000 ml/1.73 m2), de frutas (cítricos) y de verduras, pescado azul y cereales integrales. A la inversa, no se debe abusar de proteínas ni de sal.
La citraturia se eleva incrementando la ingesta de agua y de cítricos y reduciendo la de proteínas de origen animal y de sal.
Nefropatía diabética
Generalidades
Antes del descubrimiento de la insulina por Banting y Best en 1921, las complicaciones crónicas de la diabetes mellitus (DM) no eran tan frecuentes como en la actualidad ya que los pacientes diabéticos fallecían antes de que estos problemas se hicieran manifiestos. Actualmente se sabe que no hay órgano o sistema que escape de estar involucrado por la DM.
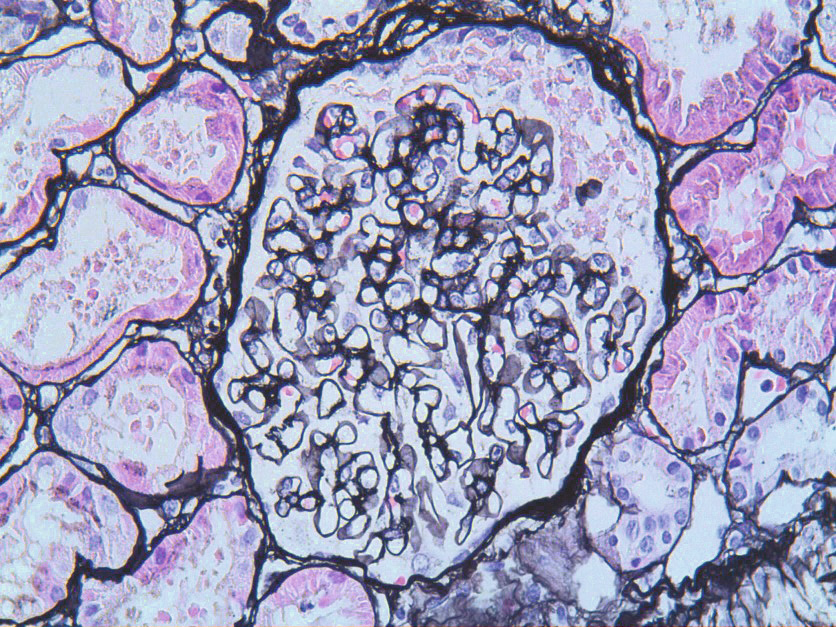
Muchas investigaciones han demostrado que en la niñez se pueden observar alteraciones que expresan daño microvascular y, aunque la mayoría de estas no se manifiestan clínicamente en la edad pediátrica, en esta época de la vida se pueden poner en marcha los mecanismos fisiopatológicos que acabarán manifestándose clínicamente en la edad adulta. Una de estas complicaciones es la nefropatía diabética, que fue reconocida en 1936 cuando Kimmestiel y Wilson, dos anatomopatólogos alemanes, descubrieron la forma nodular de esta glomerulopatía.
El síndrome clínico resultante de todas estas alteraciones se caracteriza por proteinuria persistente, hipertensión arterial y deterioro progresivo de la función renal.
La variedad preferente de afectación en la población pediátrica es la DM insulindependiente o tipo 1 (DM-1). Sin embargo, es necesario resaltar que en las últimas décadas se ha observado un importante incremento en la prevalencia de DM tipo 2 (DM-2) en niños y adolescentes. La creciente tasa de obesidad es el factor principal que explica esta situación. Así, se objetiva obesidad o sobrepeso en más del 95% de los adolescentes con DM-2. Además, existe historia familiar de DM-2 en el 90% de los casos, siendo sintomáticos en el momento de su presentación más de las dos terceras partes de los adolescentes, con más de un 13% en los que se objetiva la presencia de albuminuria en el momento del diagnóstico (el término “microalbumina” es incorrecto puesto que no se trata de una molécula más pequeña sino de cantidades reducidas). Este problema parece ir en aumento, y se estima que en el momento actual, entre un 20-30% de los nuevos casos de DM en la edad pediátrica corresponden a DM-2.
Es necesario resaltar que en las últimas décadas se ha observado un importante incremento en la prevalencia de DM tipo 2 (DM-2) en niños y adolescentes. La creciente tasa de obesidad es el factor principal que explica esta situación
La nefropatía diabética es un determinante de primer orden del exceso de morbilidad y de mortalidad prematura asociada a la DM-1. En el momento actual, con el control intensivo desde el punto de vista metabólico y de la presión arterial, y con el uso de estrategias farmacológicas con demostrada capacidad renoprotectora, las tasas de nefropatía diabética establecida y enfermedad renal terminal han descendido respecto a etapas anteriores(9). La incidencia acumulativa de nefropatía diabética aumenta progresivamente hasta aproximadamente los 20 años de evolución de la diabetes, cuando alcanza su punto máximo, para descender a partir de este momento, sugiriendo que el riesgo de desarrollar esta complicación no es constante a lo largo del curso de la enfermedad.
Detección precoz de la nefropatía diabética incipiente
Es fácilmente entendible la importancia de contar con un método simple y reproducible que permita discriminar a los pacientes con DM-1 en función del riesgo de desarrollar nefropatía. Desde esta perspectiva, se ha demostrado la utilidad del estudio del ritmo circadiano de la presión arterial. Así, una alteración de este patrón circadiano, en concreto, una elevación en la presión arterial nocturna, precede a la aparición de albuminuria. Se ha descrito que un descenso normal nocturno de la presión arterial tiene un valor predictivo negativo del 91% para el desarrollo de albuminuria, con una reducción del 70% en el riesgo de presentar esta complicación(10).
En el momento actual, el marcador aceptado como capaz de identificar precozmente a los pacientes que asocian un alto riesgo para desarrollar nefropatía diabética es la albuminuria persistente. Para un diagnóstico correcto, la albuminuria ha de ser positiva en dos de tres determinaciones consecutivas realizadas en un período de tres a seis meses. La cuantificación de la excreción de albúmina en orina de 24 horas es considerada el patrón de oro, aunque también podrá realizarse la determinación en orina minutada o en una muestra de orina aislada. Este último método, donde se determina el índice albúmina/creatinina (normal: menor de 30 mg/g), ha mostrado resultados superponibles a los obtenidos en orina de 24 horas, evitando el posible error derivado de una recolección incompleta de orina. El uso de este cociente ha sido recomendado como la estrategia de despistaje en todos los pacientes diabéticos.
Características en la adolescencia
Cuando la diabetes se inicia precozmente, al llegar a la adolescencia pueden observarse los primeros datos de nefropatía, especialmente, si el control de la enfermedad ha sido inadecuado durante la infancia.
Si se diagnostica diabetes en niños pequeños y la duración prepuberal de la diabetes es muy larga, los pacientes parecen estar protegidos contra la retinopatía diabética. Esta protección desaparece si el control metabólico ulterior es malo. En cambio, cuando el inicio es en la pubertad, el riesgo de retinopatía diabética es mayor y menos dependiente del control metabólico y puede estar influenciado por factores relacionados con la edad, como la presión arterial.
La ocurrencia de eventos importantes en la vida de los pacientes se asoció con una peor atención de la diabetes y con más cualidades psicosociales negativas en adolescentes con diabetes tipo 1(11). Como se ha indicado más arriba, en las últimas décadas se ha observado un importante incremento en la prevalencia de DM tipo 2.
Consideraciones terapéuticas
Desde el punto de vista terapéutico, la presencia de albuminuria representa un estadio evolutivo de la nefropatía diabética en la cual, el tratamiento es efectivo para prevenir la progresión de la enfermedad renal. Una duración corta de la albuminuria, unas bajas concentraciones séricas de colesterol y triglicéridos y un adecuado control metabólico y de la presión arterial, principalmente de la presión arterial sistólica, se han identificado como factores que se asocian de forma independiente con la regresión de la albuminuria(12). El tratamiento farmacológico inicial de elección será un inhibidor del enzima de conversión de la angiotensina (IECA), con una dosis que podrá ser progresiva hasta alcanzar la dosis máxima efectiva recomendada. Es de interés destacar que este tratamiento ha de establecerse en todo paciente con albuminuria, tanto hipertensos como normotensos, dado que se consigue una reducción precoz de la hiperfiltración glomerular, de la presión intraglomerular, de la albuminuria y de la progresión a nefropatía clínica. En pacientes normotensos, la dosis será la máxima tolerada.
Desde el punto de vista terapéutico, la presencia de albuminuria representa un estadio evolutivo de la nefropatía diabética en la cual, el tratamiento es efectivo para prevenir la progresión de la enfermedad renal
Hipertensión arterial
Causas de hipertensión arterial en la adolescencia
La hipertensión primaria (HP), también conocida como hipertensión esencial, anteriormente considerada una enfermedad de la edad adulta, se ha vuelto cada vez más común en la población pediátrica en gran medida debido al incremento de las tasas de obesidad.
La hipertensión primaria, también conocida como hipertensión esencial, anteriormente considerada una enfermedad de la edad adulta, se ha vuelto cada vez más común en la población pediátrica en gran medida debido al incremento de las tasas de obesidad
Los antecedentes familiares de hipertensión de los padres están relacionados con un riesgo doblemente mayor de desarrollar hipertensión esencial en niños y adultos jóvenes(13). Esta asociación ha conducido a una extensa investigación para dilucidar la etiología genética subyacente de la HP. Los estudios familiares han demostrado que del 20 al 40% de los casos diagnosticados están determinados genéticamente.
Existe un creciente cuerpo de evidencia sobre la relación inversa entre el peso al nacer y la hipertensión en niños y adolescentes. Se ha observado una fuerte asociación entre pacientes con antecedentes de bajo peso al nacer y retraso del crecimiento intrauterino y se observa una relación más significativa cuando se realizan ajustes para el peso corporal actual(14). Las complicaciones a largo plazo de la hipertensión, como el accidente cerebrovascular, la insuficiencia cardíaca, el infarto de miocardio y la enfermedad renal son poco frecuentes en la población pediátrica.
La disfunción renal representa una forma de daño del órgano terminal relacionado con la hipertensión, que se manifiesta en forma de una reducción en la tasa de filtración glomerular y una excreción elevada de albúmina en la orina. La albuminuria se correlaciona bien con la progresión de la nefropatía. La hipertensión no controlada puede causar daño, también, a la vascularización retiniana.
En adolescentes se han descrito casos originados por causas de hipertensión arterial secundaria como síndrome de aorta media, arteritis de Takayasu, feocromocitoma, hipertensión de vena renal izquierda (Nutcraker) y se ha observado en pacientes operados de tetralogía de Fallot.
Hipertensión arterial y obesidad
La obesidad es una enfermedad crónica y compleja que suele iniciarse en la infancia y la adolescencia. En la actualidad es un importante y creciente problema de salud pública en dicho sector de la población. Su importancia radica, no sólo en su creciente prevalencia, sino también en las comorbilidades secundarias a ella. La obesidad está implicada en el desarrollo de diversas complicaciones de tipo metabólico y cardiovascular, típicas del adulto, pero que pueden estar presentes desde la adolescencia e incluso infancia. Entre ellas cabe destacar la resistencia a la insulina.
La resistencia a la insulina junto con la obesidad, constituyen la base fisiopatológica de la enfermedad cardiovascular. Ambas están relacionadas entre sí y con otros factores, tales como las alteraciones del metabolismo de los hidratos de carbono y de los lípidos y la hipertensión arterial, constituyendo lo que se conoce como Síndrome Metabólico.
En niños, existen escasos estudios al respecto pero los existentes, han demostrado que la presencia de obesidad y otros factores tales como hipertensión arterial, dislipemia o diabetes mellitus, se asocian a un engrosamiento de la pared arterial (medido como grosor de la intima-media de la carótida)(15). Estas lesiones son predictivas de riesgo cardiovascular en la edad adulta. No obstante, se objetiva su normalización si se actúa de forma temprana sobre ellas.
El uso de la monitorización ambulatoria de la presión arterial (MAPA) resulta muy útil. A lo largo de la última década, la MAPA ha emergido como una tecnología que soluciona varias de las limitaciones de las medidas casuales de la presión arterial en la consulta. Así, la valora múltiples veces durante un período de tiempo predefinido en el ambiente normal del paciente, tanto durante los períodos de vigilia como los de sueño, con lo cual se reduce la posibilidad de las elevaciones transitorias de PA producidas por el estrés. Esto permite evaluar no sólo las elevaciones casuales durante el día sino, también, las alteraciones en el patrón circadiano de la presión arterial a lo largo de las 24 horas.
En un estudio realizado por nuestro Grupo en una muestra constituida por 58 niños y 61 niñas obesos, observamos que la prevalencia global de hipertensión medida por MAPA era del 36%. El 14% eran hipertensos sistólicos diurnos, y el 33% hipertensos sistólicos nocturnos. De estos últimos, veinticinco de ellos (64%) sólo eran hipertensos sistólicos durante la noche, y el resto, también lo eran durante el día. Sólo cuatro pacientes eran hipertensos sistólicos diurnos de manera aislada. Ningún paciente presentó una hipertensión diastólica aislada diurna o nocturna. En el 47% del total de pacientes no se producía el descenso nocturno esperado de la PA sistólica. Esta pérdida del patrón circadiano de la PA dependía tanto del grado de obesidad como de la resistencia a la insulina (HOMA)(16).
Enfermedad de Gitelman
Los estudios de biología molecular han permitido distinguir claramente el síndrome de Bartter de una enfermedad con características similares, descrita en 1966 por Gitelman, Graham y Welt. Estos autores publicaron los datos clínicos de tres pacientes adultos, dos de ellos hermanos, afectos de hipopotasemia, hipomagnesemia y alcalosis metabólica. Durante muchos años, los pacientes con estas características fueron diagnosticados erróneamente de síndrome de Bartter. La presencia de hiperreninismo e hiperaldosteronismo, contribuyó a la confusión con el síndrome de Bartter clásico.
A finales de los años 80, la enfermedad de Gitelman o Hipomagnesemia-Hipopotasemia Familiar se identificó como una entidad distinta que se distinguía del síndrome de Bartter por la presencia de hipocalciuria, una capacidad de concentración renal prácticamente normal, una morfología glomerular renal normal en la biopsia renal y, a menudo, una sintomatología menos llamativa. El inicio de la clínica suele aparecer en la adolescencia, generalmente, con síntomas neuromusculares leves(17). El espectro de manifestaciones, no obstante, es amplio. Así, puede ser asintomática o expresarse con síntomas leves y, a veces, intermitentes (debilidad muscular, calambres, fatiga, poliuria, nicturia o dolor articular) o con síntomas más graves (tetania, convulsiones). Frecuentemente, ocurren parestesias, especialmente en la cara. La avidez por la sal es frecuente y los valores de presión arterial son más bajos que en la población general. El crecimiento no suele verse afectado, aunque se ha descrito fallo de medro y talla baja en una minoría de casos. La hipomagnesemia y la hipopotasemia prolongan la repolarización ventricular que predispone a que surjan arritmias graves. Por ello, los individuos con enfermedad de Gitelman deben evitar los deportes de competición dado que en pacientes con QT prolongado, la muerte súbita es precipitada por la actividad física. Algunos pacientes pueden tener únicamente síntomas en la edad adulta relacionados con la condrocalcinosis que causa hinchazón, calor local y sensibilidad incrementada en las articulaciones afectadas.
En pacientes con enfermedad de Gitelman la observación tanto, de que las anomalías electrolíticas se asemejaban a los efectos producidos por la administración crónica de tiazidas, como los resultados obtenidos en los estudios de aclaramientos, apuntaron a que el defecto tubular debía residir en el transporte distal de sodio y cloro sensible a tiazidas. En efecto, en 1996, se estableció que la enfermedad de Gitelman es producida por una reducción en el transporte de ClNa en el túbulo contorneado distal debido a la existencia de mutaciones en el gen SLC12A3 que codifica el cotransportador de ClNa sensible a tiazidas [renal thiazide-sensitive Na+-Cl− cotransporter NCC, thiazide sensitive contransporter, NCC], que se localiza en el lado luminal de las células del túbulo contorneado distal(18) (Figura 4).
En fisiología, Na+ y Cl– pasan desde la luz tubular al interior de la célula mediante el cotransportador de ClNa sensible a tiazidas, NCC. Mutaciones en el gen que codifica esa proteína causan la enfermedad de Gitelman. El Na+ sale de la célula mediante la Na+,K+,ATPasa. El Cl– sale de la célula mediante la acción del canal de cloro ClC-Kb. En la enfermedad de Gitelman, el descenso de actividad del cotransportador de ClNa NCC afecta el potencial de membrana necesario para la reabsorción apical de magnesio por parte del canal epitelial de magnesio TRPM6, que se localiza en la membrana apical del túbulo contorneado distal y en el borde en cepillo del duodeno. La hipomagnesemia de la enfermedad está causada, por tanto, por una pérdida urinaria e intestinal de magnesio. El mecanismo de la hipocalciuria observado en la enfermedad de Gitelman debe ser el mismo que ocurre con el uso de tiazidas. En ambos casos, el bajo contenido intracelular de sodio que se produce en las células del túbulo distal debido a la pérdida salina, favorece la salida de calcio de la célula y la entrada de sodio mediante la activación del intercambiador Na+/Ca++ basolateral, motivo por el que se reduce la calciuria. Al disminuir los niveles intracelulares de Ca++, difunde una mayor cantidad del ión hacia el interior de la célula por medio del canal catiónico selectivo de calcio apical TRPV5 (transient receptor potential cation channel subfamily V member 5; conocido anteriormente como epithelial Ca++ channel o ECaC1).
En 1996, se estableció que la enfermedad de Gitelman es producida por una reducción en el transporte de ClNa en el túbulo contorneado distal debido a la existencia de mutaciones en el gen SLC12A3 que codifica el cotransportador de ClNa sensible a tiazidas
Como en el síndrome de Bartter, el defecto de reabsorción de Na+ y Cl– en el túbulo contorneado distal determina una depleción de volumen moderada que estimula el sistema renina-angiotensina-aldosterona, favoreciendo de este modo la reabsorción de Na+ y la eliminación de K+ e H+ en los ductos colectores, dando lugar a la aparición de hipopotasemia y alcalosis metabólica. La contracción de volumen origina, además, un incremento en la reabsorción de bicarbonato en el túbulo proximal, lo que mantiene la alcalosis. La hipopotasemia se mantiene debido a la entrada de potasio en las células para equilibrar la salida de H+ de las mismas destinada, a su vez, a intentar equilibrar la alcalosis.
En todo caso, la pérdida salina es menor que el síndrome de Bartter, con lo que los niveles de renina y aldosterona no están tan elevados como en éste último (Figura 4).
Los pacientes muestran una respuesta natriurética anulada tras la administración de tiazidas. En cambio, la respuesta a la furosemida está conservada. El tratamiento consiste en la administración de sales de magnesio. La hipopotasemia se trata con el uso simultáneo de ClK y amiloride.
Malformaciones congénitas con pérdida de parénquima renal
Muchas malformaciones renales cursan con pérdida de parénquima, es decir, el número de nefronas es congénitamente reducido. Ejemplo de ellos son, por ejemplo, la agenesia renal unilateral, la displasia renal multiquistica, la hipoplasia e hipodisplasia renales, el reflujo vesicoureteral y la estenosis pieloureteral.
Para las formas más graves y más precoces de enfermedad renal, la mayor probabilidad de progresión a insuficiencia renal es en el primer año de vida, a los 5-6 años, o después del crecimiento acelerado en la adolescencia. Siendo estos dos tiempos de crecimiento global acelerado, esta observación ha llevado a algunos investigadores a proponer que el crecimiento somático en ausencia de crecimiento renal paralelo es la causa de dicha progresión a insuficiencia renal(19). Este hallazgo puede atribuirse a un cambio en la masa de nefronas disponible por unidad de peso corporal. Según el número de nefronas ausentes, la reducción del filtrado glomerular renal es más o menos marcado.
Para las formas más graves y más precoces de enfermedad renal, la mayor probabilidad de progresión a insuficiencia renal es en el primer año de vida, a los 5-6 años, o después del crecimiento acelerado en la adolescencia
La reducción de la masa renal bien es un factor de riesgo de desarrollo de enfermedad renal progresiva(20). Según la teoría de la hiperfiltración, la reducción de la masa nefrónica acarrea una sobrecarga funcional de las nefronas restantes que se verán sometidas a un estado permanente de hiperfiltración en un intento de mantener la función renal. Estos cambios inicialmente beneficiosos pueden condicionar a la larga un deterioro de la función renal. Los primeros datos sobre las lesiones escleróticas renales secundarias a la disminución de la masa renal fueron aportados por el estudio de modelos animales experimentales. Posteriormente, fueron descritas en humanos(21).
El bloqueo del SRA reduce la presión capilar glomerular e interfiere en los procesos inflamatorios y de fibrogénesis renales mediados por la angiotensina II (AII), obteniendo un efecto antiproteinúrico y renoprotector añadido a la acción antihipertensiva. Estudios experimentales recientes apuntan, además, a su acción reguladora de la función podocitaria(20). Los inhibidores de la enzima de conversión de la angiotensina (IECA) han demostrado influir favorablemente en la evolución del daño renal en animales de experimentación y humanos. Estos fármacos inhiben la ECA impidiendo la conversión de la angiotensina I a AII. Sin embargo, el bloqueo del SRA no es completo, ya que existen otras vías capaces de generar AII no dependientes de esta enzima. Los antagonistas de los receptores de la angiotensina AII (ARA) bloquean competitivamente el receptor AT-1 de la AII anulando completamente la acción mediada por este receptor. Además favorecen la unión de la AII circulante a los receptores AT-2 obteniendo un efecto vasodilatador y antiproliferativo.
Otras medidas destinadas a intentar reducir el ritmo de progresión del daño renal son el control de peso, de la hiperlipemia y de la presión arterial y una dieta reducida en proteínas.
Glomerulopatias
Las enfermedades glomerulares que con una mayor frecuencia precisan una biopsia renal en la adolescencia son las tres glomerulopatias que se mencionan a continuación.
Nefropatía IgA
Se trata de la glomerulonefritis primaria más prevalente en el mundo. Puede presentarse a cualquier edad, pero es más frecuente en la segunda y tercera década de la vida y en varones. No se conoce exactamente la patogénesis de la enfermedad pero se trata de una glomerulonefritis mediada por complejos inmunes o polímeros de IgA, los cuales se depositan a nivel del mesangio(22). Hay que tener en cuenta que un porcentaje sano de la población (3-16%) puede presentar depósitos mesangiales de IgA y, por tanto, los depósitos no inducen directamente el daño glomerular por lo que puede existir una cohorte grande de nefropatía IgA latente no diagnosticada en la población general. Además, se han documentado también depósitos de IgA en otras formas de glomerulonefritis (púrpura de Shönlein-Henoch, nefritis lúpica…). Existen casos familiares y esporádicos, teniendo estos últimos mejor pronóstico. No se ha logrado identificar el gen causal aunque sí algunos relacionados con una mayor susceptibilidad a padecer la enfermedad.
La nefropatía IgA es la forma más frecuente de glomerulonefritis. Cursa con episodios recurrentes de hematuria macroscópica, generalmente, 2-3 días después de padecer una infección respiratoria vírica o bacteriana (a diferencia de la glomerulonefritis aguda postinfecciosa que será habitualmente de 3 a 4 semanas después). Se puede acompañar de febrícula y/o dolor lumbar. Otra forma de presentación puede ser en forma de hematuria microscópica y proteinuria leve, detectándose en exámenes de orina rutinarios. Solo un porcentaje pequeño de pacientes puede debutar como un síndrome nefrótico o un síndrome nefrítico agudo con hematuria, hipertensión, edemas y daño renal agudo. Los factores clínicos de progresión de la enfermedad son el aumento de la creatinina, la hipertensión arterial y la proteinuria moderada persistente. Existen casos descritos de remisión espontánea, sobre todo en niños.
La nefropatía IgA es la forma más frecuente de glomerulonefritis. Cursa con episodios recurrentes de hematuria macroscópica, generalmente, 2-3 días después de padecer una infección respiratoria vírica o bacteriana (a diferencia de la glomerulonefritis aguda postin-fecciosa que será habitualmente de 3 a 4 semanas después)
El diagnóstico de esta enfermedad se sospechará por la clínica. A nivel analítico puede existir un aumento de los niveles séricos de IgA en un 8-15% de los niños y 30-50% de los adultos. Presentarán también un C3 y ASLO normal que se deberán solicitar para realizar el diagnóstico diferencial con otras entidades. La creatinina sérica se tiene que monitorizar, así como cuantificar la proteinuria, que es un indicador de progresión de la enfermedad. Finalmente, será la biopsia renal la que confirme el diagnóstico(23). Sin embargo, no se va a realizar de forma sistemática en todos los casos, se priorizará para aquellos con un síndrome nefrítico con proteinuria en rango nefrótico, una disminución progresiva de la función renal o proteinuria moderada persistente. Existen algunas enfermedades relacionadas con la nefropatía IgA como la cirrosis, la enfermedad celiaca y el VIH.
No existe un tratamiento curativo. En caso de proteinuria mantenida y creciente se utilizarán los IECAs- ARAII y, en el caso de progresión de la enfermedad, se podrán utilizar corticoides e inmunosupresores. En la insuficiencia renal terminal el tratamiento de elección será el trasplante renal.
La recurrencia postrasplante existe aunque la incidencia es baja (mayor si el trasplante es de donante vivo relacionado). Inicialmente se consideró una entidad benigna, pero el posterior seguimiento a largo plazo de los pacientes puso de manifiesto que entre un 20-50% de los adultos evolucionan a insuficiencia renal terminal.
Lupus eritematosos sistémico
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune multisistémica compleja que cursa en brotes y que resulta de la interacción de factores ambientales, hormonales y genéticos. La presentación en la edad pediátrica tiene una incidencia del 15-20% del total de pacientes. La edad promedio de presentación es los 12 años; es más prevalente en mujeres y más grave que cuando se inicia en la edad adulta, con mayor afectación renal (60-80%), lo que determina el pronóstico.
La clínica es variable e impredecible. Se considera “la gran imitadora” dado que puede afectar a cualquier sistema (manifestaciones mucocutáneas, musculoesqueléticas, hematológicas, cardiovasculares, neuropsiquiátricas, oculares, etc). Es importante el conocimiento de esta enfermedad para poder sospecharla en una fase temprana.
Se considera “la gran imitadora” dado que puede afectar a cualquier sistema (manifestaciones mucocutáneas, musculoesqueléticas, hematológicas, cardiovasculares, neuropsiquiátricas, oculares, etc)
Ninguna prueba, por si misma, es diagnóstica de lupus. Individuos con autoanticuerpos positivos (ANA, anti-DNA) pueden estar sanos o bien presentar otras enfermedades diferentes al lupus. Existen unos criterios de clasificación según el Colegio Americano de Reumatología que constan de 11 apartados teniendo que poseer, al menos, cuatro criterios clínicos y/o de laboratorio para diagnosticar LES. Sin embargo, un paciente puede tardar años en cumplir dichos criterios. La afectación renal se debe estudiar en todos los pacientes con LES(24). Se deben evaluar proteinuria, sedimento urinario y función renal. En caso de afectación es preciso realizar una biopsia renal para clasificar la nefritis lúpica. Los datos clínicos y analíticos habituales no pueden predecir los hallazgos histológicos en un alto porcentaje de los casos. El diagnóstico anatomopatológico es clave para establecer el pronóstico y planificar el tratamiento. La OMS elaboró una clasificación en la que se describen seis formas anatomopatológicas de afectación renal.
El tratamiento será individualizado según las manifestaciones clínicas y la histología renal. El objetivo es preservar la función renal y prevenir la aparición de brotes. Los tratamientos incluyen corticoides, inmunosupresores, hidroxicloroquina (previene los brotes y aumenta la supervivencia a largo plazo), ARA II, AAS, calcio y vitamina D, estatinas, hipotensores y AINES, así como medidas preventivas como protección solar, pérdida de peso, ejercicio físico y evitar el tabaco y el estrés.
El pronóstico de los niños y adolescentes que reciben un tratamiento adecuado es generalmente bueno. El tratamiento temprano y agresivo en pacientes con síntomas severos se asocia a un curso favorable de la enfermedad. El factor pronóstico fundamental es la lesión histológica responsable. Las clases III y IV de nefropatía lúpica evolucionan a enfermedad renal crónica en un 25-40%.
Síndrome nefrótico
El síndrome nefrótico (SN) es la manifestación clínica de las alteraciones bioquímicas producidas por una lesión glomerular, concretamente del podocito (podocitopatía), que origina una alteración de la permeabilidad de la pared capilar glomerular y retención de sodio, dando origen a las características que lo definen: proteinuria mayor de 40 mg/m2/hora (50 mg/Kg/día), albuminemia inferior a 2.5 g/dl y edemas. Secundariamente, y por pérdida de otras proteínas además de la albúmina, asociará otras alteraciones como la dislipemia, la hipercoagulabilidad con tendencia a fenómenos tromboembólicos y la susceptibilidad a infecciones.
La etiología es desconocida. Se conoce que están involucrados mecanismos inmunológicos (alteraciones de los linfocitos T, B y factores de permeabilidad vascular) o genéticos (mutaciones en los genes de las proteínas podocitarias) de forma independiente o multifactorial. Es una entidad homogénea en su expresión clínica pero heterogénea en cuanto a su curso evolutivo, respuesta al tratamiento, pronóstico e histología renal. Este amplio espectro refleja los diferentes mecanismos moleculares implicados en la patogenia de la enfermedad(25).
El SN más frecuente es el denominado “idiopático” en el que la edad de aparición más habitual es entre los dos y los ocho años con una máxima incidencia entre los tres y los cinco años. Otros tipos de SN son el congénito (el producido en menores de un año de edad), SN genético aislado (habitualmente síndromes nefróticos corticorresistentes, con edad de presentación más tardía y con biopsias compatibles con glomeruloesclerosis segmentaria y focal) o sindrómico (asociado a síndromes) y SN secundarios a otras patologías específicas. Esta clasificación está sufriendo modificaciones debido a que se ha objetivado que existen mutaciones genéticas en la mayoría de los SN congénitos y familiares y en el 10-20 % de los SN resistentes esporádicos. En caso de un debut más tardío de la enfermedad, como es en la adolescencia, habrá que sospechar un SN de origen genético. Las mutaciones más frecuentes encontradas a esta edad se encuentran en los genes NPHS2 (autosómica recesiva y casos esporádicos), INF2 y TRPC6 (autosómica dominante)(26). Estos mismos genes, además de otros, están relacionados con la glomeruloesclerosis segmentaria y focal, que es muy probable que desarrollen estos pacientes durante su evolución.
Por otro lado, la clasificación clínica del SN se establece en función de la respuesta al tratamiento con corticoides: síndrome nefrótico corticosensible (resolución clínica y analítica), corticodependiente (más de dos recaídas al disminuir la dosis de corticoides o tras dos semanas después de la suspensión) y síndrome nefrótico corticorresistente (persiste el SN clínico y/o bioquímico a pesar de tratamiento durante 4-6 semanas). Estas clasificaciones tienen un gran valor pronóstico y condicionarán la indicación de un posible tratamiento inmunosupresor.
La histología más frecuente en las biopsias son lesiones mínimas o riñón ópticamente normal, glomeruloesclerosis segmentaria focal (GESF) y glomerulonefritis proliferativa mesangial. Las dos últimas presentan peor respuesta y pronóstico a largo plazo. La indicación para la realización de una biopsia renal en esta entidad es: edad de debut por debajo de los 12 meses de edad, SN con inicio de enfermedad en la adolescencia, SN de carácter familiar, resistencia a corticoides, deterioro del filtrado glomerular o signos de SN secundario a una enfermedad sistémica o infecciosa y cambio desfavorable de la respuesta al tratamiento con corticoides como la evolución de corticosensibilidad/dependencia a corticorresistencia.
El tratamiento inicial son los corticoides y la respuesta a los mismos y la evolución determinarán la necesidad de una terapia alternativa con inmunosupresores como ciclofosfamida, ciclosporina, micofenolato, tacrolimus y, en los últimos años, también rituximab. La mayoría de los niños con SN idiopático responde al tratamiento pero alrededor del 20% son corticorresistentes. Más de dos tercios presenta recaídas de la enfermedad en los primeros dos meses y hasta el 60% tienen dependencia de los corticoides. Se considera enfermedad en remisión completa tras 7-10 años sin recaídas. La mayoría de los niños con SN corticonsensible e histología de cambios mínimos alcanzan la edad adulta en remisión completa. Sin embargo, hasta en una cuarta parte puede persistir la actividad después de los 18 años y hasta un 40% puede presentar alguna recaída en la edad adulta. La mayoría de los niños que recaen continúan siendo corticosensibles y mantienen una función renal normal. Por contra, el síndrome nefrótico corticorresistente está asociado en un 30-50 % a una evolución a enfermedad renal terminal en cinco años, si no se logra controlar.
La microscopía óptica no mostró alteraciones y en la inmunofluorescencia directa se observaron muy discretos depósitos granulares de IgM sin depósitos de IgG, IgA, C3, C1q o fibrinógeno. En la microscopía electrónica se confirmó una fusión de pedicelos (podocitopatía). En este paciente, aunque inicialmente la biopsia se trate de lesiones mínimas, lo más probable es que durante su evolución desarrolle una glomeruloesclerosis segmentaria y focal.
Tablas y figuras
Tabla I. Infecciones del tracto urinario
|
Microorganismos |
Menos frecuentes |
Raros |
|
|
Cistitis aguda |
E. coli |
Proteus Klebsiella S. saprophyticus |
Enterococo, Pseudomona, Corynebacterium urealyticum, Morganella, Citrobacter, Enterobacter, Serratia, Salmonella, Shigella |
|
Pielonefritis aguda |
E. coli Proteus |
Klebsiella, Morganella, Citrobacter, Enterobacter, Serratia, Pseudomona, Enterococo |
S. aureus, |
Modificada de González Monte E. Infecciones del tracto urinario. Lorenzo V, López Gómez JM, eds. Nefrología al día. Actualizado en junio de 2018.
Tabla II. Cistitis aguda en niños mayores y adolescentes
|
Hallazgo patológico |
S (%) |
E (%) |
VPP/VPN (%) |
|
|
Tira reactiva |
Esterasa leucocitaria + Nitritos + Esterasa leucocitaria y nitritos + |
85 50 72 |
78 98 96 |
45/89 97/90 53/93 |
|
Sedimento urinario |
>10 leucocitos/ campo en orina no centrifugada ó |
73 |
81 |
Modificada de Caballero García M, López Lledó S. Cistitis aguda en niños mayores y adolescentes Guía-ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico (v.1/2011).
Figura 1. Imagen ecográfica de un cálculo ubicado en la unión vesicoureteral
Figura 2. Litiasis fosfática infecciosa
(Fosfato amónico magnésico o estruvita)
La infección bacteriana prolongada del tracto urinario suele ser la causa más común de este tipo de litiasis. Los gérmenes ureolíticos (Proteus, Klebsiella, Pseudomona, Ureaplasma…) suelen provocar una notable elevación del pH urinario (pH> 7) y de la concentración urinaria de amonio, que conjuntamente favorecen la precipitación de fosfato amónico magnésico y de hidroxiapatita (fosfato de calcio). Detalle de un cristal de estruvita en cuyas caras se observan las marcas en “Y” que permiten su rápida identificación junto pequeñas zonas de esferulitos de hidroxiapatita (cortesía del Dr. Félix Grases. Laboratorio de Investigación en Litiasis Renal, Instituto Universitario de Investigación en Ciencias de la Salud, Universidad de las Islas Baleares, Palma de Mallorca, España).
Figura 3. Vista general y detalle al microscopio electrónico de barrido del interior del “cálculo” de carbonato cálcico
Paciente que a los 14 años expulsó tres cálculos. En el estudio metabólico se observó hipocitraturia. Vista general y detalle al microscopio electrónico de barrido del interior del “cálculo” de carbonato cálcico. La estructura no se corresponde con la típica de un cálculo renal con una morfología correspondiente a una estructura de origen vegetal, por lo que podría tratarse de una semilla (Dr. Grases).
Figura 4. Mecanismos de transporte en el túbulo contorneado distal
En fisiología, Na+ y Cl– pasan desde la luz tubular al interior de la célula mediante el cotransportador de ClNa sensible a tiazidas, NCC. Mutaciones en el gen que codifica esa proteína causan la enfermedad de Gitelman. El Na+ sale de la célula mediante la Na+,K+,ATPasa. El Cl– sale de la célula mediante la acción del canal de cloro ClC-Kb. En la enfermedad de Gitelman, el descenso de actividad del cotransportador de ClNa NCC afecta el potencial de membrana necesario para la reabsorción apical de magnesio por parte del canal epitelial de magnesio TRPM6, que se localiza en la membrana apical del túbulo contorneado distal y en el borde en cepillo del duodeno. La hipomagnesemia de la enfermedad está causada, por tanto, por una pérdida urinaria e intestinal de magnesio. El mecanismo de la hipocalciuria observado en la enfermedad de Gitelman debe ser el mismo que ocurre con el uso de tiazidas. En ambos casos, el bajo contenido intracelular de sodio que se produce en las células del túbulo distal debido a la pérdida salina, favorece la salida de calcio de la célula y la entrada de sodio mediante la activación del intercambiador Na+/Ca++ basolateral, motivo por el que se reduce la calciuria. Al disminuir los niveles intracelulares de Ca++, difunde una mayor cantidad del ión hacia el interior de la célula por medio del canal catiónico selectivo de calcio apical TRPV5 (transient receptor potential cation channel subfamily V member 5; conocido anteriormente como epithelial Ca++ channel o ECaC1).
Figura 5. Biopsia renal de un paciente adolescente con un síndrome nefrótico corticorresistente
La microscopía óptica no mostró alteraciones y en la inmunofluorescencia directa se observaron muy discretos depósitos granulares de IgM sin depósitos de IgG, IgA, C3, C1q o fibrinógeno. En la microscopía electrónica se confirmó una fusión de pedicelos (podocitopatía). En este paciente, aunque inicialmente la biopsia se trate de lesiones mínimas, lo más probable es que durante su evolución desarrolle una glomeruloesclerosis segmentaria y focal.
Bibliografía
1. Shaikh N, Craig J, Rovers M, Da Dalt L, Gardikis S, Hoberman A et al. Identification of children and adolescents at risk for renal scarring after a first urinary tract infection. JAMA Pediatrics 2014; 168:893-900.
2. Pailhoriès H, Cassisa V, Chenouard R, Kempf M, Eveillard M, Lemarié C. Staphylococcus saprophyticus: Which beta-lactam? Int J Infect Dis 2017; 65:63-66.
3. Keating GM. Fosfomycin trometamol: a review of its use as a single-dose oral treatment for patients with acute lower urinary tract infections and pregnant women with asymptomatic bacteriuria. Drugs 2013; 73:1951-1966.
4. Molina Gil-Bermejo J, Cabello V, Campoy Martínez P, Barrera Chacón J. Cistitis y pielonefritis aguda. Guías para el diagnóstico y tratamiento de las enfermedades infecciosas. Hospital Universitario Virgen del Rocío, 2018.
5. Arias Vega R, Pérula de Torres LA, Jiménez García C, Carrasco Valiente J, Requena Tapia MJ, Cano Castiñeira R et al. Comorbidity and socio-demographic factors associated with renal lithiasis in persons aged 40 to 65: A cross-sectional study. Med Clin (Barc) 2017; 149:383-390.
6. Grases Freixedas F, Costa-Bauzá A. Mecanismos de la formación de los cálculos renales. En: Nefrología Pediátrica (2ª ed.). García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B, eds. Madrid: Aula Médica 2006, pp. 917-92.
7. García Nieto VM, Pérez Bastida XI, Salvador Cañibano M, García Rodríguez VE, Monge Zamorano M, Luis Yanes MI. Quantification of the risk of urinary calcium stone formation in the urine collected at 2 times of the day in a group of children studied to rule out prelithiasis. Nefrología 2018; 38:267-272.
8. Moore ES. Hypercalciuria in children. Contr Nephrol (Vol. 27). Basel:Karger 1981; 20-32.
9. Diabetes Control and Complications Trial/epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group, Nathan DM, Zinman B, Cleary PA, Backlund JY, Genuth S, Miller R et al.. Modern-day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pitssburgh epidemiology of diabetes complications experience (1983-2005). Arch Intern Med 2009; 169:1307-1316.
10. Lurbe E, Redon J, Kesani A, Pascual JM, Tacons J, Alvarez V et al. Increase in nocturnal blood pressure and progression to microalbuminuria in type 1 diabetes. N Engl J Med 2002; 347:797-805.
11. Commissariat PV, Volkening LK, Guo Z, ElBach JL, Butler DA, Laffel LM. Associations between major life events and adherence, glycemic control, and psychosocial characteristics in teens with type 1 diabetes. Pediatr Diabetes 2018; 19:85-91.
12. Perkins BA, Ficociello LH, Kristen HS, Finkelstein DM, Warram JH, Krowlewski AS. Regression of microalbuminuria in type 1 diabetes. N Engl J Med 2003; 348:2285-2293.
13. Goldstein IB, Shapiro D, Weiss RE. How family history and risk factors for hypertension relate to ambulatory blood pressure in healthy adults. J Hypertens 2008; 26:276-283.
14. Primatesta P, Falaschetti E, Poulter NR. Birth weight and blood pressure in childhood: results from the Health Survey for England. Hypertension 2005; 45:75-79.
15. Woo KS, Chook P, Yu CW, Sung RY, Qiao M, Leung SS et al. Overweight in children is associated with arterial endothelial dysfunction and intima-media thickening. Int J Obesity 2004; 28:852-857.
16. Ruiz Pons M, García Nieto V, González García M, García Mérida M, Valenzuela Hernández C, Aguirre-Jaime A. Reduced nocturnal systolic blood pressure dip in obese children. Nefrología 2008; 28:517-524.
17. Naesens M, Steels P, Verberckmoes R, Vanrenterghem Y, Kuypers D. Bartter’s and Gitelman’s syndromes: from gene to clinic. Nephron Physiol 2004; 96:65-78.
18. Simon DB, Nelson-Williams C, Bia MJ, Ellison D, Karet FE, Molina AM et al. Gitelman’s variant of Bartter’s syndrome, inherited hypokalaemic alkalosis, is caused by mutations in the thiazide-sensitive Na-Cl cotransporter. Nat Genet 1996; 12:24-30.
19. Gonzalez Celedón C, Bitsori M, Tullus K. Progression of chronic renal failure in children with dysplastic kidneys. Pediatr Nephrol 2007; 7:1014-1020.
20. Brenner BM, Mackenzie HS. Nephron mass as a risk factor for progression of renal disease. Kidney Int 1997; S63:S124-S127.
21. Reiser J, Gersdorff G, Simons M, Schwarz K, Faul C, Giardino L, Heider T, Loos M, Mundel P. Novel concepts in understanding and management of glomerular proteinuria. Nephrol Dial Transplant 2002; 17:951-955.
22. Pillai U, Balabhadraputani K, Bhat Z. Immunoglobulin A nephropathy: A review of current literature on emerging pathophysiology. Am J Med Sci 2014; 347:249-253.
23. Coppo R. Clinical and histological risk factors for progression of IgA nephropathy: an update in children, young and adult patients. J Nephrol 2017; 30:339-346.
24. Ruiz Irastorza G, Espinosa G, Frutos MA, Jiménez Alonso J, Praga M, Pallarés L et al. Diagnóstico y tratamiento de la nefritis lúpica. Documento de consenso del Grupo de Enfermedades Autoinmunes Sistémicas (GEAS) de la Sociedad Española de Medicina Interna (SEMI) y de la Sociedad Española de Nefrología (SEN). Nefrología 2012; 32:1-35.
25. Wang CS, Greenbaum LA. Nephrotic syndrome. Pediatr Clin North Am 2019; 66:73-85.
26. Santin S, Bullich G, Tazón-Vega B, García-Maset R, Giménez I, Silva I. Clinical utility of genetic testing in children and adults with steroid-resistant nephrotic syndrome. Clin J Am Soc Nephrol 2011; 6:1139-1148.
Talla baja. Pequeño para la edad gestacional: hipocrecimiento y alteraciones metabólicas
Talla baja. Pequeño para la edad gestacional: hipocrecimiento y alteraciones metabólicas
M.T. Muñoz Calvo.
Servicio de Endocrinología. Hospital Infantil Universitario Niño Jesús. Departamento de Pediatría. Universidad Autónoma. Madrid.
Adolescere 2015; III (2): 36-45
Resumen
|
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético. El patrón de crecimiento de los Recién Nacidos Pequeños para la Edad gestacional (RNPEG) suele ser bastante característico. El 80-90% experimentan un crecimiento de recuperación, parcial o total, durante el primer o segundo año de vida y alcanzan una talla dentro de la normalidad (entre ± 2 SDS). Desde el punto de vista etiopatogénico, una tercera parte de los RNPEG se deberían a factores fetales (cromosomopatías, anomalías congénitas y síndromes dismórficos) y las otras dos terceras partes a factores maternos (malnutrición, infecciones, tóxicos…) y uterino-placentarios (malformaciones uterinas, arteria umbilical única…); no obstante, hasta en un 40 % de los casos no se identifica ninguna causa patológica. Los RNPEG, en particular si se ha seguido de un rápido incremento del peso en los primeros meses de vida, se asocia a un mayor riesgo de resistencia a la insulina, diabetes mellitus tipo 2, hipertensión arterial y aterosclerosis en la vida adulta. Es posible que estas alteraciones metabólicas adaptativas sean las responsables de una especie de “impronta metabólica” que condicionaría en la edad adulta la mayor frecuencia observada de desarrollo del SM, con el consiguiente incremento de enfermedades cardiovasculares. Palabras clave: Hipocrecimiento; Resistencia a la insulina; Diabetes; Dislipemia; Obesidad. |
Abstract
|
Antenatal growth failure is usually the result of an assault to the fetal environment or a genetic defect. The growth pattern of these small for gestational age newborns (SGA) is quite characteristic. 80-90% of them experience catch-up growth, either partial or total, during the first or second year of life reaching a height within the normal range (± 2 SDS). From the etiopathogenesis point of view, a third of SGA newborns are caused by fetal factors (chromosomal abnormalities, congenital anomalies and dysmorphic syndromes) and two thirds to maternal factors (malnutrition, infection, toxics…) and uterine-placental factors (uterine malformations, single umbilical artery…); however, in up to 40% of the cases no pathological cause is identified. SGA newborns, especially those that experience a rapid weight gain in the first months of life, associate an increased risk of insulin resistance, type 2 diabetes mellitus, hypertension and atherosclerosis in adulthood. It is possible that these adaptive metabolic processes are responsible for a “metabolic imprinting” that would condition the frequently observed development of adult metabolic syndrome, with its subsequent increase of cardiovascular disease. Key words: Growth failure; Insulin resistance; Diabetes; Dyslipidemia; Obesity. |
Caso clínico
Motivo de consulta: adolescente de 15 años y 4 meses, de raza caucásica, que consulta por incremento de peso desde hace tres años.
Antecedentes familiares: Padre sobrepeso y diabetes tipo 2 (en tratamiento con dieta e hipoglucemiantes orales), talla 175 cm, desarrollo puberal normal. Madre talla 160 cm, menarquia a los 12 años. G-A-V: 3-0-3. Talla genética: 161±5 cm.
Antecedentes Personales: embarazo controlado, RCIU desde la semana 30. Parto vaginal, inducido a la semana 36,. PRN 1700 g (-2,2 DE), LRN: 41 cm (-2,7 DE). PC: 31,5 cm (-1,9 DE). Periodo neonatal sin incidencias. Pruebas metabólicas normales. Sin hipoglucemias ni ictericia. Desarrollo psicomotor normal. Inmunizaciones correctas. A la edad de 4 años inicia tratamiento con GH recombinante por no haber realizado el crecimiento de recuperación a los 4 años de edad, presentando un incremento del ritmo de crecimiento y un estirón puberal de aproximadamente 21 cm. No presentó en ningún momento efectos secundarios por la medicación. Talla adulta normal para la talla familiar. Menarquia 12 años y 6 meses. Ciclos menstruales regulares.
Exploración física: Edad: 15 años y 4 meses. Peso 78,500 kg (+ 3,4 DE), Talla 161 cm (P50-75), IMC: 29,4 (+3,1 DE). Perímetro de cintura: 95 cm (P>97). T.A.: 100/60 mmHg. Buen estado general. Coloración normal de piel y mucosas. Obesidad central. Estrías de distensión en abdomen y cara interna de muslos. Hirsutismo (escala de Ferriman 8). Acantosis en cuello. Cuello: no se palpa bocio. ACP: normal. Abdomen: blando, depresible, sin visceromegalias. Genitales femeninos normales. Tanner V (T5, P5,Ac). Resto de la exploración normal.
Estudios complementarios:
Hemograma: fórmula y recuentos normales. Bioquímica general: normal.
Lipidograma: CT 280 mg/dl (vn: 120-200), Triglicéridos: 220 mg/dl (vn: < 100), C-HDL: 35 mg/dl (vn: 35-75), C-LDL: 210 mg/dl, C-VLDL: 34 mg/dl.
Función tiroidea: TSH 4,5 mUI/ml (vn:0,5-6), T4 libre: 0,99 ng/dl (vn: 0,65-1,4).
Glucemia: 110 mg/dl (vn: 70-100).
Sobrecarga oral de glucosa: Glucemia basal: 110 mg/dl, a los 120 minutos: 188 mg/dl. Insulina basal: 38 µUI/ml, pico: 290 µUI/ml, a los 120 minutos: 180 µUI/ml HbA1c: 6,9%.
Cortisol libre en orina de 24 horas: 35 µg/24 h (vn: 30-243).
Ecografía hepática: signos de marcada esteatosis hepática.
Discusión
Hipocrecimiento
La talla y el ritmo madurativo de un sujeto concreto están determinados por una multitud de mecanismos genéticos y epigenéticos que interaccionan a lo largo de todo el proceso de crecimiento con factores ambientales intrínsecos y extrínsecos
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético.
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético. Se suele considerar a un recién nacido como RNPEG cuando su peso y/o su longitud al nacimiento se encuentran, al menos, 2 SDS por debajo de la media para su edad gestacional (≤ -2 SDS). En los países desarrollados, sólo el 4-7 % de los recién nacidos son RNPEG; sin embargo, es una de las causas más importantes de talla baja, ya que, el antecedente de RNPEG se encuentra en el 20% de los adultos con talla baja.
Desde el punto de vista etiopatogénico, una tercera parte de los RNPEG se deberían a factores fetales (cromosomopatías, anomalías congénitas y síndromes dismórficos) y las otras dos terceras partes a factores maternos (malnutrición, infecciones, tóxicos…) y uterino-placentarios (malformaciones uterinas, arteria umbilical única…); no obstante, hasta en un 40 % de los casos no se identifica ninguna causa patológica.
Se suele considerar a un recién nacido como RNPEG cuando su peso y/o su longitud al nacimiento se encuentran, al menos, 2 SDS por debajo de la media para su edad gestacional (≤ -2 SDS).
El patrón de crecimiento de los RNPEG suele ser bastante característico. El 80-90% experimentan un crecimiento de recuperación, parcial o total, durante el primer o segundo año de vida y alcanzan una talla dentro de la normalidad (entre ± 2 SDS). El 10-20 % restante mantienen la talla baja después de los 2 años y en, al menos, un 50 % de estos, la talla final será baja. La edad ósea suele estar retrasada, pese a lo cual la pubertad se inicia habitualmente a una edad normal o incluso ligeramente adelantada, corrigiéndose rápidamente el retraso en la maduración ósea y alcanzando una talla final baja, que, en la mayoría de los casos, es similar en SDS a la talla prepuberal. Cuando el RN presenta una disminución combinada del PRN y de la LRN (RNPEG armónico) el riesgo de alcanzar una talla adulta baja es mayor que cuando sólo se afecta el PRN (RNPEG disarmónico).
Cuando el RN presenta una disminución combinada del PRN y de la LRN (RNPEG armónico) el riesgo de alcanzar una talla adulta baja es mayor que cuando sólo se afecta el PRN (RNPEG disarmónico).
Alteraciones metabólicas
Los RNPEG, en particular si se ha seguido de un rápido incremento del peso en los primeros meses de vida, se asocia a un mayor riesgo de resistencia a la insulina, diabetes mellitus tipo 2, hipertensión arterial y aterosclerosis en la vida adulta. La reducción del aporte de oxígeno y nutrientes determina una respuesta adaptativa en el feto, que tiende a preservar la diferenciación y maduración de los órganos a expensas de un menor crecimiento y una menor acumulación de energía (glucógeno y grasa). Es posible que estas alteraciones metabólicas adaptativas sean las responsables de una especie de “impronta metabólica” que condicionaría en la edad adulta la mayor frecuencia observada de desarrollo del SM, con el consiguiente incremento de enfermedades cardiovasculares (figura 1).
Los criterios establecidos por la Internacional Diabetes Federation para definir el SM, especifican puntos de corte para el perímetro de la cintura propios de la población europea (y otras poblaciones). La nueva definición ha sido dividida en los siguientes grupos de edades: de 6 a 10, de 10 a 16 y ≥16 años. En la tabla 1 se exponen estos criterios diagnósticos.
Resistencia a la insulina
Uno de los principales factores implicados en el SM es la resistencia a la insulina (RI). Los valores de los índices de RI cambian a lo largo de la infancia, sobre todo en los diferentes estadios de la pubertad, ya que ésta contribuye a la insulinorresistencia. La cuantificación de la RI se puede realizar por métodos basados en la medida de los niveles de glucemia e insulina en ayunas o tras sobrecarga oral de glucosa. Es aconsejable incluir la determinación de insulinemia basal en la evaluación de los niños y adolescentes obesos, lo que a su vez permitirá el cálculo del índice HOMA (glucosa [mmol/l] x insulina [μU/ml] / 22,5), indicador de resistencia a insulina.
Es aconsejable incluir la determinación de insulinemia basal en la evaluación de los niños y adolescentes obesos, lo que a su vez permitirá el cálculo del índice HOMA (glucosa [mmol/l] x insulina [μU/ml] / 22,5), indicador de resistencia a insulina.
Diabetes mellitus tipo 2 (DM2)
Se define por: obesidad, resistencia y déficit insulínico y ausencia de autoinmunidad pancreática. Existen factores de riesgo para su desarrollo que incluyen la historia familiar de DM2, obesidad, inactividad física, rápido incremento de peso en el periodo neonatal, diabetes gestacional u obesidad materna, etnicidad, y situaciones que predisponen a la RI (pubertad y síndrome de ovario poliquístico).
El aumento de la incidencia de DM2 se ha producido de forma paralela al aumento de la frecuencia de obesidad infantil, que puede considerarse el factor de riesgo principal para su desarrollo.
Obesidad
Una vez establecida la presencia de obesidad, la mayoría de los casos son de base poligénica y secundarios a la existencia de un desequilibrio entre el ingreso y el consumo energético, pero existen otros casos secundarios a mutaciones monogénicas (principalmente del receptor de melanocortina número 4 [MC4R]), o enfermedades endocrinológicas.
El aumento de la incidencia de DM2 se ha producido de forma paralela al aumento de la frecuencia de obesidad infantil, que puede considerarse el factor de riesgo principal para su desarrollo.
En nuestro medio, la Guía de Práctica Clínica para la Prevención y Tratamiento de la Obesidad Infanto-juvenil postula como criterios para definir el sobrepeso y la obesidad los valores de los percentiles 90 y 97, respectivamente, específicos por edad y sexo de la distribución del IMC referido a los datos y curvas de Hernández y colaboradores del año 1988.
Dislipemia
La hipertrigliceridemia es la alteración más precoz en el SM, se debe al aumento de la síntesis hepática de partículas de lipoproteínas de muy baja densidad (C-VLDL) y a la alteración de su catabolismo por disminución de la actividad de la lipoproteínlipasa. Como consecuencia de estas alteraciones, se produce un aumento de las lipoproteínas ricas en triglicéridos y, por ello, de los triglicéridos plasmáticos.
Estado proinflamatorio y protrombótico
Los marcadores biológicos de la inflamación son predictores de enfermedad cardiovascular, siendo la elevación de los niveles séricos de la proteína C reactiva (PCR), la interleuquina 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α) los que presentan una mayor correlación con las alteraciones que constituyen el síndrome metabólico (Figura 1). Los niveles circulantes de adiponectina se correlacionan de forma negativa con el índice de masa corporal y con el contenido de masa grasa, en asociación con la grasa visceral.
Disfunción endotelial
Más recientemente, los métodos incruentos por la imagen han permitido el estudio del desarrollo de la aterosclerosis. Por un lado, la medición del grosor del complejo íntima-media en localizaciones estandarizadas de las arterias carótidas, como indicador de afectación vascular arteriosclerótica. Este grosor aumenta a medida que aumentan los factores de riesgo cardiovascular, y algunos autores han observado que el incremento de los niveles de LDL-C puede predecir el grosor del complejo íntima-media en jóvenes adultos. Por otro, la dilatación mediada por flujo, que permite establecer las propiedades funcionales de las arterias, incluyendo las propiedades mecánicas como la rigidez y la distensibilidad y las propiedades adaptativas como la vasodilatación en respuesta a un estímulo. Un estudio realizado en niños obesos en la arteria braquial, demostró una disminución de la distensibilidad arterial, aumento de las estrías grasas en la pared arterial, disfunción endotelial y aumento de la resistencia a la insulina cuando se compararon con niños normopeso.
Síndrome de ovario poliquístico (SOP)
Se asocia con hiperinsulinemia y resistencia a la insulina, y se acompaña con frecuencia de dislipemia, alteraciones de los marcadores de la inflamación, y aumento de la adiposidad central, siendo éstos factores de riesgo para el desarrollo de DM2 y enfermedad cardiovascular.
Esteatosis hepática
La prevalencia en niños obesos varía de un 13% a un 38%. Varios mecanismos fisiopatológicos parecen estar implicados en su patogénesis. Por un lado, la hiperinsulinemia asociada con la resistencia a la insulina, secundaria fundamentalmente adiposidad central. Por otro, el estrés oxidativo, debido a la acumulación excesiva de grasa a nivel hepático, especialmente de triglicéridos, que produce la liberación de adipocitocinas proinflamatorias que, a nivel del hepatocito causan apoptosis y necrosis por activación de la cascada inflamatoria, fundamentalmente del factor de necrosis tumoral alfa.
La GH produce un aceleramiento pronunciado del crecimiento, máximo durante el primer año de tratamiento, siendo esta respuesta el mejor predictor de crecimiento posterior. La respuesta a la GH es dosis dependiente durante los 3-4 primeros años, haciéndose menos dosis dependiente a largo plazo.
Tratamiento
Hormona de crecimiento (GH)
La GH produce un aceleramiento pronunciado del crecimiento, máximo durante el primer año de tratamiento, siendo esta respuesta el mejor predictor de crecimiento posterior. La respuesta a la GH es dosis dependiente durante los 3-4 primeros años, haciéndose menos dosis dependiente a largo plazo. El tratamiento debe mantenerse hasta que se alcance la talla final, definida como velocidad de crecimiento menor de 2 cm/año o edad ósea >14 años en las niñas y >16 años en niños, correspondiendo al cierre de las placas de crecimiento epifisarias. Los principales determinantes de respuesta a largo plazo son la edad de inicio del tratamiento (cuanto más joven mejor), la talla media de ambos padres (cuanto más alta mejor) y la talla DE al inicio del tratamiento (cuanto talla más baja mejor). Con el tratamiento con GH, el 85% de los PEG alcanzarán una talla adulta normal superior a 2 DE y un 98% alcanzarán una talla dentro de su rango de talla genética.
Con el tratamiento con GH, el 85% de los PEG alcanzarán una talla adulta normal superior a 2 DE y un 98% alcanzarán una talla dentro de su rango de talla genética.
Obesidad
Nutricional: La ingesta calórica debe ser adecuada con la suficiente actividad física, para conseguir un peso adecuado. Se deben consumir más frutas, verduras, pescados, cereales integrales y productos lácteos desnatados. Se recomienda la disminución de zumos de frutas, bebidas y alimentos edulcorados con azúcar y sal. Además, recomiendan una ingesta de ácidos grasos trans (alimentos procesados y preparados) de <1% de las calorías totales.
El ejercicio físico regular puede mejorar la sensibilidad a la insulina en un 40% y disminuir la lipogénesis. Además, mejora los niveles de C-HDL y la función endotelial.
Asimismo, los alimentos con bajo índice glucémico ayudarán a controlar la sensibilidad a la insulina y las alteraciones lipídicas, así como asegurar un aporte extra de fibra que producen mayor sensación de saciedad y que disminuye la ingesta energética.
Ejercicio físico: El ejercicio físico regular puede mejorar la sensibilidad a la insulina en un 40% y disminuir la lipogénesis. Además, mejora los niveles de C-HDL y la función endotelial.
Tratamiento conductual. Tanto el paciente como la familia deben tomar conciencia de las conductas que han conducido al exceso de peso, y deben ser capaces de introducir cambios en la alimentación y en los estilos de vida a medio y largo plazo. Se aconseja diseñar un plan de vida diario para toda la familia.
Tratamiento farmacológico. El Comité de Expertos para la Prevención y Tratamiento de la Obesidad Infantil de la Academia Americana de Pediatría plantea su uso en la adolescencia, cuando no se hayan alcanzado los objetivos de pérdida de peso con los cambios en los estilos de vida y presenten comorbilidad severa.
Disponemos de algunos fármacos, siendo aún su indicación limitada en la adolescencia. Actualmente, sólo está comercializado un fármaco con indicación aprobada para el tratamiento de la obesidad: el Orlistat en mayores de 12 años en EE.UU (agencia FDA). LA EMA, no recomienda su uso en niños o adolescentes menores de 18 años debido a la escasez de datos sobre seguridad y eficacia.
Actualmente hay numerosos ensayos clínicos dirigidos a establecer la eficacia y la seguridad de diferentes sustancias, fármacos y hormonas que participan de manera directa o indirecta en la regulación del peso corporal.
Diabetes tipo
Los pacientes sintomáticos en el momento del diagnóstico, especialmente si tienen cetosis, deben recibir tratamiento con insulina. Una vez controlada la hiperglucemia puede sustituirse progresivamente por Metformina, que es una biguanida cuya acción consiste en la disminución hepática de glucosa, incremento de la sensibilidad a la insulina, y mayor captación periférica de glucosa mediada por la insulina. Además del control glucémico, tiene el beneficio de producir una ligera pérdida de peso o al menos estabilizarlo. Aprobado a partir de los 10 años por la FDA y la Agencia Europea del Medicamento.
En los pacientes asintomáticos, cuando no son suficientes los controles glucémicos, debe iniciarse tratamiento con Metformina. Los niños y adolescentes que presenten una hiperglucemia moderada (glucemia en ayunas entre 126 y 199 mg/dl y una HBA1c <8,5%), se puede iniciar tratamiento con metformina, comenzando con dosis bajas (500 mg dos veces al día) e ir incrementando progresivamente según tolerancia (máximo 2000 mg/día) para alcanzar los objetivos glucémicos. En los casos que la metformina no consiga un control metabólico adecuado, en aquellos pacientes con hiperglucemia ≥ 200 mg/dl, HbA1c >8,5% o manifestaciones de deficiencia insulínica (cetosis o ceotoacidosis), debe iniciarse tratamiento con insulina.
La Metformina es una biguanida cuya acción consiste en la disminución hepática de glucosa, incremento de la sensibilidad a la insulina, y mayor captación periférica de glucosa mediada por la insulina. Además del control glucémico, tiene el beneficio de producir una ligera pérdida de peso o al menos estabilizarlo.
Dislipemias
Hipercolesterolemias: se recomienda el inicio del tratamiento a partir de los 10 años de edad o en varones al inicio de la pubertad (Tanner II) y en mujeres tras la primera menstruación, después de un tratamiento dietético adecuado de seis meses a un año, siempre que los niveles de C-LDL sean superiores a 190 mg/dl o a 160 mg/dl y existan antecedentes familiares de enfermedad cardiovascular o el niño tenga dos o más factores de riesgo asociados. Las estatinas deben ser incluidas entre los potenciales fármacos de primera línea por la experiencia adquirida en los últimos años y por su capacidad de disminuir los niveles de C-LDL en torno a 18-45%. Están contraindicadas en el embarazo, por lo que debe advertirse a las adolescentes y enviarlas, en caso necesario, a consejo ginecológico.
Hipercolesterole-mias: se recomienda el inicio del tratamiento a partir de los 10 años de edad o en varones al inicio de la pubertad (Tanner II) y en mujeres tras la primera menstruación, después de un tratamiento dietético adecuado de seis meses a un año, siempre que los niveles de C-LDL sean superiores a 190 mg/dl o a 160 mg/dl y existan antecedentes familiares de enfermedad cardiovascular o el niño tenga dos o más factores de riesgo asociados.
Hipertrigliceridemia: si los niveles de TG oscilan entre 200 y 499 mg/dl, se debe realizar tratamiento dietético, cambio de estilo de vida, aumento de ingesta de pescado, y valorar tratamiento con suplementos de aceite de pescado. En niños con hipertrigliceridemia primaria (TG ≥ 500mg/dl) y tras 6-12 meses de tratamiento dietético y cambio de estilo de vida, valorar tratamiento con fibratos.
Hipertensión arterial
En la fase de pre-hipertensión la recomendación es realizar cambios en los estilos de vida, principalmente si existe historia familiar de hipertensión arterial o enfermedad cardiovascular prematura, con pérdida de 1-2 kg de peso/mes. Si existieran niveles de tensión arterial superior al percentil 95, deberá iniciarse tratamiento farmacológico, siendo la primera opción terapéutica los inhibidores de la enzima convertidora de la angiotensina (IECA) o los bloqueantes de la angiotensina II (BsAT-II), siendo el objetivo reducir la morbi-mortalidad cardiovascular a largo plazo.
Tablas y figuras
Tabla 1. Síndrome metabólico: Criterios IDF (Zimmet P et al. (4)
|
6 – <10 años |
10-16 años |
>16 años |
|
|
P.C. |
≥P90 |
≥P90 |
≥90cm en varones ≥80cm en mujeres |
|
T.A. |
SD para SM |
TAS ≥130 mmHg TAD ≥85 mmHg |
TAS ≥130 mmHg TAD ≥85 mmHg |
|
Triglicéridos |
SD para SM |
≥150 mg/dl |
≥150 mg/dl |
|
C-HDL |
SD para SM |
≤40 mg/dl |
≤40 mg/dl |
|
Glucemia ayunas |
SD para SM |
≥100 mg/dl |
≥100 mg/dl |
SD: Sin definición,
PC= perímetro de cintura,
TA= tensión arterial,
C-HDL= lipoproteínas de alta densidad.
Figura 1. Mecanismos de influencia de la obesidad sobre la enfermedad cardiovascular y la diabetes tipo 2
Bibliografía
1. Ota E, Ganchimeg T, Morisaki N, Vogel JP, Pileggi C, Ortiz-Panozo E, Souza JP, Mori R; WHO Multi-Country Survey on Maternal and Newborn Health Research Network. Risk factors and adverse perinatal outcomes among term and preterm infants born small-for-gestational-age: secondary analyses of the WHO Multi-Country Survey on Maternal and Newborn Health. PLoS One. 2014 Aug 13;9(8):e105155.
2. Argente J, Mehls O, Barrios V. Growth and body composition in very young SGA children. Pediatr Nephrol. 2010; 25(4):679-85.
3. Saggese G, Fanos M, Simi F. SGA children: auxological and metabolic outcomes – the role of GH treatment. J Matern Fetal Neonatal Med. 2013; 26 Suppl 2:64-7.
4. Güemes Hidalgo M1, Fernández de Larrea Baz N, Muñoz Calvo MT, Argente J. Response to 3 years of growth hormone therapy in small for gestational age children: clinical, hormonal and metabolic parameters. An Pediatr (Barc). 2013;78:288-96.
5. Ojha S, Saroha V, Symonds ME, Budge H. Excess nutrient supply in early life and its later metabolic consequences. Clin Exp Pharmacol Physiol. 2013;40(11):817-23.
6. Zimmet P, Alberti KG, Kaufman F, Tajima N, Silink M, Arslanian S et al. The metabolic syndrome in children and adolescents – an IDF consensus report. Ped Diabetes. 2007; 8: 299-306.
7. Reinehr T. Type 2 diabetes mellitus in children and adolescents. World J Diabetes. 2013; 4: 270-281.
8. D’Adamo E, Santoro N, Caprio S. Metabolic syndrome in pediatrics: old concepts revised, new concepts discussed. Curr Probl Pediatr Adolesc Health Care. 2013; 43: 114-23.
9. Levy-Marchal C, Arslanian S, Cutfield W, Sinaiko A, Druet C, Marcovecchio ML, Chiarelli F; ESPE-LWPES-ISPAD-APPES-APEG-SLEP-JSPE Insulin Resistance in Children Consensus Conference Group. Insulin resistance in children: consensus, perspective, and future directions. J Clin Endocrinol Metab. 2010; 95: 5189-98.
10. Moreno LA. Obesity in children and adolescents. A critical review. Endocrinol Nutr. 2013; 60 Suppl 1: 7-9.
11. Grupo de trabajo de la guía sobre la prevención y el tratamiento de la obesidad infantojuvenil. Centro Cochrane Iberoamericano, coordinador. Guía de práctica clínica sobre la prevención y el tratamiento de la obesidad infantojuvenil. Madrid: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social.Agència d´Avaluació de Tecnologia i Recerca Mèdiques; 2009. Guía de práctica clínica: AATRM N.º 2007/25.
12. Kim Y, Park H. Does Regular Exercise without Weight Loss Reduce Insulin Resistance in Children and Adolescents? Int J Endocrinol. 2013; 2013: 402-592.
13. Yu CC, Li AM, Chan KO, Chook P, Kam JT, Au CT, et al. Orlistat improves endothelial function in obese adolescents: a randomised trial. J Paediatr Child Health. 2013; 49: 969-75.
14. Kendall DL, Amin R, Clayton PE. Metformin in the treatment of obese children and adolescents at risk of type 2 diabetes. Paediatr Drugs. 2014; 16:13-20.
15. Kwiterovich PO Jr. Recognition and management of dyslipidemia in children and adolescents. J Clin Endocrinol Metab. 2008; 93: 4200-9.
16. Anyaegbu EI, Dharnidharka VR. Hypertension in the teenager. Pediatr Clin North Am. 2014; 61:131-51.