Avances en enfermedad celíaca
Avances en enfermedad celíaca
M.L. Cilleruelo Pascual.
Facultativo especialista de Área. Unidad de Gastroenterología Pediátrica. Hospital Universitario Puerta de Hierro, Majadahonda, Madrid.
Adolescere 2022; X (3): 91-98
Resumen
|
La enfermedad celíaca es un proceso sistémico desencadenado por el gluten que cursa con síntomas digestivos y extradigestivos, anticuerpos específicos, haplotipo HLA-DQ2/DQ8 y enteropatía. La guía ESPGHAN 2020 de diagnóstico de la EC en niños y adolescentes recomienda, para el estudio inicial de la EC, la determinación de IgA total y anticuerpos antitranglutaminasa (AATG). Los niños con AATG IgA ≥10 veces el límite superior de la normalidad y anticuerpos antidendomisio IgA positivos en una determinación posterior, pueden ser diagnosticados de EC sin biopsia intestinal. Debe realizarse biopsia intestinal si los niveles de AATG IgA son inferiores. El estudio genético se utilizará exclusivamente para el cribado de los pacientes de riesgo y en el caso de diagnóstico dudoso. La base del tratamiento es una dieta estricta sin gluten, pero no hay instrumentos validados que estimen la adherencia. La ESPGAHN ha publicado en 2022 un documento de posicionamiento sobre el seguimiento del niño y adolescente celíaco. En el seguimiento de estos pacientes es especialmente importante el periodo de transición a la consulta de digestivo de adultos. Los adolescentes abandonan con mayor frecuencia el tratamiento, sobre todo en situaciones sociales y durante el periodo de transición a la consulta de adultos. Para evitar esta brecha en el seguimiento, la transición debe tener en cuenta la madurez física y emocional del adolescente, para enseñarle a ser independiente en el manejo de su enfermedad. . Palabras clave: Enfermedad celíaca; Diagnóstico; Seguimiento; ESPGHAN; Dieta sin gluten; Adolescente; Transición. |
Abstract
|
Celiac disease (CD) is a systemic process triggered by gluten that involves digestive and extradigestive symptoms, specific antibodies, HLA-DQ2/DQ8 haplotype, and enteropathy. The ESPGHAN 2020 guideline for the diagnosis of CD in children and adolescents recommends, for its initial study, the determination of total IgA and anti-tranglutaminase antibodies (AtTGA). Children with IgA AtTGA ≥ 10 times the upper limit of normal and positive IgA antiendomysial antibodies in a subsequent determination can be diagnosed with CD without intestinal biopsy. Intestinal biopsy should be performed if AtTGA IgA levels are lower. The genetic study will be used exclusively for the screening of patients at risk and in the case of a doubtful diagnosis. The basis of treatment is a strict gluten-free diet, but there are no validated instruments that estimate adherence. The ESPGHAN has published in 2022 a position document on the follow-up of children and adolescents with CD. In the follow-up of these patients, the transition period to the adult digestive consultation is especially important. Adolescents drop out of treatment more often, especially in social situations and during the transition period to the adult consultation. To avoid this gap in follow-up, the transition must take into account the physical and emotional maturity of the adolescent, so as to teach him to be independent in managing his illness. Key words: Celiac disease; Diagnosis; Tracing; ESPGHAN; Gluten free diet; Teen; Transition. |
La enfermedad celíaca (EC) es un proceso sistémico inmunológico, desencadenado por el consumo de gluten y otras prolaminas relacionadas (secalinas, hordeínas y, posiblemente, aveninas) que se produce en individuos genéticamente predispuestos. Cursa con una serie de síntomas, anticuerpos específicos, marcadores genéticos (HLA-DQ2/DQ8) y enteropatía(1).
Epidemiología
En las últimas décadas se observa un aumento de la prevalencia de la EC desde el 0,6% en la década de 1991-2000 al 0,8% de 2001 a 2016
La prevalencia de la EC por estudio serológico es del 1,3%, mientras que cuando se confirma la lesión intestinal por biopsia es del 0,8%, superior en el niño que en el adulto (0,9% vs 0,5%) y en mujeres que en hombres (0,6% vs 0,4%). En las últimas décadas se observa un aumento de la prevalencia de esta enfermedad, desde el 0,6% en la década de 1991-2000 al 0,8% de 2001 a 2016. Con el mejor conocimiento de los diversos síntomas de la EC ha aumentado su diagnóstico, a pesar de lo cual, la mayoría de estos pacientes permanecen no detectados, es decir, se encuentran en la parte sumergida del llamado “iceberg celíaco” que describe las formas de presentación, sintomáticas o asintomáticas, de esta enfermedad. La EC es una enfermedad poligénica con un patrón complejo no mendeliano. Por este motivo, una importante población de riesgo son los familiares de un paciente celíaco, en los que la frecuencia de la EC es 7,5% en los familiares de primer grado y 2,3% en los de segundo grado. La prevalencia entre familiares de primer grado varía en función de su relación con el paciente índice, siendo las hermanas e hijas las de más alto riesgo, 1/7 y 1/8 respectivamente, mientras que el riesgo del resto de familiares es de 1/13 en hijos, 1/16 en hermanos, 1/32 en madres y 1/33 en padres(2).
Presentación clínica
En el registro español de pacientes pediátricos con enfermedad celíaca (REPAC 2), que recoge 4.838 pacientes diagnosticados de 2011 a 2017 en 73 centros hospitalarios de nuestro país, se observó que los síntomas digestivos se detectaban en el 71,4%
La EC puede presentarse con síntomas digestivos y extradigestivos. En el registro español de pacientes pediátricos con enfermedad celíaca (REPAC 2), que recoge 4.838 pacientes diagnosticados de 2011 a 2017 en 73 centros hospitalarios de nuestro país, se observó que los síntomas digestivos se detectaban en el 71,4%. El 28,6% presentaba síntomas extradigestivos exclusivamente y el 9,8% eran asintomáticos.
En los niños menores de 3 años predominaban los síntomas digestivos
En los niños menores de 3 años predominaban los síntomas digestivos y este porcentaje disminuía conforme aumentaba la edad, con aparición de un mayor número de casos asintomáticos a partir de los 6 años. Las formas de presentación clínica de esta cohorte de niños y adolescentes se muestra en la Tabla I.
Globalmente el 80% presentaron un estado normal de nutrición y la frecuencia de sobrepeso y obesidad fue del 12% y 3,2%, respectivamente
Globalmente el 80% presentaron un estado normal de nutrición y la frecuencia de sobrepeso y obesidad fue del 12% y 3,2%, respectivamente(3). Si comparamos nuestros resultados con los de un estudio multicéntrico efectuado en 2016 en países del centro de Europa observamos, que en nuestro país, la edad media al diagnóstico es de 4 años y el síntoma más frecuente la diarrea (45,9%) frente al diagnóstico a los 7 años y el dolor abdominal (41,2%) como síntoma predominante en el estudio centro europeo(4). No conocemos la razón específica de estas diferencias.
La EC se presenta con más frecuencia en algunas patologías constituyéndose los pacientes que las padecen en grupos de riesgo de la EC. En el estudio REPAC 2 se observaron enfermedades asociadas en 207 casos, que se detallan en la Tabla II. El 45% de estos pacientes eran asintomáticos, por lo que es obligado efectuar despistaje de la EC con el fin de evitar el infradiagnóstico en estos grupos de riesgo(3).
Criterios actuales para el diagnóstico de la EC
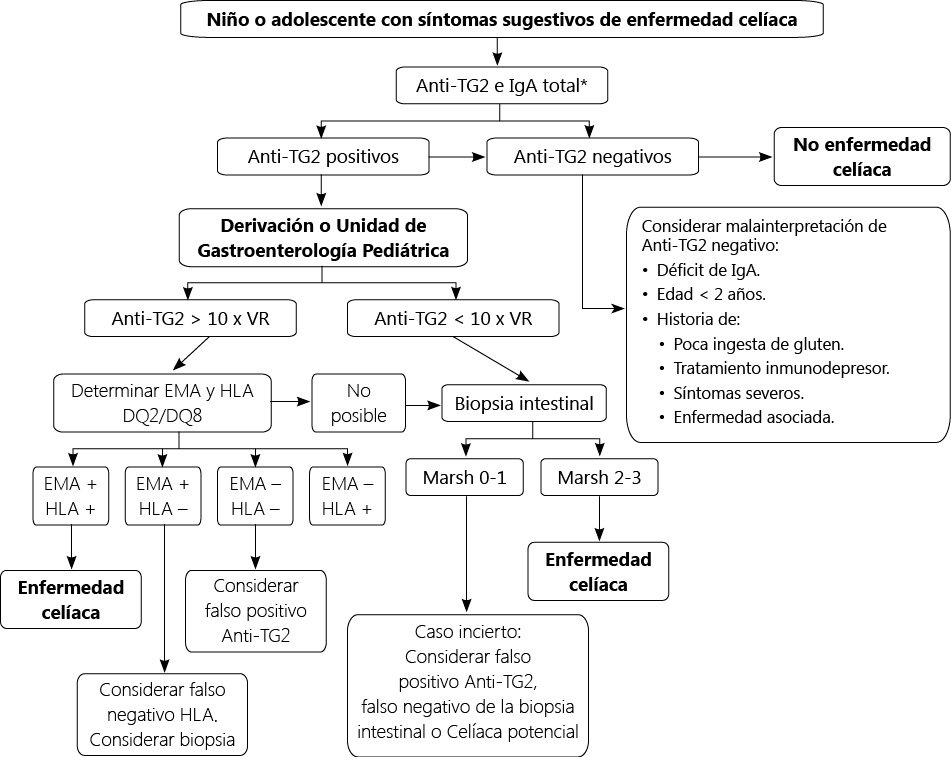
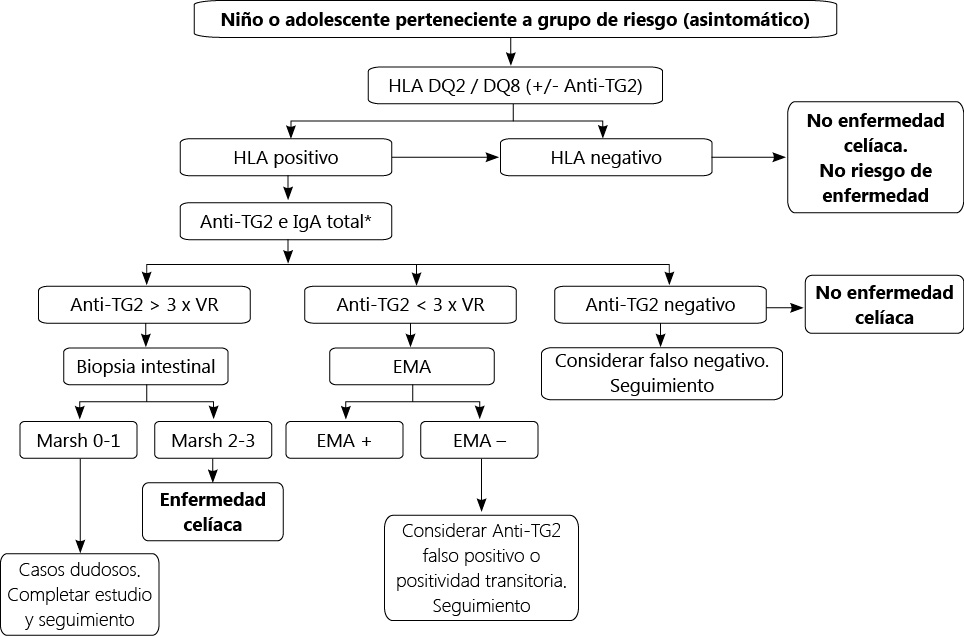
La elevada precisión diagnóstica de los anticuerpos antitransglutaminasa (AATG) y antiendomisio (AAEM) de tipo IgA ha posibilitado modificaciones sustanciales en la estrategia diagnóstica de la EC. Los cambios fundamentales se produjeron en 2012(1), cuando por primera vez se permitió el diagnóstico de EC sin biopsia intestinal en pacientes sintomáticos si se cumplían las condiciones de presentar los síntomas característicos de la EC, niveles de AATG IgA≥10 veces el límite superior de la normalidad (LSN), AAEM IgA positivos y HLA-DQ2 o DQ8 positivos. En estudios posteriores se demostró que no era necesaria la determinación de los alelos de riesgo de EC, puesto que todos los pacientes diagnosticados de EC los presentaban, por lo que influía poco en el diagnóstico. Además, en los últimos años existen datos que indican que los pacientes asintomáticos que cumplen los mismos criterios serológicos también presentan atrofia intestinal, aunque con un valor predictivo positivo inferior que en pacientes sintomáticos. Toda esta información ha dado lugar a la nueva guía de manejo de la EC ESPGHAN 2020(5). En el momento actual, en el diagnóstico de la EC hay que considerar:
- La determinación de la IgA total, porque en el déficit selectivo de IgA deben realizarse anticuerpos tipo IgG (AATG, AAEM o anti-PDG).
- La utilización de los AATG inicialmente y, sin son positivos, analizar los AAEM en una determinación posterior, con el fin de minimizar al máximo cualquier posible error de laboratorio.
- Si los títulos de AATG IgA son ≥10 veces el LSN y los AAEM IgA son positivos en una determinación posterior, puede diagnosticarse la EC sin necesidad de biopsia intestinal en pacientes sintomáticos, pero también en asintomáticos, aunque con un valor predictivo positivo inferior. En este último caso, se aconseja discutir la no realización de la biopsia intestinal con los padres y el paciente, si su edad lo permite.
- No es necesaria la determinación del HLA-DQ2/DQ8 para poder efectuar el diagnóstico en los casos que cumplen los criterios de no realización de biopsia intestinal ni tampoco cuando va a efectuarse el diagnóstico con biopsia. El estudio genético queda para el cribado de los grupos de riesgo y los casos de diagnóstico dudoso.
- Quedan fuera de estos cambios los casos con déficit selectivo de IgA y los pacientes asintomáticos con diabetes tipo 1.
Quedan fuera de estos criterios nuevos de diagnóstico los casos con déficit selectivo de IgA y los pacientes asintomáticos con diabetes tipo 1
Por tanto, existen dos excepciones a la posibilidad de efectuar el diagnóstico de la EC sin biopsia intestinal, el déficit selectivo de IgA y el paciente asintomático con diabetes tipo 1. En relación al déficit selectivo de IgA, las guías ESPGHAN 2012 no fueron suficientemente claras, por lo que, en nuestro medio, y a partir de esa fecha, bajó al 62% el número de biopsias que se efectuaban a estos pacientes. Sin embargo, hay que tener en cuenta que, al contrario de lo que ocurre con los AATG IgA, no existen estudios que hayan validado la relación entre títulos elevados de AATG IgG con la existencia de lesión intestinal, por lo que las guías ESPGAHN 2020 recomiendan la realización de biopsia intestinal en todos los casos de sospecha de EC en pacientes con déficit selectivo de IgA(5). Además, cuando se realiza la dieta sin gluten, los anticuerpos IgG presentan un descenso mucho más lento que los IgA, de modo que a dos años de evolución con dieta sin gluten, el 53% de los pacientes pueden presentar títulos aún positivos, incluso con valores superiores a 5 veces el LSN(6). Esto puede contribuir a dudar del diagnóstico si no se ha hecho inicialmente una biopsia intestinal. Respecto a los pacientes asintomáticos con diabetes tipo 1, la mayoría de los estudios reflejan que hasta el 20-30% de los que tienen serología positiva presentan una negativización espontánea de los autoanticuerpos, sobre todo si los niveles eran elevados. No obstante, en un estudio reciente de una serie numerosa de pacientes con diabetes tipo 1 y sospecha de EC, los niños con títulos de AATG IgA≥10 veces el LSN tuvieron lesión intestinal en todos los casos, incluso con títulos superiores a 7 veces el LSN, independientemente de los síntomas, por lo que los autores proponen que en el niño y adolescente diabético con sospecha de EC pueda realizarse el diagnóstico de EC sin biopsia intestinal, cuando cumpla las condiciones requeridas(7). No obstante, y hasta que este punto se clarifique, las guías ESPGHAN 2020 recomiendan hacer siempre biopsia intestinal confirmatoria en este grupo de pacientes en el caso de que sean asintomáticos(5).
Para efectuar el diagnóstico histológico de la EC se utiliza la clasificación de Marsh para la descripción de las lesiones que, de forma progresiva, se van produciendo durante el desarrollo de la EC. El grado 0, indica una mucosa intestinal normal, el grado 1, aumento de los linfocitos intraepiteliales, el grado 2, lo anterior e hiperplasia de las criptas y el grado 3, cuando existe atrofia de las vellosidades intestinales, descrita en la modificación de Oberhuber en grado 3 a (atrofia parcial), 3b (atrofia subtotal) y 3c (atrofia total). Para el diagnóstico de EC se requiere la existencia de lesión de Marsh tipo 2 o 3.
Tratamiento
Dieta sin gluten
El único tratamiento actual de la EC es la dieta sin gluten, que se ha mostrado eficaz y coste-efectiva. Las proteínas del gluten son importantes ya que aportan elasticidad y palatabilidad a un importante número de alimentos. Las dificultades en el seguimiento de la dieta se relacionan con los eventos sociales y los viajes, por lo que en estas situaciones el celíaco puede cometer transgresiones de la dieta. Por ello es importante que tenga un acceso fácil a los productos sin gluten. En esta dirección apunta el estudio efectuado por Babio y cols cuyo principal objetivo fue confeccionar una base de datos de los productos manufacturados sin gluten, dado que no existe nada similar en nuestro país, y también valorar el perfil nutricional de estos productos, cuando se comparan con sus equivalentes con gluten. Utilizando el listado de los alimentos sin gluten proporcionados por la Asociación de Celíacos de Cataluña, estudiaron 216 marcas y 2247 productos. El resumen de sus hallazgos es que el contenido de proteínas es más bajo, sobre todo en el pan y la pasta mientras que el de grasa saturada, azúcares y sodio es similar. Se ha comunicado que los productos sin gluten tienen un elevado índice glucémico y son más calóricos, lo que favorecería el desarrollo de obesidad y enfermedad cardiovascular a largo plazo.
El único tratamiento actual de la EC es la dieta sin gluten, que se ha mostrado eficaz y coste-efectiva
Sin embargo, y a la luz de los resultados de este estudio, parece que las compañías españolas están haciendo un esfuerzo para mejorar el perfil nutricional de sus productos sin gluten. En relación al precio, son de 1,3 veces a 6,9 más caros. Parte de estos elevados precios podría justificarse porque están hechos a base de arroz y maíz, que son más caros que el trigo, y porque están sujetos a controles obligatorios que aseguren que contienen menos de 20 ppm de gluten(8).
Con el objetivo de valorar las consecuencias nutricionales de la dieta sin gluten en el niño y adolescente celíaco, en un estudio reciente efectuado en nuestro medio, se comparó el estado nutricional de los niños celíacos tratados al menos durante un año con dieta sin gluten con el de un grupo de niños con dieta normal. Se valoró la antropometría, dieta, parámetros bioquímicos y densidad mineral ósea. La frecuentación de alimentos fue similar, excepto la de pasta y pan, que fue inferior en celíacos. En la distribución de los principios inmediatos se objetivó una menor ingesta de proteínas, pero dentro de límites normales. Los celíacos ingerían menos folato, hierro, calcio y magnesio, aunque todos los parámetros bioquímicos fueron normales. Sólo hubo una menor ingesta y niveles bajos de vitamina D, hecho que fue común a celíacos y no celíacos, aunque la densidad mineral ósea fue normal en ambos grupos. Todos los niños estudiados, celíacos o no, realizan una dieta rica en lípidos y proteínas y baja en fibra. Un hecho importante es que hasta el 84,3% tomaba dos o tres veces al día productos manufacturados sin gluten y sólo un 4,3% los evitaban completamente(9).
Nuevas opciones terapéuticas
Están emergiendo diversas opciones terapéuticas, diferentes a la dieta sin gluten, la mayoría de las cuales están en fase preclínica y sólo algunas en fase 2b o 3. Siguiendo la patogenia de la enfermedad las podemos clasificar en:
- Disminuir la toxicidad del gluten:
- Modificación genética de los granos de trigo
- Harinas pretratadas con proteasas
- Transaminación de la harina de trigo mediante transglutaminasa de uso industrial
- Secuestro del gluten antes de su absorción o digestion mediante endopeptidasas (Latiglutenasa)
- Evitar el aumento de la permeabilidad intestinal mediante el bloqueo de la unión de la zonulina a su receptor en el enterocito (Acetato de larazótido)
- Utilización de un inhibidor selectivo de la transglutaminasa 2
- Amortiguar la reacción inmunológica:
- Inhibición de la IL-15
- Bloqueo del HLA-DQ2
- Inducir la inmunotolerancia al gluten:
- Infección por larva de Necator Americanus
- Vacuna (Nexvax 2)
- Nanopartículas de gliadina
Pueden considerarse prometedoras la terapia enzimática (Latiglutenasa), los inhibidores de la transglutaminasa, el agonista de la zonulina (Acetato de larazótido) y el Inhibidor de la IL-15
Pueden considerarse prometedoras la terapia enzimática (Latiglutenasa), los inhibidores de la transglutaminasa, el agonista de la zonulina (Acetato de larazótido) y el Inhibidor de la IL-15. Es fundamental que las nuevas terapias no sólo sean efectivas sino también seguras. El deseo del celíaco de efectuar un tratamiento que le permita tomar gluten y mantener un intestino sano es aún lejano. La máxima aspiración, a corto plazo, será protegerse frente a las contaminaciones(10).
Seguimiento
El seguimiento del paciente celíaco tiene como objetivos la confirmación del diagnóstico al observar la desaparición de los síntomas con la retirada del gluten, la identificación y prevención de déficits nutricionales, el fomento del conocimiento por parte del paciente de la enfermedad y la dieta sin gluten y la detección de enfermedades asociadas. Se acaba de publicar un posicionamiento de la ESPGHAN sobre el seguimiento de niños y adolescentes diagnosticados de EC que, tras la valoración de 2775 publicaciones, 164 se consideraron finalmente como base para dar respuesta a una serie de cuestiones de interés en la práctica clínica(11).
Frecuencia y contenido de las visitas
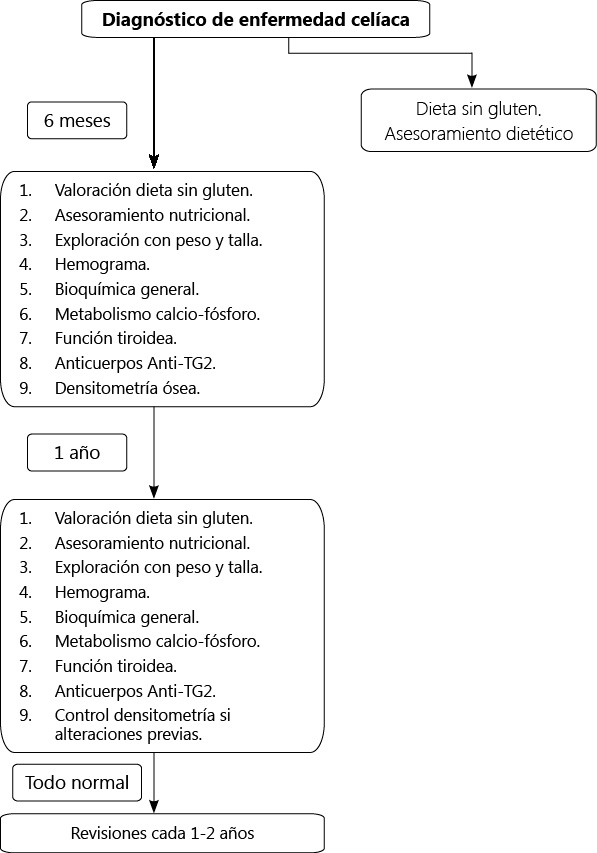
Se recomienda el seguimiento de estos pacientes comenzando los controles cada 3-6 meses tras el diagnóstico, posteriormente cada 6 meses hasta la negativización de la serología y, después, cada 1-2 años
Se recomienda el seguimiento de estos pacientes comenzando los controles cada 3-6 meses tras el diagnóstico, posteriormente cada 6 meses hasta la negativización de la serología y, después, cada 1-2 años. Se controlará en cada visita la existencia de síntomas digestivos y extradigestivos, antropometría, determinación de AATG y de los parámetros analíticos alterados al diagnóstico, hasta su normalización. Puede considerarse la determinación de TSH y tiroxina y, en relación con los anticuerpos del VHB dependerá del tipo de población. No es necesaria la monitorización de la densidad mineral ósea porque se recupera al año de la dieta sin gluten en la mayoría de los casos que han tenido alteración al diagnóstico(11).
Adherencia a la dieta
En una enfermedad con tratamiento dietético es fundamental la adherencia al mismo, pero desafortuna-damente no existe un método perfecto para valorar su cumplimiento
En una enfermedad con tratamiento dietético es fundamental la adherencia al mismo, pero desafortunadamente no existe un método perfecto para valorar su cumplimiento. Puede hacerse un registro dietético, pero se precisa un dietista y esto no siempre es posible. La valoración de los síntomas no es útil en el paciente asintomático y el uso de la biopsia intestinal es excesivamente agresivo y no puede repetirse tantas veces para confirmar el adecuado seguimiento de la dieta. Por lo que se usa la serología, aunque se sabe que la sensibilidad y la especificidad de los AATG es 50% y 45%, respectivamente, mientras que estos valores son de 83% y 91% para los AAEM(12). Existen métodos rápidos y simples que, mediante preguntas sencillas, valoran las estrategias que el paciente utiliza para evitar la ingesta de gluten, pero sólo están validados en adultos.
En los últimos años se han desarrollado técnicas que permiten determinar los llamados péptidos inmunorreactivos de gluten (GIPs). Cuando se ingiere gluten los GIPs aparecen en heces durante 2-4 días y en orina durante 4-24 horas. Se detectan mediante anticuerpos anti-α gliadina 33-mer, A1 y G12. Pueden determinarse en heces y orina mediante enzimoinmunoanálisis y en orina mediante test rápidos inmunocromatográficos, útiles para el autocontrol del paciente. La sensibilidad y especificidad de estos métodos para la detección de la ingesta inadvertida o voluntaria de gluten son superiores al 90%. Sin embargo, la información que aporta es a corto plazo y su medición aislada no identifica trasgresiones puntuales no próximas a la recogida de la muestra(13). En un estudio en adolescentes y adultos que comparó la eficacia de los AATG y los GIPs en la detección de lesión intestinal, la sensibilidad, especificidad y valor predictivo positivo de los GIPs fue de 33,3%, 81,4% y 40,9%, respectivamente, similar al del estudio serológico(14). La ESPGHAN 2022 considera que se precisan más estudios para recomendar su uso en la práctica clínica(11).
En una revisión sistemática de 49 estudios sobre adherencia a la dieta se observaron niveles muy variables que oscilaban entre el 23% al 98%, independientemente del método utilizado, por lo que todos parecen útiles, aunque no exista consenso sobre el método ideal. La menor adherencia la presentaban los adolescentes y la mayor las familias con un mejor conocimiento de la enfermedad y que formaban parte de una asociación de enfermos. Sin embargo, no existían diferencias en cuando a género, medio rural o urbano y nivel socio-económico. Tampoco hubo relación con la edad al diagnóstico, historia familiar de EC, la existencia o no de comorbilidades y los síntomas al diagnóstico(15).
Situaciones clínicas especiales
Si al diagnóstico se detectó anemia por déficit de hierro fundamentalmente, pero también de vitamina B12 o folato, se recomienda su corrección porque tarda en torno a un año en recuperarse bajo la dieta sin gluten, tiempo excesivamente largo para periodos de crecimiento rápido como es la adolescencia
Existen una serie de situaciones clínicas que se plantean con frecuencia en el seguimiento de estos pacientes. Si al diagnóstico se detectó anemia por déficit de hierro fundamentalmente, pero también de vitamina B12 o folato, se recomienda su corrección porque tarda en torno a un año en recuperarse bajo la dieta sin gluten, tiempo excesivamente largo para periodos de crecimiento rápido como es la adolescencia. Si existe ferropenia sin anemia se recomienda una actitud expectante sin suplementación si se observa mejoría de los depósitos de hierro.
Una vez iniciada la dieta sin gluten, los AATG deben desaparecer en 18-24 meses. Si no descienden en 6-12 meses hay que reevaluar la dieta. Se realizará biopsia intestinal en casos seleccionados, ya sea por duda en el diagnóstico o por aparición de comorbilidades, ya que los títulos de anticuerpos ligeramente elevados raramente se relacionan con daño en la mucosa intestinal(11).
En situaciones en la que se duda del diagnóstico la ESPGHAN 2022 recomienda efectuar una prueba de provocación con gluten, antes de la cual se realizará estudio genético
En situaciones en la que se duda del diagnóstico la ESPGHAN 2022 recomienda efectuar una prueba de provocación con gluten, antes de la cual se realizará estudio genético. Si el paciente no es HLA DQ2/DQ8 es muy poco probable que sea celíaco. Si, por el contrario, el estudio genético es positivo puede hacerse una biopsia intestinal, aunque no es obligado, previa a la reintroducción del gluten en cantidad de 10-15 gramos al día, teniendo en cuenta que una rebanada de pan tiene de 3 a 5 gramos de gluten. Se realizarán controles clínicos y serológicos cada 3 meses durante el primer año y biopsia intestinal si aparecen síntomas y/o anticuerpos de la EC. Si esto no ha ocurrido al año del comienzo de la prueba de provocación con gluten, el paciente puede realizar una dieta normal y se efectuará control clínico y serológico anual o bianual(11).
Pacientes con diabetes tipo 1, déficit de IgA y EC potencial
En los casos en los que el diagnóstico de la EC ha sido diferente, como la diabetes tipo 1 y el déficit selectivo de IgA, el seguimiento, sin embargo, será similar al del resto de celíacos. En el primer caso debe efectuarse de forma coordinada con el endocrinólogo y dietista y se valorará el apoyo psicológico y la función tiroidea. En el segundo caso, se efectuará utilizando anticuerpos de tipo IgG que, como se ha comentado previamente, descienden mucho más lentamente que los de tipo IgA.
En una serie amplia de niños con EC potencial se observó que la prevalencia acumulada de atrofia intestinal a 12 años de seguimiento era del 43%, lo que indica que un elevado porcentaje de estos pacientes no van a desarrollar la EC. Los autores recomiendan valorar cuidadosamente la retirada del gluten a estos niños para evitar el sobretratamiento
Uno de los problemas más complejos que se nos puede plantear es la existencia de la llamada EC potencial. La EC potencial se caracteriza por la existencia de serología positiva, pero con biopsia intestinal normal (Marsh 0) o con aumento exclusivo de los linfocitos intraepiteliales (Mash 1) en un paciente con o sin síntomas. En una serie amplia de niños con EC potencial se observó que la prevalencia acumulada de atrofia intestinal a 12 años de seguimiento era del 43%, lo que indica que un elevado porcentaje de estos pacientes no van a desarrollar la EC. Los autores recomiendan valorar cuidadosamente la retirada del gluten a estos niños para evitar el sobretratamiento. Los factores que favorecieron la negativización de la serología a lo largo del seguimiento fueron la edad inferior a 3 años, la lesión Marsh 0 y un menor número de linfocitos intraepiteliales γ/δ(15). Las guías ESPGHAN 2022 plantean la posibilidad de efectuar una prueba de dieta sin gluten en el paciente sintomático. Si el paciente es asintomático o tiene síntomas leves, se mantendrá la dieta con gluten y se realizarán controles anuales en los que se pondrá especial énfasis en el crecimiento y en los parámetros bioquímicos de calcio, fósforo, fosfatasa alcalina, vitamina D e incluso se valorará la realización de una densitometría ósea. Se realizará una nueva biopsia intestinal en el caso de aparición de síntomas y/o ascenso de los niveles de anticuerpos, aunque también se planteará si los anticuerpos se mantienen persistentemente positivos sin ascenso(11).
Calidad de vida
La calidad de vida de pacientes cuyo tratamiento es dietético se ve afectada fundamentalmente en los diversos ámbitos de la vida social. Los estudios indican que la calidad de vida del paciente celíaco es peor que la de la población general al diagnóstico de la enfermedad, pero cuando realizan la dieta, a pesar de ser estricta y de por vida, la calidad de vida no parece afectada. La mayoría de los estudios indican que la percepción de los padres es peor que la del propio paciente. Los factores relacionados con una peor calidad de vida en nuestro medio son el no cumplimiento de la dieta y el tener dificultades económicas y/o sociales para realizarla(16). La ESPGHAN 2022 recomienda valorar la calidad de vida mediante cuestionarios específicos, bien en el momento de la visita o previamente on-line, para poder comentar los resultados con la familia y el paciente, si la edad lo permite(11).
Transición a la consulta de adultos
La transición es un proceso gradual que se inicia con los especialistas pediátricos y cuyo objetivo es hacer a los pacientes independientes en el manejo de su enfermedad
Por último, el seguimiento es fundamental para poder efectuar la transición a las consulta de digestivo de adultos. La transición es un proceso gradual que se inicia con los especialistas pediátricos y cuyo objetivo es hacer a los pacientes independientes en el manejo de su enfermedad. Hasta la adolescencia, el gastroenterólogo pediátrico dirige las explicaciones sobre la enfermedad y la dieta prioritariamente a la familia, que es la que toma la responsabilidad del tratamiento, por lo que el niño cuando llega a la adolescencia puede tener un conocimiento limitado de su enfermedad. Durante la transición se evidencian las peculiaridades propias del adolescente, como la limitada experiencia de la vida, su vivencia de invencibilidad, la mayor libertad en la gestión de su dieta y una mayor tendencia a efectuar transgresiones en situaciones sociales, que además, no suelen causarle síntomas. Todo ello hace que se trate de un periodo de alto riesgo de abandono de la dieta. Para realizar una transición segura hay evitar la brecha en el cuidado médico, asegurar el bienestar físico y mental en este complicado periodo y efectuar un plan individualizado. El consenso de Praga dio recomendaciones para abordar la transición en diversas enfermedades crónicas. Se recomienda que se comience a hablar de la transición a los 12-13 años y efectuar el plan entre los 14 a los 16 años, para que sea efectiva a los 18 años, aunque el gastroenterólogo pediátrico la comenzará en función de la madurez del paciente.
Se recomienda que se haga un “informe de transición” donde se incluya cómo se hizo el diagnóstico, la evolución de la serología, la antropometría, enfermedades asociadas, si existen, y el cumplimiento de la dieta
Se recomienda que se haga un “informe de transición” donde se incluya cómo se hizo el diagnóstico, la evolución de la serología, la antropometría, enfermedades asociadas, si existen, y el cumplimiento de la dieta. Deben efectuarse visitas conjuntas del especialista de niños y adultos con el paciente y la familia, durante las cuales se dará al adolescente la oportunidad de expresar sus expectativas y modalidad de seguimiento(17).
Tablas y figuras
Tabla I. Síntomas de presentación de la enfermedad celíaca en niños y adolescentes
|
45,9% |
|
39,9% |
|
39,7% |
|
34,7% |
|
31,7% |
|
21,1% |
|
15,6% |
|
15,2% |
|
14,4% |
|
9,8% |
|
7,6% |
|
7,5% |
|
3,7% |
|
2,4% |
|
0,7% |
Modificado de Pérez Solis D, Cilleruelo Pascual ML, Ochoa Sangrador C, García Burriel JI, Sánchez-Valverde F, Eizaguirre Arocena J et al. Spanish National Registry of Paediatric Coeliac Disease: Changes in the clinical presentation in the 21st century. Estudio REPAC 2: 2011-2017. REPAC: Registro español de pacientes pediátricos con enfermedad celíaca.
Tabla II. Enfermedades asociadas
|
93 (1,9%) |
|
55 (1,1%) |
|
42 (0,9%) |
|
19 (0,4%) |
|
2 (0,04%) |
|
1 (0,02%) |
Resultados del estudio REPAC 2: 2011-2017. REPAC: Registro español de pacientes pediátricos con enfermedad celíaca.
Bibliografía
- Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, et al. ESPGHAN Working Group on Coeliac Disease Diagnosis. J Pediatr Gastroenterol Nutr. 2012; 54:136-60.
- Rajput MS, Chauhan A, Makharia GK. Epidemiology of Celiac Disease. In Advances in Celiac Disease. Jose Amil-Dias, Isabel Polanco Ed. Springer 2021; 7-22.
- Pérez Solis D, Cilleruelo Pascual ML, Ochoa Sangrador C, García Burriel JI, Sánchez-Valverde F, Eizaguirre Arocena J et al. Spanish National Registry of Paediatric Coeliac Disease: Changes in the clinical presentation in the 21st century. J Pediatr Gastroenterol Nutr 2022: 74: 805-11.
- Riznik P, De Leo L, Dolinsek J, Gyimesi J, Klemenak M, Koletzko B, et al. Clinical Presentation in Children With Coeliac Disease in Central Europe. J Pediatr Gastroenterol Nutr. 2021;72: 546–51.
- Husby S, Koletzko S, Korponay-Szabó I, Kurppa K, Mearin ML, Ribes-Koninckx C, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosing Coeliac Disease 2020. J Ped Gastroenterol Nutr 2020; 70: 141-56.
- Vecino López R, Miranda Cid C, Rodrigo García G, García Romero R, Cilleruelo ML, Román Riechmann E, on behalf of the Spanish Working Group on Coeliac Disease. Influence of the 2012 European Guidelines in Diagnosis and Follow-up of Coeliac Children With Selective IgA Deficiency. J Pediatr Gastroenterol Nutr. 2020;71: 59–63.
- Cerqueiro Bybrant M, Udén E, Frederiksen P, Gustafsson AL, Arvidsson CG, Fureman AL, et al. Celiac disease can be predicted by high levels of tissue transglutaminase antibodies in children and adolescents with type 1 diabetes. Pediatr Diabetes. 2021;22:417–24.
- Babio N, Lladó-Bellette N, Besora-Moreno M, Castillejo G, Guillén N, Martínez-Cerezo F. A comparison of the nutritional profile and price of gluten-free products and their gluten-containing counterparts available in the Spanish market. Nutr Hosp 2020;37:814-22.
- Ballestero Fernández C, Varela-Moreiras G, Úbeda N, Alonso-Aperte E. Nutritional Status in Spanish Children and Adolescents with Celiac Disease on a Gluten Free Diet Compared to Non-Celiac Disease Controls. Nutrients 2019; 11, 2329; doi:10.3390/nu11102329.
- Gianfrani C, Vitale S, Troncone R. New Therapeutic Strategies in Celiac Disease. In Advances in Celiac Disease. Jose Amil-Dias, Isabel Polanco Ed. Springer 2021; 171-91.
- Mearin ML, Agardh D, Antunes H, Al-Roma A, Auricchio R, Castillejo G et al. ESPGHAN position papel on management and follow-up of children and adolescents with coeliac disease. J Pediatr Gastroenterol Nutr 2022, Publish Ahead of print. doi: 10.1097/MPG.0000000000003540.
- Silvester JA. Tests for serum transglutaminase and endomysial antibodies do not detect most patients with celiac disease and persistent villus atrophy on gluten-free diets: a meta-analysis. Gastroenterology 2017;153: 689–701
- Coto L, Mendia I, Sousa C, Bai JC, Cebolla A. Determination of gluten immunogenic peptides for the management of the treatment adherence of celiac disease: A systematic review. World J Gastroenterol 2021; 27: 6306-21.
- Laserna-Mendieta EJ, Casanova MJ, Arias A, Laura Arias-González L, Majano P, Mate LA et al. Poor Sensitivity of Fecal Gluten Immunogenic Peptides and Serum Antibodies to Detect Duodenal Mucosal Damage in Celiac Disease Monitoring. Nutrients 2021; 13, 98.
- Myléus A, Reilly NR, Green PHR. Rate, risk factors and outcomes of non adherence in pediatric patients with celiac disease: A systematic review. Clin Gastroenterol Hepatol 2020; 18: 562-73.
- Barrio J, Cilleruelo ML. Quality of Life in Celiac Disease. In Advances in Celiac Disease. Jose Amil-Dias, Isabel Polanco Ed. Springer 2021; 194-213.
- Ludvigsson JF, Agreus L, Ciacci C, Crowe SE, Geller MG, Green PHR et al. Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Gut 2016;65:1242–51.