Actualización de la enfermedad celíaca
Actualización de la enfermedad celíaca
MJ Martínez Gómez, JF Viada Bris
Sección de Gastroenterología y Nutrición. Hospital Universitario Infantil Niño Jesús. Madrid.
Fecha de recepción: 18 de diciembre 2013
Fecha de publicación: 27 de febrero 2014
Adolescere 2014; II (1): 8-23
Resumen
|
La enfermedad celíaca es una de las patologías crónicas intestinales más frecuentes de distribución mundial, estimándose la prevalencia en España entre 1:180-1:220. Actualmente se define como una enfermedad sistémica de naturaleza autoinmune, provocada por el gluten y prolaminas relacionadas con el mismo, que aparece en individuos genéticamente predispuestos. Se caracteriza por la presencia de una combinación variable de síntomas, anticuerpos específicos, haplotipo HLA-DQ2 y/o HLA-DQ8 y enteropatía. Palabras clave: Enfermedad celíaca, Gluten. |
Abstract
|
Celiac disease is one of the most common chronic intestinal diseases worldwide. Prevalence in Spain is estimated at between 1:118-1:220. It is currently defined as a systemic autoimmune disorder, induced by gluten and prolamines related to it, which manifests in genetically predisposed individuals. It is characterized by the presence of a variable combination of symptoms, specific antibodies, haplotype HLA-DQ2 and / or HLA-DQ8 and enteropathy. Key words: Celiac disease, Glutens. |
Introducción
La enfermedad celíaca es una enfermedad sistémica de naturaleza autoinmune, provocada por el gluten y prolaminas relacionadas con el mismo, que aparece en individuos genéticamente predispuestos. Se caracteriza por la presencia de una combinación variable de síntomas, anticuerpos específicos, haplotipo HLA-DQ2 y/o HLA-DQ8 y enteropatía
La enfermedad celíaca se define en la actualidad como una enfermedad sistémica de naturaleza autoinmune, provocada por el gluten y prolaminas relacionadas con el mismo, que aparece en individuos genéticamente predispuestos. Se caracteriza por la presencia de una combinación variable de síntomas, anticuerpos específicos, haplotipo HLA-DQ2 y/o HLA-DQ8 y enteropatía. Los anticuerpos específicos de la enfermedad celíaca son: autoanticuerpos anti trasglutaminasa tisular (tTG2), anticuerpos antiendomisio (EMA) y anticuerpos antipéptidos deaminados de la gliadina (DGP).
Esta enfermedad viene condicionada por una intolerancia permanente al gluten, proteína fundamentalmente estructural que se encuentra en diversos cereales tales como: el trigo, la avena, la cebada y el centeno y que se compone a su vez de dos tipos de proteínas: las prolaminas y las gluteninas. Las prolaminas presentes en el trigo (gliadina), en la cebada (hordeína), en la avena (avenina) y en el centeno (secalina) parecen ser la porción tóxica fundamental que condiciona la intolerancia que sufren estos pacientes.
Epidemiología
Hasta hace dos décadas la enfermedad celíaca se consideraba una enfermedad poco frecuente que afectaba, fundamentalmente a pacientes pediátricos de origen caucásico que debutaban con un cuadro de malabsorción intestinal grave. Como consecuencia del mejor conocimiento de la enfermedad y el desarrollo de nuevos métodos serológicos más sensibles y específicos, en la actualidad esta patología se considera una enfermedad frecuente de distribución mundial y que afecta a pacientes tanto pediátricos como adultos.
La enfermedad celíaca es una de las patologías intestinales crónicas más frecuentes a nivel mundial estimándose su prevalencia en 1:100
Los estudios epidemiológicos poblacionales llevados a cabo en los últimos años han objetivado una prevalencia (porción de sujetos afectos respecto a la población total en un momento concreto) de 1:100 (rango: 0,25-1,26%). En España los estudios realizados en las Comunidades Autónomas de Madrid, Asturias y País Vasco arrojan unas cifras de prevalencia en población adulta de 1:370 y en población pediátrica de 1:118-1:220. La variabilidad de la prevalencia entre los diversos estudios viene condicionada, fundamentalmente, por los criterios utilizados para el diagnóstico de la enfermedad. En cualquier caso, las conclusiones de los estudios más recientes ponen de manifiesto que por cada enfermo celiaco diagnosticado existen 5-10 sin diagnosticar.
Los datos sobre la incidencia son mucho más escasos. La Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica promovió la realización del estudio REPAC con el fin de estimar la incidencia de la enfermedad celíaca en España, obteniendo una incidencia cruda de diagnóstico de casi 8 por cada 1000 recién nacidos vivos.
Patogenia
La patogenia de la enfermedad celíaca aún no ha sido completamente establecida. Los modelos descritos más aceptados la consideran una enfermedad inmunológica en la que concurren factores genéticos y ambientales.
En la hipótesis vigente actualmente se integran factores que actúan sobre el epitelio y la lámina propia intestinal. Por un lado existe una digestión incompleta del gluten. A su vez, existe un incremento de la permeabilidad de la mucosa intestinal a la gliadina del gluten, un transporte transepitelial de los péptidos hacia la lámina propia y una pérdida de tolerancia a los mismos.
Los péptidos no digeridos de la gliadina son desaminados en la submucosa por la Tg-2, favoreciendo así su unión a moléculas HLA DQ2 y DQ8 presentes en la membrana de las células presentadoras de antígenos de la submucosa y en los linfocitos T CD4+ de la lámina propia. Como consecuencia directa se produce una activación de la respuesta inmune con aumento de la síntesis de citoquinas proinflamatorias y de anticuerpos antigliadina (AGA), antipéptidos deaminados de la gliadina y anticuerpos antitransglutaminasa tisular 2.
Aún no se conoce la causa por la cual sólo algunas personas con HLA de riesgo desarrollan la enfermedad celíaca, qué vías moleculares condicionan la inflamación ni cuál es la implicación real de los anticuerpos tTG2.
Clínica y clasificación
Clásicamente los pacientes con enfermedad celíaca se clasificaban de acuerdo a su sintomatología en dos grandes grupos: aquellos que presentaban sintomatología típica (enfermedad celíaca clásica o típica) o atípica (enfermedad celíaca pauci o monosintomática o enfermedad celíaca atípica).
• Enfermedad celíaca clásica o típica: en esta forma predominan los trastornos intestinales. Suele aparecer en pacientes entre los 6 y los 24 meses de edad. Tras un tiempo variable desde la introducción del gluten, estos pacientes debutan con retraso ponderoestatural, diarrea crónica, vómitos e hiporexia. La exploración física suele ser normal, aunque en muchos casos se asocia distensión abdominal marcada y aspecto de malnutrición. Por último estos niños suelen presentar algún trastorno del carácter presentándose como pacientes tristes o irritables. Los anticuerpos séricos son positivos y existe una atrofia vellositaria grave.
En la actualidad la forma de presentación más frecuente es la pauci o monosintomática y aquella que se expresa con síntomas extradigestivas
• Enfermedad celíaca pauci o monosintomática (atípica): esta forma puede cursar con síntomas intestinales y/o extradigestivas. Tanto el porcentaje de positividad de los anticuerpos séricos como el grado de atrofia vellositaria es variable.
Siguiendo las nuevas recomendaciones publicadas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) en el 2012 se clasifica la enfermedad celíaca en: formas sintomáticas, formas asintomáticas (silentes), formas latentes y formas potenciales (tabla I).
• Enfermedad celíaca sintomática: dentro de este epígrafe se agrupan los pacientes que presentan síntomas o signos gastrointestinales y síntomas o signos extradigestivos.
o Gastrointestinales: diarrea crónica, estreñimiento crónico, dolor abdominal, nauseas, vómitos y distensión abdominal.
o Extradigestivos: estancamiento ponderal, retraso del crecimiento, retraso de la pubertad, anemia crónica, osteopenia/osteoporosis, defectos del esmalte de los dientes, irritabilidad, fatiga crónica, neuropatía, artritis/artralgias, amenorrea, hipertransaminasemia. Existen otros síntomas extradigestivos descritos en la literatura que se asocian a la enfermedad celíaca. (Tabla II)
• Enfermedad celíaca asintomática o silente: estos pacientes presentan HLA compatible con la enfermedad celíaca, anticuerpos séricos positivos, hallazgos compatibles en la biopsia intestinal y no muestran sintomatología alguna.
• Enfermedad celíaca latente: estos pacientes presentan HLA compatible y se caracterizan por haber tenido una enteropatía previa gluten-dependiente, es decir, daño histológico consumiendo gluten. Posteriormente el daño desaparece aún comiendo gluten. Los anticuerpos séricos y los síntomas pueden estar presentes o no.
• Enfermedad celíaca potencial: en este caso los pacientes muestran también un HLA susceptible y anticuerpos séricos positivos, pueden presentar algún síntoma aunque no existe daño histológico. A lo largo del seguimiento estos pacientes pueden presentar daño histológico gluten-dependiente.
Enfermedades asociadas
Se han descrito numerosas enfermedades asociadas con la enfermedad celíaca. En su mayoría son de origen inmunológico por lo que parece que comparten un sustrato patogénico común. Aquellas sobre las que existe mayor evidencia son: la artritis crónica juvenil, el síndrome de Down, el síndrome de Turner, el síndrome de Williams, la nefropatía IgA, el déficit de IgA, tiroiditis autoinmune, la hepatitis autoinmune y la diabetes mellitus.
Diagnóstico
El diagnóstico de la enfermedad celíaca se asienta sobre cuatro pilares fundamentales: la historia clínica (y exploración física), la determinación de anticuerpos serológicos, el estudio genético de susceptibilidad y la biopsia intestinal.
1. Historia clínica y exploración física: permiten establecer el diagnóstico de sospecha de la enfermedad. En la actualidad la forma de presentación más frecuente es la pauci o monosintomática y aquella que se expresa con síntomas extradigestivos.
2. Estudio de anticuerpos específicos serológicos: en la enfermedad celíaca se encuentran elevados los autoanticuerpos anti trasglutaminasa tisular (tTG2), anticuerpos antiendomisio (EMA) y anticuerpos antipéptidos deaminados de la gliadina (DGP). Actualmente el resto de anticuerpos que se utilizaban para el diagnóstico y seguimiento de la enfermedad celíaca han perdido relevancia. Cabe destacar que los anticuerpos antigliadina (AGA) aparecen elevados de forma característica tanto en la enfermedad celíaca como en otros trastornos relacionados con el gluten como son: la dermatitis herpetiforme, la ataxia cerebelosa causada por gluten, la alergia a gluten y los trastornos del espectro de la sensibilidad al gluten.
Existen varios estudios realizados en los últimos años que han demostrado una correlación positiva entre los niveles de tTG2 y la gravedad de la lesión histológica. Este hallazgo ha hecho que en la actualidad se hayan revisado los criterios diagnósticos de esta enfermedad y que pueda prescindirse de la biopsia intestinal en pacientes concretos.
En cuanto a los métodos empleados para su análisis es importante considerar que tanto los anticuerpos tTG2 como los DGP se detectan por técnicas automatizadas de enzimoinmunoensayo, mientras que los EMA se determinan por métodos manuales de inmunofluorescendia por lo que requieren un personal correctamente cualificado. Todos estos anticuerpos pueden presentarse en forma de IgA, IgG e incluso IgE. En general en la práctica clínica, se utilizan los tTG2 y EMA de tipo IgA y los DGP IgG. En caso de que exista un déficit de IgA podremos utilizar los anticuerpos de tipo IgG. Tanto los tTG2 como los EMA han demostrado tener una sensibilidad y especificidad mayor del 95%. Para la correcta interpretación de estos anticuerpos resulta obligatorio valorar una serie de aspectos para no malinterpretar un posible resultado negativo:
• Déficit de IgA
• Edad del paciente (en los pacientes menores de 2 años los tTG2 suelen ser negativos, a esta edad se realizará la determinación de los anticuerpos DGP IgG que presentan mayor rendimiento).
• Tiempo y cantidad de consumo de gluten (unas semanas con una dieta exenta de gluten pueden invalidar un resultado negativo).
• Tratamiento con inmunosupresores.
3. Estudio genético de susceptibilidad: la enfermedad celíaca tiene una fuerte predisposición genética por los heterodímeros HLA DQ2 y HLA DQ8. En la mayoría de las poblaciones estudiadas, más del 90% de los enfermos celiacos expresan el hetrodímero HLA-DQ2 codificado por los alelos DQA1*05 y DQB1*02, en posición cis, asociados a DR3 (DQ2.5) más común en Centroeuropa y el norte de Europa, o en trans, en heterocigotos DR5/DR7 (DQ7.5/DQ2.2) más frecuente en la cuenca mediterránea. Del resto de pacientes celiacos HLA DQ2 negativos, muchos de ellos presentan un segundo heterodímero de riesgo: el HLA-DQ8 (codificado por los alelos DQA1*03 y DQB1*0302, en cis y asociado a DR4), o son portadores de algunos de los alelos que codifican para los heterodímeros HLA-DQ2 por separado (DQA1*05 ó DQB1*02).
Es importante conocer que hasta el 25-30% de la población general tiene el heterodímero DQ2, por lo que su utilización para el diagnóstico de la enfermedad es limitada. La utilidad del estudio genético radica en su alto valor predictivo negativo, permitiendo descartar la enfermedad celíaca con un 99% de certeza en todos aquellos pacientes con dicho estudio negativo.
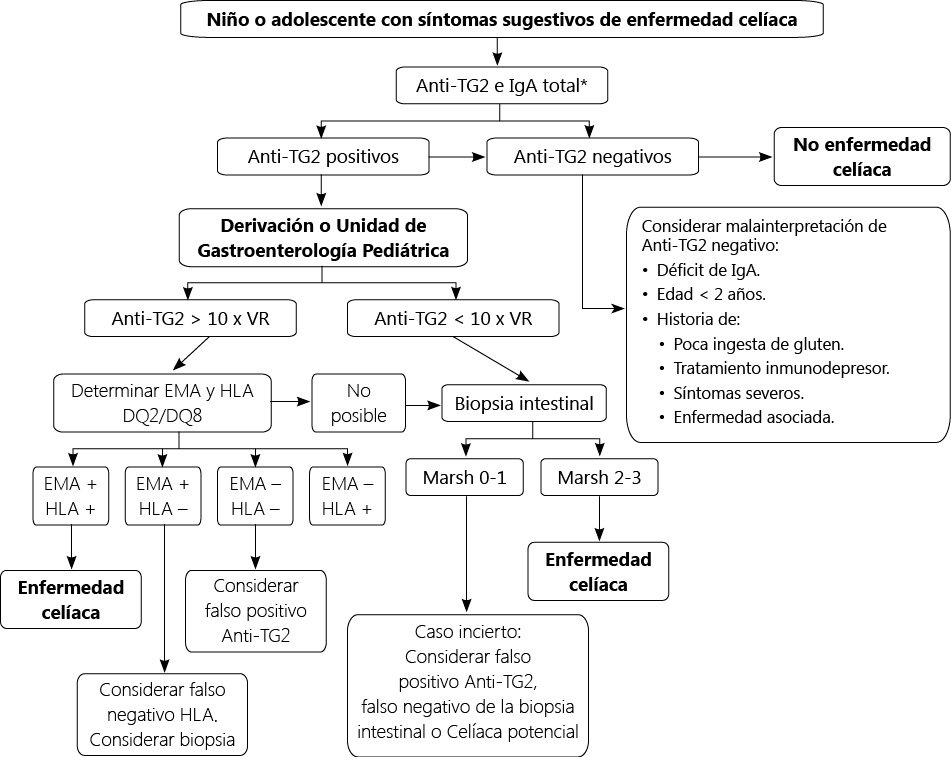
Los pacientes con sintomatología compatible con enfermedad celíaca, valores de tTG2 IgA diez veces por encima de su valor normal, EMA positivos y HLA-DQ2 y/o HLA-DQ8 positivos podrán ser diagnosticados de enfermedad celíaca sin necesidad de realizar biopsia intestinal
4. Biopsia intestinal: hasta la publicación de los últimos criterios diagnosticados propuestos por la ESPGHAN en el 2012, la biopsia intestinal se consideraba el gold estándar para el diagnóstico de la enfermedad celíaca en todos los casos. En la actualidad en los pacientes que cumplen todos los siguientes criterios: sintomatología compatible con enfermedad celíaca, valores de tTG2 IgA diez veces por encima de su valor normal, EMA positivos y HLA-DQ2 y/o HLA-DQ8 positivos; no estaría indicada la realización de biopsia intestinal. En todos los demás casos la biopsia intestinal deberá hacerse para evitar realizar diagnósticos incorrectos.
Las biopsias han de tomarse mediante endoscopia digestiva alta de la segunda y tercera porción del duodeno. Debido a que la afectación es característicamente parcheada se recomienda tomar al menos dos muestras de cada una de estas localizaciones.
Dentro del espectro lesional de la enfermedad celíaca podemos encontrar: la atrofia vellositaria, hiperplasia de las criptas, disminución de la relación vellosidad/ cripta, linfocitosis intraepitelial e infiltración de la lámina propia por células plasmáticas, linfocitos, mastocitos, basófilos y eosinófilos.
Sin duda, la clasificación propuesta por Marsh y modificada posteriormente por Oberhuber, ha contribuido a un mejor conocimiento del espectro lesional de la enfermedad celíaca, utilizándose hoy en día para el diagnóstico histológico. Estas lesiones no son patognomónicas de la enfermedad celíaca pudiéndose encontrar en otras entidades: alergia a proteínas de la leche de vaca, alergia a proteínas de la soja, diarrea crónica, parasitosis por Giardia Lamblia, inmunodeficiencias, esprue tropical y sobrecrecimeinto bacteriano.
Actualmente sólo las lesiones de Marsh 2, 3 y 4 se consideran consistentes para el diagnóstico de enfermedad celíaca. Las lesiones de bajo grado (Marsh 1) no son específicas ya que sólo el 10% de los individuos tienen finalmente esta enfermedad. En estos casos la positividad de los depósitos de tTG2 IgA en la mucosa o el aumento de los linfocitos γδ incrementan la probabilidad de enfermedad celíaca.
Nuevos criterios diagnósticos
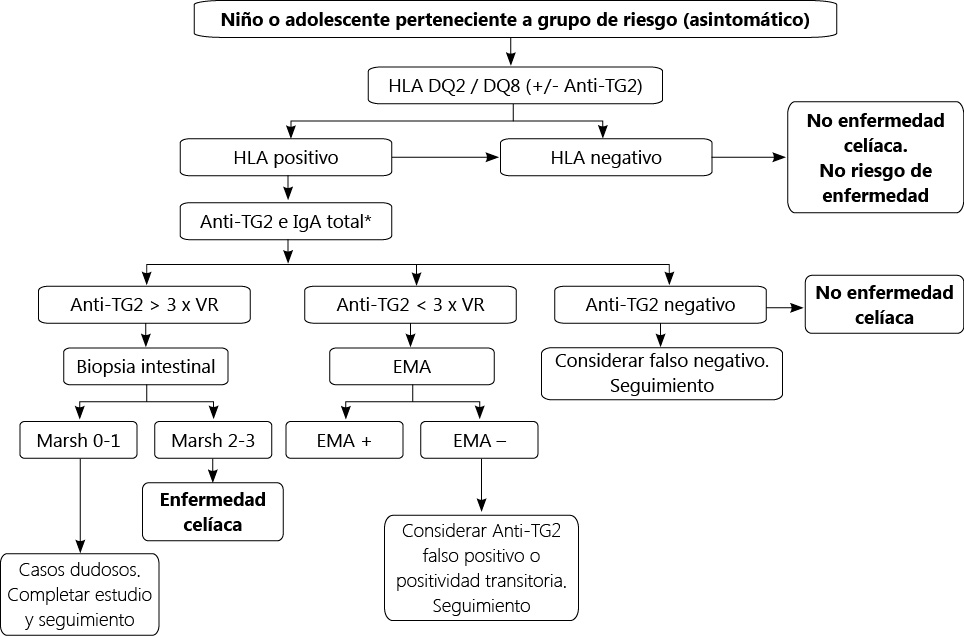
Como ya se ha comentado en este artículo en la actualidad se siguen los nuevos criterios diagnósticos publicados por la ESPGHAN. En ellos se diferencia muy claramente dos grupos de pacientes: los pacientes con sintomatología sugestiva de enfermedad celíaca y aquellos que presentan un riego genético o pertenecen a un grupo de riesgo. A continuación se detallan ambos algoritmos en las figuras 1 y 2.
En esta misma publicación quedan recogidas las situaciones en las que deberemos sospechar el diagnóstico de enfermedad celíaca y por tanto estaría indicada la realización de un cribaje mediante la determinación de los tTG2 (Tabla III).
El único tratamiento es la dieta estricta de exclusión de gluten de por vida, aunque existen muchas líneas de investigación con resultados prometedores
Tratamiento
El único tratamiento disponible en la actualidad para la enfermedad celíaca es la dieta de exclusión del gluten de manera estricta y de por vida. Se deberán eliminar los siguientes cereales: el trigo y sus especies (trigo duro, espelta o trigo verde o salvaje, Kamet y cucus), la avena, la cebada, el centeno y sus híbridos (triticale). El gluten está presente en hasta el 80% de los productos de consumo habitual bien de forma directa o bien de forma indirecta (aromatizante, espesante o aglutinante). Esto hace que la dieta sin gluten se base principalmente en una alimentación rica en alimentos naturales. Hoy en día, existen muchos productos manufacturados fabricados sin gluten, asociaciones que informan y asesoran a las familias y una normativa estricta que asegura la exención de cantidades de gluten perjudiciales en este tipo de alimentos. La Federación de Asociaciones de Celiacos de España (FACE) se encarga de actualizar y repartir entre sus socios la lista de aquellos alimentos que pueden consumirse sin riesgo alguno. En 2013 ha sido actualizada por última vez editándose con el nombre de “Lista de alimentos aptos para celiacos 2013”. Así mismo han editado una versión dirigida a los pacientes pediátricos este mismo año con el nombre de “La Chiquilista”.
Estos pacientes además precisarán de otros tratamientos dependiendo del estado de malabsorción y/o malnutrición pudiendo precisar en el tratamiento nutricional inicial dietas hipoalergénicas, hipercalóricas o pobre en fibra. En ocasiones, y debido al daño intestinal, existe un déficit de enzimas de pared por lo que se deberá excluir temporalmente la lactosa de la dieta hasta la recuperación de la lactasa de las vellosidades. La administración de suplementos de hierro u otros minerales o vitaminas vendrá condicionada también por el estado inicial y durante el seguimiento del paciente.
El mayor conocimiento de la fisiopatología de esta entidad ha abierto nuevas vías de investigación con diversos tratamientos que actualmente están en fase de estudio. Si estos tratamientos resultasen exitosos estos pacientes podrían reintroducir el gluten en la dieta en determinadas cantidades mejorando sustancialmente su calidad de vida. Entre estas terapias emergentes destacan: la fabricación de gluten modificado genéticamente, el inhibidor de la zonulina (larazótido acetato), la terapia de inducción a la tolerancia de gluten mediante inmunoterapia, la administración de determinadas cepas de probióticos, la administración de endoproteasas y los inhibidores de la transglutaminasa 2.
Complicaciones
Como ya se ha mencionado en el presente artículo, la prevalencia de enfermedades autoinmunes está aumentada en la enfermedad celíaca con respecto a la población general y se incrementa con la edad al diagnóstico, estando en relación con el tiempo de exposición al gluten.
En el momento del diagnóstico se han encontrado deficiencias de micronutrientes tales como el hierro, el cobre y el zinc que podrían estar implicados en las alteraciones neurológicas que pueden manifestar estos pacientes.
Entre las complicaciones más importantes destaca la disminución de la densidad mineral ósea (presentes hasta en 2/3 de los pacientes al debut de la enfermedad), lo que puede condicionar en los pacientes diagnosticados de forma tardía un aumento del riesgo de osteoporosis. Por ello los controles del metabolismo del calcio y la densitometría ósea deberían incluirse entre los controles de esta enfermedad sobre todo en pacientes con largos periodos de exposición al gluten.
Seguimiento
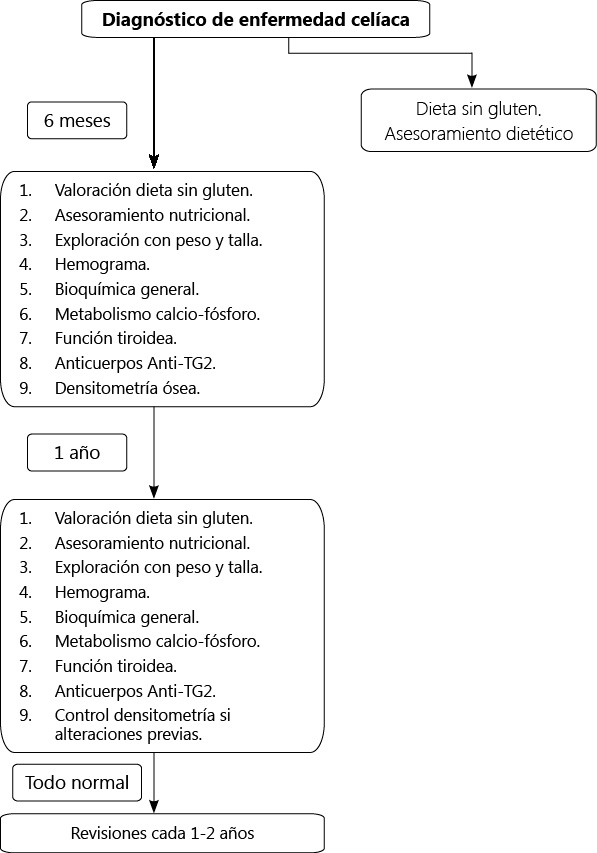
Dado que en la actualidad la única terapia posible es la dieta sin gluten, al diagnóstico de la enfermedad tanto el paciente como la familia deberán recibir asesoramiento dietético para la correcta realización de la dieta. La adhesión estricta a la dieta es fundamental para la recuperación clínica e histológica, sin embargo hay estudios que establecen que hasta en un 6%-37% de los casos existe una completa falta de adherencia. Por ello estos pacientes deben ser seguidos de forma regular para comprobar tanto la mejoría de los síntomas como la normalización de la determinación de anticuerpos. Se estima que el tiempo medio necesario para que los niveles de anticuerpos se normalicen es de entre 6 a 12 meses posteriores a la exclusión del gluten en la dieta. En general no será necesario realizar controles endoscópicos posteriores al diagnóstico, quedando reservados para aquellos pacientes en los que no haya una respuesta clínica (tras realizar una minuciosa revisión de la dieta).
En cuanto a la provocación con gluten, en la actualidad sólo debería plantearse en los casos en los que existan dudas en el diagnóstico. Se desaconseja realizarla antes de los 5 años de edad y durante la etapa de la pubertad para no interferir en el crecimiento ni en el desarrollo. Antes de iniciar la misma deberemos tener el estudio HLA y una biopsia intestinal para valorar el estado del duodeno. Durante el tiempo que dure la provocación, los pacientes deberán ingerir al día la cantidad normal de gluten (aproximadamente 15g/día). Mientras duré la provocación, se harán controles periódicos de tTG2 hasta dos años después de la reintroducción de gluten. Si tras este periodo no hay datos de recaída se dará por concluida la prueba de provocación.
Existe poca evidencia científica acerca del método más adecuado para el seguimiento de estos pacientes. Tras el diagnóstico el seguimiento clínico y la determinación de anticuerpos serológica se hará con menor frecuencia. Si existe una respuesta adecuada se irán espaciando los controles. De forma general los objetivos que perseguimos con el seguimiento son:
1. Comprobar la desaparición de la clínica, el crecimiento y desarrollo adecuado y la normalización analítica.
2. Realizar un control del seguimiento correcto de la dieta sin gluten por parte del paciente y su familia.
3. Detectar déficits y carencias nutricionales secundarias a la enfermedad y/o a la dieta de exclusión.
4. Diagnosticar la posible aparición de otras enfermedades asociadas a la enfermedad celíaca.
En la figura 3 queda resumida la periodicidad de los controles clínicos y analíticos.
Tablas y figuras
Tabla 1. Formas clínica de la enfermedad celíaca
|
Forma |
HLA DQ2 y/o DQ8 |
Enteropatía |
Anticuerpos |
Síntomas |
|
Sintomática |
+ |
+ |
+ |
+ |
|
Asintomática o silente |
+ |
+ |
+ |
– |
|
Latente |
+ |
– |
+/- |
+/- |
|
Potencial |
+ |
– |
+ |
+/- |
Tabla 2. Manifestaciones extradigestivas de la enfermedad celíaca
|
Mucocutáneas: — Dermatitis herpetiforme. — Estomatitis aftosa recidivante. |
|
Déficits nutricionales: — Déficit de hierro y ácido fólico. — Déficit de vitamina K. — Globales: fallo de Medro, edemas de piernas, calambres musculares, crisis de tetania… |
|
Trastornos del crecimiento y desarrollo: — Talla baja. — Pubertad restrasada. |
|
Trastornos neuropsiquiátricos: — Epilepsia y crisis de hipotonía. — Neuropatía periférica. — Trastornos del aprendizaje. — Cefaleas, neuropatía y trastornos del carácter. — Ataxia cerebelosa. |
|
Defectos del esmalte dentario. |
|
Osteoarticulares: — Osteopenia y osteoporosis. — Artritis. |
|
Enfermedad hepática: — Hepatitis reactiva (hipertransaminasemia criptogenética). |
|
Miscelánea: — Trastornos reproductivos y de la esfera sexual. — Hipoesplenismo (leucopenia y/o trombopenia. — Afectación tiroidea. — Diabetes mellitus. — Fatiga crónica. — Litiasis renal. — Pancreatitis. |
Tabla 3. Situaciones en las que deberemos investigar el diagnóstico de enfermedad celíaca
|
1. Niños y adolescentes que presenten los siguientes síntomas de etiología no filiada: a. Fallo de medro, estancamiento de peso, estancamiento de talla o talla baja. b. Diarrea crónica o intermitente. c. Retraso puberal, amenorrea. d. Anemia por déficit de hierro. e. Nauseas o vómitos, dolor abdominal crónico, distensión abdominal, estreñimiento crónico. f. Dermatitis herpetiforme. g. Alteración en la prueba de función hepática. h. Fatiga crónica. i. Aftosis bucal recurrente. j. Fracturas óseas ante traumatismos banales/ osteopenia/ osteoporosis. 2. Niños y adolescentes que pertenecen a alguno de los siguientes grupos de riesgo: a. Familiares de primer grado de individuos con enfermedad celíaca. b. Diabetes Mellitus tipo I. c. Síndrome de Down. d. Enfermedad tiroidea autoinmune. e. Déficit selectivo de IgA. f. Enfermedad hepática autoinmune. g. Síndrome de Turner. h. Síndrome de Williams. |
Figura 1. Algoritmo diagnóstico en niños/adolescentes con síntomas sugestivos de enfermedad celíaca
Figura 2. Algoritmo diagnóstico en niños/adolescentes asintomáticos pertenecientes a grupos de riesgo
Figura 3. Algoritmo de seguimiento de la enfermedad celíaca
Bibliografía
1. Husby S, Koletzko S, Korponay-Szabo I, Mearin L, Phillips A, Shamir R, et al. ESPGHAN guidelines for the diagnosis for coeliac disease in children and adolescents. An evidence-based approach. J Pediatr Gastroenterol Nutr. 2012; 54: 136-60.
2. Vitora JC, Bilbao JR. Novedades en enfermedad celíaca. An Pediatr (Barc). 2013; 78:1-5.
3. Sapone A, Bai JC, Ciacci C, Dolinsek J, Grenn P, Hadijavassiliou M, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Medicine.2012,10:13.
4. Román Riechmann E, Cilleruelo Pascual ML, Gutiérrez Junquera C. Epidemiología de la enfermedad celíaca. En: Polanco Allué I, editor. Enfermedad celíaca presente y fututo. Madrid: Ergón S.A.; 2013. p. 29-33.
5. Gujral N, Freeman HJ, Thomson A. Celiac disease: Prevalence, diagnosis, pathogenesis and treatment. World J Gastroenterol 2012 November 14; 18(42): 6036-6059.
6. Green PHR, Cellier C. Celiac disease. N Eng J Med. 2007; 357: 1731-3.
7. Tye-Din J, Anderson R. Inmunophatogenesis of celiac disease. Curr Gastroenterol Rep. 2008; Oct;10(5):456-65.
8. Polanco I, Mearin ML. Enfermedad celíaca. En: Argüelles F, et al, eds. Tratado de gastroenterología, hepatología y nutrición pediátrica aplicada de la SEGHNP. Madrid: Ergon; 2010. P.284-291.
9. Bousoño Garcia C. Manifestaciones extra-digestivas de enfermedad celíaca en la infancia. En: Polanco Allué I, editor. Enfermedad celíaca presente y fututo. Madrid: Ergón S.A.; 2013. p. 15-22.
10. Coronel Rodríguez C, Guisado Rasco MC. Enfermedad celíaca. Pediatr Integral. 2011; XV(2): 109-125.
11. Klapp G, Masip E, Bolonio N, Donat E, Polo B, Ramos D, Ribes-Koninckx. Celiac disease: the new proposed ESGHAN diagnostic criteria do work well in a selected population. J Pediatr Gastroenterol Nutr. 2013;56: 251–256
12. Reintroduction of gluten following flour transamidation in adult celiac patients: a randomized, controlled clinical study. Clin Dev Immunol. 2012.
13. Larazotide acetate in patients with coeliac disease undergoing a gluten challenge: a randomised placebo-controlled study. Aliment Pharmacol Ther. 2013
14. Effect of pretreatment of food gluten with prolyl endopeptidase on gluten-induced malabsorption in celiac sprue. Clin Gastroenterol Hepatol. 2005.
15. Live probiotic Bifidobacterium lactis bacteria inhibit the toxic effects induced by wheat gliadin in epithelial cell culture. Clin Exp Immunol. 2008
16. Are transglutaminase 2 inhibitors able to reduce gliadin-induced toxicity related to celiac disease? A proof-of-concept study. J Clin Immunol. 2013 Jan;33(1):134-42.
17. Martínez González MJ. Seguimiento del paciente pediátrico. En: Polanco Allué I, editor. Enfermedad celíaca presente y fututo. Madrid: Ergón S.A.; 2013. p. 15-22-
18. Egner W, Shrimpton A, Sargur R, Patel D, Swallow K. ESPGHAN Guidance on Coeliac Disease 2012: Multiples of ULN for decision making do not harmonise assay performance across centres. JPGN.2012; 55: 733-5.