El adolescente con enfermedad crónica digestiva.Transición de los cuidados médicos de la época pediátrica a la del adulto
El adolescente con enfermedad crónica digestiva.
Transición de los cuidados médicos de la época pediátrica a la del adulto
B. Espín Jaime.
Hospital Infantil Virgen del Rocío. Sección de Gastroenterología, Hepatología y Nutrición Pediátrica. UGC Pediatría. Sevilla.
Adolescere 2018; VI (2): 53.e9-53.e16
Resumen
|
Toda enfermedad digestiva de curso crónico que debute en la edad pediátrica y que prevalezca durante la edad adulta debe ser objeto de un proceso de transición que además de cumplir las características generales implícitas a cualquier modelo de transición, debe incluir elementos diferenciales derivados de las singularidades propias del ámbito digestivo. Existen recomendaciones en relación a aspectos diferenciales a tener en cuenta en la transición de pacientes con enfermedad inflamatoria intestinal y enfermedad celiaca, junto a escasas indicaciones específicas sobre cómo efectuarla en pacientes con esofagitis eosinofílica. Palabras clave: Adolescente; Gastroenterología; Enfermedad inflamatoria intestinal; Enfermedad celiaca. |
Abstract
|
Any chronic gastrointestinal disease with pediatric onset that prevails during adulthood must be object of a transition process that in addition to fulfilling the general characteristics implicit in any transition model, must include differential elements derived from the own singularities of the digestive field. There are recommendations regarding differential aspects to be taken into account in the transition of patients with inflammatory bowel disease and celiac disease, together with a few specific indications on how to perform it in patients with eosinophilic esophagitis. Key words: Adolescent; Gastroenterology; Inflammatory bowel disease; Celiac disease. |
Introducción
Los pacientes pediátricos afectos de una enfermedad crónica a medida que se aproximan a la adolescencia deben afrontar un proceso de adaptación relacionado con el traslado de una unidad pediátrica a una de adultos. Es un momento importante que lleva implícito una serie de cambios substanciales:
Los pacientes pediátricos afectos de una enfermedad crónica a medida que se aproximan a la adolescencia deben afrontar un proceso de adaptación relacionado con el traslado de una unidad pediátrica a una de adultos
- El paso de un modelo de atención de carácter más protector y paternalista, focalizado en la familia, en el que la toma de decisiones y el cumplimiento del tratamiento se encuentran fundamentalmente a cargo de los padres, a otro más independiente, centrado en el paciente, del que se espera que sea autónomo para tomar decisiones y responsabilizarse de su tratamiento. Dicho cambio genera habitualmente muchas dudas, temores e inseguridades tanto a los pacientes como a sus familias.
- La obligación por parte del paciente de asumir la responsabilidad de conciliar la vida social, escolar y el cuidado de su salud en una etapa en la que al adolescente con frecuencia le faltan las capacidades emocionales y madurativas necesarias para aceptar y entender por completo todos los aspectos de su enfermedad así como para cumplir adecuadamente con el régimen terapéutico.
- El cambio en los profesionales médicos. Con frecuencia a lo largo del proceso diagnóstico y en los años posteriores se llega a desarrollar una fuerte dependencia emocional del niño y la familia con el equipo pediátrico – médicos, enfermeras, otros profesionales – lo que conduce a una resistencia a abandonar el ámbito asistencial pediátrico.
Resulta de gran importancia por ello, efectuar este proceso de una forma programada, progresiva y consensuada con el paciente y la familia, tratando así de minimizar las repercusiones que dichos cambios puedan tener en la salud del adolescente(1,2).
Resulta de gran importancia por ello, efectuar este proceso de una forma programada, progresiva y consensuada con el paciente y la familia, tratando así de minimizar las repercusiones que dichos cambios puedan tener en la salud del adolescente
Procesos de transición de patologías digestivas
Existen pocas publicaciones sobre cómo efectuar el proceso de transición de pacientes con patologías digestivas. Hay que esperar a los últimos años para encontrar recomendaciones europeas por parte de varias Sociedades Italianas de Gastroenterología en 2015(3) y de la Sociedad Británica de Gastroenterología en 2017(4). Esta última incluye además la revisión de la evidencia publicada hasta el momento y la opinión de expertos mediante el método AGREE reconociendo como principales patologías subsidiarias de un proceso de transición programada junto a las enfermedades hepáticas crónicas, la enfermedad inflamatoria intestinal (EII), la enfermedad celiaca, la esofagitis eosinofílica y los trastornos funcionales gastrointestinales complejos.
A la hora de planificar el paso a adultos, en todas ellas debemos tener en cuenta una serie de circunstancias:
- Existen con frecuencia variaciones en cuanto al diagnóstico, pronóstico y asistencia continuada entre la presentación pediátrica y la del adulto(4.5). Dichas diferencias son especialmente evidentes en la EII y la enfermedad celiaca. En la primera por ejemplo destaca que al debut el fenotipo es más extenso, se efectúa un mayor uso de la nutrición enteral exclusiva para el control del brote inflamatorio en los casos de enfermedad de Crohn y los procedimientos endoscópicos generalmente se llevan a cabo bajo anestesia general mientras que en la celiaquía la aproximación diagnóstica es diferente, con una tendencia a efectuar menos exploraciones endoscópicas en la edad pediátrica y una mayor preocupación sobre complicaciones del orden tumoral en el adulto.
- La transición se ha identificado como un periodo vulnerable donde existe un mayor riesgo de desatención en diferentes ámbitos de la salud que pueden tener repercusiones importantes. Así, tanto la asistencia a los controles médicos como la tasa de adherencia al tratamiento y las dietas de exclusión (en el caso de pacientes celiacos y con trastornos eosinofílicos) durante la adolescencia son más bajas que en otras edades o estadios del desarrollo previos, con el consiguiente riesgo de descompensación de su enfermedad de base y desarrollo posterior de complicaciones (en los casos de EII la necesidad de tratamiento quirúrgico aumenta y, al igual que en pacientes celiacos, hay una mayor frecuencia de anemia, disminución del potencial de crecimiento y de densidad mineral ósea)(4).
- Un objetivo importante debe ser tratar de minimizar los riesgos reseñados en el apartado anterior y en este sentido existen algunos estudios que muestran beneficios derivados de la puesta en marcha de forma planificada de un programa de transición. En 2012, Cole y colaboradores publican los datos del seguimiento de 72 pacientes diagnosticados en edad pediátrica de EII, de los que una parte fueron transferidos a servicios de adultos mediante un programa formal de transferencia y otros no, encontrando mejores tasas en los primeros en relación a la adherencia al tratamiento, el número de ingresos, la necesidad de cirugía en los dos años posteriores y la proporción de pacientes que alcanza el máximo potencial de crecimiento(6).
Se han demostrado mejores resultados en la EII cuando se hace la transición programada versus si se deja al paciente a su voluntad
Barreras de la transición
La percepción del proceso por parte de las personas implicadas en él es muy diferente. Por una parte el paciente y su familia muestran con frecuencia su reticencia a un cambio que incluye no solo al personal médico referente sino también en ocasiones el centro hospitalario, los controles de la enfermedad y la forma de efectuar pruebas complementarias. El adolescente puede también experimentar un sentimiento ambivalente al desear, por un lado, ser tratado en un ambiente más adecuado a sus expectativas de independencia, pero por otro lado desconfiar de un nuevo equipo que le es ajeno. Por el contrario, los padres por regla general tratan de retrasar el paso a un gastroenterólogo de adultos al que con frecuencia perciben como alguien menos implicado o sensibilizado respecto a las necesidades sociales y personales del paciente. Realizar la transición les hace enfrentarse al hecho de que van a tener menos papel protagonista en el cuidado de su hijo pues el manejo del paciente adulto se basará fundamentalmente en el consenso entre el facultativo y el paciente.
Junto a las reticencias derivadas del adolescente y su familia, la visión que del proceso de transferencia tienen los facultativos implicados en el mismo suele dificultar aún más su adecuado desarrollo. Así, en un estudio realizado en Gran Bretaña cuyo objetivo era tratar de identificar las principales barreras existentes en un programa de transición en EII los autores pusieron de manifiesto la diferente percepción que del mismo tenían los facultativos pediátricos y los de adultos(7). Mediante cuestionario postal encontraron que el desarrollo de un programa estructurado de transición era considerado como muy importante por el 80% de los pediatras, en comparación con sólo el 47% de los facultativos de adultos (p=0.001). Una mayor proporción de gastroenterólogos de adultos identificaba una inadecuada preparación de los adolescentes a la hora de realizar la transferencia (79% vs 42%, p=0.001) siendo las principales áreas de deficiencia percibidas el desconocimiento de la enfermedad y la falta de autonomía. Ambos grupos de profesionales reconocían como principales barreras para el desarrollo de un programa de transición la falta de recursos, de tiempo y de apoyo por parte de otros servicios. Por último, tanto los pediatras (62%) como los mismos gastroenterólogos de adultos (65%) reconocían una preparación subóptima en medicina del adolescente por parte de los facultativos de adultos.
Modelos de transición
En la actualidad no existe un único modelo que sea unánimemente recomendado. Existen diferentes formatos, cuya idoneidad y eficacia dependerán de la patología, los recursos y el ámbito en el que se desarrollen. Teniendo en cuenta que no deben considerarse excluyentes, los modelos más empleados son:
Existen diferentes formatos, cuya idoneidad y eficacia dependerán de la patología, los recursos y el ámbito en el que se desarrollen
- Intercambio de información entre el gastroenterólogo pediátrico y el digestivo de adultos sobre el historial médico más relevante del paciente. Constituye el formato más fácil pero recomendable solo como complemento a cualquiera de los dos referidos a continuación.
- Programación de visitas conjuntas atendidas por los facultativos del área pediátrica y de adultos. El número de las mismas será variable, siendo recomendable que las primeras sean dirigidas desde el ámbito pediátrico mientras que las últimas lo sean desde el ámbito de adultos.
- Creación de una consulta específica de transición que sirve como eje central en la preparación del adolescente para el traspaso, habitualmente coordinada por personal de enfermería especializada, y en la que participan a lo largo de un periodo de tiempo, de forma integrada, el resto de personal implicado: pediatra, gastroenterólogo de adultos, nutricionista, psicólogo…
Independientemente del modelo que se adopte de transición, el solapamiento entre la atención pediátrica y la de adultos es el elemento fundamental sobre el que vertebrar todo el proceso que debe incluir además(1,2):
- Individualización del proceso, en base a la experiencia local, personal, los recursos, y la geografía. Las características del entorno sanitario en el que nos movamos – nivel del centro hospitalario, recursos técnicos y profesionales disponibles – condicionaran de forma determinante los aspectos organizativos de la transición.
- Flexibilidad. Es difícil definir cuál es la edad idónea para efectuar el inicio de la transición ya que si bien la edad cronológica es un factor importante, no debe ser el único factor a tener en cuenta, considerándose que otros tales como la madurez emocional y física, puntos de vista del adolescente la visión de los padres/cuidadores, el estado de actividad de la enfermedad, la adherencia al tratamiento, el grado de autonomía en el manejo de la enfermedad, así como el entorno socio-familiar son determinantes a la hora de decidir el momento adecuado.
- Continuidad. Es importante plantear el proceso de transición 1 ó 2 años antes de la derivación, y articularlo en 3 fases:
- Fase I o preparatoria. Implica comenzar la educación tanto del paciente como de la familia en el proceso de transición con el objetivo de aumentar gradualmente su autonomía en el manejo de la enfermedad. Al finalizar la misma, los pacientes deberán conocer las características de su enfermedad, ser capaces de reconocer la aparición de síntomas o de las complicaciones relacionadas con la misma, así como, entender los fundamentos del tratamiento y los efectos secundarios relacionados con los fármacos prescritos. Su duración por tanto, estará muy ligada al tiempo que tarden en conseguirse estos objetivos.
- Fase II o propiamente de transición. Debe empezar cuando se considere que el paciente está listo para ser remitido a adultos, ha alcanzado la independencia en el manejo de su enfermedad y/o ha alcanzado la madurez generalmente dentro del rango de edad entre los 16 y 20 años. Dependiendo de la enfermedad específica y de la gravedad de ésta, el momento de transición se puede alargar, ya que no es recomendable realizar la derivación cuando el paciente está inestable o en una fase aguda de la enfermedad.
- Fase III o post-transición. El traspaso es completo aunque el pediatra debe permanecer disponible para posibles revisiones y la discusión de aspectos del caso.
- El papel crucial de un coordinador de transición designado para supervisar el proceso es un tema recurrente en la literatura y como ya se ha comentado, suele calificarse como el componente clave del programa permitiendo el solapamiento entre la atención pediátrica y la del adulto.
- Herramientas que permitan la preparación y evaluación para la transferencia (programas de educación específicos, implicación de asistentes sociales y/o psicólogos, grupos de apoyo, textos informativos, listas de verificación de habilidades, consultas conjuntas y/o multidisciplinares), cuyo empleo dependerá en gran medida de las características y recursos del centro y que van encaminadas fundamentalmente a potenciar:
- El conocimiento de la enfermedad por parte del adolescente.
- La identificación de áreas de debilidad que requieran mayor soporte durante el programa de transición.
- La obtención de habilidades del paciente en el manejo de su enfermedad.
- Abordaje de temas que ocasionan gran preocupación en el adolescente: el propio proceso de transición, la repercusión que en su imagen corporal tienen tratamientos o la propia enfermedad, el acceso a drogas, alcohol y tabaco así como las complicaciones derivadas de su consumo, la afectación en la calidad de vida y en la esfera emocional, preguntas sobre el área sexual y la posible repercusión que la patología puede tener en su futura descendencia, etc…
- Control mediante auditorías que deben ser regulares para localizar debilidades y facilitar mejoras e incluir la evaluación de un número de pacientes que acceden al programa, el impacto del mismo y el grado de satisfacción del paciente. La tasa de ingresos, el uso de los servicios de soporte, asistencia a las revisiones, uso de esteroides, adherencia a la medicación, satisfacción del paciente… pueden ser potenciales medidas a considerar para valorar el impacto.
Es difícil señalar la edad óptima de hacer la transición
Dado el conocimiento que tienen los adolescentes de las nuevas tecnologías, es imprescindible usarlas en el control y educación para la salud
Las tecnologías móviles y de la web han pasado a ser en la actualidad esenciales en la forma de comunicación entre adolescentes, por lo que su incorporación en la transición ofrece ventajas como más rapidez en la comunicación sobre su estado de salud, mejor y más fácil acceso a citaciones y enlaces a textos de interés relacionados con su enfermedad, todo ello a bajo coste y con la capacidad para superar la mayoría de las barreras geográficas.
Aspectos específicos de los procesos de transición en Gastroenterología
Fuera de las recomendaciones genéricas establecidas para todo proceso de transición, existen pocas que sean específicas sobre las patologías dentro del área de la Gastroenterología:
EII
Son especialmente reseñables las recomendaciones publicadas en 2002 por la Sociedad Norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica (NASPGHAN)(8), los objetivos deseables a alcanzar en base a la edad postulados por Hait y cols en 2006(9) y las guías clínicas sobre transición en EII, también norteamericanas, publicadas en 2011(10). (TABLAS I y II)
Todos ellos hacen especial hincapié en la implicación de los profesionales en el proceso, la planificación del mismo y la necesidad de enfatizar sus beneficios. Asimismo, resaltan que debe transmitirse la necesidad de un seguimiento por un facultativo experto en una serie de problemas relacionados con la EII que normalmente no son tratados por pediatras como fertilidad, vida sexual, embarazo y prevención del cáncer colorrectal, así como de otros problemas de salud habituales en la edad adulta no relacionados directamente con la enfermedad.
Es necesario tratar temas como fertilidad, vida sexual, embarazo y prevención del cáncer colorrectal
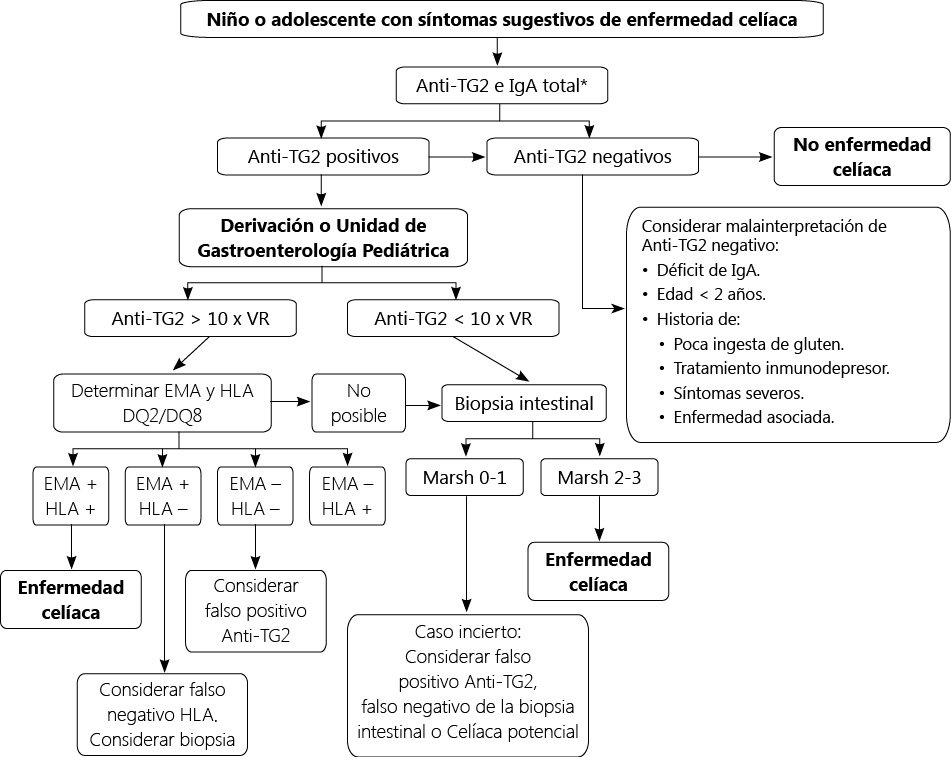
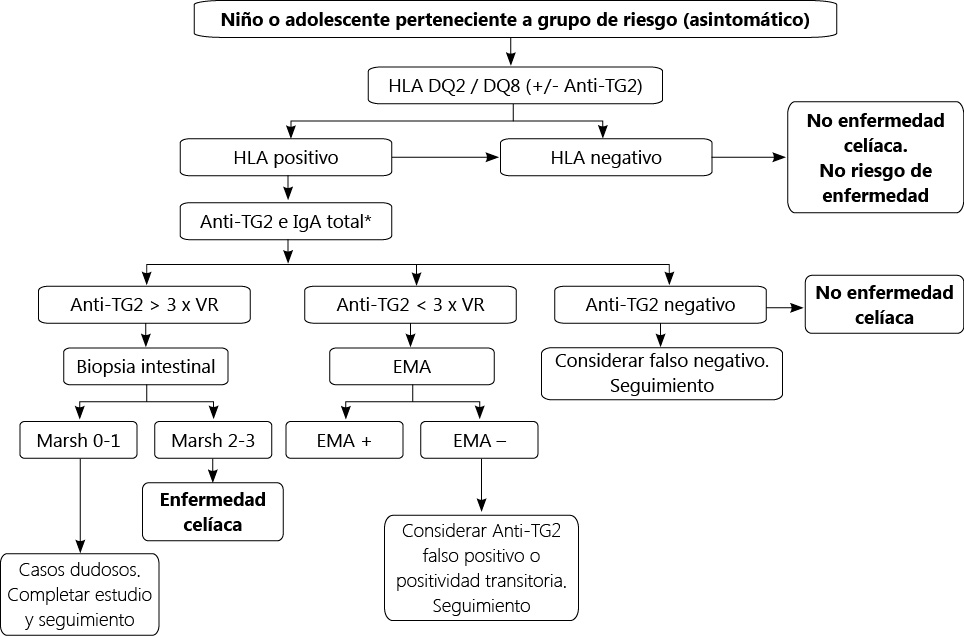
Enfermedad celiaca
Las recomendaciones en cuanto a las características específicas del proceso de transición en el paciente celiaco se resumen en un documento de consenso publicado en 2016 realizado por un grupo de 17 expertos de 10 países (Suecia, Italia, Alemania, Noruega, Dinamarca, Holanda, Gran Bretaña, Estados Unidos, Australia e Israel) y 2 representantes de organizaciones de pacientes (Asociación de Sociedades Europeas de Celiaquía y la Fundación de Enfermedad Celiaca de Estados Unidos)(11).
En él se resaltan aspectos especialmente importantes que siempre deben plantearse ante un adolescente celiaco y que se resumen en:
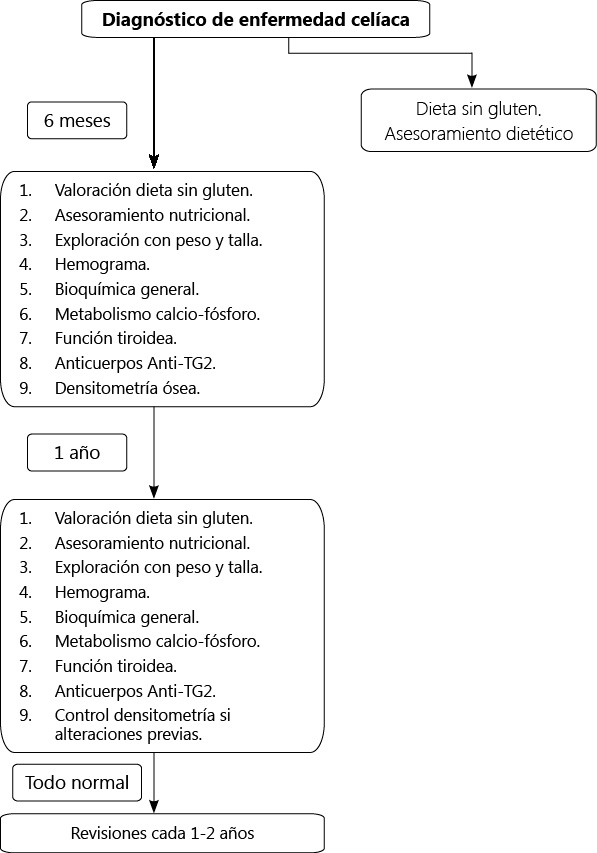
- Ofrecer información al paciente y su familia en relación a las consecuencias que puede tener la realización incorrecta de la dieta en la salud ósea, la fertilidad y el desarrollo de complicaciones tumorales (Tabla III).
- Valoración de la necesidad de efectuar una densitometría ósea antes de efectuar el paso a una unidad de adultos en los casos de mala adherencia a la dieta de exclusión y en aquellos en los que se hayan constatado alteraciones en la densidad mineral ósea previamente.
- De forma consensuada establecer qué medidas son necesarias en el seguimiento y si es necesario efectuar exploraciones endoscópicas. Se debe considerar la realización de una gastroscopia previa a la transición en 4 supuestos: dudas en el diagnóstico, mala adherencia a la dieta, deseo de conocer el estado histológico de la mucosa intestinal y presencia de síntomas que sugieran una enfermedad celiaca activa u otra patología.
Esofagitis eosinofílica
No se han publicado recomendaciones específicas en la esofagitis eosinofílica más allá de un programa diseñado para la transición de estos pacientes en un centro norteamericano y en el que se resaltan como elementos específicos importantes la necesidad de implicar en el proceso a alergólogos, endoscopistas y dietistas junto a la insistencia en mantener una adecuada adherencia a las medidas terapéuticas (12).
Tablas y figuras
Tabla I. Lista de objetivos a conseguir por parte del paciente afecto de EII y los facultativos que lo atienden
|
Edad |
Paciente |
Equipo médico |
|
11-13 años |
|
|
|
14-16 años |
|
|
|
17-19 años |
|
|
|
20-23 años |
|
|
Modificado de Haitet al(9)
Tabla II. Recomendaciones en el proceso de transición de la EII dirigidas a los facultativos
|
Recomendaciones para el gastroenterólogo pediátrico: |
|
|
Recomendaciones para el gastroenterólogo de adultos: |
|
Modificado de Leung et al(10).
Tabla III. Objetivos específicos y temas a debatir en la transición de pacientes con enfermedad celiaca
|
Objetivos a alcanzar durante la transición en la enfermedad celiaca |
|
|
Temas a plantear durante la transición en la enfermedad celiaca |
|
Modificado de Ludvigsson et al (11).
Bibliografía
1. Cooley WC, Sagerman PJ, Barr MS, Ciccarelli M, et al. American Academy of Pediatrics, American Academy of Family Physicians and American College of Physicians, Transitions Clinical Report Authoring Group. Clinical Report—Supporting the Health Care Transition From Adolescence to Adulthood in the Medical Home. Pediatrics 2011;128:182–200.
2. Nagra A, McGinnity PM, Davis N, Salmon AP. Implementing transition: Ready Steady Go. Arch Dis Child Educ Pract Ed 2015; 100: 313–320.
3. Elli L, Maieron R, Martelossi S, Guariso G, Buscarini E et al. Transition of gastroenterological patients from paediatric to adult care: a position statement by the Italian Societies of Gastroenterology. Dig Liver Dis 2015; 47(9): 734-40.
4. Brooks,AJ, Smith PJ, Cohen R, Collins P, Douds A, Forbes V et al. UK guideline on transition of adolescent and young persons with chronic digestive diseases from paediatric to adult care. Gut 2017; 66: 988–1000.
5. Martin de Carpi J. Transicion a los cuidados del adulto. Enfermedad Inflamatoria Intestinal al día 2012; 11(187-195).
6. Cole R, Ashok D, Razack A, et al. Evaluation of outcomes in adolescent inflammatory bowel disease patients following transfer from pediatric to adult health care services: case for transition. J Adolesc Health 2015; 57: 212–17.
7. Sebastian S, Jenkins H, Mccartney S, et al. The requirements and barriers to successful transition of adolescents with inflammatory bowel disease: differing perceptions from a survey of adult and paediatric gastroenterologists. J Crohns Colitis 2012;6:830–44.
8. Baldassano R, Ferry G, Griffiths A, Mack D, Markowitz J, Winter H. Transition of the patient with Inflammatory Bowel Disease from pediatric to adult care: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2002; 34: 245-8.
9. Hait E, Arnold JH, Fishman LN. Educate, communicate, anticipate. Practical recommendations for transitioning adolescents with IBD to adult health care. Inflamm Bowel Dis 2006;12:70-3.
10. Leung Y, Heyman MB, Mahadevan U. Transitioning the adolescent inflammatory bowel disease patient: guidelines for the adult and pediatric gastroenterologist. Inflamm Bowel Dis 2011; 17: 2169–73.
11. Ludvigsson JF, Agreus L, Ciacci C, et al. Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Gut 2016;65:1242–51.
12. Dellon ES, Jones PD, Martin NB, et al. Health-care transition from pediatric to adult-focused gastroenterology in patients with eosinophilic esophagitis. Dis Esophagus 2013; 26: 7–13.