Guía clínica: Escroto vacío
Guía clínica: Escroto vacío
A.L. Luis Huertas, R. Espinosa Góngora, C. Riñón Pastor.
Servicio de Cirugía pediátrica. Hospital Infantil Universitario Niño Jesús. Madrid.
Fecha de recepción: 15 de septiembre 2017
Fecha de publicación: 30 de octubre 2017
Adolescere 2017; V (3): 66-74
Resumen
|
La situación de escroto vacío, o ausencia de testículos en la bolsa escrotal, se produce principalmente por causas relacionadas con alteraciones en el desarrollo o descenso testicular, como ocurre en los casos de agenesia, atrofia, maldescenso o criptorquidia congénitas. En un menor número de casos, la causa es adquirida, secundaria a torsión testicular o a un mal descenso testicular adquirido. Estas situaciones requieren siempre tratamiento quirúrgico, y deben diferenciarse de los casos de testículos retráctiles, en los que no es necesario ningún tratamiento. Las secuelas y complicaciones más importantes a largo plazo, son la infertilidad y el cáncer testicular, más probables a medida que se retrasa el tratamiento en el tiempo. El riesgo de malignización es máximo ante la presencia de restos testiculares atróficos intraabdominales, por lo que está indicada su extirpación por vía laparoscópica. En las situaciones de testículos no descendidos viables, el tratamiento indicado es la orquidopexia, que además de disminuir los riesgos de malignización e infertilidad, permiten la exploración adecuada del testículo en su situación adecuada en el escroto. Palabras clave: Criptorquidia; mal descenso testicular; orquidopexia. |
Abstract
|
Empty scrotum or non-palpable testicles in the scrotal sacs, is mainly produced by causes related to anomalies in testicular development or its descent to scrotum, such as in testicular agenesis, atrophy or congenital cryptorchidism. Fewer cases are produced by acquired causes, after testicular torsion processes or due to acquired undescended testicles. In all these patients, a surgical treatment is indicated, and the possibility of retractile testicles must be ruled out, since no treatment is indicated in the latter. The most important long-term sequelae and complications are male infertility and testicular cancer, more likely when delayed treatment is carried out. Laparoscopic extirpation of atrophic testes is indicated to avoid the high risk of malignant tumor development in intraabdominal gonads. In viable testes, orchidopexy is the treatment of choice. It decreases the probability of testicular malignant degeneration and male infertility and allows the adequate palpable teste exploration in its normal scrotal location. Key words: Cryptorchidism; undescended testes; orchidopexy. |
Concepto
El escroto vacío se define como la ausencia de testículos palpables en el escroto durante la exploración física. Puede ser unilateral, más frecuente, o bilateral.
El escroto vacío se define como la ausencia del testículo palpable en el escroto. Requiere siempre un tratamiento quirúrgico, excepto en los casos debidos a testículos retráctiles o en ascensor
Clasificación
— Agenesia Testicular: se produce por la falta de formación y desarrollo testicular durante el período embrionario, que conlleva a la ausencia total de testículo: anorquia.
— Atrofia testicular: en estos casos, el testículo se ha formado durante la gestación, pero debido a algún proceso vascular isquémico, prenatal o postnatal, éste sufre atrofia progresiva hasta su desaparición. En ocasiones, permanecen mínimos restos atróficos en el escroto, que pueden palparse o no, a la exploración.
— Maldescenso testicular Congénito: el testículo no desciende hasta la bolsa escrotal durante el desarrollo embrionario, y se localiza en cualquier punto del trayecto normal hacia el escroto. Puede localizarse en la cavidad intraabdominal (criptorquidia vera), o a lo largo del trayecto inguinal.
Suele producirse de forma aislada, y en los casos más severos (intraabdominales o bilaterales), es más frecuente su asociación a otras anomalías congénitas, o ser signo de endocrinopatías, de alteraciones cromosómicas o alteraciones del desarrollo sexual.
— Testículo no descendido adquirido: ocurre cuando el testículo desciende normalmente a la bolsa escrotal durante el primer año de vida, pero vuelve a ascender situándose fuera del escroto en etapas posteriores. Se debe en la mayoría de los casos a la falta de crecimiento del cordón espermático, que permanece corto en relación con el crecimiento del niño, y retrae el testículo.
— Testículos en ascensor o retráctiles: la gónada se ha formado y ha descendido a su localización normal y la ausencia de palpación del testículo en el escroto se debe a un reflejo cremastérico exagerado intermitente que lo sitúa en la región inguinal ocasionalmente. El testículo desciende al escroto de manera espontánea o a la tracción manual con facilidad.
Etiopatogenia
La agenesia y el maldescenso testicular congénito
Se producen como consecuencia de fallos en la formación y desarrollo de los testículos o en el descenso normal al escroto, durante el desarrollo embrionario. Alteraciones genéticas u hormonales o causas ambientales, durante este período, pueden afectar a pasos “clave” en estas etapas, dando lugar a esta patología(1).
— Causas genéticas: Esta patología puede estar relacionada con diferentes alteraciones cromosómicas, como el Síndrome de Klinefelter, o con alteraciones estructurales del cromosoma Y. Se han descrito síndromes en los que la criptorquidia constituye un rasgo clínico: Síndrome de Noonan, Prader-Willi, Beckwith-Wiederman, entre otros.
Alteraciones en la secreción de la hormona antimulleriana (AMH) secundarias a disfunciones en la activación del factor transcripcional SRY, y de otros como: WT1, SF1, SOX9, FGF9 y DAX1, producen alteraciones en la diferenciación de los genitales internos, en la secreción de testosterona y en su transformación a dehidrotestosterona, que influye a su vez, en el desarrollo de los genitales externos y en el descenso testicular.
También las mutaciones en el gen INSL-3 (“insulina-like factor 3”) y en su receptor LGR8, involucrados en la masculinización del gubernaculum testis, se asocian a criptorquidia.
— Factores ambientales: La prematuridad o el bajo peso al nacer influyen en el desarrollo de la criptorquidia no sindrómica. Así mismo, el contacto con sustancias químicas como: pesticidas, filatos, y talatos (constituyentes en algunos plásticos), con propiedades estrogénicas, podrían afectar el descenso testicular al actuar como disruptores endocrinos interfiriendo la síntesis o acción de los andrógenos.
Atrofia testicular
Fundamentalmente se debe a un accidente vascular isquémico que necrosa el tejido testicular y éste queda atrófico o desaparece. La causa más frecuente es la torsión testicular producida por una mala fijación del testículo en el escroto, que permite el giro del testículo sobre sí mismo estrangulando el cordón espermático e impidiendo el aporte sanguíneo adecuado a la gónada. La torsión testicular puede ocurrir a cualquier edad, aunque es más frecuente en el periodo perinatal y en torno a la pubertad.
Diagnóstico
La anamnesis y una correcta exploración física son fundamentales para el diagnóstico del escroto vacío. En la mayoría de las ocasiones no son necesarias pruebas complementarias adicionales en el enfoque y tratamiento de esta patología(2).
Anamnesis
Se debe reflejar en la historia clínica:
• Antecedentes familiares de criptorquidia u otras alteraciones relacionadas con defectos en el desarrollo genital: trastornos de la diferenciación sexual, hipospadias, entre otros.
• Antecedentes obstétricos: edad gestacional, peso al nacimiento, ingesta o contacto con fármacos antiandrogénicos.
• Información sobre el momento en el que se apreció la ausencia del testículo en la bolsa escrotal, y si se describe como unilateral o bilateral.
Exploración Física
Es aconsejable realizar la exploración en un ambiente cálido y relajado, intentando tranquilizar al paciente y disminuir su ansiedad. El paciente debe estar en decúbito supino con las piernas en ligera abducción. En caso de duda se puede explorar en posición de “cuclillas” o bien realizar la exploración de Taylor (niño sentado con las piernas cruzadas).
Palpación de la zona inguino-escrotal: se deslizarán los dedos a lo largo del canal inguinal hasta la base del escroto para detectar el testículo. Valorar:
• Si el testículo está en el canal inguinal.
• Si existe asimetría o hipoplasia de la bolsa escrotal.
• En el caso de que se haya palpado el testículo en algún punto del canal inguinal: se explorará el tamaño, la consistencia y la movilidad del mismo, valorando si es posible su descenso al escroto mediante tracción manual; y si permanece o reasciende al soltar la tracción.
Estudios hormonales
Deben realizarse ante la presencia de criptorquidia unilateral asociada a otras anomalías o criptorquidia bilateral, para descartar una deficiencia en el desarrollo sexual.
• Cariotipo.
• Gonadotropinas y testosterona basales.
• Inhibina B y AMH: son marcadores de integridad de las células de Sertoli, y se pueden detectar durante el periodo prepuberal.
• Estímulo con HCG (hormona gonadotropina coriónica). Mediante esta prueba se miden los niveles de testosterona tras la administración de hCG, considerándose una respuesta normal cuando duplican los niveles de testosterona.
Esta prueba tiene un valor predictivo positivo del 89% y negativo del 100%, por lo que negatividad es diagnóstica de anorquia, y su positividad sugiere la presencia de testículo de tamaño suficiente para intentar la orquidopexia. Actualmente, no disponemos de HCG en nuestro país, pero se puede solicitar por medicación extranjera.
Pruebas de imagen
Se solicitarán pruebas de imagen en caso de dudas diagnósticas, cuando no sea posible palpar el teste en la exploración física o cuando se asocien otras alteraciones en los genitales externos. La ecografía abdomino-pélvica permite visualizar la presencia de testículos en la zona inguinal. Es la prueba de imagen habitualmente utilizada en los casos en los que el testículo no es palpable en la raíz escrotal o en la región inguinal. Sin embargo, el hecho de no identificar el testículo, no descarta su existencia, por lo que siempre será necesaria la exploración quirúrgica en estos casos.
Consideraciones pronósticas: fertilidad y cáncer testicular
Desde hace décadas es sabido que los pacientes con criptorquidia presentan mayor riesgo de infertilidad y de malignización testicular en la gónada afecta a largo plazo. De hecho, la mayoría de las investigaciones de los últimos años se relacionan con la capacidad reproductiva, y con la posibilidad del desarrollo de cáncer testicular durante la edad adulta.
Los pacientes con criptorquidia tienen mayor riesgo de infertilidad y cáncer testicular en la edad adulta, más frecuente aún en los casos no tratados en la pubertad
A pesar de que los resultados de las publicaciones más recientes apoyan la práctica de la orquidopexia a edades tempranas (antes de los 12- 18 meses de edad) en base a una posible mejora de la espermatogénesis, y a un descenso en el riesgo de malignización, no existen aún estudios prospectivos que puedan demostrar el pronóstico real de estos pacientes en cuanto a estos dos aspectos(3).
Fertilidad
Se ha demostrado que los pacientes con criptorquidia bilateral tienen peor pronóstico en cuanto a la fertilidad, haciendo suponer que en los casos unilaterales el testículo sano contralateral suple la deficiencia del testículo no descendido. Así, se han descrito alteraciones de la fertilidad en el 33% de los casos unilaterales y en 66% de los bilaterales.
Se han documentado fallos en la maduración andrógeno-dependiente de las células germinales a espermatogonias en los testículos criptorquídicos, dando lugar a un descenso en el recuento de células madre para las etapas de espermatogénesis postpuberal. Sin embargo, no se ha podido demostrar una relación estadísticamente significativa entre los hallazgos histológicos en el momento de la orquidopexia y parámetros de fertilidad (niveles hormonales y seminogramas) en la edad adulta, por lo que actualmente no se recomienda realizar biopsias testiculares para predecir la futura fertilidad(4).
Cáncer testicular(5)
Como se ha comentado anteriormente, la criptorquidia es un factor de riesgo para el desarrollo de tumores testiculares a partir de la pubertad. Aunque las cifras de riesgo varían mucho entre las distintas publicaciones, la mayoría sitúan esta probabilidad en torno al 5%-10% de pacientes adultos con cáncer testicular e historia previa de criptorquidia en la infancia. Además, se acepta que este riesgo aumenta cuanto más tarde se realice la corrección quirúrgica, y que es máximo si el testículo se ha descendido en el momento de la pubertad o posteriormente, o si permanece criptorquídico. Otras situaciones que aumentan el riesgo de padecer tumores testiculares en la edad adulta son: la localización intraabdominal del testículo no descendido, y la bilateralidad.
Por otro lado, no se ha demostrado mayor riesgo de malignización en el testículo contralateral, localizado en su localización escrotal normal.
Los tumores testiculares asociados a testículos maldescendidos suelen presentarse entre los 20 y 40 años de edad y el tipo histológico más frecuentemente descrito es el seminoma.
Aunque se han descrito factores ambientales, como la exposición a la elevada temperatura intraabdomninal del testículo no descendido; se desconocen aún sus mecanismos de influencia, o la existencia de otros factores en el microambiente gonadal, que favorezcan el proceso de carcinogénesis del testículo cripotorquídico.
Tratamiento
El objetivo del tratamiento de los testículos no descendidos es la colocación del testículo en su posición escrotal normal con el objetivo de disminuir el riesgo de secuelas y complicaciones futuras, como: infertilidad, torsión, traumatismos o cáncer testicular. Así mismo, la colocación del testículo en la bolsa escrotal permite la accesibilidad del testículo a la palpación y su correcta exploración ante cualquier tipo de patología, evitando diagnósticos tardíos de situaciones graves como la torsión o el cáncer testicular(6).
Aunque tradicionalmente se han aplicado tratamientos médicos con gonadotropinas, en la actualidad, el tratamiento indicado en el maldescenso testicular congénito es siempre quirúrgico. La cirugía permite la exploración y valoración del parénquima y estructura del teste o restos testiculares si los hubiera, la confirmación de la existencia o no de un proceso vaginal persistente (cpvp: pliegue peritoneal que acompaña a los testículos en su descenso desde el abdomen durante la gestación), además de la posibilidad de descender el testículo a escroto. La eliminación de tejido testicular atrófico, malformado y no viable y el cierre mediante ligadura de este proceso vaginal, evitan los riesgos futuros de degeneración maligna y de aparición de hernia inguinal, respectivamente.
Testículos Retráctiles o en ascensor: la mayoría de los casos no requieren tratamiento quirúrgico, ya que esta situación es considerada una variante de la normalidad. Durante la pubertad la situación mejora cuando el testículo adquiere tamaño adulto, y el reflejo cremastérico no consigue elevar el teste fuera de la bolsa escrotal quedando éste alojado en su posición normal de forma permanente.
Los testículos retráctiles o en ascensor requieren un seguimiento clínico durante el tiempo necesario hasta confirmar de forma segura un correcto descenso testicular
Los pacientes con testículos retráctiles deben seguirse mediante exploración anual o bianual hasta que el teste adquiera un tamaño adecuado y se descarte de forma definitiva un posible ascenso testicular no dependiente del reflejo cremastérico, que requiera tratamiento quirúrgico. La tasa de “ascenso tardío” ocurre en 1/3 de los casos aproximadamente, estando indicada la cirugía dentro de los 6 meses desde el momento del diagnóstico.
Tratamiento quirúrgico
Los aspectos fundamentales a tener en cuenta en el tratamiento quirúrgico del maldescenso testicular son: la edad indicada para la intervención quirúrgica, distinguir entre testes palpables y no palpables en cuanto a la elección de las técnicas quirúrgicas adecuadas a realizar, y diferenciar los pacientes con testes retráctiles o en ascensor que no requieren ser intervenidos.
Ante una situación de escroto vacío, el antecedente de descenso testicular normal durante el periodo perinatal y primera infancia debe hacernos pensar en una situación de maldescenso testicular adquirido, que requiere tratamiento quirúrgico
Edad: Aunque no existe un consenso definitivo en cuanto a la edad exacta de tratamiento, siempre se recomienda antes de los 2 años de edad.
Las recomendaciones más actuales indican el tratamiento quirúrgico en torno al año de edad, al considerarse una etapa en la que ya el procedimiento quirúrgico es seguro, y ante la teoría de que en este momento hay tiempo para la recuperación de una fertilidad dañada, sobre todo en los testículos no palpables situados proximalmente al anillo inguinal interno, en los que se ha confirmado un mayor riesgo de depleción de células de Leydig y germinales testiculares.
Nunca debe llevarse a cabo antes de los 6 meses de edad, ya que es un período en el que se puede producir el descenso testicular al escroto de forma espontánea(7).
Testículos Palpables
La técnica estándar para el tratamiento del teste palpable es la funiculolisis y oquidopexia por vía inguinal. Mediante este procedimiento, el éxito de posicionamiento testicular en el escroto es del 96%(2).
Habitualmente, en la mayoría de los pacientes, cuando no presentan patologías asociadas, este procedimiento se realiza en régimen de cirugía mayor ambulatoria (CMA).
No está indicada la administración de antibioterapia profiláctica de forma sistemática.
Aunque generalmente en los casos bilaterales se indica un tratamiento quirúrgico escalonado en dos tiempos, en los pacientes con testículos palpables y de localización inguinal cercana al escroto, en los que se supone un procedimiento quirúrgico de descenso fácil y con escaso riesgo de complicaciones quirúrgicas, es posible el tratamiento quirúrgico bilateral en un solo procedimiento.
A continuación, se enumeran los pasos clave de esta técnica quirúrgica, para la que es fundamental el buen conocimiento de la anatomía del canal inguinal y del retroperitoneo.
1. La intervención se inicia mediante la realización de una incisión cutánea inguinal transversa sobre el anillo inguinal interno;
2. Se realiza apertura del canal inguinal, localización y disección del cordón espermático y del testículo. A continuación, se moviliza el teste y cordón espermático mediante la sección del gubernáculo, que habitualmente fija el teste al pubis. En este momento, se comprueba el aspecto del teste, y se informa sobre su localización exacta, tamaño y malformaciones existentes. Se realiza además la extirpación de apéndices testiculares o del epidídimo si se confirman;
3. Disección de los elementos del cordón y sutura del conducto peritoneovaginal (cpvp) mediante ligadura, si existe. En este paso, se debe tener especial cuidado en la disección de los vasos sanguíneos del cordón para evitar la atrofia testicular secundaria a la isquemia del tejido. Otra estructura que no debe ser lesionada es el nervio ilioinguinal que discurre por el canal inguinal adyacente al cordón espermático y que se encarga de la inervación de la región del pubis y parte superomedial del muslo, escroto o labios mayores;
4. Por último: incisión en la piel del escroto y colocación y fijación del testículo en la bolsa escrotal.
Una alternativa a la vía inguinal es la orquidopexia por vía escrotal ó Técnica de Bianchi, indicada cuando el teste está en inguinal cercana al pubis, siendo éste accesible desde el escroto. Mediante este abordaje, se realiza una única incisión en el escroto, continuando con los mismos pasos de disección del cordón espermático anteriormente descritos en la vía inguinal. Cuando la indicación quirúrgica es correcta, la tasa de éxitos y complicaciones es similar a la técnica convencional inguinoescrotal, por lo que la elección de una u otra técnica se hará en función de la experiencia y preferencias particulares del cirujano(8).
Durante el período postoperatorio, se debe evitar el esfuerzo físico y los deportes que provoquen microtraumatismos en la zona escrotal (montar en bicicleta, por ejemplo), durante aproximadamente un mes, ya que pueden incrementar la inflamación de la zona quirúrgica y/o movilizar el testículo.
El seguimiento postoperatorio se realizará a intervalos variables hasta la pubertad. Habitualmente, se comienza cada 3-6 meses durante el primer año postoperatorio, espaciando posteriormente las revisiones de forma progresiva. En cada revisión se debe valorar la posición, el tamaño y el crecimiento del testículo.
A excepción de los cambios inflamatorios locales en el postoperatorio inmediato, las complicaciones a largo plazo son poco frecuentes y consisten en: atrofia testicular (0,3%) o reascenso (4%), requiriendo reintervención quirúrgica en ambos casos.
Testículos No Palpables
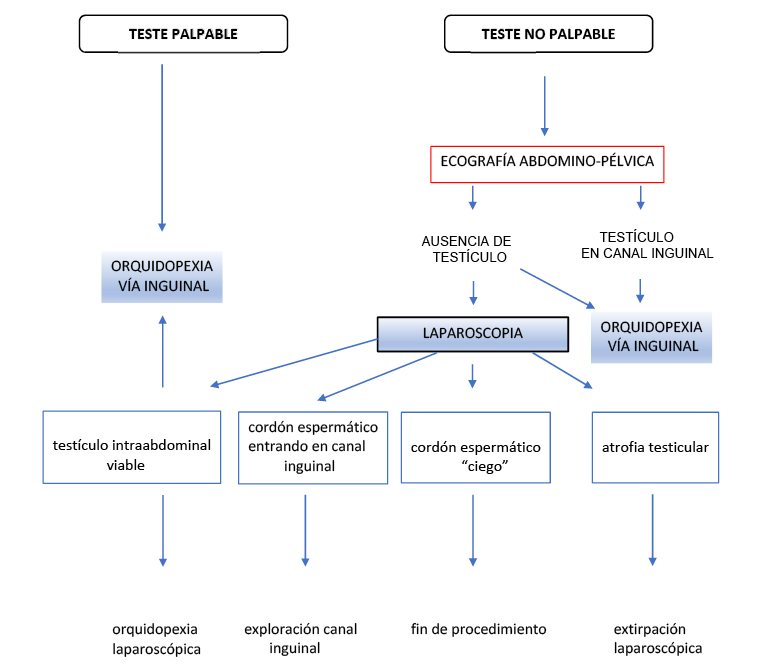
En el tratamiento de los testículos no palpables, se puede optar por un abordaje inicial por vía inguinal, o bien por una exploración abdominal por laparoscopia que nos permitirá tanto confirmar la existencia o no de testículo intrabdominal y su localización, como practicar el tratamiento más adecuado.
Siempre, en ambos casos, la primera medida a realizar antes de la intervención quirúrgica es la exploración de la región inguinoescrotal bajo anestesia, ya que hasta en un 20% de testes no palpables inicialmente, se palpan en la región inguinal una vez que el paciente está anestesiado. Este hecho descarta la realización de un abordaje laparoscópico, estando indicada la orquidopexia por vía inguinal.
• La Exploración Laparoscópica (9, 10): Se inicia mediante la colocación de un trócar umbilical para la introducción de una óptica que permite la visualización de la cavidad abdominal y la confirmación de la presencia o ausencia de testículos intraabdominales, y su aspecto. Con esta técnica, además, se pueden explorar los anillos inguinales (visualizar la persistencia del conducto peritoneo vaginal) y examinar los elementos del cordón espermático: conducto deferente y vasos espermáticos.
Los hallazgos laparoscópicos son variables, existiendo distintas posibilidades según la siguiente distribución:
a. entrada de los elementos del cordón al canal inguinal a través del anillo inguinal interno (40%);
b. testículo atrófico (11%);
c. vasos espermáticos con terminación “ciega” (10%);
d. testículo intraabdominal viable (37%).
En el primer caso en el que se confirma la presencia del cordón espermático entrando en el canal inguinal, se debe continuar la exploración quirúrgica por vía inguinal para confirmar la existencia de testículo y fijarlo a la bolsa escrotal si éste es viable.
Si se observa un cordón espermático con un extremo ciego atrófico (“blind ending cord”), situación considerada como ausencia de testículo por atrofia testicular, se da por finalizado el procedimiento, no siendo necesaria la exploración inguinal.
En el caso en el que se objetive la presencia de testículo intraabdominal viable, se puede continuar el procedimiento de descenso y fijación (pexia) testicular en el escroto: tanto por vía laparoscópica como por vía inguinal.
En los casos de cordones espermáticos cortos en los que no es posible el descenso testicular a escroto en un primer momento, la técnica laparoscópica gold standard es la denominada: Técnica de Stephens-Fowler. Consiste en un procedimiento quirúrgico secuencial en el que en el primer tiempo se realiza la coagulación de los vasos espermáticos, dejando la vascularización del testículo sólo con el aporte vascular de la arteria deferencial. En el segundo procedimiento, se realiza el descenso testicular definitivo a la bolsa escrotal, y está indicado a partir de los 6 meses de la primera intervención quirúrgica.
El objetivo del tratamiento en estas dos fases, es dar tiempo para el desarrollo de vasos colaterales desde la arteria deferencial para la vascularización del testículo.
Aunque está aceptada la variante de la técnica Stephens-Fowler en un sólo tiempo, ésta es menos aceptada por el mayor riesgo de atrofia testicular. Así, la probabilidad de supervivencia testicular en dos tiempos está en torno al 90%, frente al 50-60% en un solo tiempo.
Por último, la orquiectomía (extirpación testicular) laparoscópica se indica en aquellos casos en los que se confirma un testículo intraabdominal atrófico.
• Si se opta por el Abordaje Inguinal: se realiza una exploración del canal inguinal en busca del cordón espermático y testículo, tal y como se ha descrito para los testes palpables. Se realiza orquidopexia inguinal si se confirma un testículo viable, o extirpación (orquiectomía) de restos testiculares, si se diagnostica atrofia testicular. Cuando no se visualizan el teste ni los elementos del cordón en el canal inguinal, se continuará la disección hacia el peritoneo a través del anillo inguinal interno en busca de los elementos del cordón espermático y del testículo. Si aún así, no se observan dichos elementos, se realizará una laparoscopia en busca de hallazgos intraabdominales.
Ante un escroto vacío a la exploración y la no detección de testículo en la ecografía abdominal, el procedimiento de elección es la laparoscopia exploradora. Si se confirma la presencia de restos testiculares atróficos intraabdominales, se debe realizar orquiectomía por el elevado riesgo de malignización, máximo en la etapa postpuberal
Como consideración general en los testículos no palpables bilaterales, para cualquiera de las técnicas elegidas, se recomienda la orquidopexia en dos tiempos, retrasando el descenso testicular del segundo lado para dar tiempo a evaluar los resultados de la primera orquidopexia.
Así mismo, si durante el procedimiento de la orquidopexia, no es posible descender el testículo a la bolsa escrotal por la existencia de un cordón espermático demasiado corto, es aconsejable dejar el testículo en el canal inguinal, en una situación palpable, y realizar el descenso definitivo en un segundo tiempo, esperando el crecimiento de los vasos sanguíneos del cordón.
Por último, es importante señalar que la biopsia testicular no es un procedimiento rutinario indicado durante las técnicas de orquidopexia, siendo recomendada sólo en situaciones especiales, como en los casos de genitales ambiguos, alteraciones cromosómicas o como parte de otros estudios en pacientes con patologías endocrinológicas.
• Complicaciones del tratamiento quirúrgico:
La complicación quirúrgica más importante durante los procedimientos de orquidopexia: es la atrofia testicular. Ésta se puede producir, tanto por daño de los vasos espermáticos en la manipulación del cordón durante la reparación quirúrgica, como por cambios inflamatorios severos locales durante el período postoperatorio, describiéndose hasta en el 1,8% de los casos más severos (6).
Más frecuentes, y habituales son los cambios inflamatorios de mayor o menor grado, y otras complicaciones posibles como, la infección de herida quirúrgica, hemorragia local o la formación de hematomas.
Por último, la aparición de una hernia inguinal (en los casos en los que no se ha extirpado un proceso vaginal persistente) o el reascenso testicular, son complicaciones menos frecuentes, pero que requieren una reintervención quirúrgica.
Tratamiento hormonal
Como se ha mencionado anteriormente, el tratamiento de elección en caso de maldescenso testicular, agenesia testicular y atrofia testicular es indiscutiblemente quirúrgico. En líneas generales, asociar el tratamiento hormonal con gonadotropina coriónica humana (hCG) u hormona liberadora de gonadotropinas (GnRH) al tratamiento quirúrgico, no está indicado de forma generalizada, pudiéndose administrar en casos individualizados con el objetivo de mejorar la fertilidad (criptorquidia bilateral con testes intrabdominales, testículos únicos o si el contralateral se ha dañado anteriormente). No obstante, no existe consenso universal a este respecto habiéndose obtenido resultados contradictorios en muchos casos(11).
Colocación de prótesis testicular
Está indicada cuando, como consecuencia de la extirpación de restos testiculares atróficos o por agenesia testicular congénita, el paciente no presenta gónada en el lado afecto. Derivado de la ausencia de ocupación del hemiescroto sin testículo, se produce la atrofia progresiva del mismo quedando con el tiempo aplanado.
La colocación de prótesis testicular se recomienda cuando el paciente ha completado su desarrollo puberal y la indicación es exclusivamente estética
La indicación de colocación de prótesis testicular es exclusivamente estética y se debe llevar a cabo sólo si el paciente lo solicita. Se prefiere su colocación cuando el paciente ha completado la pubertad y no sólo puede decidir y consentir la intervención, sino que además, presenta ya un tamaño testicular adulto en el lado sano que nos permite colocar una prótesis definitiva y simétrica, similar al testículo contralateral.
El procedimiento se realiza siempre por vía inguinal a través de la cual se realiza la disección del espacio escrotal creando un bolsillo subcutáneo donde se alojará la prótesis.
Tablas y figuras
Figura 1. Algoritmo de actuación. Actuación ante escroto vacío
Bibliografía
1. Lee PA, Houk CP. Cryptorchidism. Curr Opin Endocrinol Diabetes Obes. 2013;20(3):210-6.
2. Kolon TF, Herndon CD, Baker LA, Baskin LS, Baxter CG, Cheng EY, et al. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol. 2014;192(2):337-45.
3. Kollin C, Ritzen EM. Cryptorchidism: a clinical perspective. Pediatr Endocrinol Rev. 2014;11 Suppl 2:240-50.
4. Kraft KH, Canning DA, Snyder HM, 3rd, Kolon TF. Undescended testis histology correlation with adult hormone levels and semen analysis. J Urol. 2012;188(4 Suppl):1429-35.
5. Lip SZ, Murchison LE, Cullis PS, Govan L, Carachi R. A meta-analysis of the risk of boys with isolated cryptorchidism developing testicular cancer in later life. Arch Dis Child. 2013;98(1):20-6.
6. Penson D, Krishnaswami S, Jules A, McPheeters ML. Effectiveness of hormonal and surgical therapies for cryptorchidism: a systematic review. Pediatrics. 2013;131(6):e1897-907.
7. Kim SO, Hwang EC, Hwang IS, Oh KJ, Jung SI, Kang TW, et al. Testicular catch up growth: the impact of orchiopexy age. Urology. 2011;78(4):886-9.
8. Gutierrez Duenas JM, Lorenzo G, Ardela Diaz E, Martin Pinto F, Dominguez Vallejo FJ. [First results of the orchiopexy via scrotal approach]. Cir Pediatr. 2011;24(2):79-83.
9. Tekgül S RE, Gerharz P, et al. Crytorchidism 2013.
10. Evi Comploj AP. Diagnosis and Management of Cryptorchidism. European Urology Supplements 2012;11(2):2-9.
11. Abaci A, Catli G, Anik A, Bober E. Epidemiology, classification and management of undescended testes: does medication have value in its treatment? J Clin Res Pediatr Endocrinol. 2013;5(2):65-72.