Alteraciones tiroideas en la adolescencia
Alteraciones tiroideas en la adolescencia
M. Sanz Fernández, M.D. Rodríguez Arnao, A. Rodriguez Sánchez.
Sección de Endocrinología Pediátrica. Servicio de Pediatría. Hospital General Universitario Gregorio Marañón. Madrid.
Fecha de recepción: 20 de septiembre 2017
Fecha de publicación: 30 de octubre 2017
Adolescere 2017; V (3): 17-30
Resumen
|
El hipotiroidismo es la causa más frecuente de disfunción tiroidea en adolescentes, siendo la causa más frecuente de hipotiroidismo adquirido la tiroiditis autoinmune. Cualquiera que sea la causa, el hipotiroidismo en niños puede tener un efecto deletéreo sobre el crecimiento, desarrollo puberal y rendimiento académico. La enfermedad de Graves es la causa más frecuente de hipertiroidismo en niños y adolescentes y habitualmente se presenta durante la adolescencia temprana. Alrededor del 2% de los niños tienen nódulos tiroideos palpables. La mayoría de ellos serán benignos, lesiones inflamatorias y adenomas foliculares, pero algunos pueden ser de etiología maligna. La glándula tiroidea en los niños es especialmente susceptible a la radiación y carcinogénesis. Esta es una de las razones por las que el cáncer tiroideo en los niños suele diagnosticarse en estadios avanzados de la enfermedad. Palabras clave: hormonas tiroideas; hipotiroidismo; hipertiroidismo; nódulo tiroideo; cáncer tiroideo. |
Abstract
|
Hypothyroidism is the most common disturbance of the thyroid function among adolescents, in whom acquired hypothyroidism is most often caused by autoimmune thyroiditis. Whatever its cause, hypothyroidism in children can have deleterious effects on growth, pubertal development and school performance. Graves’ disease is by far the most common cause of hyperthyroidism in children and adolescents, and usually presents during early adolescence. About 2% of children have palpable thyroid nodules. Most of these are benign, including inflammatory lesions or follicular adenomas, but a few may be malignant. The thyroid gland in children is particularly susceptible to irradiation and carcinogenesis. This may be one of the reasons why children with thyroid cancer tend to present with advanced disease. Key words: thyroid hormones; hypothyroidism; hyperthyroidism; thyroid nodule; thyroid cancer. |
Hipotiroidismo adquirido
Introducción: El hipotiroidismo es la causa más común de disfunción tiroidea en niños y adolescentes. Como en los adultos, el hipotiroidismo adquirido puede ser primario (originado en la glándula tiroidea) que es lo más frecuente o central (de origen hipotálamo hipofisario), mucho más raro. El hipotiroidismo primario puede ser clínico (aumento TSH y T4L baja) o subclínico (aumento de TSH y T4L normal). Sea cual sea la causa el hipotiroidismo en el niño puede afectar negativamente el crecimiento, el desarrollo puberal y el rendimiento escolar.
El hipotiroidismo adquirido es la causa más frecuente de disfunción tiroidea en la adolescencia, la mayoría serán causados por tiroiditis crónica autoinmune
Epidemiología: La prevalencia del hipotiroidismo autoinmune en la infancia se estima entre 1-2% con un claro predominio en el sexo femenino 4:1(1). Aproximadamente en el 50% de los casos existen antecedentes familiares de enfermedad tiroidea autoinmune.
Etiología: La causa más frecuente del hipotiroidismo adquirido, excluida la deficiencia de yodo, es la tiroiditis crónica autoinmunitaria, excepcional antes de los 5 años de edad y frecuente en la adolescencia(2). Las causas más frecuentes del hipotiroidismo adquirido, similares a las de los adultos, se detallan en la tabla 1. La historia clínica y exploración física pueden ser de utilidad en el diagnóstico etiológico.
La enfermedad tiroidea autoinmune hipofuncional (Tiroiditis de Hashimoto) es la causa más frecuente de hipotiroidismo en adolescentes y suele acompañarse de aumento difuso del tamaño de la glándula tiroides (bocio). Es más común en mujeres que en varones y más en raza caucásica. Es más frecuente encontrar bocios con función tiroidea normal que con hipotiroidismo(3). Se estima que el 6.3% de los adolescentes entre 12-19 años tiene anticuerpos antitiroglobulina positivos y 4.8% anticuerpos antiperoxidasa positivos. La probabilidad de presentar positividad de los anticuerpos tiroideos es dos veces más frecuente en mujeres que en varones adolescentes. La historia natural de la tiroiditis eutiroidea es que el 36% a los cinco años tienen TSH > 5 mUI/l. La evolución a los tres años entre los niños con anticuerpos antitiroideos y TSH entre 5-10: solo el 40% mejoraron, el 20% siguieron igual y el 40% desarrollaron hipotiroidismo clínico.
Algunas alteraciones genéticas como la trisomía 21, el síndrome de Turner, el síndrome de Klinefelter y el síndrome de Williams y algunas enfermedades autoinmunes como la diabetes mellitus, la enfermedad celiaca, la alopecia o el vitíligo tienen un riesgo incrementado de desarrollar una tiroidis autoimune e incluso un hipotiroidismo(4).
Otras causas menos comunes de hipotiroidismo adquirido son el déficit de yodo, que constituye la causa mundial más frecuente de hipotiroidismo. Además el hipotiroidismo puede aparecer tras radioterapia en zona cervical y cefálica (dosis 50 Gy) o ser secundario a la ingesta de medica-mentos como el litio, amiodarona, antiepilépticos, antitiroideos e inhibidores de la tirosin quinasa.
Clínica: los síntomas más comunes en el hipotiroidismo son el cansancio, la intolerancia al frío, el estreñimiento y las irregularidades menstruales. Puede aparecer retraso puberal o incluso en los casos graves de larga evolución, pubertad precoz. En la niñez, la manifestación clínica más habitual es la disminución de la velocidad de crecimiento que origina talla baja. El descenso en la velocidad del crecimiento puede preceder en años al resto de síntomas, así que en cualquier niño en estudio por talla baja hay que hacer una determinación de las hormonas tiroideas. Otro síntoma habitual es el empeoramiento del rendimiento escolar. Sin embargo, en algunos casos pese a que lo más frecuente es que el rendimiento académico disminuya, puede mejorar en algunos niños, tal vez porque son menos activos y, por lo tanto, menos distraídos y más capaces de concentrarse. Una de las razones del retraso en el diagnóstico es que los padres ven estos últimos cambios como positivos. Otros síntomas comunes son: hipoactividad, apatía, letargia, piel seca, cabello quebradizo, alopecia de cejas, cara edematosa, dolores musculares. Si la causa es hipotalámica o hipofisaria el niño puede tener también cefalea, alteraciones visuales y manifestaciones propias de otros déficits hormonales.
En la niñez, la manifestación clínica más habitual del hipotiroidismo es la disminución de la velocidad de crecimiento por lo que en cualquier niño en estudio por talla baja hay que hacer una determinación de las hormonas tiroideas
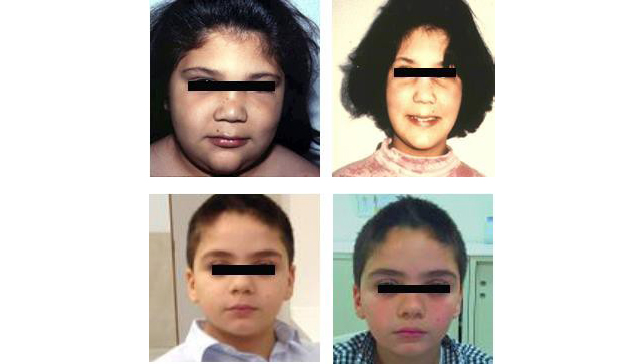
El hallazgo físico más frecuente al diagnóstico es el aumento de tamaño difuso de la glándula tiroides (bocio), que se observa en el 40% de las tiroiditis autoinmunes. Otras veces el tamaño de la glándula es normal o no palpable. En la exploración física podemos encontrar talla baja, sobrepeso, facies edematosa (Figura 1) con expresión plácida, bradicardia, pseudohipertrofia de los músculos, disminución de los reflejos osteotendinosos. En raras ocasiones, los niños pueden presentarse con una miopatía y niveles de creatina quinasa sérica muy elevados, conocido como síndrome de Kocher-Debre-Semelaigne(5). Algunos pacientes tienen hiperprolactinemia y raramente galactorrea. La secreción de hormona de crecimiento puede ser normal o estar disminuida, y los niveles séricos de IGF-I están generalmente disminuidos(6). El hipotiroidismo puede ser causa de ganancia ponderal. El incremento excesivo de peso se asocia con hipertirotropinemias leves (entre 5-10 mU/L) con normalización de los niveles tras lograr la pérdida de peso(7).
El incremento excesivo de peso se asocia con hipertirotropi-nemias leves (entre 5-10 mIU/L) con normalización de los niveles tras lograr la pérdida de peso
En ocasiones se encuentra un aumento de la hipófisis, por hiperplasia de las células tirotropas, al hacer una resonancia magnética nuclear (RMN) en el estudio de la talla baja, por lo que siempre hay que excluir hipotiroidismo primario en cualquier niño que presente un aumento de la silla turca. Este aumento de tamaño es reversible con tratamiento de L-tiroxina.
La hipercolesterolemia es habitual. En casos avanzados se puede encontrar además bradicardia, bradipnea, derrames pleurales o pericárdicos (se resuelven con hormona tiroidea), alteraciones del electrocardiograma (ECG), hipotensión arterial, cardiomegalia, ascitis y en algún caso encefalopatía.
En el hipotiroidismo subclínico que generalmente es asintomático, pueden encontrarse síntomas leves o inespecíficos como astenia, alteraciones de peso, estreñimiento o dislipemia.
Diagnóstico: El diagnóstico del hipotiroidismo se basa en la constatación de valores séricos bajos de T4 libre (T4L) en el hipotiroidismo franco o normal en el hipotiroidismo compensado o subclínico. Un estado de hipotiroidismo puede cursar con distintas alteraciones hormonales, resumidas en la tabla 2. Para identificar el nivel de alteración del eje tiroideo se pueden usar las siguientes pruebas:
• TSH basal: elevada en el hipotiroidismo primario, normal en el hipotiroidismo hipotalámico y disminuida en el hipofisario. La secreción de TSH presenta un ritmo circadiano, por lo que la medición debe ser valorada entre las 8-9 am para que la sensibilidad sea más alta. Valores de TSH entre 5-10 mU/L deberían ser repetidos antes de iniciar tratamiento pues en el 70% de los casos serán normales en la siguiente determinación(8). En niños obesos, es frecuente encontrar valores moderadamente elevados de TSH que no precisan tratamiento con hormona tiroidea y se normalizarán tras pérdida ponderal.
En niños con elevaciones moderadas de TSH (5-10 mU/L) se debería repetir la función tiroidea antes de iniciar el tratamiento. Hasta en un 70% de los pacientes, la TSH se habrá normalizado. Existen controversias sobre cuando tratar el hipotiroidismo subclínico, aunque la recomendación actual es tratar cuando los valores de TSH son supe-riores a 10 mU/L
• Test de TRH: para diferenciar entre hipotiroidismo hipofisario (TSH basal no se incrementa tras el estímulo de TRH) y el hipotalámico (la respuesta de la TSH al estímulo TRH es elevada y plana), del síndrome de resistencia generalizada a hormonas tiroideas (respuesta exagerada). El bocio es el hallazgo más frecuente pero poco específico en la exploración física ya que puede estar presente en hipotiroidismo, hipertiroidismo o normofunción tiroidea. Es necesario valorar el aspecto de la glándula tiroidea en tres posiciones (posición cervical neutra, en hiperextensión y al tragar saliva con la cabeza en posición media). En una inspección visual normal, el contorno de la glándula tiroides no debería ser visible en ninguna de las tres posiciones, el cuello debe ser simétrico y no visualizarse adenopatías. A la palpación el tiroides puede clasificarse según la Organización Mundial de la Salud en tres grados: grado O: no visible ni palpable, grado 1: bocio es palpable pero no visible en posición neutra y grado 2, cuando el bocio es visible y palpable en posición neutra(9).
Tratamiento: el tratamiento de elección es la levotiroxina. EL objetivo del tratamiento es normalizar el crecimiento y desarrollo. En niños con elevaciones moderadas de TSH (5-10 mU/L) se debería repetir la función tiroidea antes de iniciar el tratamiento. Hasta en un 70% de los pacientes, la TSH se habrá normalizado. Existen controversias sobre cuando tratar el hipotiroidismo subclínico, aunque la recomendación actual es tratar cuando los valores de TSH son superiores a 10 mU/L(10). El objetivo del tratamiento es alcanzar valores de TSH en el rango normal-bajo (0.5-2.0 mU/L) y de T4 libre en el normal-alto (1.3-1.8 ng/dl).
Las necesidades de hormonas tiroideas en la infancia son superiores a las empleadas en la edad adulta. En niños entre 1-3 años, se recomienda tratar con dosis entre 4-6 mcg/kg/día, entre los 3-10 años, de 3-5 mcg/kg/día y en los mayores de 10 años, entre 2-4 mcg/kg/día.
En el hipotiroidismo central, el tratamiento se monitoriza en función de los valores de T4 libre o T4 total. El objetivo es similar al del hipotiroidismo primario.
Hipertiroidismo
Introducción: Las manifestaciones clínicas del hipertiroidismo en niños y adolescentes son similares a las de la edad adulta. Es importante diferenciar dos términos:
• Hipertiroidismo: aumento de síntesis de hormonas tiroideas por el tiroides.
• Tirotoxicosis: conjunto de signos y síntomas clínicos que se derivan de la presencia en sangre de cantidades excesivas de hormonas tiroideas.
Epidemiología y etiología: El hipertiroidismo en la infancia y adolescencia es muy infrecuente y de etiología multifactorial constituyendo solo el 5% de los casos totales de hipertiroidismo. En el 95% de los casos, la causa es la enfermedad tiroidea autoinmune hiperfuncional (enfermedad de Graves). La incidencia anual de la enfermedad de Graves (EG) está aumentando y se sitúa desde aproximadamente 1/100.000 en niños prepúberes hasta 3/100.000 en adolescentes, la prevalencia se estima en aproximadamente 0.02% (1:5.000). Solamente un 15% tienen edad de aparición entre 5-10 años de edad. El pico de presentación y la mayoría de los casos (80%) se diagnostican hacia los 10-15 años. La enfermedad de Graves es más frecuente en niños con otras patologías autoinmunes y en niños con historia familiar de enfermedad tiroidea autoinmune(11-12). Predomina en mujeres (5/1).
La causa más frecuente de hipertiroidismo en la adolescencia es la enfermedad tiroidea autoinmune hiperfuncional (enfermedad de Graves). El tratamiento de primera elección son los fármacos antitiroideos. Si aparecen efectos secundarios por estos fármacos, recidivas o no remisión de la enfermedad, el tratamiento debe ser definitivo: cirugía o yodo radioactivo I131, en ambos casos con el objetivo de ablación tiroidea y lograr el hipotiroidismo
Etiología: en la tabla 3 se detallan los tipos de hipertiroidismo según su etiología.
Clínica: El hipertiroidismo en la infancia suele ser insidioso: deterioro del rendimiento escolar, labilidad emocional, trastornos de conducta, irritabilidad, ansiedad o nerviosismo. Puede aparecer: insomnio, intolerancia al calor, sudoración, sofocos, rubor facial, flushing, hipertermia, aumento del apetito, pérdida de peso, fatiga. Pueden presentar aceleración del crecimiento acompañado de adelanto de la maduración ósea, según el tiempo que se tarde en llegar al diagnóstico. En la exploración física destacan: ROT vivos y exaltados, fasciculaciones en la lengua, taquicardia, palpitaciones, hipertensión arterial o temblor fino. El bocio es frecuente (98% de los casos), aunque en general de tamaño moderado. Dentro de las alteraciones oftalmológicas, el exoftalmos suele ser leve y asimétrico, siendo más frecuentes la retracción y amplia apertura palpebral. En niñas adolescentes, puede producirse oligomenorrea o amenorrea.
Diagnóstico: Tras la sospecha clínica, el diagnóstico bioquímico confirmará el hipertiroidismo, cuando existan niveles suprimidos de TSH (<0,2 µU/ml), elevados de hormonas tiroideas libres (T4L y T3L). En la enfermedad de Graves, los anticuerpos estimulantes del tiroides (TSI) están presentes en el 90% de los casos; en el 10% restante, también existen anticuerpos bloqueantes del receptor de TSH, pero no pueden medirse con los ensayos comerciales disponibles. En la mayoría de los pacientes, se detectan además, anticuerpos antitiroglobulina y antiperoxidasa (niveles más bajos que en las tiroiditis). Los niveles de tiroglobulina están elevados. Estos son de utilidad, para descartar una ingestión exógena de hormonas tiroideas, en dónde la tiroglobulina estará normal o disminuida.
En el diagnóstico por imagen, la ecografía ha desplazado a la gammagrafía. La ecografía muestra un tiroides aumentado de tamaño con ecogenicidad homogénea y con flujos vasculares elevados en el doppler. El uso de la gammagrafía se reserva para los casos de bocio nodular o sospecha de adenoma tóxico.
Tratamiento: Existen 3 opciones terapéuticas: fármacos antitiroideos (metimazol, carbimazol o propiltiouracilo), radioyodo o cirugía. Los fármacos antitiroideos son la primera elección. Si aparecen efectos secundarios por estos fármacos, recidivas o no remisión de la enfermedad, el tratamiento debe ser definitivo: cirugía o yodo radioactivo I131, en ambos casos con el objetivo de ablación tiroidea y lograr el hipotiroidismo.
Fármacos antitiroideos: Es siempre la primera opción terapéutica. Los fármacos antitiroideos (tionamidas) son metimazol (MTZ) y el carbimazol (CBZ) (que se metaboliza a metimazol). El propiltiouracilo (PTU) no está, actualmente, recomendado en la infancia ni en la adolescencia por sus potenciales graves efectos secundarios (necrosis hepática fulminante), estando reservado solo para el primer trimestre de gestación por los efectos teratogénicos de MTZ y CBZ(13). Ambos fármacos inhiben la síntesis de hormonas tiroideas interfiriendo en la oxidación y organificación del yodo. El PTU, además, bloquea la conversión de T4 en T3 y disminuye la concentración de anticuerpos estimulantes de receptor de TSH (TSI, TSHRAb). Ninguno de los fármacos actúa sobre la liberación de las hormonas tiroideas ya formadas, motivo por el cual la función tiroidea normaliza solo después de varias semanas de tratamiento.
La dosis inicial de CBZ o MTZ es de 0,1-1 mg/kg/día (dosis máxima: 30 mg/día) cada 8-12-24 horas y la del PTU, de 5-10 mg/kg/día en 3 tomas, por vía oral. Ambos son igual de eficaces, pero el PTU tiene mayor frecuencia de efectos adversos, además de ser más graves (hepatotoxicidad).
Los efectos secundarios de los antitiroideos son más frecuentes en niños que en adultos y pueden presentarse en el 20-30% de los casos. Algunos son dependientes de dosis y otros idiosincrásicos. En la mayoría de los casos, son leves, aunque existen algunos graves, como la agranulocitosis, que obligan a suspender la medicación. Ante casos de fiebre o enfermedad intercurrente debe interrumpirse la medicación y realizar un control analítico urgente. Se debe suspender la medicación y acudir a urgencias en caso de fiebre, enfermedad intercurrente, ictericia, orina oscura o heces pálidas.
Existen dos opciones en la utilización de fármacos antitiroideos:
• Bloquear la producción de hormonas tiroideas mediante fármacos antitiroideos y prevenir el hipotiroidismo consecuente al añadir levotiroxina (1-2 µg/kg/día) una vez alcanzado el eutiroidismo comprobado bioquímicamente.
• Disminuir progresivamente la dosis de fármacos antitiroideos hasta alcanzar niveles de T4L y TSH dentro de la normalidad. A las 2-6 semanas si se ha conseguido normofunción tiroidea, se reducen progresivamente las dosis el 30-50%. Posteriormente, se realizan controles periódicos cada 4-6 semanas para lograr un estado de eutiroidismo sin añadir levotiroxina. Esta sería la opción más recomendable, por la posibilidad de menor frecuencia de efectos adversos dosis-dependientes, al tratarse con dosis más bajas de antitiroideos.
El tratamiento con antitiroideos se mantiene entre 2-4 años hasta alcanzar la remisión. Algunos factores relacionados con peores tasas de remisión son: sexo masculino, menor edad al diagnóstico, bocio grande, pacientes prepúberes, menor índice de masa corporal, oftalmopatía, recidivas previas y niveles muy elevados iniciales de T4L o de TSI.
Se puede añadir al tratamiento, betabloqueantes (propranolol o atenolol, este último más cardio-selectivo) a una dosis de 0,5-1 mg/kg/día, para el control inicial de los síntomas del hipertiroidismo mientras comienza el efecto de los fármacos antitiroideos. Progresivamente se retiran, en aproximadamente dos semanas, coincidiendo con el comienzo de la actividad de los fármacos antitiroideos de síntesis. Los fármacos betabloqueantes deben ser evitados en pacientes con asma e insuficiencia cardíaca.
A pesar de conocer que los pacientes pediátricos presentan con menor frecuencia remisión de la enfermedad hipertiroidea y requieren tratamientos más prolongados con fármacos antitiroideos, todavía hay controversias sobre cuando realizar un tratamiento definitivo (cirugía, yodo radioactivo).
Radioyodo (I131): El I131 es una alternativa en el caso de efectos secundarios de los fármacos antitiroideos, en no adherencia al tratamiento, en no remisiones, en recidivas tras tratamiento médico prolongado el tiempo suficiente o por no aceptar tratamiento con cirugía(14). Para su posible administración, hay que valorar riesgos/beneficios. La remisión con este tratamiento es superior a 95%. El objetivo del tratamiento es inducir hipotiroidismo. Las recomendaciones actuales lo consideran un tratamiento seguro, pero debe utilizarse a dosis elevadas (ablativas) (> 200 µCi de I131 por gramo de tejido tiroideo estimado) para asegurar la destrucción de la glándula. En glándulas de más de 80 g de tejido estimado, puede no ser efectivo y ser preferible cirugía.
Algunos Centros administran 15 mCi como dosis fija en niños, pero se recomienda utilizar la dosis calculada, porque puede ser suficiente administrar menor cantidad de I131. Si los niveles de T4L son elevados pre dosis de I131, deben utilizarse previamente betabloqueantes y MTZ o CBZ hasta mejoría y entonces administrar el I131. Los fármacos antitiroideos se suspenden cinco a siete días antes de administrar I131, manteniendo los betabloqueantes si son necesarios. Si no hay orbitopatía, no precisan cobertura esteroidea para la terapia con I131.
El tratamiento ablativo tiroideo induce hipotiroidismo primario yatrógeno, que precisa tratamiento hormonal sustitutivo con levotiroxina oral. Tras I131, el hipotiroidismo suele aparecer hacia los 2 meses del tratamiento. En algunas series, la levotiroxina se inicia a dosis de 1 mcg/kg/día a los 15 días de la administración del I131, para evitar el hipotiroidismo que empeoraría la afectación ocular hipertiroidea.
La glándula tiroides comienza a disminuir de tamaño aproximadamente a las 8 semanas de recibido el I131. Si a los 6 meses de la administración del I131 persiste hipertiroidismo, una segunda dosis de I131 es requerida.
En caso de recidiva del hipertiroidismo tras tratamiento quirúrgico, se recomienda el uso de I131, con ablación del resto tiroideo, ya que el riesgo de complicaciones es mayor en una segunda intervención quirúrgica.
En niños menores de 5 años parece razonable evitarlo por ser mayor el riesgo de tumores a edades más tempranas. Se considera adecuado después de los 10 años de edad, y si no hay un grupo quirúrgico experto disponible en presencia de efectos secundarios graves por fármacos antitiroideos(13).
Basados en recomendaciones del Comité de Efectos Biológicos de Radiaciones Ionizantes (BEIR), por riesgos teóricos no se recomienda I131 en menores de 5 años y en los pacientes entre 5-10 años evitar >10mCi de I131. Los efectos secundarios descritos son leves: náuseas y dolor local en cara anterior del cuello. Muy rara vez desencadena crisis tirotóxica, relacionada con niveles muy elevados de T4L pre tratamiento con I131. Deben controlarse niveles de Vitamina D para evitar hipocalcemias posteriores.
Los pacientes que reciben I131 deben evitar el contacto con otros niños de familia/colegio, sobre todo, menores de tres años de edad, durante, al menos, siete días post dosis, aunque al ser < de 33mCi las dosis recibidas no precisen ingreso en aislamiento hospitalario.
Cirugía (tiroidectomía total): es una alternativa en efectos secundarios de fármacos antitiroideos, en no adherencia al tratamiento, en no remisiones, en recidivas tras tratamiento médico prolongado el tiempo suficiente, oftalmopatías graves, bocios de gran tamaño, bocios multinodulares o nódulos autónomos de gran tamaño o rehusar tratamiento con I131. Los pacientes deben presentar normofunción tiroidea para la intervención, con el objeto de prevenir una posible crisis tiroidea. El tratamiento hormonal sustitutivo con levotiroxina debe comenzar inmediatamente después de la cirugía. Las posibles complicaciones de la cirugía incluyen hipoparatiroidismo permanente, lesiones del nervio laríngeo recurrente. Debe realizarse por cirujanos expertos en patología tiroidea (más de 30 tiroidectomías/año). Las posibles complicaciones de la cirugía incluyen: hipoparatiroidismo permanente y lesiones del nervio laríngeo recurrente. Como profilaxis de la hipocalcemia postoperatoria, se puede administrar calcitriol (dosis 25-50 mcg/día), tres días antes de la intervención.
Nódulos tiroideos y cáncer tiroideo
Introducción: En torno a un 2% de los niños tienen un nódulo tiroideo (NT) palpable. Aunque la mayoría son benignos, algunos pueden ser de etiología maligna. La glándula tiroides en la infancia es, a diferencia del adulto, más susceptible a la carcinogénesis por lo tanto, cuando un niño presenta un NT se debe sospechar la presencia de cáncer tiroideo y realizar una evaluación cuidadosa.
La glándula tiroides en la infancia es, a diferencia del adulto, más susceptible a la carcinogénesis por lo tanto, cuando un niño presenta un NT se debe sospechar la presencia de cáncer tiroideo y realizar una evaluación cuidadosa
Epidemiología: La prevalencia de NT en los niños y adolescente es 0.05-1.8%, los NT son malignos con mayor frecuencia que en adultos(15). La prevalencia de los NT en niños visualizados por ecografía aumenta al 3%. Los NT son 2-3 veces más frecuentes en niñas que en niños, sobre todo después de la pubertad.
Los factores de riesgo para el desarrollo de NT en adolescentes son:
• Sexo femenino.
• Pubertad (la prevalencia aumenta con la edad).
• Déficit de yodo.
• Historia previa de enfermedad tiroidea autoinmune o congénita.
• Irradiación cervical previa (linfoma de Hodgkin o acondicionamiento de trasplante de médula ósea).
• Historia familiar de enfermedad tiroidea.
El riesgo de malignidad para los NT en la infancia es baja en ausencia de factores de riesgo, menor del 1%. El riesgo de malignización de los NT encontrados de forma incidental en una prueba de imagen es el mismo que para los nódulos palpables (20% vs 16%).
Clasificación: Los NT pueden ser sólidos, quísticos o de naturaleza mixta. Además pueden ser solitarios o múltiples, dando lugar a una glándula multinodular que además puede ser de tamaño normal o hiperplásica (bocio multinodular)(16).
El 75-80% de los NT en los niños son benignos: nódulos coloideos, hiperplasia nodular benigna, adenomas foliculares, quistes hemorrágicos o simples, abscesos, tiroiditis linfocitarias, bocio multinodular, agenesia de un nódulo con hipertrofia del otro), el 15-20% restante son malignos (carcinoma, linfoma o metástasis). La causa más frecuente de NT solitario en la infancia es el adenoma folicular. El cáncer tiroideo más frecuente en la infancia es el cáncer papilar (83%)(17) seguido por el carcinoma folicular (10%), ambos derivados de células foliculares del tiroides. En tercera posición está el carcinoma medular (5%) derivado de las células parafoliculares del tiroides. Menos frecuentes (<2%) encontramos linfomas tiroideos y metástasis de tumores a distancia. El carcinoma anaplásico es excepcional en la infancia.
Los factores de riesgo de malignización de un nódulo tiroideo son:
• Sexo masculino.
• Edad menor a 10 años.
• Morfología: sólido, crecimiento rápido, consistencia dura, firme, adherido a estructuras vecinas, adenopatía cervical especialmente si es ipsilateral.
• Clínica: disfonía, parálisis de cuerdas vocales, disfagia, disnea.
• Historia familiar: Cáncer de tiroides (carcinoma papilar, medular o neoplasia endocrina múltiple tipo 2) o síndromes relacionados (poliposis adenomatosa familiar, complejo de Carney, enfermedad de Cowden, síndrome de Gardner, síndrome de Werner).
• Historia personal:
— Radiación cervical previa (enfermedad de Hodgkin o acondicionamiento para trasplante de médula ósea). Dosis superiores a 2.500 cGy y tiempo trascurrido desde la radiación más de 10 años, menor edad del niño al recibir la irradiación por la sensibilidad mayor del tirocito a la misma.
— Enfermedad tiroidea previa.
— Asociación con otra patología: hiperparatiroidismo (MEN2A), feocromocitoma (MEN2Ay 2B), ganglioneuromas (MEN2B).
• Analítica: hipofunción tiroidea, elevación de calcitonina y/o CEA.
• Ecografía:
— Nódulo: sólido, hipoecoico, localización subcapsular, microcalcificaciones, bordes gruesos e irregulares, ausencia de halo periférico, aumento de vascularización central o vascularización caótica (Doppler), altura > anchura, crecimiento extracapsular.
• Adenopatías: redondeadas, microcalcificaciones, áreas quísticas, aumento de vascularización periférica, ausencia de hilio graso.
• Gammagrafía: hipocaptante o frío. Esta prueba solo está indicada en los casos en que el valor de TSH esté suprimido o la calcitonina elevada (Figura 2).
• Punción aspiración aguja fina (PAAF): características de malignidad. Debe realizarse guiada con ecografía.
Numerosos síndromes están asociados a carcinomas tiroideos:
• Neoplasia endocrina múltiple tipo 2 (MEN2): de herencia autosómica dominante por mutación del gen RET, está asociada al cáncer medular de tiroides en sus variantes MEN2A, MEN2B y cáncer medular de tiroides familiar.
• Poliposis asociada al gen APC (5q21-q22): incluye el síndrome de Gardner, la poliposis adenomatosa familiar clásica y atenuada, y el síndrome de Turcot tipo 2 (o “síndrome de tumor cerebral-glioma y poliposis tipo 2”). Todas ellos se heredan de forma autosómica dominante y se caracterizan por la presencia de pólipos colónicos con posibilidad de malignización, y riesgo para cáncer papilar de tiroides (variante cribiforme-morular).
• Mutaciones en el gen PTEN (incluidos los síndromes de Cowden –en adultos–, de Bannayan-Riley-Rubalcaba –en la infancia–, y de proteus-Like). Caracterizados por tumores de tipo hamartomatoso en piel y diversos tejidos como el tiroides, con susceptibilidad a cáncer diferenciado (folicular o papilar). Los criterios clínicos para la sospecha de este síndrome incluyen macrocefalia >2DE (100%) + al menos uno de los siguientes: autismo o retraso del desarrollo psicomotor, alteraciones cutáneas (lipomas, tricolemomas, papilomas orales o lentigos en el pene), alteraciones vasculares (hemangiomas o alteraciones arteriovenosas) o pólipos gastrointestinales.
• Complejo Carney tipos 1 (PRKAR1A; 17q24.2) y 2 (CNC2; 2p16): representa al complejo “mixomas, manchas pigmentadas e hiperactividad endocrina”. Sigue una herencia autosómica dominante e implica la aparición de tumores endocrinos (corteza adrenal, hipófisis, tiroides y testículo) y muchos otros no endocrinos: cardiacos, nerviosos, cutáneos, de mama u óseos. El CT más descrito (3% de los casos) es la variante papilar aunque puede ser también folicular (formas diferenciadas de CT).
• Síndrome de Werner (WRN; 8p12): tipo de progeria con incremento del riesgo para osteosarcoma, sarcomas de tejidos blandos y cáncer diferenciado de tiroides (folicular y papilar).
• Síndrome DICER1 (14q32.13): síndrome de susceptibilidad tumoral familiar que confiere mayor riesgo para padecer un blastoma pleuropulmonar; otros tumores descritos son de ovario de distinta estirpe, el nefroma quístico, de tiroides (bocio multinodular, adenomas y posible cáncer diferenciado), etc.
Diagnóstico: se debe realizar una historia clínica completa y exploración física minuciosa en busca de signos clínicos que sugieran malignidad, determinar la función tiroidea y realizar una evaluación ecográfica y citológica.
La función tiroidea se debe valorar mediante la determinación de:
— TSH, T4 libre y T3L. La mayoría de los NT cursan con eutiroidismo.
— Anticuerpos antitiroideos: sugiere el diagnóstico de enfermedad tiroidea autoinmune aunque pueden ser positivos en la población normal.
— Calcitonina: marcador de la afectación de las células C, permite detectar una hiperplasia de las células C del tiroides o un cáncer medular. Su determinación es imprescidible en caso de sospecha de carcinoma medular (historia familiar o fenotipo compatible). Se debe determinar mediante inmunoanálisis y los rangos de normalidad son en niñas <0.2-11.7 pg/ml y niños <0.2-17 pg/ml.
— Tiroglobulina: solo debe determinarse para el seguimiento de pacientes tratados de un cáncer tiroideo como indicador de tiroides residual o metástasis.
La ecografía es la prueba de imagen de elección.
La PAAF guiada por ecografía está indicada en los NT ≥ 1 cm o ≥ 0.5 cm si existe sospecha ecográfica de malignidad o factores de riesgo de malignidad. En caso de nódulos múltiples, se debe realizar la PAAF en el nódulo de mayor tamaño y en los que tengan características ecográficas de malignidad. La sensibilidad de la PAAF en niños y adolescentes es 83% (65- 98%), la especificidad 92% (72-100%), valor predictivo positivo 75% (50-96%), y el porcentaje de falsos negativos del 5% (1-11%) y de falsos positivos del 5% (0-7%).
Los diagnósticos citológicos utilizados clasifican los resultados (Sistema de Bethesda) en:
• Clase I: no diagnóstico. Resultados no diagnósticos o insatisfactorios en un 10-15% de los casos.
• Clase II: benigno. Realizar seguimiento clínico y ecográfico cada 6-18 meses. Si crecimiento significativo del NT o cambios ecográficos repetir PAAF.
• Clase III: lesiones foliculares. Hace referencia a muestras con un patrón folicular que puede ser benigno o maligno (carcinoma papilar de tiroides, carcinoma folicular de tiroides, neoplasias de células de Hürthle, variante folicular del carcinoma papilar de tiroides. La principal dificultad de la PAAF es establecer el diagnóstico entre muestras benignas foliculares y carcinoma folicular de tiroides.
• Clase IV: sospechoso de proliferación folicular. Muestras con celularidad adecuada sugestivas pero que no completan los criterios de malignidad o muestras con escasa celularidad pero con criterios de malignidad.
• Clase V: sospechoso de malignidad.
• Clase VI: Carcinoma papilar. Maligno o positivo.
Tratamiento: tras conocer la citología del NT, si éste es benigno, se recomienda actitud expectante y seguimiento del NT de forma seriada (palpación, determinación de función tiroidea y ecografía), pero esto supone una carga emocional importante para el paciente y su familia.
El tratamiento habitual en NT sólido benigno o NT quístico en niños y adolescentes es la nodulectomía o hemitiroidectomía realizada por un cirujano experto en tiroides. El tratamiento de los NT con características de malignidad en la PAAF es la tiroidectomía total ± linfadenectomía, seguida en algunos casos de tratamiento ablativo con radioyodo para destruir el tejido tiroideo residual y disminuir el riesgo de recaídas y de tratamiento supresor con levotiroxina.
No se recomienda el tratamiento con levotiroxina en pacientes eutiroideos con NT benignos en la PAAF.
Tablas y figuras
Tabla 1. Etiología del hipotiroidismo adquirido
Tabla 2. Alteraciones tiroideas en el hipotiroidismo
|
Alteración |
TSH |
T4 libre |
T3 libre |
Comentario |
|
Hipotiroidismo primario |
↑ |
↓ |
– |
Examinar el bocio, niveles de anticuerpos (antitiroglobulina y antiperoxidasa) |
|
Hipotiroidismo subclínico |
↑ |
normal |
– |
Examinar el bocio, niveles de anticuerpos (antitiroglobulina y antiperoxidasa) |
|
Hipotiroidismo central |
↓/normal |
↓ |
– |
Evaluar déficit de otras hormonas tiroideas y prueba de imagen |
|
Déficit de TBG |
normal |
↓ |
– |
T4 libre normal, varones (ligado a X) |
|
Prematuridad |
↓/normal |
↓ |
– |
Niveles normales de T4 libre, tratamiento controvertido |
|
Síndrome del eutiroideo enfermo o Síndrome de T3 baja |
↓/normal |
↓ |
↓ |
T3 más baja que T4, niveles elevados de T3 reversa |
|
Hipertiroidismo |
↓ |
↑ |
↑ |
Niveles elevados de TSI, ratio T3/T4 elevado |
|
Síndrome de resistencia a hormonas tiroideas |
Inapropiadamente normales |
↑ |
↑ |
Bocio, Trastorno por déficit de atención e hiperactividad, Ratio T3/T4 normal |
Tabla 3. Clasificación etiológica del hipertiroidismo/tirotoxicosis en el niño y en el adolescente
|
Autoinmune: — Enfermedad de Graves-Basedow (0.02%) — Tiroiditis- Hashitoxicosis (11.5%) |
|
No autoinmune: Tiroiditis (liberación de hormonas tiroideas por destrucción del tejido tiroideo) — Tiroiditis subaguda (asociada a enfermedad viral) — Tiroiditis silente — Tiroiditis supurativa aguda (asociada a infección) — Tiroiditis inducida por radioterapia Nódulo autónomo funcional — Adenoma tóxico — Bocio multinodular hiperfuncionante — Adenoma hiperfuncional asociado al Síndrome de McCune-Albright — Carcinoma tiroideo hiperfuncionante Inducido por TSH — Adenoma hipofisario productor de TSH — Síndrome de resistencia a las hormonas tiroideas (mutaciones TRβ) Inducido por yodo (Jod-Basedow) Inducido por la hCG (coriogonadotropina humana) — Tirotoxicosis gestacional con hiperémesis gravídica — Mola hidatiforme — Coriocarcinoma Tejido tiroideo ectópico — Estruma ovárico — Carcinoma tiroideo folicular con metástasis funcionantes Tirotoxicosis facticia (ingestión excesiva de hormonas tiroideas exógenas) Terapia supresora (en el contexto de tratamiento excesivo con hormonas tiroideas) |
Figura 1. Pacientes con hipotiroidismo primario adquirido
A la izquierda, facies al diagnóstico de la enfermedad. A la derecha, facies después del tratamiento con levotiroxina.
Figura 2. Nódulo tiroideo no captante en gammagrafía tiroidea correspondiente a carcinoma medular de tiroides
Bibliografía
1. De Vries L, Bulvik S, Phillip M. Chronic autoimmune thyroiditis in children and adolescents: at presentation and during long-term follow-up. Arch Dis Child. 2009;94(1):33-37.
2. Sanz Fernández M, Rodríguez Sánchez A, González Ruiz de León E. Patología tiroidea en el niño y en el adolescente. Pediatr Integral 2015; XIX (7): 467-476.
3. Demirbilek H, Kandemir N, Gonc EN, et al. Hashimoto’s thyroiditis in children and adolescents: a retrospective study on clinical, epidemiological and laboratory properties of the disease. J Pediatr Endocrinol Metab 2007; 20(11):1199-205.
4. Uncu S, Yaylı S, Bahadır S, Okten A, Alpay K.Relevance of autoimmune thyroiditis in children and adolescents with vitiligo.Int J Dermatol. 2011; 50(2):175-9.
5. Cimbek EA, Şen Y, Yuca SA, et al. Kocher-Debré-Semelaigne syndrome with rhabdomyolysis and increased creatinine. J Pediatr Endocrinol Metab 2015; 28:1383-5.
6. Purandare A, Co Ng L, Godil M, et al. Effect of hypothyroidism and its treatment on the IGF system in infants and children. J Pediatr Endocrinol Metab 2003; 16:35-42.
7. Pacifico L, Anania C, Ferraro F, Andreoli GM, Chiesa C. Thyroid function in childhood obesity and metabolic comorbidity. Clin Chim Acta. 2012; 413(3- 4):396-405.
8. Lazar L, Frumkin RB, Battat E, et al. Natural history of thyroid function tests over 5 years in a large pediatric cohort. J Clin Endocrinol Metab 2009; 94:1678-82.
9. World Health Organization (WHO). Goitre as a Determinant of the Prevalence and Severity of Iodine Deficiency Disorders in Populations. Geneva, Switzerland: WHO; 2014.
10. Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM; American Thyroid Association Task Force on Thyroid Hormone Replacement. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014; 24(12):1670-751.
11. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, Rivkees SA, Samuels M, Sosa JA, Stan MN, Walter MA. American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid. 2016; 26(10):1343-1421.
12. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I et al. Hyperthyroidism and other causes of thyrotoxicosis: Management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid. 2011; 21:593- 647.
13. Rivkees SA, Szarfman A. Dissimilar hepatotoxicity profiles of propylthiouracil and methimazole in children. J Clin Endocrinol Metab 2010; 95:3260-7.
14. Rodriguez Arnao MD, Rodríguez Sanchez A, Sanz Fernández M. Hipertiroidismo y yodo radioactivo en infancia y adolescencia. Rev Esp Endocrinol Pediatr 2015;6 Suppl(1).
15. Francis GL, Waguespack SG, Bauer AJ, et al. Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2015; 25:716-59.
16. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19:1167-214.
17. Hogan AR, Zhuge Y, Perez EA, Koniaris LG, Lew JI, Sola JE. Pediatric thyroid carcinoma: incidence and outcomes in 1753 patients. J Surg Res. 2009; 156(1):167-72.
Bibliografía recomendada
• Sanz Fernández M, Rodríguez Sánchez A, González Ruiz de León E. Patología tiroidea en el niño y en el adolescente. Pediatr Integral 2015; XIX (7): 467-476.
• Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM; American Thyroid Association Task Force on Thyroid Hormone Replacement. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014; 24(12):1670-751.
• Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, Rivkees SA, Samuels M, Sosa JA, Stan MN, Walter MA. American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis.Thyroid. 2016; 26(10):1343-1421.
• Francis GL, Waguespack SG, Bauer AJ, et al. Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2015; 25:716.
• American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19:1167.