Dolor musculoesquelético en la adolescencia. Etiología y orientación diagnóstica
Dolor musculoesquelético en la adolescencia. Etiología y orientación diagnóstica
C. Muñoz Gómez(1), J. de Inocencio Arocena(2,3).
(1)Servicio de Pediatría. Hospital Universitario Sanitas
La Moraleja. Madrid. (2)Unidad de Reumatología pediátrica. Hospital Universitario 12 de Octubre. Madrid. (3)Departamento de Salud Pública y Materno-Infantil. Universidad Complutense de Madrid
Fecha de recepción: 22-12-2023
Fecha de publicación: 31-03-2024
Adolescere 2024; XII (1): 6-14
Resumen
|
El dolor musculoesquelético (DME) es frecuente en la edad pediátrica en general y en la adolescencia en particular. Durante la adolescencia, características propias del sistema musculoesquelético en desarrollo y su mayor y más intensa participación en actividades deportivas hacen que esta entidad cobre más importancia. El dolor puede originarse en cualquiera de los componentes del sistema musculoesquelético y puede ser debido a múltiples causas, siendo las más frecuentes en adolescentes las de origen mecánico. Las bases para un adecuado abordaje diagnóstico son la anamnesis y la exploración física. Sin embargo, diferentes estudios sugieren que los pediatras carecen de una adecuada formación tanto en la exploración del sistema musculoesquelético como en la orientación diagnóstica de las patologías que afectan al aparato locomotor. En este artículo se revisan las características del DME en la adolescencia, las causas más frecuentes y los primeros pasos para una orientación diagnóstica que permita identificar los pacientes que requieran la realización de pruebas complementarias o su derivación a otros especialistas. Palabras clave: Dolor; Musculoesquelético; Adolescentes. |
Abstract
|
Musculoskeletal pain (MSP) is a common complaint in Pediatrics, particularly in adolescents. The combination of an immature skeleton and their active participation in competitions and sports makes them especially susceptible. Pain can arise from any of the components of the musculoskeletal system (MSS). There are multiple etiologies of MSP in adolescence, being trauma the most common. The medical history and physical examination are the most important tools to assess MSP. Nevertheless, several studies suggest that many pediatricians lack appropriate knowledge and skills to assess the MSS. This update reviews the characteristics of MSP during adolescence, its most common causes and the systematic approach to their diagnosis. Key words: Pain; Musculoskeletal; Adolescents. |
Introducción
La Asociación Internacional para el Estudio del Dolor (IASP, International Association for the Study of Pain) define el dolor musculoesquelético (DME) como una experiencia sensorial y emocional desagradable, asociada real o aparentemente a daño tisular real o potencial, que afecta al sistema musculoesquelético (músculos, bursas, tendones, ligamentos, articulaciones o huesos)(1).
La IASP matiza que el dolor es una experiencia personal influenciada de forma variable por factores biológicos, psicológicos y sociales; el concepto de dolor se aprende y es diferente de nocicepción, ya que el dolor no solo proviene de la actividad de neuronas sensoriales.
El dolor musculo-esquelético (DME) es un motivo de consulta frecuente en pediatría
Es un motivo de consulta frecuente en Urgencias y en las consultas de atención primaria, que puede originarse en cualquier componente del sistema musculoesquelético(2,3).
La frecuencia del dolor musculo-esquelético (DME) aumenta con la edad
El sistema musculoesquelético pediátrico presenta características que pueden dar lugar a distintas patologías en función de la edad. Algunas de estas características son, en el niño pequeño, la presencia del cartílago de crecimiento, la existencia de epífisis y apófisis cartilaginosas, la unión del tendón y el hueso mediante una interfase cartilaginosa, la mayor elasticidad de ligamentos y tendones y la variabilidad de la elasticidad y fuerza de la masa muscular, que aumenta con la edad. La adolescencia, a su vez, supone un periodo de mayor vulnerabilidad debido a la mayor participación en actividades deportivas, al incremento de la fuerza muscular con unos tendones y ligamentos más elásticos que en la edad adulta y a una gran actividad de los cartílagos de crecimiento(4).
El sistema musculo-esquelético de los adolescentes posee características que lo hacen más vulnerable a las lesiones
Sin embargo, a pesar de la prevalencia y las peculiaridades propias de los pacientes pediátricos, muchos pediatras refieren no sentirse cómodos al realizar la exploración del sistema musculoesquelético y la orientación diagnóstica del DME(2,5). Además, la literatura sugiere que la presencia de DME en la adolescencia aumenta la probabilidad de padecer DME crónico en la edad adulta(6).
Epidemiología
El DME es un motivo de consulta frecuente en Urgencias y en las consultas de atención primaria de Pediatría representando, junto al dolor de cabeza y el abdominal, una de las causas más frecuentes de dolor en pediatría(2,7). Su prevalencia oscila entre un 15 % y un 30 % de la población en función de las series consultadas(2,3,8,9).
La distribución por sexos es variable, aunque, en general, no suele mostrar diferencias significativas. Sin embargo, todas las series coinciden en que su frecuencia aumenta conforme aumenta la edad de los sujetos, especialmente en la adolescencia(2,3,8). Este incremento podría tener relación con las peculiaridades del sistema ME previamente descritas, con la actividad física de impacto de mayor intensidad y en mayor proporción en la adolescencia(4,10) o con un estilo de vida sedentario y un mayor uso de dispositivos electrónicos con pantallas(6).
Descripción clínica
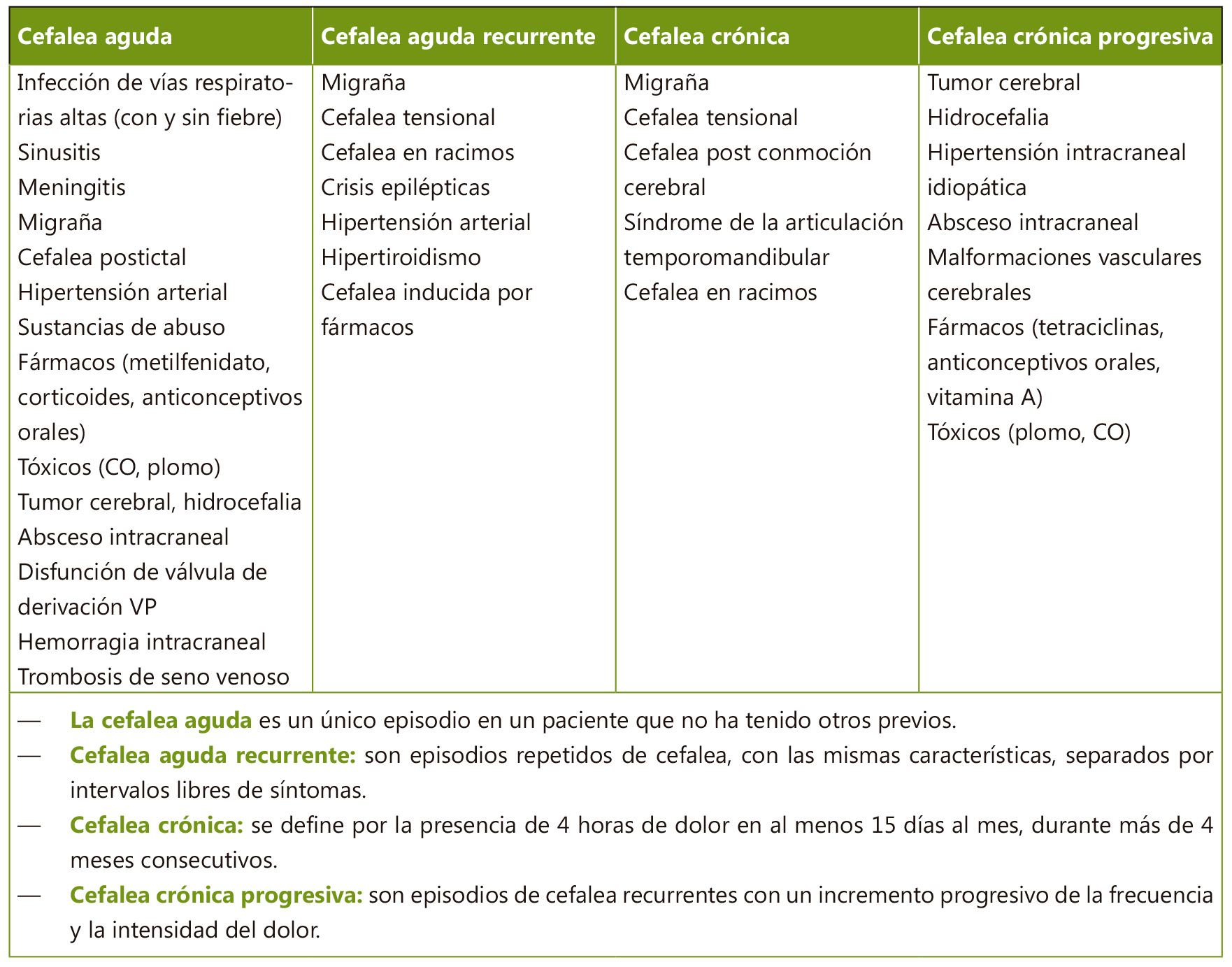
El DME puede originarse en cualquiera de los componentes del sistema musculoesquelético.
Las localizaciones pueden variar en función de la edad y la causa. En general, en Pediatría el dolor afecta más frecuentemente a los miembros inferiores, sobre todo a nivel de rodillas y tobillos(2,3,8). Asimismo, las fracturas de radio distal y las lesiones de los dedos de las manos también son un motivo de consulta recurrente en niños más mayores, especialmente en Urgencias(3). Por lo que respecta a la afectación axial, el dolor lumbar y cervical resulta particularmente frecuente en adolescentes, y su prevalencia se ha incrementado de manera significativa en la última década. Hasta qué punto contribuyen al DME un estilo de vida más sedentario y el uso de pantallas no está determinado, aunque hay estudios que sugieren esta relación(6).
En la mayoría de los casos las causas del DME son benignas y autolimitadas, principalmente procesos mecánicos
Las características clínicas del DME varían en función de su etiología. Aunque las causas más frecuentes suelen ser entidades benignas y autolimitadas, su diagnóstico diferencial incluye algunas enfermedades que requieren un diagnóstico precoz y derivación a unidades especializadas para su tratamiento.
La presencia de dolor de ritmo inflamatorio (que empeora con el reposo y mejora con la actividad) y la persistencia de los síntomas más de 6 semanas deberían hacer considerar la derivación a una unidad de reumatología pediátrica. La presencia de sintomatología sistémica, el dolor intenso que despierta al paciente por la noche o la impotencia funcional también son signos de alarma.
Abordaje diagnóstico
Las bases del abordaje diagnóstico son una anamnesis y una exploración física sistemáticas que permitan detectar los signos de alarma propios de patologías que requieran su derivación precoz a especialistas
La anamnesis y la exploración física suponen las bases del abordaje diagnóstico del DME no siendo preciso realizar, en la mayoría de los casos, pruebas complementarias más allá de una analítica básica con reactantes de fase aguda y/o una radiografía.
A pesar de ello, se sigue produciendo una demora en el diagnóstico y en la derivación de patologías cuyo pronóstico se podría beneficiar de un diagnóstico y manejo precoces (neoplasias, artritis idiopática juvenil, etc.), probablemente relacionada con una falta de formación de los pediatras en la exploración del sistema musculoesquelético(2,5).
Dado que el DME se puede originar en cualquier componente del sistema musculoesquelético, el objetivo de la anamnesis y exploración es triple: (1) identificar dónde se origina la sintomatología, (2) determinar qué pacientes precisan pruebas complementarias y (3) decidir quiénes requieren derivación a otros especialistas y quienes deben continuar su seguimiento clínico sin otras intervenciones.
Anamnesis
Diferenciar entre dolor inflamatorio (aparece tras reposo predominio matutino y rigidez) y mecánico (asociado a actividad
física predominio vespertino)
Siempre que sea posible se debe realizar la anamnesis directamente al paciente respetando su intimidad. Conviene tener en cuenta aspectos psicológicos propios de la adolescencia que pueden influir en la entrevista clínica, ya que pueden simular o negar sintomatología por miedo a ser juzgados o recriminados, o a que se les prohíba hacer algún tipo de actividad (deporte, baile, etc.)(4). Además, la dinámica familiar puede aportar información de utilidad, especialmente cuando el dolor asocia un componente funcional(2).
Los puntos que deberían analizarse en la anamnesis son:
- Caracterización del dolor: localización (diafisaria, metafisaria, articular), tiempo de evolución, presencia de dolor constante o intermitente y, en este caso, características de los intervalos libres de síntomas, limitación de actividades, necesidad de analgesia y respuesta a fármacos. La repercusión significativa del dolor en la vida del adolescente o el dolor que despierta por la noche deben ser tomados en consideración. Además, es de utilidad diferenciar entre dolor de ritmo o patrón inflamatorio (aparece tras reposo prolongado, de predominio matutino y asocia rigidez) o mecánico (asociado con la actividad física, de predominio vespertino).
- Antecedentes traumáticos significativos previos (24-48 horas antes del inicio de DME): aquellos que produzcan dolor, impotencia funcional, tumefacción o hematomas. Es importante preguntar sobre el mecanismo, la localización y el tiempo que ha transcurrido hasta la aparición de los síntomas.
- Síntomas acompañantes: fiebre, clínica constitucional.
- Antecedentes personales y familiares(2).
La anamnesis debería permitir identificar los posibles signos de alarma: sintomatología sistémica incluyendo fiebre, dolor de patrón inflamatorio, dolor intenso que no mejora con analgesia y/o que despierta por la noche, que asocia impotencia y alteración funcional o dolor/síntomas persistentes(2).
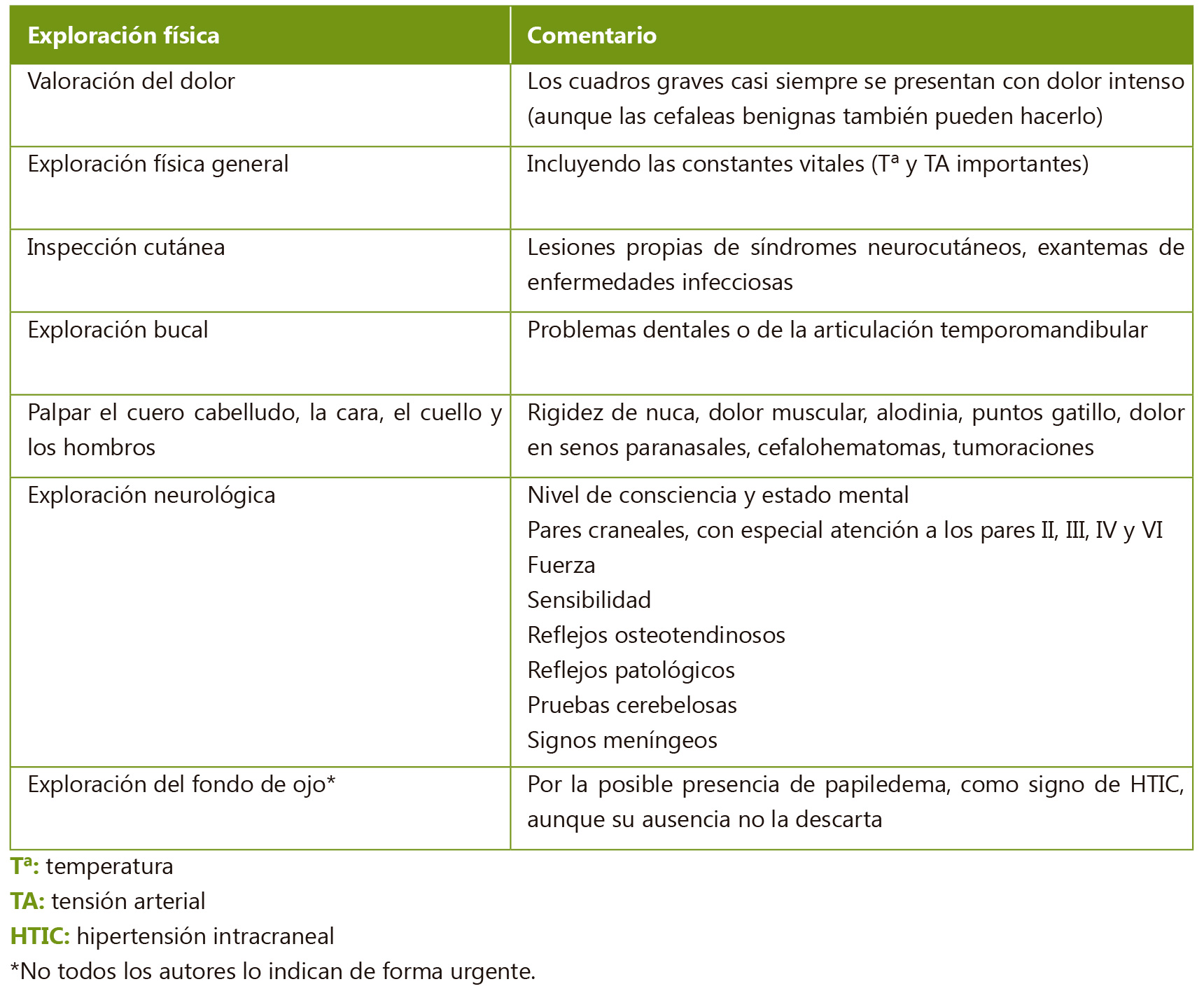
Exploración física
Antes de empezar a realizar la exploración física, se puede obtener información mediante la observación de la marcha del paciente al entrar en la consulta(2,11) cuando no se siente observado.
Es importante realizar una evaluación sistemática del estado general y por aparatos y no únicamente del sistema musculoesquelético o del sitio concreto en el que presente dolor.
La inspección debe realizarse con el paciente descalzo y en ropa interior para identificar lesiones cutáneas, exantemas, hematomas, etc.(2,11).
La exploración del sistema musculoesquelético ha de ser sistemática, valorando cada articulación por separado en todos los ejes de movimiento y, siempre que sea posible, comparando con la extremidad contralateral(11). En la exploración articular deben valorarse la presencia de tumefacción, limitación y dolor, así como buscar posibles asimetrías. Las discrepancias de longitud se pueden medir utilizando bloques o cinta métrica. No debe olvidarse explorar la columna, incluyendo la región cervical y las articulaciones sacroilíacas.
Pruebas complementarias
Habitualmente no son necesarias. En caso de realizarse, algunas de utilidad son:
La presencia de ASLO a títulos altos, solo implica antecedente de infección estreptocócica
- Analítica:
- Valoración de reactantes de fase aguda: sospecha de infección o inflamación.
- Fórmula manual y lactato deshidrogenasa: sospecha de malignidad.
- Perfil hepático y creatin fosfocinasa: si presencia de dolor muscular(12).
- No se recomienda la determinación sistemática de factor reumatoide y anticuerpos antinucleares como prueba de cribado ante la presencia de DME, ya que su valor predictivo positivo es muy bajo.
- La presencia de ASLO a títulos altos únicamente implica un antecedente de infección estreptocócica(1).
- Pruebas de imagen:
- Radiografía simple: puede ser de utilidad en caso de dolor óseo a punta de dedo.
- Ecografía: en caso de detectar tumefacción o limitación dolorosa de una articulación.
- Otras: gammagrafía ósea con Tc 99, RM o TC.
Causas más frecuentes
Existen multitud de patologías que pueden causar DME en adolescentes, la mayor parte de ellas benignas y autolimitadas:
Causas traumatológicas y ortopédicas
Los traumatismos suponen la causa más frecuente de DME en la edad pediátrica, siendo más frecuentes y más graves cuanto mayor es el paciente. Se producen como consecuencia de un traumatismo y pueden originar lesiones y dolor a nivel de hueso, articulaciones o partes blandas(2,3,4).
Lesiones agudas:
La epifisiolisis de cadera en adolescentes representa una urgencia ortopédica
- Epifisiolisis: su incidencia está aumentando. En los subtipos III y IV de Salter-Harris la fractura afecta la capa germinal de la fisis y afectan la superficie articular, por lo que se consideran de mayor gravedad(4).
La epifisiolisis de cadera es de especial importancia en adolescentes porque representa una urgencia ortopédica. Se presenta con un deslizamiento posterior de la cabeza femoral. Es más frecuente en varones. Su etiología es desconocida. Clínicamente cursa con dolor de ritmo mecánico y alteración de la marcha. En la exploración física presentan disminución de la rotación interna y, en ocasiones, se aprecia acortamiento de la extremidad. El diagnóstico se realiza con una radiografía de cadera preferentemente en proyección axial, en la que resulta más evidente el desplazamiento de la cabeza femoral(2).
- Inestabilidad femoropatelar: la rótula presenta diferentes grados de luxación respecto al surco troclear. La luxación ocasional o recurrente de la rótula es la menos grave y la más frecuente(4).
- Esguinces de tobillo: hasta el 30 % de las lesiones producidas en adolescentes deportistas, aunque su frecuencia está sobreestimada(4).
- Rotura del ligamento cruzado anterior: poco frecuente debido a la elasticidad de los tendones que predispone más a las fracturas de la eminencia tibial. Clínicamente cursa con dolor y hemartros(4).
- Avulsiones óseas: de la eminencia tibial y del polo inferior de la rótula.
- Lesiones meniscales: poco frecuentes, aunque su incidencia está subiendo al aumentar la práctica deportiva. Clínicamente cursa con dolor, derrame articular y síntomas mecánicos(4).
El S. de dolor femoro-patelar es la causa más frecuente de dolor anterior en la rodilla del adolescente
- Síndrome de dolor femoro-patelar:
Es una de las causas más frecuentes de dolor anterior de rodilla en adolescentes(13). Se han utilizado diferentes términos, incluidas condropatía y condromalacia rotuliana(2,13), aunque el término condromalacia debería reservarse para los casos en los que se observan lesiones en la superficie articular de la rótula. Se define como dolor alrededor o detrás de la rótula que se agrava con la carga manteniendo la rodilla en flexión (correr, subir escaleras, saltar, ponerse en cuclillas)(2,13). Es un proceso transitorio que mejora con la madurez del sistema locomotor. El manejo es conservador, con reposo relativo, analgesia y ejercicios para potenciar el cuádriceps(2,13). En caso de no responder al manejo conservador se recomienda realizar una radiografía simple ya que, aunque no es necesaria para su diagnóstico, si es útil para excluir otros diagnósticos(13).
- Apofisitis:
Consiste en la inflamación de la zona de inserción de tendones potentes en los huesos.
Se producen debido a la menor resistencia a la tracción de la apófisis en esta etapa del crecimiento, unida a una posible sobrecarga en el contexto de la práctica deportiva. Son más frecuentes en adolescentes (de 8 a 13 años), en varones y se relacionan con el deporte.
Su síntoma principal es el dolor apofisario localizado a punta de dedo y contra resistencia de la musculatura involucrada(2,14).
La exploración física suele ser normal salvo por la presencia de dolor a punta de dedo. Si no se sospechan fracturas no se recomienda realizar estudios de imagen(2).
Son entidades autolimitadas y su manejo es conservador. Consiste en el reposo relativo, particularmente el deportivo, desaconsejándose el reposo absoluto. Las medidas locales pueden ser de ayuda en el alivio del dolor. En caso de no mejoría, la fisioterapia puede ser útil. No suele ser precisa la analgesia oral ni la utilización de ortesis o férulas.
Las apofisitis más frecuentes son: la de Osgood-Schlatter, la de Sever y la de Sinding-Larsen-Johanson
Las más frecuentes son la apofisitis calcánea de Sever y las que se originan en la rodilla (Osgood-Schlatter y Sinding-Larsen-Johanson), que también se clasifican como osteocondrosis. El síndrome de Osgood-Schlatter es la apofisitis de la tuberosidad tibial anterior y es la más frecuente en los adolescentes que practican deporte(2). La enfermedad de Sever tiene lugar en la apófisis del calcáneo. Es característica la aparición de dolor en la zona del talón y la cojera tras el ejercicio(2).
- Osteocondrosis: enfermedad de Perthes:
Las osteocondrosis se producen como consecuencia de una interrupción temporal de la vascularización en el complejo hueso-cartílago de una articulación en concreto. La entidad más frecuente en edad pediátrica es la enfermedad de Legg-Calvé-Perthes(15). Consiste en una necrosis avascular de la cabeza femoral. Es más frecuente en la edad pediátrica (3-10 años)(2) y debe considerarse en el diagnóstico diferencial del dolor de cadera. Los síntomas se presentan de forma subaguda, con dolor referido a la ingle o la rodilla y puede asociar cojera(2,15). El diagnóstico se realiza mediante radiografía axial de caderas (proyección de Lowenstein), donde se puede apreciar, dependiendo del estadio, la aparición de una semiluna hipodensa en el hueso subcondral, la fragmentación de la cabeza femoral o su asimetría con respecto al contralateral. La gammagrafía ósea permite un diagnóstico precoz(2).
Los pacientes deben ser derivados al diagnóstico al traumatólogo(2,15).
- Síndromes por sobrecarga:
- Osteocondritis disecante juvenil: alteración idiopática focal del hueso subcontral.
Es más frecuente en MMII (rodilla, tobillo) y su causa es desconocida, probablemente multifactorial; podría tener relación con microtraumatismos repetitivos de un área vulnerable. Clínica variable: dolor mal localizado y relacionado con la actividad deportiva(4).
- Osteocondritis disecante juvenil: alteración idiopática focal del hueso subcontral.
- Fracturas de estrés: son poco frecuentes excepto en adolescentes corredores de fondo. Suelen afectar a la epífisisis proximal de la tibia y a la cabeza del segundo metatarsiano(4). Generalmente ocurren tras actividad deportiva repetida o en adolescentes sedentarios que realizan mayor actividad física de la habitual en un momento concreto(2). Tienen una reacción perióstica rápida y callo óseo grande, lo que puede confundirse con otras patologías(4).
La clínica suele ser larvada, con dolor de ritmo mecánico de intensidad creciente con el ejercicio mantenido que le obliga a interrumpir la actividad(2). Es necesaria una alta sospecha clínica para su diagnóstico. Los cambios no son visibles en una radiografía simple hasta pasado un mínimo de dos semanas, sin embargo, la gammagrafía permite un diagnóstico precoz.
En las fracturas de estrés la gammagrafía permite un diagnóstico precoz
Hipermovilidad articular benigna
El rango de movilidad normal de una articulación es variable y depende, entre otros factores, de la edad, la etnia y el sexo. Se considera hipermovilidad articular la presencia de un mayor rango de movilidad articular del considerado “normal” en ausencia de patologías del sistema conectivo. Se diagnostica utilizando los criterios de Beighton. No se trata de una patología, sino de una variante de la normalidad(2), cuya prevalencia oscila entre el 2,3 % y el 64 % dependiendo de la edad, la etnia y los criterios utilizados para su diagnóstico(16). La hipermovilidad por sí sola no explica la presencia de dolor, por lo que se considera que lo que lo produce es el desequilibrio biomecánico subyacente(16). Puede suponer un factor de riesgo para el desarrollo de DME crónico(17). El manejo es conservador, aconsejándose reposo relativo en la fase aguda y siendo de especial importancia tranquilizar a la familia(2).
Síndromes de amplificación dolorosa
En una parte importante de los adolescentes, el DME agudo o crónico es de origen desconocido(2). Este dolor puede variar en intensidad (de leve a incapacitante) y frecuencia (de muy ocasional a continuo) representando un amplio espectro de presentaciones clínicas que han recibido distintas denominaciones, aumentando la confusión sobre esta entidad (dolor idiopático, síndrome de dolor regional complejo tipo I, fibromialgia juvenil, distrofia simpática refleja, etc.) Todos ellos parecen compartir un mecanismo patogénico similar, por lo que se podrían englobar bajo el término paraguas de “síndromes de amplificación del dolor”(18). Su patogenia es desconocida, aunque parecen estar implicados diferentes factores, como la sensibilización central, disautonomía, predisposición genética, alteraciones neuroendocrinas o factores psicosociales.
Las entidades más frecuentes son la fibromialgia juvenil y el síndrome del dolor regional complejo tipo I.
La fibromialgia juvenil es una patología multifactorial con dolor a múltiples niveles, asociada a fatiga crónica, variaciones del estado de ánimo y alteraciones del sueño
La fibromialgia juvenil es una patología multifactorial caracterizada por dolor a múltiples niveles, asociada con fatiga crónica, variaciones del estado de ánimo y alteraciones del sueño. También pueden presentar alodinia e hiperalgesia. El inicio del dolor a menudo es gradual y carece de desencadenante aparente. El diagnóstico de la fibromialgia juvenil se realiza mediante criterios y es de exclusión.
El síndrome del dolor regional complejo tipo I, por el contrario, es una forma poco frecuente y severa de síndrome de amplificación del dolor, que suele iniciarse después de traumatismos e inmovilizaciones, y que comprende dolor y alteraciones motoras y sensitivas. Clínicamente se caracteriza por dolor intenso que asocia cambios de coloración y temperatura. El dolor normalmente se inicia en una zona localizada y se puede intensificar e irradiar a otras áreas. También puede asociar edema y alodinia con dolor al mínimo contacto cutáneo, así como limitación de la movilidad o incluso cambios tróficos en casos con más tiempo de evolución(12). El diagnóstico se realiza por criterios clínicos y requiere manejo por especialistas con experiencia. Es fundamental el control del dolor y la movilización precoz de la extremidad afectada(18).
Infecciones osteoarticulares
El agente causal más frecuente en la adolescencia es el Staphylococcus aureus(19). Deben ser sospechadas y tratadas con precocidad. Se debe sospechar en caso de limitación dolorosa o inmovilidad de una extremidad, acompañada de fiebre y malestar general. En caso de afectación articular, presentará tumefacción, calor y limitación de la movilidad. Puede afectar al esqueleto axial (pelvis, articulaciones sacroilíacas o columna vertebral), asociando manifestaciones gastrointestinales y requiriendo un elevado índice de sospecha clínica. La localización más frecuente es en miembros inferiores(1). En caso de artritis, es imprescindible la obtención de líquido articular como medida diagnóstica y terapéutica. En la analítica se observarán leucocitosis con neutrofilia y elevación de reactantes de fase aguda. El tratamiento consiste en terapia secuencial, con administración inicial de antibioterapia intravenosa y posterior paso a vía oral(19).
Enfermedades inflamatorias
Artritis idiopática juvenil
La artritis idiopática juvenil es la enfermedad reumática crónica más frecuente en pediatría
Es la enfermedad reumática crónica más frecuente en pediatría(2,20). Actualmente los criterios de clasificación de ILAR (International League of Associations for Rheumatology) la definen como la artritis de más de 6 semanas de duración en pacientes menores de 16 años en ausencia de otras causas identificables(20). Es una entidad heterogénea, con diferentes formas de presentación y evolución, que es abordada en otro capítulo de esta monografía por lo que no se tratará aquí. Según los criterios de clasificación actuales, existen 7 categorías, en las que se agrupan pacientes con características clínicas similares(20). En todas las categorías es característica la rigidez articular, siendo más frecuente el dolor en aquellos que presentan entesitis (inflamación de la inserción de los tendones, cápsulas y ligamentos en el hueso).
Otras causas inflamatorias
Hay múltiples enfermedades que pueden cursar con artritis, incluyendo artritis postinfecciosas (artritis reactivas, fiebre reumática y artritis postestreptocócica, enfermedad de Lyme, etc.), autoinmunes (asociada a enfermedad inflamatoria intestinal, lupus eritematoso sistémico, etc.) y autoinflamatorias (síndromes de fiebre periódica, interferonopatías, etc.) que, por motivos de extensión, no se pueden abordar en este capítulo.
Neoplasias
La leucemia es el principal diagnóstico diferencial a realizar con la AIJ
Diferentes tipos de neoplasias pueden causar DME. La leucemia es la entidad más frecuente; habitualmente cursa con sintomatología sistémica y su principal diagnóstico diferencial es la AIJ sistémica. Los tumores óseos sólidos benignos (osteoma osteoide) y malignos (osteosarcoma, sarcoma de Ewing) también pueden producir DME(2). Clínicamente destacan las discordancias existentes en la exploración entre la intensidad del dolor y los escasos hallazgos presentes en la exploración articular y analíticamente entre los reactantes de fase aguda (elevados) y el recuento de plaquetas (disminuido). Dada su escasa frecuencia, la realización de radiografías es de utilidad en los casos en los que la localización del dolor o la persistencia de los síntomas no sean explicables por otras patologías(2).
Tratamiento y prevención
Todos los pediatras deberían tener una formación básica en la exploración del sistema musculo-esquelético
El tratamiento será diferente según la etiología. En general, como primer escalón se pueden utilizar AINEs. El reposo relativo puede ser de utilidad en las lesiones de origen mecánico incluyendo aquellas por sobreuso. En general, el reposo absoluto está desaconsejado e incluso puede empeorar el curso del proceso, como en el caso de los síndromes de amplificación del dolor.
Respecto a la prevención, además de la formación en la exploración del sistema musculoesquelético, han de tenerse en cuenta medidas específicas para prevenir las lesiones deportivas, dada la prevalencia en esta etapa y la incidencia creciente. En general, deben evitarse la sobrecarga y la elevada exigencia en deportistas, así como adecuar la intensidad de los deportes de contacto.
Bibliografía
1. Terminology [Internet]. International Association for the Study of Pain (IASP). 2021 [citado el 21 de diciembre de 2023]. Disponible en: https://www.iasp-pain.org/resources/terminology/.
2. de Inocencio Arocena J. Dolor musculoesquelético en pediatría de atención primaria. Etiología y orientación diagnóstica. Arch Argent Pediatr. 2006;104(3):275–83.
3. de Inocencio J, Carro MÁ, Flores M, Carpio C, Mesa S, Marín M. Epidemiology of musculoskeletal pain in a pediatric emergency department. Rheumatol Int [Internet]. 2016 [Consultado 15 Dic 2023];36(1):83–9. Disponible en: http://dx.doi.org/10.1007/s00296-015-3335-9.
4. de Bergua Domingo, JM, Knörr Giménez, J. Lesiones deportivas en el adolescente. Adolescere. 2021;IX(3):48–59.
5. Jandial S, Myers A, Wise E, Foster HE. Doctors likely to encounter children with musculoskeletal complaints have low confidence in their clinical skills. J Pediatr [Internet]. 2009 [Consultado 15 Dic 2023];154(2):267–71. Disponible en: http://dx.doi.org/10.1016/j.jpeds.2008.08.013.
6. da Costa L, Lemes IR, Tebar WR, Oliveira CB, Guerra PH, Soidán JLG, et al. Sedentary behavior is associated with musculoskeletal pain in adolescents: A cross sectional study. Braz J Phys Ther [Internet]. 2022 [Consultado 15 Dic 2023];26(5):100452. Disponible en: http://dx.doi.org/10.1016/j.bjpt.2022.100452.
7. Perquin CW, Hazebroek-Kampschreur AAJM, Hunfeld JAM, Bohnen AM, van Suijlekom-Smit LWA, Passchier J, et al. Pain in children and adolescents: a common experience. Pain [Internet]. 2000 [Consultado 15 Dic 2023];87(1):51–8. Disponible en: http://dx.doi.org/10.1016/S0304-3959(00)00269-4.
8. Fuglkjær S, Hartvigsen J, Wedderkopp N, Boyle E, Jespersen E, Junge T, et al. Musculoskeletal extremity pain in Danish school children – how often and for how long? The CHAMPS study-DK. BMC Musculoskelet Disord [Internet]. 2017 [Consultado 15 Dic 2023];18(1). Disponible en: http://dx.doi.org/10.1186/s12891-017-1859-8.
9. Khanom S, McDonagh JE, Briggs M, Bakir E, McBeth J. Adolescents’ experiences of fluctuating pain in musculoskeletal disorders: a qualitative systematic review and thematic synthesis. BMC Musculoskelet Disord [Internet]. 2020 [Consultado 15 Dic 2023];21(1):645. Disponible en: http://dx.doi.org/10.1186/s12891-020-03627-1.
10. Legault ÉP, Descarreaux M, Cantin V. Musculoskeletal symptoms in an adolescent athlete population: a comparative study. BMC Musculoskelet Disord [Internet]. [Consultado 15 Dic 2023]. 2015;16(1):210. Disponible en: http://dx.doi.org/10.1186/s12891-015-0681-4.
11. Alonso Hernández J. Exploración sistemática del aparato locomotor. Adolescere. 2021;IX(3):7–16.
12. Weiser P. Approach to the patient with noninflammatory musculoskeletal pain. Pediatr Clin North Am [Internet]. 2012 [Consultado 15 Dic 2023];59(2):471–92. Disponible en: http://dx.doi.org/10.1016/j.pcl.2012.03.012.
13. Gaitonde DY, Ericksen A, Robbins RC. Patellofemoral Pain Syndrome. Am Fam Physician. 2019;99(2):88–94.
14. Lirola Criado JF. Apofisitis. Adolescere. 2021;IX(3):32–6.
15. Achar S, Yamanaka J. Osteochondrosis: Common Causes of Pain in Growing Bones. Am Fam Physician. 2019;99:610–8.
16. Armon K. Musculoskeletal pain and hypermobility in children and young people: is it benign joint hypermobility syndrome? Arch Dis Child [Internet]. 2015 [Consultado 15 Dic 2023];100(1):2–3. Disponible en: http://dx.doi.org/10.1136/archdischild-2014-306556.
17. van Meulenbroek T, Huijnen IPJ, Simons LE, Conijn AEA, Engelbert RHH, Verbunt JA. Exploring the underlying mechanism of pain-related disability in hypermobile adolescents with chronic musculoskeletal pain. Scand J Pain [Internet]. 2021 [Consultado 15 Dic 2023];21(1):22–31. Disponible en: http://dx.doi.org/10.1515/sjpain-2020-0023.
18. Hoffart CM, Wallace DP. Amplified pain syndromes in children: treatment and new insights into disease pathogenesis. Curr Opin Rheumatol [Internet]. 2014 [Consultado 15 Dic 2023];26(5):592–603. Disponible en: http://dx.doi.org/10.1097/BOR.0000000000000097.
19. Saavedra-Lozano J, Calvo C, Huguet Carol R, Rodrigo C, Núñez E, Pérez C, et al. Documento de Consenso SEIP-SERPE-SEOP sobre etiopatogenia y diagnóstico de la osteomielitis aguda y artritis séptica no complicadas. An Pediatr (Barc) [Internet]. 2015 [Consultado 15 Dic 2023];83(3):216.e1-10. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2014.08.006.
20. Martini A, Lovell DJ, Albani S, Brunner HI, Hyrich KL, Thompson SD, et al. Juvenile idiopathic arthritis. Nat Rev Dis Primers [Internet]. 2022 [Consultado 15 Dic 2023];8(1). Disponible en: http://dx.doi.org/10.1038/s41572-021-00332-8.
No existen conflictos de interés en la realización de este artículo.