Comunicaciones Orales y Posters 2024 nº2
COMUNICACIONES PRESENTADAS EN EL XXVII CONGRESO DE VALENCIA DE LA SOCIEDAD ESPAÑOLA DE MEDICINA DE LA ADOLESCENCIA (SEMA)
COMUNICACIONES PRESENTADAS EN EL XXVII CONGRESO DE VALENCIA DE LA SOCIEDAD ESPAÑOLA DE MEDICINA DE LA ADOLESCENCIA (SEMA)
Adolescere 2024; XII (2)
|
COMUNICACIONES PREMIADAS |
|
1ER PREMIO |
”MEDICINA VS VETERINARIA”: IMPLANTACIÓN DE UNA CONSULTA MULTIDISCIPLINAR DE GINECOLOGÍA DE LA ADOLESCENCIA
Pérez Pascual M, Bonet De Luna C, Ruano Fernández J, Ruiz Martínez T. Hospital Universitario La Paz. Madrid.
Introducción: La adolescencia se caracteriza por importantes cambios físicos, psicológicos, emocionales y sociales. Muchos profesionales que se sienten inseguros al tratar con adolescentes, se centran estrictamente en su especialidad (“su órgano afecto”). Por falta de tiempo, pero sobre todo por falta de formación, no abordan cuestiones vitales y relacionales que son importantísimas para entender lo que está pasando. Por ello, en nuestro hospital, decidimos hacer un estudio piloto de 6 meses, pasando simultáneamente pediatra y ginecólogo del adolescente una consulta conjunta. Objetivos: Analizar la aportación que la presencia de un pediatra especializado en adolescencia tiene en una consulta de ginecología enfocada a pacientes de 12 a 18 años. Material y métodos: Estudio descriptivo retrospectivo. Variables: edad de la paciente, motivo de consulta, diagnóstico de ginecología, diagnóstico de adolescencia y resolución. Resultados: Durante 6 meses se ha pasado consulta, 2 días al mes un pediatra y un ginecólogo, especializados en adolescentes. Han sido un total de 12 días, registrándose pacientes entre 12 y 17 años cumplidos, que acudían en modalidad presencial. Se estudian las aportaciones hechas al diagnóstico ginecológico, de la “mirada pediátrica“. De un total de 252 pacientes atendidas en estas consultas, se excluyeron aquellas que no cumplían criterios de inclusión (edad fuera del rango de 12 a 17 años cumplidos), quedando N 144. El pediatra intervino en 50 de ellas (34,7 %). Más del 60 % tenía edades entre 14 y 16 años. Los motivos de consulta más frecuentes fueron síndrome menstrual anómalo, solicitud de anticoncepción (AC) y dismenorrea que coinciden con la mayoría de los diagnósticos ginecológicos. Los aportes más frecuentes realizados por el pediatra al diagnóstico ginecológico han sido: necesidad de educación para la salud (EpS), centrar en la patología crónica que condicionaba signos y síntomas ginecológicos y la presencia de anorexia nerviosa no identificada. También fue importante la aportación del pediatra en aspectos ético legales, sobre esterilización en menores de edad con dificultades cognitivas. Finalmente se ayudó en el manejo multidisciplinar de algunos ASI (infecciosos, sociales, psicológicos, legales, educacionales y sistémicos). Cuando evaluamos el 32 % que se derivó a adolescencia, vemos que los motivos principales fueron anorexia nerviosa, obesidad, abuso sexual y patología crónica. Conclusiones: En una consulta de ginecología del adolescente hasta un 34,7 % de las pacientes van a necesitar un abordaje integral. De nuestro estudio, un 32 % precisó derivación a consultas de medicina de la adolescencia, para ampliar la valoración a las distintas esferas biopsicosociales. Hasta un 50 % de las que precisaron intervención por el pediatra se hizo en la misma consulta conjunta. La colaboración entre ambas disciplinas, repercutió en mayor conocimiento y satisfacción para las profesionales. Para las pacientes, las consultas fueron más resolutivas y su grado de satisfacción (expresado verbalmente) mayor. Los profesionales que atendemos adolescentes debemos sensibilizarnos en el deber explorar otras esferas micro, meso y macro
ambientales (Bronfenbrenner), que están condicionando su salud y su comportamiento. No somos veterinarios, somos médicos. Eso implica que la atención debe ser prestada con humanidad, capacidad de escucha (respeto, calidad y calidez) y conocimientos técnicos. Ser médicos con una mirada integradora, sin centrar exclusivamente en “el órgano afecto de nuestra especialidad”. Hacerlo así, mejora la adherencia al tratamiento, favorece el cambio de conducta y aumenta de forma clara la satisfacción de todos: padres, profesionales y pacientes.
|
2º PREMIO |
DESCRIPCIÓN Y COMPARACIÓN DE HÁBITOS DE ACTIVIDAD FÍSICA Y SEDENTARISMO ENTRE POBLACIÓN INFANTIL Y ADOLESCENTE CON NORMOPESO, SOBREPESO Y OBESIDAD
Corral Bellón S, De Blas Zapata A, Hartgring I, Arocas Lázaro F, Baixauli López L. Hospital General Universitario de Valencia.
Introducción: En la población infantil el 60 % no alcanza las recomendaciones de actividad física diaria. El abuso de dispositivos electrónicos puede favorecer el sedentarismo y con ello, la obesidad. Objetivo: identificar la relación que existe entre el tiempo de uso de pantallas, la actividad física y la composición corporal de un grupo de niños y adolescentes. Material y métodos: Estudio observacional transversal en participantes entre 8-16 años. Se registró composición corporal mediante impedanciometría, actividad física medida con acelerometría durante 7 días y uso de pantallas en cuestionarios estandarizados. Resultados: Muestra de 164 pacientes (62,8 % obesidad y dos grupos control: 22 % normopeso y 15,2 % sobrepeso). El uso medio diario de pantallas fue de 6,3 horas entre semana y 8,45 el fin de semana. Los pacientes con obesidad presentaron menor número de pasos diarios respecto a los normopeso y sobrepeso (p=0,0001) y paralelamente, mayor consumo diario de pantallas entre semana (p=0,04). Existe además una relación significativa entre el porcentaje de grasa de los pacientes y el tiempo de sedentarismo. Conclusión: Se evidencia alta prevalencia de abuso de pantallas. Mayor tiempo de sedentarismo se relaciona con mayor porcentaje de masa grasa.
|
POSTERS |
DOLOR DE MIEMBROS INFERIORES EN EL ADOLESCENTE, UN RETO EN PEDIATRÍA
Martí Enrique V(1), Blanes Segura S(2). (1)Hospital Virgen de los Lirios. (2)Centro de Salud la Bassa, Alcoy. Alicante.
Introducción: El dolor musculoesquelético es un motivo de consulta frecuente en la adolescencia. En la mayoría de los casos la etiología es benigna. Presentamos dos casos de patología ósea y su abordaje. Objetivo: Reconocer los síntomas guía para completar el estudio diagnóstico de los adolescentes con dolor y patología ósea, así como conocer el abordaje multidisciplinar que requieren para un adecuado tratamiento. Conclusiones: Caso 1: Adolescente de 13 años, aparición brusca de un bulto en la rodilla derecha. No traumatismo previo ni otra clínica de interés. Exploración física: tumoración ósea de 5 cm en cara anterior de tibia derecha. No dolor ni crepitación. Radiografía y TAC: Displasia osteofibrosa en tibia derecha (Figura 1). Se realiza seguimiento multidisciplinar en unidad de tumores óseos con actitud expectante. Asintomática a día de hoy. Caso 2: Adolescente de 13 años, dolor de las caderas tras partido de fútbol. Exploración física: Dolor a la palpación y movilización de cadera izquierda. No traumatismo. Sin otra clínica de interés. Se realiza radiografía, TAC y RMN: Arrancamiento espina iliaca anteroinferior izquierda. Quiste óseo aneurismático en fémur derecho (Figura 2), se deriva a comité de tumores óseos y se decide intervención para infiltración local de corticoides. La anamnesis y la exploración minuciosa son esenciales para llegar al diagnóstico y tratamiento adecuado del adolescente con dolor. Aunque la mayoría de casos son benignos, en los casos con síntomas de alarma debemos realizar un amplio diagnóstico diferencial para llegar a un tratamiento multidisciplinar etiológico. Resumen: El dolor musculoesquelético es un motivo de consulta frecuente en la adolescencia. En la mayoría de los casos la etiología es benigna. Presentamos dos casos de patología ósea en adolescentes y su abordaje con el objetivo de reconocer que síntomas de alarma debemos tener en cuenta los pediatras para completar adecuadamente el estudio y diagnóstico de estos pacientes. La anamnesis y la exploración minuciosa permiten orientar el diagnóstico de entidades como la displasia osteofibrosa y el quiste óseo aneurismático. Se tratan de entidades benignas, pero que en ocasiones requieren tratamiento invasivo. La adecuada orientación diagnóstica nos permite evitar ansiedad familiar anticipatoria.
TRIADA DE LAS ATLETAS
Castillo Ávila Y, Posso Cardenas YR, Kaur A, Siurana Rodríguez JM, Reyes Alayo JL. Hmnens Barcelona.
Introducción: La triada de la atleta involucra baja disponibilidad de energía, disfunción menstrual, y baja densidad mineral ósea. La presencia de los tres componentes implica mayor gravedad sobre la salud de la atleta y su rendimiento deportivo. Objetivo: Una historia clínica detallada en la adolescente deportista es fundamental para el diagnóstico de la triada de las atletas. Caso clínico: Adolescente femenina de 14 años, quien realiza danza contemporánea de 16 a 20h semanales, los últimos 4 meses presenta vértigos a los cambios posturales asociado a astenia y amenorrea. No pérdida de peso. Al examen clínico denota palidez mucocutánea, los exámenes complementarios: electrocardiograma y ecocardiograma normales, bioimpedanciometría con composición corporal adecuada, analítica sanguínea: ferropenia severa e hipovitaminosis D. Tras evidenciar la presencia de la triada de la atleta se indica suplemento con sulfato ferroso y vitamina D, reducción horaria en la actividad deportiva y adecuada nutrición. Tras 6 meses de seguimiento evolutivo presenta mejoría clínica y mejor rendimiento deportivo. Conclusión: Una historia clínica detallada en las adolescentes deportistas permite un diagnóstico precoz de la triada de la atleta. El diagnóstico precoz de esta patología permite adoptar medidas de prevención como primera línea de tratamiento y adecuarlas a cada deporte.
ALERGIA INDUCIDA POR EJERCICIO FÍSICO
Reyes Alayo JL, Posso Cardenas YRs, Kaur A, Siurana Rodríguez JM, Castillo Ávila Y.Hmnens Barcelona.
Introducción: La alergia inducida por ejercicio físico es una patología en aumento en los últimos años con prevalencia en adolescentes deportistas. El consumo de alimento al que el paciente está sensibilizado y al realizar inmediatamente ejercicio físico puede desencadenar síntomas cutáneos, angioedema, dificultad respiratoria e incluso anafilaxia. Las proteínas transportadoras de lípidos (LTP) ampliamente distribuida en el reino vegetal, es la causa más frecuente de alergia alimentaria. En ocasiones los pacientes alérgicos a LTP presentan síntomas únicamente en presencia de cofactores como el ejercicio físico o la toma de antiinflamatorios. Objetivo: Una historia clínica detallada en los adolescentes deportistas es fundamental para el diagnóstico de la alergia inducida por ejercicio. Caso clínico: Adolescente de 12 años con episodios repetidos de lesiones pruriginosas y angioedema labial después de práctica deportiva. Durante anamnesis indica que ocurre tras consumo de manzana previo al entrenamiento. Mejoría clínica con antihistamínicos. En alergología se realiza estudio analítico que confirma alergia a la corteza de la manzana mediada por las LTP. Control evolutivo favorable, realiza deporte evitando el consumo de alimentos con contenido LTP antes o después de la práctica deportiva. Conclusión: Elaborar una historia clínica detallada permite el diagnóstico precoz de la alergia inducida por ejercicio físico.
DOLOR ESQUELÉTICO EN EL ADOLESCENTE, NO TODO ES PSICOSOMÁTICO
Carvajal Roca E, Nieto García A, Alcayde Blat T, Güemes Heras I, Moreno Ballestero V. Hospital La Salud. Valencia.
Introducción: El dolor musculoesquelético es muy frecuente en niños y adolescentes y constituye una causa habitual de consulta médica y de derivación a reumatólogos pediátricos y cirujanos ortopédicos. Se ha estimado que, entre un 10 y un 20 % de los niños en edad escolar lo presentan. En la mayoría de los casos no encontraremos una patología que justifique el dolor. El dolor dorsolumbar es uno de los más frecuentes y, recientes estudios, muestran que la mayoría de los adolescentes con este dolor responden a procesos benignos, limitados o idiopáticos. Por ello no todos los pacientes deben ser sometidos a una batería de pruebas de imagen y laboratorio. Lo más importante es una buena historia clínica, guiada por una anamnesis dirigida y una exploración minuciosa. Objetivos: Comunicamos el caso de dos adolescentes con dolor músculo esquelético. Material o pacientes y método: Adolescente mujer 12,5 años que presenta dolor en glúteo izquierdo que irradia al muslo de 4 semanas de evolución. Acudió en varias ocasiones a PU y a traumatología pautando analgesia ante la radiología lumbosacra normal. A las 4 semanas inició fiebre y malestar por lo que se ingresó para estudio. La analítica presenta leucocitosis con neutrofilia. Se realizó RM que evidenció afectación inflamatoria de la articulación sacroiliaca izquierda con colección organizada de 25×15 mm de tamaño (Figura 1 y 2) aislándose en el hemocultivo a las 24 horas un Staphylococcus aureus. Se inicia tratamiento con Levofloxacino y reposo evidenciando en los controles analíticos descenso de los reactantes de fase aguda y mejoría de capacidad funcional. Caso clínico: Paciente masculino de 15 años remitido desde consultas externas de neurocirugía porque desde hace 2 semanas presenta dolor en extremidades inferiores que 10 días después asoció sensación de parestesias y acorchamiento. Se realizó RM de rodilla y lumbar que no evidenció hallazgos patológicos. Ante la progresión de parestesias y adormecimiento llegando a tener parestesias hasta cintura consultó de nuevo. No antecedentes familiares ni personales de interés. Se completó estudio con RM de columna que identifica una masa de 55 x 53 x 61 mm que parece tener origen T10 que ejerce severo efecto masa con desplazamiento y compresión del saco tecal y del cordón medular (Figura 3-5). Ante las características de la lesión ósea se plantea como primera posibilidad origen tumoral por lo que se programa biopsia ósea que confirma diagnóstico de osteoblastoma. Conclusiones: Aunque el dolor musculoesquelético, en la mayoría de las veces, es benigno, en ocasiones puede ser una manifestación de una enfermedad importante, por lo que para el diagnóstico diferencial debemos realizar una historia clínica completa y una exploración adecuada para evitar diagnósticos erróneos que puedan condicionar diagnósticos tardíos que empeoren el pronóstico.
DISFAGIA PSICÓGENA SECUNDARIA A UN ATRAGANTAMIENTO EN VARÓN ADOLESCENTE
Velasco Molina VM, Redondo Grande C, Tejada Pérez M, Sánchez-Rico Lucas-Torres B, Pérez Pascual M. Hospital Universitario La Paz. Madrid.
Introducción: En la disfagia psicógena los síntomas de dificultad para deglutir no tienen una base orgánica evidente, sino que están relacionados con factores psicológicos o emocionales. Tiene gran importancia clínica por su afectación en la calidad de vida. Objetivo: A través de un caso clínico repasar el abordaje de la disfagia en el adolescente. Pacientes y método. Caso clínico: Varón de 12 años, acude por rechazo de la ingesta de sólidos desde hace 3 semanas. Inicio tras episodio de atragantamiento que precisó maniobra de Heimlich. Describe sensación de escozor y aprensión con la deglución. Pérdida de 1 kg desde entonces. Antecedente de abuso sexual. Derivado a digestivo, descartan patología orgánica. Se inicia acompañamiento desde atención primaria, instaurando dieta túrmix y batidos poliméricos consiguiendo estabilidad antropométrica y coordinación con profesionales de salud mental. Discusión y conclusiones: La disfagia psicógena influye en la capacidad para alimentarse de manera adecuada, provocando pérdida de peso, desnutrición y riesgo de aspiración. Puede estar relacionada con ansiedad, depresión u otros trastornos emocionales. El pediatra de Atención Primaria desempeña un papel central en su diagnóstico y manejo al brindar una atención integral, facilitar la coordinación entre especialistas y ofrecer apoyo continuo a las familias, contribuyendo a un enfoque más efectivo y humano.
ACOSO ENTRE IGUALES: ¿SABEMOS CÓMO ACTUAR?
Pérez Pascual M(1), Pereira Velázquez A(2). (1)Hospital Universitario La Paz. Madrid. (2)Hospital Alfredo Perrupato. Argentina.
Introducción: El acoso entre iguales unido a las nuevas tecnologías ha hecho que las víctimas sufran 24 horas al día todos los días de la semana. Saber detectar el cyberbulling y cómo actuar tiene que estar claro para el profesional que trata con adolescentes. Objetivo: A través de un caso clínico repasar el abordaje del acoso entre iguales. Caso clínico: Adolescente de 14 años en seguimiento por TDAH, estabilidad clínica, presenta desde hace un mes irritabilidad, contestaciones, aumento de inatención, lo achaca al TDAH. Durante la entrevista, refiere que empezó a salir con una chica de su clase hace dos meses, que le propuso hacer sexting y aceptó. Después quiso dejar la relación, pero la chica le amenazó con mandar las fotos. Se las mandó a toda la clase a través de redes sociales, además le están dejando sólo en clase por este motivo. Por eso está siempre con el móvil y no duerme. No presenta ideación autolítica. De acuerdo con el paciente se decide notificarlo según el protocolo. Discusión y conclusiones: Ante un evento de ciberacoso es importante tener conocimiento acerca de las medidas de urgencia que se deben llevar a cabo para preservar la seguridad del menor y que cese el acoso.
ABUSO SEXUAL EN LA ADOLESCENCIA: UN DESAFÍO MULTIDISCIPLINAR
Pérez Pascual M(1), Pereira Velázquez A(2). (1)Hospital Universitario La Paz. Madrid. (2)Hospital Alfredo Perrupato. Argentina.
Introducción: Proteger a la adolescencia de la violencia sexual, es una asignatura pendiente como profesionales garantes de los derechos de los menores. Objetivos: A través de un caso clínico repasar la atención del abuso sexual en la adolescencia. Caso clínico: Paciente de 15 años acude a Urgencias acompañada de sus padres quien refiere que hace 6 semanas, un desconocido le agarra e intenta penetración vaginal, no lo consigue porque llega otra persona y se va.
La paciente se iba de vacaciones y no dijo nada para no preocupar a sus padres. Con el inicio del instituto se comenzó a agobiar, se lo dijo a la orientadora del centro y ésta avisó a la familia. Pusieron denuncia y les derivaron a urgencias para valoración. Se realiza examen físico general incluyendo valoración ginecológica sin alteraciones, himen íntegro. Se realiza analítica de sangre con serologías y muestra para ITS en orina. Se confecciona parte de lesiones, hoja de notificación y derivación a trabajo social y como es mayor de 12 años se deriva a la consulta de adolescencia de nuestro hospital. Discusión y conclusiones: Como profesionales de la salud debemos detectar y actuar ante abusos sexuales en adolescentes con contundencia sin revictimizar, para ello son necesarios protocolos en los distintos niveles asistenciales.
RUNAWAY. LOS NIÑOS QUE HUYEN DE CASA
Lucendo Noriega MC(1), Bonet De Luna C (2), Pérez Pascual M(2), Sanco Martínez A(2). (1)Hospital Universitario Miguel Servet, (2)Hospital Universitario La Paz. Madrid.
Introducción: En España, la mayor parte de las desapariciones de menores denunciadas tuvieron como causa la fuga del hogar de estos. Este asunto resulta de gran relevancia social y médica, ya que estos menores tienen unas necesidades sanitarias específicas que deben conocerse. Objetivo: Revisión bibliográfica del impacto y del manejo de los casos de menores que huyen de casa. Conclusiones: Estos episodios, incluso de corta duración, tienen consecuencias nefastas y cruciales para su desarrollo y con implicaciones para el resto de su vida. Por ello, es fundamental detectar aquellos menores en riesgo y desarrollar un manejo multidisciplinar e individualizado para cada uno de ellos. Resumen: Runaway se considera a cualquier menor que se vaya de casa sin permiso y pase al menos una noche fuera si es menor de 15 años o dos si es mayor de esa edad. El perfil de Runaway es aquel menor entre 15 y 17 años, de sexo femenino y cuyo principal motivo fue un ambiente familiar negativo. Se han detectado diversos factores, el abuso de sustancias o la inestabilidad domiciliaria que pueden ayudar a detectar aquellos menores en riesgo de huir del hogar de manera que se pueda elaborar un plan de ayuda y soporte para estos pacientes.
SÍNDROME DE KLEINE-LEVIN. A PROPÓSITO DE UN CASO EN UNA ADOLESCENTE
Pérez Pascual M(1), Gonzalo A(2) , Redondo Grande C(1).(1,3)Hospital Universitario La Paz. Madrid, (2)Hospital Universitario de Burgos.
Introducción: El síndrome Kleine-Levin es infrecuente, debemos conocerlo para poder pensar en él ante un caso de somnolencia y despersonalización en la adolescencia. El abordaje bio psico social nos dará la clave para el mejor enfoque del paciente y evitar escalada de pruebas innecesarias. Objetivo: A través del caso de una paciente de 14 años de nuestra consulta, revisaremos las características del síndrome de Kleine-Levin, haciendo diagnóstico diferencial con otras patologías. Caso clínico: Paciente de 14 años, previamente sana, consulta por 3 episodios de 5 días de duración en los últimos 2 meses consistentes en somnolencia excesiva y amnesia del episodio. La paciente reconoce el inicio de los síntomas al encontrarse bradipsíquica. Los padres refieren que durante los episodios se encuentra la mayor parte del tiempo dormida, pero es capaz de levantarse a realizar actividades de la vida diaria. Estos lo relacionan con periodos de deprivación de sueño. Se realiza una anamnesis detallada en la que no se objetiva problemática psicosocial ni impresiona de psicopatología con una exploración física dentro de la normalidad. Se realiza diagnóstico diferencial. Resultados: Se realiza diagnóstico diferencial con etiología autoinmune como encefalitis por autoanticuerpos anti NMDA, crisis epilépticas del lóbulo temporal, enfermedades metabólicas o mitocondriales que, podrían presentarse a cualquier edad con síntomas neurológicos. Trastorno de ansiedad, siendo muy frecuente dentro de la población adolescente, o patología psicosomática. Descartados estos procesos, la paciente cumple criterios clínicos de síndrome de Kleine-Levin. Se realiza seguimiento de la paciente en nuestra consulta encontrando asociación entre ciclos menstruales y estos episodios, tras 5 meses de seguimiento desaparecen los episodios, realizando la paciente vida normal. Para completar el estudio se deriva a consultas de neurología. Discusión y Conclusiones: El síndrome de Kleine-Levin consiste en episodios recurrentes y autolimitados de hipersomnia y alteración cognitiva y conductual. La periodicidad y duración de los episodios es variable. Entre los episodios presentan un patrón de sueño y cognitivo normal. Suele existir un factor desencadenante. Durante el episodio agudo duermen unas 15-20 horas, pueden mostrarse agresivos si se les impide el descanso, el tiempo que permanecen en vigilia muestran alteraciones cognitivas y de la percepción en todos los casos, estar como en un sueño, desrealización de los sentidos, se muestran apáticos, confusos, irascibles, gran labilidad emocional, ansiedad de separación. Pueden presentar otros síntomas como cefalea, foto o sonofobia y alucinaciones. Tras el episodio, vuelven a la normalidad y están asintomáticos. Los primeros días pueden sufrir insomnio y amnesia parcial. Suelen mostrar preocupación por lo que le ha ocurrido. Pueden reconocer el inicio del episodio si ya han presentado otros, referir que se sienten raros y la familia observar que están menos habladores, con cierto enlentecimiento cognitivo y cansados. Por tanto, podemos concluir que, el abordaje bio psico social nos dará la clave para el mejor enfoque del paciente y evitar escalada de pruebas innecesarias. Al ser un síndrome poco frecuente, conviene repasarlo para tenerlo en cuenta ante episodios de somnolencia y amnesia en el paciente adolescente.
EMBARAZO ADOLESCENTE. A PROPÓSITO DE DOS CASOS
Pérez Pascual M, Tejada Pérez M, Sánchez-Rico Lucas-Torres B, Redondo Grande C, Velasco Molina VM. Hospital Universitario La Paz. Madrid.
Introducción: El embarazo afecta a 17 millones de adolescentes al año, siendo la segunda causa de mortalidad entre los 15 y 19 años en regiones pobres. Durante la adolescencia se adquiere la capacidad reproductiva y se completan los patrones psicológicos del adulto, consolidando la independencia. La maternidad en este periodo altera el desarrollo personal y social, con acentuación de conflictos no resueltos y de la emotividad. Objetivos: El objetivo del trabajo es analizar la repercusión y el manejo del embarazo en la adolescencia mediante dos casos clínicos. Material y métodos: Se revisan las historias clínicas de dos pacientes de la unidad del adolescente recogiendo datos del embarazo y del contexto social. Resultados y conclusiones: Las pacientes son dos jóvenes de 17 y 14 años, derivadas a consultas del adolescente tras ser diagnosticadas de embarazo no deseado, a las 18 y 23 semanas de gestación respectivamente, ambas con su contexto cultural y personal específico. Es esencial un enfoque biopsicosocial y un equipo multidisciplinar. Los objetivos del médico son ayudar a aceptar el embarazo, fortalecer los vínculos familiares y valorar suplementos nutricionales, especialmente en chicas en la primera adolescencia, que continúan su crecimiento y desarrollo. Es importante la prevención de embarazos no deseados principalmente mediante la educación.
ASMA DE DIFÍCIL CONTROL DURANTE LA ADOLESCENCIA. TRATAMIENTO CON DUPILUMAB. CASO CLÍNICO
Zafra Anta MA, Fruhbeck Muñoz M, Montañés Martín M, González Mancebo E, Gandolfo Cano MM. Hospital U Fuenlabrada. Madrid.
Introducción: El asma es una de las enfermedades crónicas más frecuentes en la edad pediátrica, afecta hasta un 10-15 % de los adolescentes y adultos jóvenes. Es heterogéneo y cambiante con el tiempo. Se recomienda buscar el control según el tratamiento escalonado que proponen las guías: GEMA, consenso REGAP, etc. A pesar de los corticoides inhalados, algunos pacientes permanecen sintomáticos, con elevada morbilidad, limitación de su actividad habitual, necesidad de urgencias-hospitalizaciones y alteración importante de su calidad de vida. Objetivo: Describir la evolución clínica y manejo terapéutico en un paciente con asma de difícil control durante la adolescencia-adulto joven. Caso clínico: Varón de 19 años, diagnóstico de asma y dermatitis atópica desde los 2 años. Seguimiento en Neumopediatría y Alergología desde los 6 años, tratado inicialmente con budesónida-montelukast.
El asma tuvo empeoramiento hacia los 13, 15 y 18 años. Ingresos a los 14 y 17 años. Ver figura. Crisis en otoño-invierno. Mantenía síntomas casi diarios, también nocturnos y con el ejercicio. Se subió el tratamiento a gravedad escalón 5 de la GEMA. Se evalúan los factores psico-sociales y ambientales. Se realiza educación sanitaria en asma. A los 18-19 años: ACT: 19-20 (asma no controlada). TAI: 46. Eosinofilia >500. FeNO 40-50. IgE 2000 KU/L. Espirometría y oscilometría con patrón obstructivo, test broncodilatador positivo. Radiografía normal. Se diagnostica Asma de Difícil Control (ADC). Fenotipo asma T2 eosinofílica. Se presenta en Comité de ADC (enero, 2022): se decide biológico (Dupilumab; monoclonal frente a subunidad alfa de IL-4 y frente a IL-13) por asma y dermatitis atópica graves mal controladas. Muy buena respuesta y control actual, tanto del asma como de la dermatitis atópica. Mejoría incluso de impulsividad del TDAH. Buena tolerancia a la medicación. Iniciada actividad laboral. Con adaptación. Comorbilidades: ver figura. Comentarios: El asma en la adolescencia requiere en ocasiones una intervención multidisciplinar y tratamiento de escalón elevado según las guías. El asma grave tiene gran morbilidad y afecta a la calidad de vida y adaptación a actividades habituales del adolescente-adulto joven. La Unidad de ADC y la consulta monográfica facilitan el manejo y las intervenciones farmacológicas o conductuales de forma individualizada.
DISTINTAS FORMAS DE PRESENTACIÓN DE LA ENFERMEDAD INFLAMATORIA INTESTINAL EN LA ADOLESCENCIA
Fornes RM, Pico Sirvent L, Tronchoni Belda M, Giner Sopena G, Torres Palomares D. Hospital La Salud. Valencia.
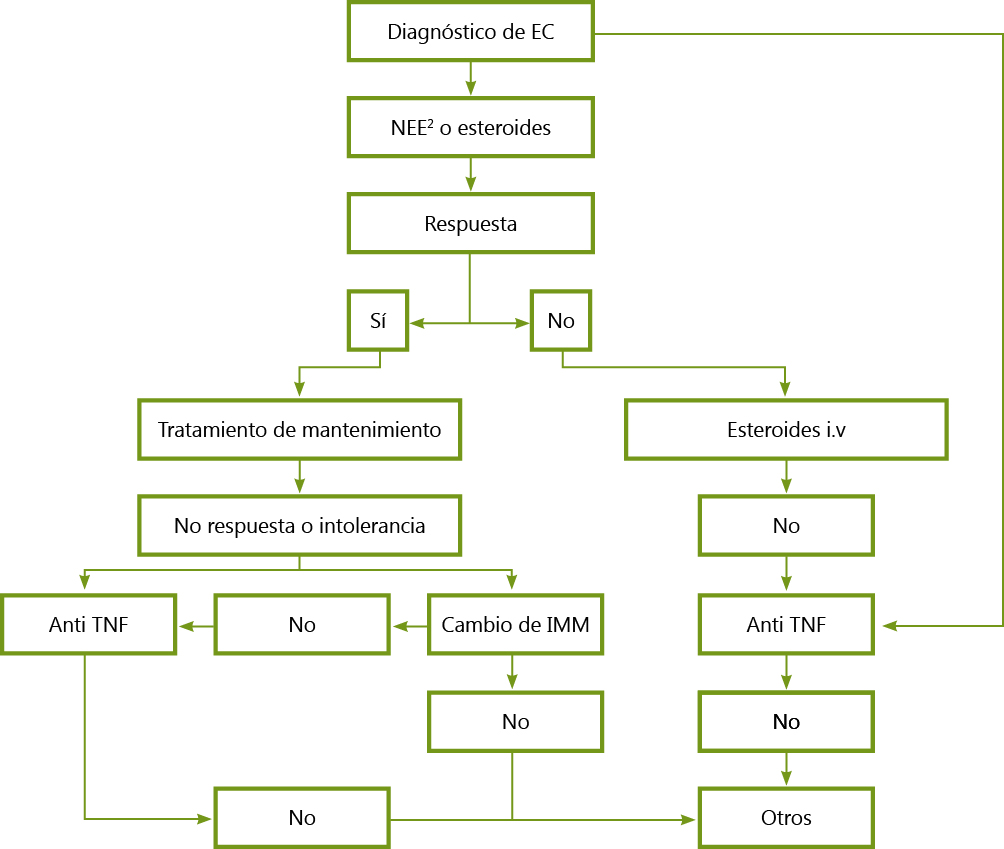
Introducción: La enfermedad inflamatoria intestinal (EII) se caracteriza por inflamación crónica en diferentes localizaciones del tubo digestivo. Etiología multifactorial. Incluye: colitis ulcerosa (CU) localizada en colon y enfermedad de Crohn (EC) que puede afectar cualquier tramo digestivo. La forma de presentación clásica incluye dolor abdominal (DA), rectorragia, diarrea, tenesmo y urgencia defecatoria, sobre todo en adultos. Diagnóstico mediante anamnesis, exploración, análisis sangre y heces y confirmación por endoscopia/histología. Mayor incidencia entre la 2ª- 4ª década de la vida, pero un 30 % se diagnostica en menores de los 18 años, aumentando su incidencia en los últimos años, siendo el pico de mayor presentación entre los 11 y 13 años. Objetivo: La EII-Pediátrica (EII-P) es poco frecuente en pediatría, pero se debe tener presente por la importancia del diagnóstico y tratamiento precoz. Nuestro objetivo es averiguar si la forma de presentación y características son diferentes al adulto. Para ello presentamos 4 casos clínicos diagnosticados en nuestro hospital. Casos clínicos/pacientes/resumen 1º Caso Clínico: varón de 13,5 años consulta por DA de 5 días evolución con deposiciones diarreicas últimas 48h. Inicia rectorragia hace 24h. Hace 3 meses episodio similar que cedió espontáneamente. Exploración: habito asténico, palidez, abdomen doloroso, sin defensa, blumberg negativo. A. sangre: parámetros normales tanto hemograma, bioquímica, reactantes y coagulación. Persiste rectorragia realizando Ecografía: engrosamiento difuso e hiperemia de pared de todo el marco cólico, sugestivo pancolitis programándose Colonoscopia confirmando CU. 2º Caso Clínico: varón de 13,5 años, remitido por pediatra por desnutrición (IMC 11,5 %) con pérdida de peso (5 Kg) en 6 meses refiriendo desde entonces inapetencia y DA intermitente con deposiciones blandas, voluminosas 2-3 veces/día y A. sangre con parámetros dentro normalidad, salvo ferropenia. Persiste clínica intermitente de DA, diarrea y algún vómito con pérdida de peso progresiva en los 3 meses siguientes. Exploración REG, delgadez extrema, abdomen doloroso flanco derecho sin defensa. A. sangre completa con parámetros normales salvo leve aumento PCR y sangre oculta en heces con calprotectina elevada. Ecografía: engrosamiento pared colon ascendente e íleon terminal con TAC sugestivo de EC confirmada mediante Colonoscopia. 3º Caso Clínico: mujer de 12 años que consulta por DA moderado de 2 días evolución asociando vómitos. Ingreso hace 2 meses por mismo cuadro con P. imagen no concluyentes, controlada en consultas con mejoría, aunque pérdida de peso. Exploración: REG, dolor abdominal en ambos flancos. A. sangre completa con aumento de reactantes (PCR, PCT) y calprotectina en límite superior. Ecografía y TAC no concluyente, solicitando colonoscopia compatible con EC. 4º Caso Clínico: varón de 13 años que consulta por dolor intenso perianal asociando pico febril de 39ºC. Hábito estreñido y fisura anal reciente. Se constata absceso perianal y se ingresa. A. sangre: discreta elevación reactantes (PCR, PCT), cultivos, Ecografía: evidencia colección de 4 mm y RNM pélvica. Persiste clínica a pesar de antibiótico IV, aumentando reactantes en controles y supuración de absceso por ano. Se procede a limpieza quirúrgica con drenaje y alta. Controlado en C. externa con persistencia de lesión inflamatoria se solicita colonoscopia que confirma EC. Conclusiones: A diferencia de los adultos, cuya presentación es similar, en los niños la presentación más frecuente es la EC con mayor incidencia en varones a diferencia de adultos que no tienen diferenciación por sexos. No hay pruebas diagnósticas específicas, pues las alteraciones hematológicas dependen de la actividad inflamatoria. Es fundamental la búsqueda activa de esta enfermedad en adolescentes con episodios más o menos repetidos de diarrea, dolor abdominal, pérdida de peso inexplicable, astenia y/o retraso en la maduración sexual. El niño y el adolescente se encuentran en fases comprometidas del crecimiento, de ahí la importancia de un diagnóstico y tratamiento temprano.
PSORIASIS GUTTATA ASOCIADA A INFECCIÓN FARINGO-AMIGDALAR POR ESTREPTOCOCO BETA-HEMOLÍTICO DEL GRUPO A
Giner Sopena G, Fornés Vivas R, Picó Sirvent L, Torres Palomares D, Tronchoni Belda M. Hospital La Salud. Valencia.
Objetivos: Ampliar los conocimientos sobre las complicaciones cutáneas de las infecciones por EBHA y para ello presentamos un caso clínico. Caso / resumen: Varón de 12 años que acude a la Consulta por brote de lesiones cutáneas, escasamente pruriginosas de 5 días de evolución. Refiere fiebre de 48 horas, motivo por el que acude a Urgencias días previos, solicitándose test rápido para detección de Ag de EBHA, que resulta positivo. Se pauta tratamiento con amoxicilina 500 mg cada 12 hrs. Presenta exantema papular y placas eritemato-descamativas de predominio en cuello y tronco. No asocia afectación de cuero cabelludo, retroauricular ni palmo-plantar. No asocia afectación articular. Refieren antecedentes familiares de Psoriasis. Con la sospecha diagnóstica de PSORIASIS GUTTATA se deriva a Dermatología que confirma el diagnóstico y pauta corticoides tópicos, con mejoría progresiva hasta la resolución espontánea. Conclusiones: La psoriasis es una enfermedad cutánea inflamatoria crónica, sistémica y recidivante, que se caracteriza por pápulas y placas eritemato-escamosas, de características clínicas variables. Al retirarlas por rascado se observa una superficie húmeda con un piqueteado hemorrágico característico conocido como signo del rocío hemorrágico de Auspitz. La distribución de las lesiones suele ser simétrica y afecta a las superficies de extensión de los codos, rodillas y tronco. En la edad pediátrica, son más frecuentes las formas de presentación atípicas, como la psoriasis guttata. Se manifiesta como exantema de aparición brusca, con erupción de pequeñas pápulas eritemato-descamativas, de color asalmonado, de 2-15 mm, de distribución generalizada, afectando al tronco y la raíz de extremidades; puede afectar la cara y el cuero cabelludo, pero respeta palmas y plantas. Asocia prurito e hiperpigmentación post inflamatoria. A menudo es precedida por una infección por EBHA. El brote de psoriasis puede persistir durante tres a cuatro meses y tiende a la resolución espontánea, considerándose un cuadro autolimitado. El tratamiento de primera línea consiste en Fototerapia rayos UV y/o Corticoides tópicos más vitamina D tópica. La localización de la infección estreptocócica más frecuente es la faringoamigdalar, aunque en raras ocasiones puede ser de origen cutáneo perianal. El brote en piel suele ocurrir 2-3 semanas después de la infección en un 56-97 % de los pacientes. En la psoriasis guttata no existe predilección por sexos y en un 30-40 % de los casos hay un antecedente familiar de psoriasis. No es una enfermedad genéticamente homogénea y existe evidencia de que los diferentes subfenotipos de la enfermedad pueden estar asociados a distintas variaciones genéticas. La patogénesis de la psoriasis guttata no está bien definida; sin embargo, se ha propuesto una hipótesis multifactorial en pacientes que tienen una predisposición genética y que implica una incorrecta respuesta inmunológica.
El factor desencadenante más importante y conocido es el infeccioso (faringoamigdalitis estreptocócica) junto a una predisposición genética HLA (en concreto el alelo HLA Cw*0602), presente en el 30 % de psoriásicos frente al 10-15 % de la población general. La variación genética HLA-Cw*0602 presenta por sí mismo un alto riesgo para la psoriasis. En el transcurso de una faringoamigdalitis se produciría una presentación de antígenos estreptocócicos o superantígenos mediada por HLA-Cw6 a los linfocitos T de las amígdalas, que proliferarían y adquirirían capacidad de direccionamiento cutáneo, reconociendo autoantígenos epidérmicos, dando lugar a lesiones de psoriasis. La psoriasis no es frecuente en los niños, pero la presentación guttata es típica de esta edad y ante su sospecha hay que sospechar una infección por EBHA generalmente faringo-amigdalar y con menor frecuencia anal.
TRASTORNO DE CONDUCTA ALIMENTARIA: MÁS ALLÁ DEL DOLOR FUNCIONAL EN EL ADOLESCENTE
Rodríguez Fernández MT, Goerlich Buch M, López Sánchez B, Remedios Mateo L, Corredor Andrés B. Hospital Universitario de Toledo.
Introducción: La anorexia nerviosa (AN) se caracteriza por un comportamiento alimentario anormal que provoca pérdida de peso y desnutrición, siendo habitual que los pacientes nieguen dichos comportamientos y justifiquen su baja ingesta por otros motivos, como el dolor abdominal. Caso clínico: Adolescente de 12 años en estudio por dolor abdominal de 6 meses de evolución refiriendo que le impide la ingesta. Presenta pérdida de peso progresiva, con percentiles dentro de la normalidad, sin otros síntomas salvo amenorrea. En Atención Primaria se realiza estudio de dolor abdominal crónico con analítica normal, coprocultivo y ecografía abdominal normal. Posteriormente acude a urgencias por persistencia de epigastralgia, donde llama la atención restricción alimentaria y aumento de actividad física. Se deriva a consulta de Gastroenterología por sospecha de trastorno de conducta alimentaria precisando ingreso por pérdida ponderal progresiva, distorsión de la imagen corporal y miedo intenso a engordar. Discusión: La AN es una entidad de elevado riesgo orgánico, sin embargo, en los pacientes que no cumplen todos los criterios se puede ignorar dicho riesgo y pueden ser infradiagnosticados. Es importante realizar una adecuada anamnesis y tener presentes los datos sugestivos de AN, especialmente en adolescentes que justifiquen su baja ingesta alimentaria por otros síntomas.
ASIMETRíA TORÁCICA DOLOROSA EN ADOLESCENTE ¿CUáL ES SU DIAGNóSTICO?
Carvajal Roca E(1), Güemes Heras I(1), Alcayde Blat T(1) Nieto García A(1), Moreno Ballestero V(2). (1)Servicio de Pediatría. Hospital La Salud. Unidad del Adolescente. Clínicas Universitarias de la UCV. Valencia. (2)Servicio de radiología. Hospital La Salud. Valencia.
Introducción: Las malformaciones de la pared torácica constituyen un grupo variado de defectos que afectan a la caja torácica (costillas, esternón y columna dorsal). Normalmente, estas deformidades están presentes al nacimiento, pero en ocasiones, se muestran por primera vez o se exacerban en la adolescencia. Éstas además de condicionar una anomalía estética y compromiso de las estructuras torácicas pueden condicionar dolor que genera una gran ansiedad y preocupación, tanto en el niño como en los padres, ya que piensan que es sinónimo de patología grave. Objetivos: Revisar las causas de asimetría torácica de inicio reciente en adolescente. Paciente y método: Escolar de 10 años de edad que ingresa por presentar desde hace 2 días febrícula, aumento de tamaño de hemitórax derecho y dolor en las costillas inferiores. No refiere antecedente traumático ni infeccioso actual, aunque desde hace 20 días presenta tos continua en contexto de gripe A. La exploración es normal salvo la presencia de dolor a la palpación de las últimas costillas en lado derecho anterior afectando sobre las costillas 4 y 5. Aumento de partes blandas (zona del pectoral mayor sin aumento de tamaño del tejido mamario) sin signos inflamatorios ni crepitación. (Figura 1). Al ingreso se completa estudio solicitando; hemograma y bioquímica, RX de tórax y eco de partes blandas que fue normal. Ante la persistencia del dolor se solicita RM de parrilla costal que confirma el diagnóstico (Figura 2). Conclusiones y resultado: El dolor torácico es un motivo de consulta infrecuente en los servicios de urgencias pediátricos, pero genera gran ansiedad y preocupación pues es, con frecuencia, percibido como una patología cardíaca potencialmente letal, aunque casi siempre se trata de un proceso benigno. Las principales causas de dolor torácico son: Idiopática: la más frecuente (35 %); Origen musculoesquelético o condrocostal (30 %); Psicógena (14 %), como ansiedad, depresión o desórdenes de conversión; Causa respiratoria (12 %), la más frecuente de este grupo es el asma inducida por el esfuerzo, otras pueden ser neumotórax, pleuritis, tos, neumonía; Alteraciones gastrointestinales (4-7 %); Origen cardiaco (1-4 %) El síndrome de Tietze, también llamado costocondritis, fue introducido por Alexander Tietze en 1921 y se caracteriza por un engrosamiento doloroso de carácter inflamatorio no supurado, de uno o más cartílagos costoesternales. Aparece en todas las edades, pero tiene predilección por la segunda y tercera década de la vida, con afinidad por el sexo femenino. No tiene etiopatogenia clara, pero se pueden identificar posibles desencadenantes como traumatismos en la pared torácica anterior, tos crónica, exceso de uso de la extremidad superior, estereotomía en pacientes sometidos a cirugías cardiacas o inflamaciones inespecíficas de las articulaciones costoesternales. Clínicamente se caracteriza por: síntomas dolorosos con expresión variable, evolución prolongados, cursos progresivos, nunca de aparición brusca o aguda, el dolor precede a la aparición del abultamiento, esta sintomatología se exacerba con el ejercicio y la actividad. A la exploración física se evidencia tumefacción en la zona, dolorosa a la palpación, de aspecto denso y sin fluctuaciones. Las pruebas de imagen de elección para el diagnóstico es la resonancia magnética que es excelente para evidenciar anomalías cartilaginosas, articulares y óseas. El tratamiento es reposo y AINES en algunos casos es necesario tratamiento corticoideo.
¿TENER UN MECHÓN BLANCO AL NACIMIENTO TE PROTEGE DE SUFRIR UN VITÍLIGO?
Liquete Arauzo L(1), Pérez Ruiz E(2) , Hernández Molledo Z(3), Latre Peralta M(4), Chávez Gil VE(5). (1)Pediatra CS Villamuriel de Cerrato, Palencia. (2)Psiquiatra. Hospital de Segovia. (3)Enfermera pediátrica CS Villamuriel de Cerrato, Palencia. (4)Matrona CS de Villamuriel de Cerrato, Palencia. (5)Médico de familia. Área de Palencia.
Introducción: Tener un mechón blanco al nacimiento -poliosis- acompañado de una mancha hipocrómica es diagnóstico de piebaldismo. El piebaldismo constituye una enfermedad hereditaria de diagnóstico clínico que se caracteriza por la no progresión – a diferencia del vitíligo. Describimos el caso de una adolescente con piebaldismo y lesiones peribucales hipocrómicas que supusieron un verdadero reto diagnóstico. Caso clínico: Adolescente de 12 años que consulta telefónicamente en pandemia por mancha hipocrómica de reciente aparición en comisura bucal izquierda. Refieren gran afectación de su imagen corporal hoy debido a la aparición de esta lesión. En interconsulta a Dermatología que excluye el diagnóstico de vitíligo por padecer piebaldismo. 12 meses después consulta por un cuadro ansioso-depresivo con ideas autolíticas. Se constata además que las lesion hipocrómica es mucho más extensa, la poliosis es en región occipital y no hay familiares cercanos afectados. En pruebas diagnósticas hay presencia de autoanticuerpos tiroideos. Discusión: el piebaldismo es un diagnóstico que no libra al paciente de sufrir un trastorno autoinmune a lo largo de su vida. Muchos trastornos autoinmunes debutan con lesiones hipopigmentarias evolutivas.
El diagnóstico telefónico de las lesiones no excluye la obligación de agotar las opciones diagnósticas máxime si se trata de una adolescente en la que se está produciendo un daño en su autoimagen.
CON 12 AÑOS TUVE MI PRIMER MÓVIL, CON 14 AÑOS NO LO TENGO NI LO QUIERO…
Liquete Arauzo L(1), Pérez Ruiz E(2), Hernández Molledo Z(3), Chávez Gil VE(4), Pérez Garrido JB(5). (1)Pediatra CS Villamuriel de Cerrato, Palencia. (2)Psiquiatra. Hospital de Segovia. (3)Enfermera pediátrica CS Villamuriel de Cerrato, Palencia. (4)Médico de familia. Área de Palencia. (5)Enfermero CS Pintor Oliva (Palencia).
Introducción: Pese a la evidencia de que un mal uso de las Tics tiene repercusiones en el neurodesarrollo y la salud futura de los adolescentes, la digitalización de la educación es una realidad. Con la escuela digital, limitar las horas de uso de Tics representa un reto añadido para las familias. Actualmente, en España, existe un movimiento impulsado por las familias que solicitan la regulación estatal del uso de dispositivos en aulas. Objetivo: Conocer variables relacionadas con el uso de Tics. Muestra de adolescentes PAP semiurbana. Material: Estudio descriptivo observacional. Encuesta, muestra aleatoria de adolescentes (12-14 años) N=25. Resultados: 80 % varones. Edad media: 13,8 años. Edad del primer móvil: 12,4 ±0,6. Horas de uso: 3,8±0,9 horas a diario y 5,8±1,2 el fin de semana. El 8 % de los sujetos declararon no tener móvil ni quererlo en el momento actual (edad media:13,9±0,2,100 % varones) pese a haberlo tenido previamente. Conclusiones: aunque los datos obtenidos en esta encuesta no son representativos de la totalidad de la población adolescente debido a su pequeño tamaño, hoy es incuestionable que a nivel familiar, docente y profesional hay un cambio de tendencia respecto a anteriores estimaciones en la misma población (en los 2 años anteriores no se reflejó este comportamiento). Limitaciones: se necesitan más estudios para conocer si esta variable, en la percepción sobre el uso de nuevas tecnologías en adolescentes se trata de un hallazgo casual o de una tendencia.
ULISES, TELÉMACO, PENÉLOPE, CIRCE Y TELÉGONO; UNA FAMILIA DISFUNCIONAL. INFLUENCIA DE LA MIGRACIÓN EN EL ADOLESCENTE
Tomás Aguirre B. Grupo de Trabajo Pediatría Social SVP.
Introducción: El síndrome de Ulises está descrito como una situación prepatológica: supone un estrés muy importante en las personas migrantes que condiciona la aparición de patología psicológica y psicosomática. Hasta ahora se ha centrado en los adultos, pero ¿cómo afectan las migraciones a los adolescentes? Apoyémomos en estos perfiles: Penélope (queda en el lugar de origen con una vida más caótica y en soledad), Telémaco (el hijo que anhela al progenitor ausente y debe madurar antes de tiempo), Circe (la nueva pareja del lugar de llegada; mujer independiente que quizá también migró previamente y que también es abandonada) y Telégono (hijo de esta nueva pareja que también es abandonado). Objetivo: Valoramos 4 casos para ilustrar las consecuencias psicosociales que la migración está teniendo en los adolescentes. Material y métodos: Describimos 4 historias vividas en nuestra consulta de atención primaria (CAP) y en urgencias de pediatría (UPED). Penélope es una chica de 13 años que acude a UPED acompañada por su madre por ingesta de ibuprofeno con ideación autolítica. La ingesta se produce en la noche y, por la mañana, ante malestar abdominal intenso refiere el suceso a su madre quien avisa al 112 quien la trae a urgencias. Ingresa en UCI-P para administración de carbón activado y lavados gástricos repetidos. Una vez estabilizada se rehistoria. Llegada de Colombia apenas dos semanas antes, refiere una intensa sensación de soledad y desarraigo, sin encontrar sentido a su existencia por lo que realiza el intento autolítico. Circe es una chica de 13 años que seguimos en la CAP desde su llegada de Argentina hace 6 meses. Su madre, con antecedentes psiquiátricos y alcoholismo quedó allí. Vive con su padre y la pareja de este. Ambos trabajan muchas horas y los ve poco. Acude a la consulta sola en muchas ocasiones; en la última me refiere importante reacción en la zona genital tras el mantenimiento de conductas sexuales con las últimas parejas (ocasionales). Confirmamos alergia al látex. Telégono es una chica de 12 años que acude a nuestra consulta por la orientadora del instituto por absentismo y autolesiones (cutting). Nacida en España, de padre hondureño y madre venezolana. El sustento económico recae en la madre que pasa la mayor parte del día trabajando, y el padre, frustrado, es adicto al alcohol. Convive con su hermano mayor y dos hermanos muy pequeños a los que tiene que cuidar, sin familia extensa. Refiere importante sensación de soledad y falta de autoestima. Telémaco es su hermano de 16 años que también presenta absentismo escolar. En una visita en la que acompaña a su hermana, nos refiere “que tiene que ser el hombre de la casa” por lo que abandonará sus estudios para trabajar en breve. En alguna ocasión, al enfrentarse a su padre con el que mantiene una tensa relación, ha sufrido maltrato. Conclusiones: Los adolescentes implicados en procesos migratorios están expuestos a un importante estrés que puede llevar a situaciones de muy alto riesgo (conductas sexuales de riesgo, autolesiones, intentos de suicido, abandono de planes de futuro…) Desde las CAP y los servicios de urgencias debemos estar atentos a los signos de alarma e incidir en los condicionantes sociales que pueden afectar a estos jóvenes, considerando la migración en sí misma como un factor de riesgo psicosocial, para actuar lo antes posible. Los controles de salud son momentos de especial atención, debiendo incluir en ellos las cuestiones que afecten al entorno, arraigo, autoestima, autoconcepto y proyectos de futuro.