Síndrome de Ovario Poliquístico (SOP)
Síndrome de Ovario Poliquístico (SOP)
M T Muñoz Calvo.
Servicio de Endocrinología del Hospital Infantil Universitario Niño Jesús. Profesora Asociada del Departamento de Pediatría de la UAM. Miembro del Grupo del Programa de Obesidad Infantil y de la Adolescencia del CIBEROBN, Instituto de Salud Carlos III. Madrid. España.
Adolescere 2016; IV (2): 20-31
Resumen
|
El síndrome de ovario poliquístico (SOP) es un trastorno de presentación heterogénea y uno de los motivos frecuentes de consulta en adolescentes. La etiología es multifactorial y se implican factores genéticos y ambientales (intrauterinos y extrauterinos). Las manifestaciones clínicas son hirsutismo, irregularidades menstruales y acné. Además se acompaña de alteraciones metabólicas, tales como hiperinsulinemia, resistencia a la insulina, dislipemia y obesidad. Los objetivos del tratamiento son alcanzar la ovulación, normalizar los ciclos menstruales, disminuir y si es posible eliminar el hirsutismo y el acné, obtener una pérdida de peso aceptable, y tratar la dislipemia y la hiperglucemia para disminuir el riesgo de enfermedad cardiovascular.. Palabras clave: Hirsutismo; Hiperandrogenismo; Anovulación; Insulinoresistencia; Dislipemia |
Abstract
|
Polycystic ovary syndrome (PCOS) is a frequent presenting complaint for adolescents and it has a heterogeneous presentation. Its etiology is multifactorial involving genetic and environmental (intrauterine and extrauterine) factors. The clinical manifestations are hirsutism, menstrual irregularities and acne. Furthermore, it is accompanied by metabolic abnormalities such as hyperinsulinemia, insulin resistance, dyslipidemia and obesity. The aims of treatment are to achieve ovulation, normalize menstrual cycles, reduce and if possible eliminate hirsutism and acne, achieve an adequate weight loss and treat dyslipidemia and hyperglycemia to reduce the risk of cardiovascular disease. Key words: Hirsutism; Hyperandrogenism; Anovulation; Insulin resistance; Dyslipidemia |
Introducción
El SOP es la causa más frecuente de hiperandrogenismo (HA) en adolescentes, que determina la aparición de pubarquia prematura, hirsutismo, acné y trastornos menstruales. Además, se acompaña de alteraciones metabólicas: hiperinsulinemia, resistencia a la insulina, dislipemia y obesidad; sin embargo, estas alteraciones no están incluidas en los criterios diagnósticos del síndrome.
Los síntomas y signos clásicos de HA y anovulación en mujeres adultas, no están suficientemente claros en las adolescentes, ya que se solapan sus síntomas con la fisiológica androgenización durante la pubertad y la maduración completa del eje hipotálamo-hipófiso-gonadal.
La prevalencia es desconocida, aunque recientemente un estudio epidemiológico en adolescentes entre 16 y 19 años observa un 7% de HA y un 4,3 % de SOP.
Etiopatogenia
La etiología es multifactorial y se implican factores genéticos y ambientales intrauterinos (programación del desarrollo fetal) y extrauterinos (dieta, obesidad, vida sedentaria, toxinas y ciertos fármacos).
Actualmente, existe una base genética múltiple, las familias de mujeres con SOP tienen un mayor riesgo que el resto de la población de presentar el cuadro. Los estudios genéticos se han centrado en aquellos genes que intervienen en las vías metabólicas implicadas en la patogénesis del SOP. Se han descrito alteraciones genéticas que afectan a la célula β pancreática y al receptor de la insulina. Otros muchos genes han sido estudiados con resultados contradictorios. Es el caso del gen de la adiponectina, donde la mayoría de autores no han podido encontrar asociación entre la alteración del gen de la adiponectina y el SOP. Variaciones en el polimorfismo (CAG) del exón 1 del gen del receptor de andrógenos producen alteraciones en la transcripción del gen y secundariamente variaciones clínicas de la actividad de los andrógenos.
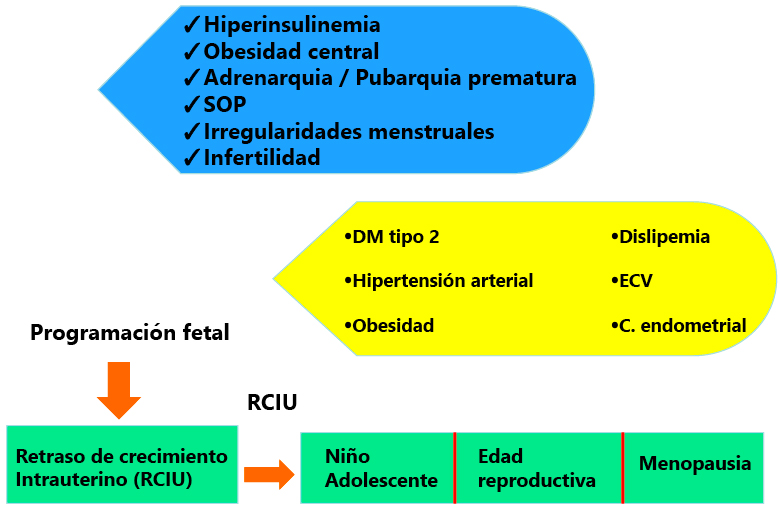
Estudios observacionales clínicos sugieren que el SOP pueda originarse es estadios muy tempranos del desarrollo, posiblemente en la vida intrauterina. El exceso de glucocorticoides [resultado de la hipoxia fetal y del retraso de crecimiento intrauterino (RCIU)] o la elevación de los andrógenos maternos durante el embarazo pueden promover cambios en la expresión génica que se relacionen con mayor riesgo de SOP (Figura 1).
En niños pequeños para la edad gestacional con un crecimiento de recuperación rápido, tienen riesgo de desarrollar resistencia a la insulina y obesidad
Los niños pequeños para la edad gestacional tienen un número de adipocitos reducido al nacimiento, y si realizan un crecimiento recuperador rápido, no son capaces de acomodar las grasas, produciéndose una hipertrofia de los escasos adipocitos disponibles, no existiendo un correcto reservorio para la grasa. Cuando los aportes calóricos superan la capacidad de almacenamiento, habrá riesgo de desarrollar resistencia a la insulina y secundariamente una respuesta compensatoria con hiperinsulinemia y obesidad central que pueden alterar la distribución de la grasa corporal, y acelerar el inicio de la adrenarquia y de la pubertad, con menarquia temprana, talla final por debajo de la talla diana, dislipemia, alteración del perfil de adipoquinas e HA subclínico en los primeros meses postmenarquia, que evolucionan a SOP clínico en un porcentaje significativo de casos en 2-3 años. En la infancia la forma más común de hiperandrogenismo funcional es la pubarquia prematura que puede ser autolimitada o progresar hacia un SOP (15-20%).
El HA esta asociado con un exceso de peso durante la pubertad. La obesidad junto a la hiperinsulinemia, la disminución de la SHBG (proteína transportadora de esteroides sexuales) y el incremento de los niveles de testosterona libre, van a producir un aumento de la producción de andrógenos en el tejido adiposo abdominal, lo que va a favorecer el HA. Asimismo, éste puede alterar la regulación de los pulsos de LH durante la maduración del eje hipotálamo-hipofiso-gonadal, condicionando un HA persistente.
Entre las entidades de riesgo para el desarrollo de SOP hay que señalar:
• la obesidad de inicio precoz asociada a resistencia a la insulina
• el bajo peso al nacer asociado a una recuperación postnatal rápida y exagerada de peso y al desarrollo de pubarquia precoz (aparición de vello pubiano antes de los ocho años), y/o pubertad adelantada e hiperinsulinismo
• la prolongación del periodo de anovulación fisiológica mas allá de dos años postmenarquia
• la hiperplasia suprarrenal congénita y otros trastornos virilizantes
Criterios Diagnósticos
En 1990, el Instituto Nacional de la Salud Americano,definió el SOP como un proceso de HA clínico o bioquímico con anovulación crónica, una vez excluidas otras causas. En el año 2003, las Sociedades Europea y Americana de Reproducción Humana (ESHRE/ASRM) en Rotterdam añadieron un tercer criterio: la presencia de ovarios poliquísticos en la ecografía, siendo necesario para el diagnóstico la presencia de dos de los tres criterios. En 2009 the Androgen Excess Society lo definió por la presencia de HA (clínico y/o bioquímico) como criterio principal y otro adicional que sería la disfunción ovulatoria (oligo-anovulación) o morfología de ovario poliquístico. En el año 2012 la ESHRE/ASRM consideró que la oligomenorrea o amenorrea debería estar presente al menos dos años después de la menarquia o amenorrea primaria a los 16 años, junto con hiperandrogenismo clínico y bioquímico, asimismo, los ovarios poliquísticos por ultrasonido incluyen un aumento del tamaño ovárico superior a 10 cc. En el año 2013, the Endocrine Society Clinical Practice Guidelines sugieren que el diagnóstico de SOP debe estar basado en la presencia de HA clínico y/o bioquímico y en la presencia de oligomenorrea persistente. Los síntomas anovulatorios y la morfología de los quistes ováricos son insuficientes para hacer el diagnóstico en las adolescentes (tabla 1), teniendo que ser cautos en el diagnóstico de SOP por las posibles implicaciones futuras. Por tanto, debe realizarse el seguimiento a largo plazo con síntomas sugerentes de SOP que inicialmente no reúnen los criterios diagnósticos del síndrome.
Oligo-anovulación o anovulación
Los ciclos menstruales irregulares y una tasa escasa de ovulación son frecuentes en la adolescencia. Al año de la menarquia, el 65% de las adolescentes tienen ciclos regulares (entre 21-45 días). A los 3 años el 90% de las adolescentes tienen un patrón de 10 o más ciclos por año. Por ello se ha sugerido esperar hasta dos años tras la menarquia para valorar la regularidad de los ciclos.
Los ciclos anovulatorios están presentes en el 85% de los ciclos menstruales durante el primer año tras la menarquia, el 59% durante el tercer año y el 25% durante el sexto año. Los síntomas anovulatorios pueden presentarse como amenorrea primaria o secundaria, oligomenorrea (< 6 ciclos por año) o hemorragia uterina disfuncional asociados a niveles elevados de andrógenos y LH. Asimismo, la oligomenorrea que persistía más de 2 años postmenarquia sería un buen predictor futuro de irregularidades menstruales.
Hiperandrogenismo
El HA en la infancia y la adolescencia determina alteraciones en los tejidos diana, condicionando la aparición de pubarquia prematura, hirsutismo, acné, trastornos menstruales o virilización.
No existen criterios clínicos diagnósticos del exceso de andrógenos en las adolescentes, por tanto utilizaremos el término hirsutismo, acné moderado o severo y/o irregularidades menstruales. El hirsutismo se define por la presencia de vello excesivo terminal en zonas andrógeno-dependientes en mujeres. Refleja la interacción entre los andrógenos circulantes, la concentración local y la sensibilidad del folículo piloso a los mismos. Por tanto la severidad del hirsutismo no se correlaciona con las concentraciones circulantes de andrógenos circulantes.
Ovarios poliquísticos
En mujeres adultas los criterios diagnósticos de SOP incluyen: 12 o más folículos de 2-9 mm en al menos un ovario o un ovario mayor de 10 cc por ecografía transvaginal. Existen dos picos de crecimiento del volumen ovárico: a los ocho años, coincidiendo con la adrenarquia y alrededor de los 12 años, coincidiendo con la pubertad. Entre los 6-11 años el volumen ovárico aumenta su volumen hasta 1,19-2,52 cc. Durante la pubertad, en respuesta al estímulo hormonal, el ovario se hace más ovoide y tiene un volumen entre 1,8-5,7cc con una media de 4cc desarrollando un aspecto multifolicular. La presencia de menos de seis folículos durante la infancia y en los primeros años postmenarquia se considera un hecho fisiológico.
En las adolescentes, es difícil el diagnóstico ecográfico de ovarios poliquísticos, debido a la dificultad de realizar ecografías transvaginales, ya que la ecografía abdominal es menos discriminatoria sobre todo en obesas. El valor de 8 cc es el más aceptado en la actualidad como valor normal del volumen ovárico en adolescentes. Aun así, el tamaño ovárico tiene escasa sensibilidad como criterio diagnóstico de SOP en adolescentes.
En las adolescentes es difícil el diagnóstico ecográfico de ovarios poliquísticos, ya que esta prueba es menos discriminatoria sobre todo en obesas
Debido a las limitaciones de la ecografía se han buscado otros marcadores como la hormona antimulleriana (AMH), una glicoproteína dimérica de la superfamilia de los factores de crecimiento tisular tipo β (TGF-β), que es un marcador de desarrollo folicular sintetizado por las células de la granulosa de los folículos ováricos. Los niveles plasmáticos de la AMH se correlacionan con el desarrollo de folículos preantrales y antrales, desde la pubertad hasta el final de la edad reproductiva. Se encuentra elevada en mujeres con SOP, y podría ser un dato de gran apoyo para el diagnóstico.
Diagnóstico
— Antecedentes familiares:
Una historia clínica detallada, debe incluir antecedentes familiares de SOP o irregularidades menstruales, infertilidad, acné, hirsutismo, alopecia o quistes ováricos. Además, investigar historia familiar de diabetes tipo 2, dislipemia, apnea del sueño, hígado graso, y aumento de ECV. Dentro de los antecedentes personales, el peso bajo al nacer y/o la pubarquia prematura podrían estar asociados con riesgo de SOP en determinadas poblaciones.
— Examen físico: antropometría (IMC, perímetro de cintura), distribución de la grasa corporal,
medición de la TA.
— Valoración del hirsutismo: se realiza con la escala de Ferriman-Gallwey modificada. Es un método visual y subjetivo, clasifica de 9 a11 áreas corporales (labio superior, barbilla, tórax, parte superior e inferior de la espalda, parte superior e inferior del abdomen, brazos y muslos) (Figura 2) graduando entre 0 y 4 según la intensidad del hirsutismo. Existe controversia en el punto de corte para definir el hirsutismo, pero una puntuación > 8 en mujeres de raza caucásica se considera diagnóstico. Asimismo, identificar signos de resistencia a la insulina, obesidad abdominal e hiperinsulinismo (acantosis nigricans).
La valoración del hirsutismo se realiza con la escala de Ferriman-Gallwey. Una puntuación >8 se considera diagnóstica
— Valoración del ciclo menstrual.
— Descartar otras causas de HA incluyendo la hiperplasia suprarrenal de presentación tardía (aceleración del ritmo de crecimiento y edad ósea y test de ACTH > 10 ng/dl), hipotiroidismo, hiperprolactinemia, síndrome de Cushing, tumores secretores de andrógenos u ováricos y ciertos fármacos (ácido valproico, esteroides anabólicos, entre otros).
— Determinaciones hormonales (en fase folicular del ciclo menstrual o en amenorrea) deben valorarse junto con la clínica, teniendo en cuenta la edad de la paciente, momento de la recogida de la muestra y ensayo a utilizar. Se estudiaran:
• Niveles de testosterona total y libre. La Endocrine Society en 2007, recomienda utilizar los niveles de testosterona total, pero debido a la variabilidad diaria y según el ciclo menstrual, recomiendan medirla entre las 8 y las 10 de la mañana y durante la fase folicular.
• DHEA-S, androstendiona, 17 OH progesterona, SHBG.
• FSH, LH y prolactina. La determinación de los niveles de gonadotropinas (FSH y LH) son de escasa utilidad en el diagnóstico diferencial, un cociente LH/FSH >2 se presenta en un 30-50% de los casos de SOP.
• La testosterona libre es el marcador más sensible del HA pero no esta disponible para uso clínico, por ello se sugiere utilizar el Índice de Andrógenos Libre (IAL) que presenta buena correlación con los niveles de testoterona libre, (testosterona total nml/l / SHBG nmol/l x100), y un valor normal se considera < 5.
El marcador más sensible de hiperandrogenismo es la testosterona libre o el índice de andrógenos libres
— Se debe realizar una ecografía ovárica para excluir tumores secretores de andrógenos y determinar la morfología de los ovarios.
— Aproximadamente, el 55-73% de las pacientes adolescentes con SOP asocian sobrepeso u obesidad, y es motivo de preocupación que la incidencia del síndrome está en aumento (asociado a obesidad de predominio central). La insulinorresistencia que es frecuente en pacientes obesas con un aumento del perímetro cintura y de la grasa visceral, puede empeorar las manifestaciones metabólicas y reproductivas del síndrome.
— En obesas adolescentes con SOP se debe realizar una SOG para diagnosticar alteraciones de la tolerancia a la glucosa o diabetes tipo 2. En un estudio reciente la prevalencia de alteración de la tolerancia a la glucosa fue de un 16% y un 1,2% tenían diabetes tipo 2. Además, las adolescentes con SOP presentan un aumento de los niveles de colesterol total y del C- LDL, disminución del C- HDL, alteraciones en la secreción de las adipocitoquinas y de los marcadores inflamatorios, y modificaciones en la tensión arterial. Un 11,8% de las adolescentes con SOP presentan un síndrome metabólico y, aproximadamente, el 35% de las adolescentes con SOP y sobrepeso u obesidad lo asocian.
Se debe realizar una SOG en obesas, para diagnosticar alteraciones de la tolerancia a la glucosa
Tratamiento
Los objetivos del tratamiento son los siguientes:
1. Alcanzar la ovulación
2. Normalizar los ciclos menstruales
3. Disminuir y si es posible eliminar el hirsutismo y el acné
4. Obtener una pérdida de peso aceptable
5. Tratar la dislipemia y la hiperglucemia para dismuir el riesgo de ECV
Cambios de los estilos de vida
Hay que insistir en cambios en sus hábitos de alimentación e incremento del ejercicio, con un equipo multidisciplinar, incluyendo psicólogos y dietistas. La pérdida de un 10% de peso mejoraba la función menstrual y la fertilidad, en paralelo a la mejoría de la resistencia a la insulina y las alteraciones metabólicas. Un reciente estudio de un año de intervención demuestra que con la pérdida de peso, definida por una reducción del IMC >0,2 se asociaba a disminución de los niveles de testosterona, incremento de SHBG y reducción de la amenorrea de un 69% a un 27%. Asimismo, la prevalencia de síndrome metabólico disminuía del 35 al 4%, con reducción del índice HOMA, los triglicéridos y la TA.
Anticonceptivos hormonales (AHC)
La combinación de etinilestradiol (EE) y progesterona suprime la producción ovárica de andrógenos, incrementa los niveles de SHBG y disminuye las concentraciones de testosterona libre. La progesterona evita la hiperplasia endometrial. Una dosis de 30 mcg de EE por día es suficiente para suprimir la actividad folicular ovárica y disminuir los síntomas de HA.
Se utilizan AHC de tercera o cuarta generación, que contengan progestágenos de acción antiandrogénica como el acetato de ciproterona y la drosperinona (derivado de la espironolactona). El acetato de ciproterona parece ser más eficaz en el tratamiento del hirsutismo, disminuyendo los niveles de testosterona y delta-4-androstendiona y normalizando el ratio FSH/LH, pero a su vez, empeora el estado de resistencia a la insulina y tiene un efecto negativo en el perfil lipídico, produciendo aumento de triglicéridos. Asimismo, la drospirenona es eficaz en la mejoría de la relación cintura/cadera. Entre los 6 y 9 meses de su utilización se puede encontrar mejoría del hirsutismo y se recomienda utilizarlo al menos dos años (Tabla 2).
Antes del inicio del tratamiento con AHC se descartarán las siguientes alteraciones clínicas:
• Trombofilia: no se recomienda la realización de cribado de rutina a la población general antes de indicar la AHC
• Enfermedad tromboembólica venosa (TEV): el riesgo absoluto es bajo en adolescentes, siendo del 5 al 10% en menores de 20 años. El incremento de riesgo aparece en los primeros meses tras el inicio del tratamiento y se reduce con la duración del mismo. Se realizará un análisis de sangre si existen factores de riesgo (obesidad, tabaquismo, enfermedad crónica) o un episodio previo de tromboembolismo idiopático
• Migrañas con aura
• Uso de anticonvulsivantes: fenitoína, carbamacepina y lamotrigina, entre otros
• Hipertensión arterial
• Dislipemia severa asociada a otros factores de riesgo cardiovascular
• Diabetes mellitus con vasculopatía asociada
• Inmovilización prolongada
Sensibilizadores a la insulina
La metformina es una biguanida que actúa disminuyendo la producción hepática de glucosa, incrementando la sensibilidad a la insulina, y produciendo mayor captación periférica de glucosa mediada por la insulina, pero no existen criterios aceptados para el uso de meftormina en adolescentes.
La metformina está indicada en pacientes con alteración de la tolerancia a la glucosa o con síndrome metabólico
En obesas mejora la resistencia a la insulina y la pérdida de peso. En más de la mitad de los casos consiguen regularizar los ciclos menstruales e inducir la ovulación. Asimismo, en mujeres con SOP reducen los niveles de andrógenos e incrementan los de SHBG.
Un estudio doble-ciego, randomizado en adolescentes con SOP en tratamiento con 750 mg de metformina dos veces al día y placebo se observó que la probabilidad de recuperación de los ciclos menstruales era 2,5 veces más alta en las pacientes en tratamiento con meftormina frente a placebo, con disminución de los niveles de testosterona e incremento del C-HDL.
La metformina esta indicada en pacientes con alteración de la tolerancia a la glucosa o con síndrome metabólico, aunque no existe resultados a largo plazo que demuestren los resultados, y no se muestra eficaz en el tratamiento del hirsutismo (Tabla 2).
Bloqueantes del receptor de andrógenos
La espironolactona es un antiandrógeno utilizado en el tratamiento del HA, especialmente en el hirsutismo. Varios estudios en adolescentes con SOP demuestran que produce una mejoría clínica del HA y de las irregularidades menstruales, pero no de las alteraciones metabólicas. Tanto la espironolactona como el finasteride está fuera de ficha técnica. La flutamida, no es aconsejable por el riesgo de hepatoxicidad hepática además de no tener indicación pediátrica (Tabla 2).
Tratamiento del hirsutismo
El tratamiento puede ser dividido en tres grupos: sistémico, tópico y cosmético.
• Sistémico: AHC.
• Tópico: terapia local con clorhidrato de eflornithina (Vaniqa®), inhibidor de la enzima ornitina-decarboxilasa implicada en la diferenciación y crecimiento del folículo piloso, pudiéndose observar mejoría en las 4-8 semanas siguientes de su inicio, reduciendo el vello facial en el 70% de las tratadas, y a su vez mejorando su calidad de vida.
• Medidas cosméticas: decoloración, depilación, fotodepilación y electrolisis. Para destruir los folículos afectados es necesario utilizar electrolisis o láser.
Seguimiento
Es fundamental motivar a las adolescentes con SOP y reforzar la importancia de la prevención de los factores de riesgo asociados al síndrome metabólico. Se aconseja revisar periódicamente: peso, tensión arterial, niveles de glucosa y lípidos y realizar una sobrecarga oral de glucosa cada 3-5 años o mas frecuente si presentara incremento de peso o síntomas de DM tipo 2.
En aquellas pacientes con riesgo de SOP, pero sin HA bioquímico, se debe realizar un seguimiento con determinación de andrógenos y si existe indicación clínica una SOG.
Tablas y figuras
Tabla 1. Criterios diagnósticos del SOP
|
Hiperandrogenismo clínico o bioquímico |
Oligomenorrea/anovulación crónica |
Ovarios |
||
|
NIH 1990 |
Si |
Si |
No |
Excluir otras causas |
|
Rotterdam |
Si |
Si |
Si |
Requiere 2 de los 3 criterios |
|
Androgen Excess Society, 2009 |
Si |
Si |
Si |
HA+ otro criterio |
|
Rotterdam |
Si |
Si (presente al menos 2 años) |
Si |
HA clínico y bioquímico |
|
Endocrine Society Clinical Practice Guidelines. 2013 |
Si |
Si |
No, en |
En adultos, requiere 2 de estos criterios |
NIH: Instituto Nacional de la Salud, SOP: síndrome de ovario poliquístico, HA: hiperandrogenismo
Tabla 2. Tratamiento del SOP: mecanismo de acción y posibles efectos secundarios
|
Tratamiento |
Mecanismos en acción |
Efectos secundarios |
|
Anticonceptivos |
Disminuye la producción de andrógenos (inhibición de la secreción de gonadotropinas) Disminuye la testosterona libre por incremento de SHBG |
Mayor riesgo de Cambios en la sensibilidad a la insulina, tolerancia a la glucosa y metabolismo lipídico |
|
Metformina |
Desconocido, disminuye la hiperinsulinemia |
Trastornos gastrointestinales (diarrea, naúseas, vómitos) Mayor riesgo de acidosis láctica |
|
Bloqueantes del receptor de andrógenos Espironolactona |
Inhibe la acción de los andrógenos |
Hiperkaliemia Alteraciones gastrointestinales (diarrea, vómitos) Urticaria, rash Cefalea, letargia Potencial teratógeno |
Figura 1. Historia natural del SOP.
Modificado de Sanchez de Melo A et al. Reproduction; 2015
Figura 2. Escala de Ferriman-Gallewy
Modificada para la valoración del hirsutismo (Yildiz BO et al. Hum Reprod Update 2010)
Bibliografía recomendada
1. Gambineri A, Fanelli F, Prontera O, Repaci A, Di Damazi G, Zanotti L. Prevalence of hyperandrogenic states in late adolescent and young women: epidemiological survey on italian high- school students. J Clin Endocrinol Metab. 2013; 98: 1641-50.
2. Witchel SF, Oberfield S, Rosenfield RL, Codner E, Bonny A, Ibáñez L, Pena A, Horikawa R, Gómez-Lobo V, Joel D, Tfayli H, Arslanian S, Dabadghao P, García Rudaz C, Lee PA. The Diag- nosis of Polycystic Ovary Syndrome during Adolescence. Horm Res Paedi atr 2015;83:376-389.
3. Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Re- vised 2003 consensus on diagnostic cri- teria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004; 19: 41-7.
4. Azziz R, Carmina E, Dewailly D, et al. Position statement: criteria for de- fining polycystic ovary syndrome as a predominantly hyperandrogenic syn- drome: an Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006; 91: 4237-45.
5. Dewailly D, Lujan ME, Carmina E, Cedars MI, Laven J, Norman RJ, Escobar-Morreale HF. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014; 20: 334-52.
6. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2013; 98: 4565-92.
7. Escobar-Morreale HF, Carmina E, Dewailly D, Gambineri A, Kelestimur F, Moghetti P, Pugeat M, Qiao J, Wijeyarat- ne CN, Witchel SF, Norman RJ. Epide- miology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society. Hum reprod update 2012;18:146-70.
8. Merino PM, Codner E, Cassorla F. A ra- tional approach to the diagnosis of po- lycystic ovarian syndrome during ado- lescence. Arq Bras Endocrinol Metabol 2011;55:590-8.
9. Alpañés M, Luque-Ramírez M, Martí- nez-García MA, Fernández-Durán E, Álvarez-Blasco F, Escobar-Morreale HF. Influence of adrenal hyperandrogenism on the clinical and metabolic phenotype of women with polycystic ovary syndrome. Fertil Steril 2015;103:795-801.
10. Luque-Ramírez M, Alvarez-Blasco F, Botella-Carretero JI, Martínez-Bermejo E, Lasunción MA, Escobar-Morreale HF. Comparison of ethinyl-estradiol plus cyproterone acetate versus metformin effects on classic metabolic cardio- vascular risk factors in women with the polycystic ovary syndrome. J Clin Endocrinol Metab 2007;92(7):2453-61.
11. Hecht Baldauff N, Arslanian S. Optimal management of polycystic ovary syndro- me in adolescence. Arch Dis Child 2015 doi:10.1136/archdischild-2014-306471.
12. Yildiz BO, Bolour S, Woods K, Moore A, Azziz R. Visually scoring hirsutism. Hum Reprod Update. 2010; 16: 51-64.