Adolescente y cuidados paliativos: conceptos esenciales y situación en tiempos de COVID-19
Adolescente y cuidados paliativos: conceptos esenciales y situación en tiempos de COVID-19
I.de Noriega Echevarría(1), A.González Peña(2), R.Martino Alba(3)
(1)Especialista en Pediatría y sus Áreas Específicas. Máster Universitario en Cuidados Paliativos Pediátricos.(2)Trabajador Social. Unidad de Atención Integral Paliativa Pediátrica de Madrid (UAIPPM).(3)Jefe de Sección. Unidad de Atención Integral Paliativa Pediátrica de Madrid (UAIPPM).(1,2,3)Hospital Infantil Universitario del Niño Jesús, Madrid.
Adolescere 2020; VIII (3): 64-73
Resumen
|
Los cuidados paliativos buscan prestar una atención integral a pacientes con enfermedades incurables y potencialmente mortales y a sus familias. Esto implica abordar no solo sus necesidades físicas, sino también las dimensiones psicológica, social y espiritual de la enfermedad y de su vivencia. En el caso de los pacientes adolescentes, la existencia de una enfermedad grave va a condicionar la experiencia que el adolescente tiene de esta etapa de su vida. Se presenta un caso clínico en el que se explican los principales conceptos de los cuidados paliativos pediátricos, así como un segundo caso en el que se explica la experiencia de una Unidad de Cuidados Paliativos Pediátricos en la atención a pacientes durante la pandemia por COVID-19, así como las repercusiones que ésta tuvo en los pacientes. Palabras clave: Cuidados paliativos; Cuidados al final de la vida; Adolescentes; COVID-19. |
Abstract
|
Palliative care seeks to provide comprehensive care to patients with incurable and life-threatening illnesses and their families. This implies addressing not only their physical needs, but also the psychological, social and spiritual dimensions of the disease and of their experience. In the case of adolescent patients, the existence of a serious illness will condition the adolescent’s experience of this stage of their life. A clinical case is presented in which the main concepts of pediatric palliative care are explained, as well as a second case in which the experience of a Pediatric Palliative Care Unit in caring for patients during the COVID-19 pandemic is presented, including the repercussions that it had on patients. Key words: Palliative care; End of life care; Teenagers; COVID-19. |
Caso 1. Conceptos generales en cuidados paliativos pediátricos
Javier es un paciente de 15 años con distrofia muscular de Duchenne (DMD) grave. Desde los 10 años es dependiente de silla de ruedas para movilizarse y portador de ventilación mecánica no invasiva nocturna desde hace 2 años que tolera bien por insuficiencia respiratoria restrictiva. Presenta un síndrome de Cushing grave con obesidad secundaria por el empleo prolongado de corticoides. En consulta de control con su neumólogo, refiere presentar desde hace 4-5 meses de manera progresiva aumento de sensación de disnea durante el día a la que se une sensación de hinchazón en ambas piernas y mayor cansancio. A la exploración física llama la atención la auscultación pulmonar, que presenta únicamente mínimos crepitantes en ambas bases, no objetivados anteriormente, junto con hepatomegalia y edema fovelar bilateral a la altura de ambos gemelos. ¿Cuál sería su actitud?
Desde un punto de vista puramente “clínico” el manejo diagnóstico de este paciente probablemente no plantee demasiadas dudas. Los signos que presenta, más allá de su insuficiencia respiratoria basal nos hablan de la presencia de una insuficiencia cardiaca de nueva aparición. Probablemente requiere de alguna valoración adicional (radiografía, ecocardiografía…) para confirmar el diagnóstico. Sin embargo, en cuanto al plan terapéutico, es necesario enmarcar la aparición de esta nueva complicación dentro de una enfermedad incurable como es la DMD en la que el desarrollo de insuficiencia cardiaca, más allá de ser un problema “nuevo” puede suponer un riesgo importante para Javier, incluyendo la posibilidad de fallecimiento prematuro. Este debe hacer que nos planteemos la necesidad de responder a las necesidades de Javier no solo desde un punto de vista “técnico” sino valorando en global su situación clínica, especialmente la situación de Javier como adolescente en transición a la vida adulta. Para responder a esta pregunta surgen los cuidados paliativos.
Cuidados paliativos pediátricos: definición, epidemiología y atención
Los cuidados paliativos buscan prestar una asistencia activa e integral a personas de todas las edades con enfermedades graves, especialmente cuando estas personas se encuentran al final de su vida(1). Buscan mejorar su calidad de vida, la de sus familias y cuidadores respetando la dignidad de la persona. En España, se estima que entre 11.000 y 15.000 pacientes menores de 20 años tienen necesidades paliativas(2). En la última década, distintos recursos asistenciales han ido apareciendo a nivel regional en España para ofrecer cobertura paliativa pediátrica.
La clasificación propuesta por la Asociación de Padres de Niños con Enfermedad Terminal de Reino Unido (ACT), estableció cuatro grupos en función de la trayectoria de los pacientes
Por su propia definición, los cuidados paliativos no engloban a una única enfermedad sino a un grupo muy heterogéneo de enfermedades en las que existe la posibilidad de fallecer prematuramente. En este sentido, la clasificación propuesta por la Asociación de Padres de Niños con Enfermedad Terminal de Reino Unido (ACT), estableció cuatro grupos en función de la trayectoria de los pacientes(3). En la Tabla 1 se muestra la modificación de dicha clasificación que se emplea en España (modificada por Ricardo Martino), la cual tiene en cuenta a los pacientes con situaciones agudas amenazantes para la vida y la inclusión de un grupo perinatal por sus características propias.
En este sentido, la enfermedad de Javier, sin ninguna duda se trata de una enfermedad subsidiaria de recibir cuidados paliativos pediátricos. Se trata de una enfermedad de curso progresivo que ha recibido tratamiento durante mucho tiempo para enlentecer la progresión de la enfermedad (grupo 2 de la ACT), pero, al fin y al cabo, incurable. Más allá de los problemas físicos, afectará probablemente a todas las esferas de la vida de Javier y su familia. La siguiente pregunta que nos debemos plantear es: ¿Cuándo deben los pacientes con necesidades paliativas entrar en contacto con especialistas en cuidados paliativos pediátricos?
Inicio de atención paliativa específica: identificación del punto de inflexión
La OMS, en su definición de cuidados paliativos pediátricos propone que estos deberían iniciarse “en el momento del diagnóstico de la enfermedad, independien-temente de que el niño reciba tratamiento dirigido a la enfermedad
La Organización Mundial de la Salud, en su definición de cuidados paliativos pediátricos propone que estos deberían iniciarse “en el momento del diagnóstico de la enfermedad, independientemente de que el niño reciba tratamiento dirigido a la enfermedad”(1). Otras organizaciones internacionales como la Asociación Europea de Cuidados Paliativos también defiende una integración precoz(4) incluso cuando existen opciones curativas para el paciente de manera que se pueda beneficiar de un abordaje integral precoz de sus enfermedades. Sin embargo, distintos estudios, sobre todo en el ámbito de la oncología han puesto de relieve que existen barreras a esta integración precoz(5). Es necesario entender que la atención paliativa no es exclusiva de los profesionales con dedicación específica sino que se debe realizar desde distintos niveles(2):
- Primer nivel: o “enfoque paliativo”. Consiste en atender las necesidades del paciente de modo que se acepte la posibilidad de fallecimiento como acontecimiento vital, sin privarle de lo que necesite para estar bien. Debe ser proporcionado por todos los profesionales que atienden a estos pacientes: pediatra de atención primaria, de urgencias, enfermería, etc.
- Segundo nivel: llevado a cabo por aquellas especialidades en las que la muerte del paciente es un hecho relativamente frecuente (Cuidados Intensivos Pediátricos y Neonatales, Oncología, Neurología…) y en la que los pacientes tienen un nivel de complejidad mayor. Pueden requerir de la asistencia puntual de equipos de cuidados paliativos pediátricos. Incluye la adquisición de competencias más avanzadas como el manejo básico de síntomas o la comunicación de malas noticias.
- Tercer nivel: o atención paliativa pediátrica especializada. Proporcionada a aquellos pacientes en los que la complejidad clínica, personal, familiar o social lo requiera.
En el enfoque paliativo, cualquier profesional que atienda al paciente debería comprender cuál va a ser la evolución previsible, sin dejar de darle todo aquello que fuese bueno para él en cada momento
Por lo tanto, de acuerdo con la definición de enfoque paliativo, cualquier profesional que atienda a Javier debería comprender cuál va a ser la evolución previsible de Javier, sin dejar de darle todo aquello que fuese bueno para él en cada momento. Esto mismo sería aplicable en el caso de que en lugar de tratarse de una enfermedad irreversible, se tratase de una enfermedad curable. Aquellas situaciones en las que no se acepte la posibilidad de fallecimiento pueden conducir a una situación de obstinación médica (no solo terapéutica, sino incluso en algunos casos, diagnóstica) y no aplicar aquellas medidas que pudieran ser buenas para ese paciente podrían dar lugar a una situación de abandono.
Al momento en que el paciente debe pasar a ser atendido por equipos especializados en cuidados paliativos pediátricos, Ricardo Martino propuso la identificación del Punto de Inflexión
En cuanto al momento en que el paciente debe pasar a ser atendido por equipos especializados en cuidados paliativos pediátricos, Ricardo Martino propuso la identificación del Punto de Inflexión (Figura 1)(6). Se trata del periodo de tiempo en la vida del paciente en el que se identifica un cambio de tendencia en la trayectoria clínica de su enfermedad, manifestado como una aceleración en el empeoramiento clínico, disminución de los intervalos libres de síntomas, incremento de los ingresos hospitalarios, ausencia de respuesta a la escalada de tratamientos o recaída repetida de su proceso basal.
En el caso de Javier, la aparición de un problema nuevo (insuficiencia cardiaca) que se puede asociar a un deterioro final de la enfermedad y en el cual no existen opciones curativas, nos marca el paso de este punto de inflexión. La DMD quedaría encuadrada dentro del grupo 2 de la clasificación de la ACT: enfermedad de curso progresiva en la que el tratamiento intensivo consigue prolongar la supervivencia y mejorar la calidad de vida durante un tiempo. Es comprensible que, a lo largo de estos años, la enfermedad probablemente haya afectado a Javier no solo en su componente físico, sino también en la esfera psicológica, social y espiritual. Como ejemplo de aspectos a considerar en la atención integral de un paciente como Javier en el resto de dimensiones podemos plantear algunos ejemplos:
- Esfera psicológica: ¿Cómo afectará a Javier la consciencia de sus limitaciones? ¿Y de su empeoramiento progresivo con dependencia de dispositivos? ¿Cómo afectará a la relación con sus padres? ¿Cómo le afectarán determinados tratamientos (corticoides) a su estado emocional? ¿Cómo le afectará la alteración que la enfermedad y los tratamientos han producido en su cuerpo? ¿Cómo se sentirá Javier en la gestión de su propia salud?
- Esfera social: ¿Cómo afecta la enfermedad a su escolarización (ingresos, dependencia de silla de ruedas, dispositivos…)? ¿Y la relación con sus iguales? ¿Cómo le afectará su limitación para la movilidad? ¿Cómo se verá afectada la vivencia de su sexualidad?
- Esfera espiritual: ¿Cómo afectará la vivencia de su enfermedad a su sistema de creencias? ¿Qué sentido puede darle a su enfermedad? ¿Y a su vida?
En la adolescencia como etapa de transición hacia la vida adulta en la que la persona se define como individuo, la relación con la enfermedad va a marcar en gran medida todas estas preguntas. Sin embargo, cada persona lo vivirá de una manera distinta, ya no solo por la propia enfermedad (es distinta la vivencia que tenía un paciente con una enfermedad crónica que sufre desde los primeros años de vida como la DMD, que la aparición “súbita” de una enfermedad como un cáncer o que una enfermedad con una afectación neurológica grave como una parálisis cerebral infantil) sino también por la propia historia del paciente.
Ante el aumento previsible de complejidad que la situación actual de Javier plantea, sería necesario que iniciase seguimiento por un equipo específico de cuidados paliativos pediátricos, que incluya entre sus miembros a profesionales de medicina, enfermería, psicología y trabajo social(4). Esta transición debería realizarse de manera consensuada con neumología, con cardiología (de cara a valorar el mejor manejo posible de su insuficiencia cardiaca desde un punto de vista sintomático y fisiopatológico) y el resto de especialistas implicados, así como con especialistas en cuidados paliativos y con el propio Javier. Lo ideal hubiera sido que Javier y su familia hubieran entrado en contacto previamente con el equipo de cuidados paliativos. La mayoría de equipos cuentan con la posibilidad de atender a los pacientes mientras están ingresados o en consultas ambulatorias que favorecen incorporar aspectos de la atención paliativa específica antes del paso del punto de inflexión.
Ante el empeoramiento de la situación clínica de Javier se decide iniciar seguimiento por la Unidad de Cuidados Paliativos, que plantea la posibilidad de atenderlo en su programa de hospitalización a domicilio. Su neumólogo se lo comunica a sus padres, pero ellos dicen que no quieren que se informe al paciente ¿Considera que debe informarle? ¿Cómo lo haría? ¿Qué aspectos prepararía de cara a iniciar la atención domiciliaria?
La comunicación es el acto clínico más frecuente. Se debe entender como un flujo bidireccional de información en la que se busca transmitir un mensaje dentro de un contexto. En este sentido, la comunicación de malas noticias, a pesar de ser un acto relativamente frecuente y muy trascendente no suele abordarse de manera formal en la mayoría de currículos formativos de grado de los programas sanitarios o en los programas de formación de especialistas en Ciencias de la Salud. Si bien no hay una manera única de ofrecer información, a modo de resumen, existen algunos protocolos útiles que suelen ser útiles para abordar la comunicación de malas noticias de los cuales ofrecemos un resumen en estos 7 pasos(7):
- Prepararse personalmente para dar la noticia: repasar la información a transmitir y nuestro estado emocional.
- Preparar el contexto de la comunicación: escoger un lugar en el que se respete la intimidad del paciente y su familia, que permita que estén cómodos y en el que no vaya a haber interrupciones.
- Explorar la información que el paciente sabe y la que quiere saber: ambas situaciones pueden abordarse desde el empleo de preguntas abiertas “¿Qué es lo que sabes?” “¿Qué es lo que te preocupa de tu enfermedad ahora?” “¿Quieres que te expliquemos los resultados de la prueba?”.
- Compartir la información: retomando la información de la que dispone el paciente, lanzando un “mensaje de alarma” antes de dar la información relevante. Esta información debe ser clara y sencilla, evitando tecnicismos.
- Facilitar y acoger la expresión emocional: tras dar la información dejar un tiempo de silencio y posteriormente explorar si la respuesta es acorde a la información ofrecida.
- Establecer un plan terapéutico y resolver dudas: como manera de realinear los objetivos y esperanzas del paciente. Debe tener objetivos asequibles con puntos de referencia temporales que tanto el paciente como su familia puedan tener claros.
- Resumen y disponibilidad: como manera de cerrar la entrevista. Ofrecer a responder preguntas más adelante, entendiendo la comunicación como una vía abierta y no como un acto puntual.
Una pregunta fundamental que nos tenemos que responder a la hora de valorar qué información debemos transmitir al paciente es: “¿es necesaria esta información para que el paciente tome decisiones sobre su salud?”
De cara a valorar a quién se debe informar, la Ley Básica Reguladora de la Autonomía del Paciente establece que el titular de la información es el propio paciente(8). Una pregunta fundamental que nos tenemos que responder a la hora de valorar qué información debemos transmitir es: “¿es necesaria esta información para que el paciente tome decisiones sobre su salud?”. A la hora de transmitir información no buscamos solo “pasar” los contenidos de una prueba o una valoración sino hacerlo de manera que el paciente pueda integrarlo y tomar decisiones no solo clínicas sino para el resto de ámbitos de su vida, respondiendo a su vez a las necesidades emocionales que la transmisión de esta información genera. Esto enlaza con el proceso de consentimiento en el menor. En este sentido, la última modificación de la Ley de Autonomía del Paciente establece que el consentimiento por representación no cabe en mayores de 16 años (salvo en caso de riesgo grave para su vida o salud) o menores emancipados y que un paciente menor de esta edad podrá dar su consentimiento si su médico responsable le considera competente.
En este sentido, la preocupación de los padres es razonable: tienen miedo a que la información haga daño a Javier. Cabe explicarles que para Javier puede ser importante conocer su pronóstico vital de cara a poder afrontar el periodo de final de vida y poder decidir sobre sus tratamientos, asustarse lo menos posible ante la aparición de síntomas nuevos, poder realizar despedidas… En cualquier caso, la información debe darse de manera progresiva, pudiendo ser necesarias varias entrevistas, ya que puede haber pacientes competentes que no deseen estar informados, que solo deseen estar informados parcialmente o que requieran tiempo para asimilar determinada información. En la primera entrevista será necesario explorar cuánto quiere saber Javier y hasta qué punto quiere participar en la toma de decisiones, dado que, independientemente de su edad, puede querer delegar determinadas decisiones en sus padres.
Sobre los programas de atención a domicilio, distintos estándares internacionales señalan el domicilio como el lugar preferente de cuidados
Sobre los programas de atención a domicilio, simplemente referir que distintos estándares internacionales señalan el domicilio como el lugar preferente de cuidados(4). En los adolescentes, que el paciente esté en su casa puede ser especialmente relevante ya que no solo se trata de un ambiente en el que el paciente se encuentra más seguro, sino que además le permite mantener una privacidad mayor y un mayor contacto con su realidad. Sin embargo, la atención domiciliaria requiere del establecimiento de un acuerdo bilateral entre el equipo médico responsable y el paciente y su familia. La atención a domicilio debe acompañarse de una planificación anticipada que permita tratar en domicilio situaciones médicas de urgencia y acordar aquellas situaciones en las que el paciente o su familia prefieran ingresar o en las que el ingreso sea necesario para el equipo sanitario.
En el caso de Javier, debemos valorar que posibles problemas pueden aparecer en relación con el manejo de las complicaciones de su enfermedad. No se debe dar nada por hecho y debe valorarse aspectos en los que se presupone que el paciente y su familia se pueden estar manejando adecuadamente. En Javier algunos aspectos a considerar serían:
- Movilizaciones: como llegan a su casa; si viven en un piso, valorar si cuentan con ascensor; como se moviliza por la casa; si cuenta con adaptaciones para el aseo; si cuenta con cama que pueda movilizarse.
- Manejo de dificultades respiratorias: repasar ajustes de la ventilación mecánica y posibles accesorios (aspirador de secreciones, tosedor, dispositivo para nebulizar…); si cuentan con medicación de rescate para la disnea (opioides, benzodiacepinas…).
- Alimentación: valorar si el paciente presenta disfagia, si ha precisado soporte con sonda nasogástrica en algún momento…
- Manejo de procesos intercurrentes: valorar si habitualmente se han manejado en casa o han ingresado. En futuras entrevistas valorar también si el paciente o su familia preferirían que Javier falleciese en su casa o en el hospital.
En este contexto ¿es adecuado mantener la ventilación mecánica no invasiva de Javier?
Cada medida clínica debe responder a un objetivo terapéutico que sea alcanzable para el paciente
La identificación del punto de inflexión es importante porque suele marcar un cambio en el plan terapéutico. Ante cada nueva medida nos debemos plantear si responde al mejor interés del paciente en un ejercicio dinámico de adecuación de medidas, que debe reevaluarse en función del estado del paciente a cada momento. Cada medida clínica debe responder a un objetivo terapéutico que sea alcanzable para el paciente. Así en Javier, el empleo de una ventilación mecánica no invasiva puede seguir sirviendo como objetivo primario al tratamiento de los síntomas molestos asociados a su insuficiencia respiratoria (disnea, astenia, cefalea…), independientemente del efecto de ésta sobre su pronóstico vital si en global le supone un beneficio. Mientras esto sea un objetivo plausible y bueno para Javier, debería valorar mantenerse.
A la hora de abordar la adecuación de medidas debemos considerar varios aspectos(9):
- El abordaje de dilemas éticos requiere del establecimiento de las posibilidades clínicas existentes (antes de resolver un dilema ético se debe resolver el dilema clínico). Solo con un diagnóstico y un conocimiento adecuado de las posibilidades disponibles se podrá llegar a un juicio adecuado.
- Tomar decisiones implica poder elegir entre varios cursos posibles. Es necesario establecer la evolución previsible y la posible toma secundaria de decisiones en función del curso planteado, siendo realistas con los objetivos alcanzables.
- No se puede definir el mejor interés del paciente únicamente atendiendo a la dimensión física de su enfermedad. Una decisión puramente “técnica” puede tener repercusiones sobre el resto de esferas del paciente (p.ej. administrar un tratamiento intravenoso puede requerir permanecer ingresado, limitando el contacto social con personas importantes para el paciente).
- En los pacientes adolescentes el autocuidado y la gestión de la propia salud pueden jugar un papel esencial dentro de su bienestar global.
- A veces es necesario no plantearse elegir entre una decisión “acertada” o “fallida”, sino por la decisión prudente que menos nos limite el curso de acción. Esto puede ayudar a revalorar el plan en función del curso evolutivo de la situación.
En el caso de Javier se nos puede plantear la duda de si una medida como la ventilación mecánica no invasiva está prolongando su vida innecesariamente. Como se ha comentado anteriormente, hay que tener en cuenta que el objetivo terapéutico de la ventilación puede ser el de mejorar la calidad de vida del paciente a través de la disminución de la disnea. Si bien puede que esté prolongando en parte su vida, este objetivo, mientras Javier mantenga una calidad de vida buena para él y la ventilación no le suponga mayor sufrimiento, puede ser bueno.
Javier inicia seguimiento por la Unidad de Cuidados Paliativos. De manera progresiva presenta empeoramiento de su disnea, necesitando durante más horas al día su ventilación mecánica no invasiva hasta hacerse continua. Cada vez se encuentra más somnoliento y asténico a pesar de realizarse ajustes en su medicación. ¿Está indicado mantener la ventilación mecánica no invasiva?
Llegados a este punto la situación de deterioro clínico de Javier ha cambiado. El empeoramiento de su situación clínica requiere de una reevaluación del plan y los objetivos terapéuticos. En este punto sería necesario identificar si nos encontramos en el periodo final de vida de Javier. En esta fase de la enfermedad, el empeoramiento de la situación clínica del paciente puede producir un aumento de la carga sintomática en la que aquellas medidas de soporte que prolongan artificialmente la vida (en este caso la ventilación mecánica, pero también sería aplicable a nutrición, hidratación, antibioterapia…) pueden ir en contra del mejor interés del paciente al prolongar el sufrimiento del paciente.
A la exploración se identifica un latido cardiaco en ritmo de galope, con un pulso periférico rápido y débil, con aumento de hepatomegalia y edemas. Se interpretan estos signos como indicativos de final de vida. Se le explica al paciente y a su familia que el mantenimiento de la ventilación mecánica está contribuyendo a mantenerle despierto y con más disnea. Se acuerda inicio de perfusión de morfina subcutánea para control de disnea y posteriormente se retira la interfaz de la ventilación mecánica comprobando que Javier queda progresivamente más dormido y tranquilo. Fallece en las horas siguientes acompañado por sus padres.
Caso 2. Asistencia sociosanitaria a pacientes con necesidades paliativas ante la pandemia por COVID-19
Manuel es un paciente residente en Madrid, de 14 años, con un daño medular grave causado por un accidente de tráfico hace 3 años que le ha dejado como secuela fundamentalmente una afectación motora con tetraparesia grave, con hipotonía axial e hipertonía de extremidades y dolor secundario en caderas, con mantenimiento de una buena capacidad cognitiva y comunicativa. Vive con su madre y con su abuela materna, recayendo todos los cuidados derivados de su enfermedad en su madre: cambios posturales, fisioterapia respiratoria y motora (que también recibe en el colegio), aseo… La abuela, de 81 años, presenta una fragilidad importante y si bien puede hacerse cargo de las labores básicas del hogar no puede hacerse cargo de los cuidados habituales de Manuel. Por lo demás, mantiene una buena calidad de vida, acude a un colegio ordinario de integración, mantiene un núcleo de amigos estable con los que realiza actividades de ocio. No ha presentado reagudizaciones graves, salvo un ingreso por infección respiratoria que evolucionó bien con soporte con una ventilación mecánica no invasiva. Recibe seguimiento por la Unidad de Atención Integral Paliativa Pediátrica de Madrid (UAIPPM) ambulatoriamente en consultas para control de síntomas (fundamentalmente dolor e hipertonía), si bien ha presentado estabilidad clínica en los últimos meses. Manuel ha expresado en varias ocasiones que, a raíz de los ingresos que tuvo tras el accidente, prefiere permanecer el menor tiempo posible en el hospital.
En el contexto del confinamiento secundario a la pandemia por SARS-CoV-2, llama la abuela para explicar que la madre de Manuel ha ingresado por un cuadro de neumonía bilateral por COVID-19 en el hospital. Su situación no era grave, pero parece que el ingreso durará un mínimo de una semana. Manuel también presenta sintomatología compatible con infección respiratoria leve, sin disnea; la abuela también se considera caso probable por presentar clínica catarral y ageusia sin mayor repercusión clínica. Sin embargo, la abuela está preocupada ya que no puede realizar adecuadamente los cuidados de Manuel, fundamentalmente el aseo para el que hay que movilizarle y los cambios de la cama a la silla ortopédica. Explica que el abuelo paterno (el cual no ha tenido contacto con Manuel y su familia desde el inicio del confinamiento) se ha ofrecido a ir a la casa a hacerse cargo de los cuidados de Manuel, pero están preocupados por un cuadro de posible infección en él, dado que presenta enfermedad pulmonar obstructiva crónica (EPOC) moderada, hipertensión arterial y diabetes mellitus tipo 2 en tratamiento. Han intentado contactar con posibles cuidadoras profesionales, pero no consiguen candidatos ante la presencia de clínica compatible con infección por coronavirus. Pregunta por la existencia de recursos adicionales para ofrecer cuidados a Manuel. ¿Qué le respondería?
La pandemia por SARS-CoV-2 también ha afectado a los pacientes pediátricos con necesidades paliativas. El caso clínico presentado es una adaptación de un caso real que tuvo que atender la Unidad de Atención Integral Paliativa Pediátrica de Madrid (UAIPPM) en Abril de 2020. Esta Unidad cuenta con un equipo interdisciplinar que proporciona atención ambulatoria y domiciliaria 24 horas al día, 365 días al año, así como con planta de hospitalización propia en el Hospital Infantil Universitario del Niño Jesús. Durante la primera oleada de la pandemia por SARS-CoV-2 que ocurrió en Madrid en los meses de Marzo a Junio de 2020, ante el desconocimiento de la posible afección que este cuadro podía tener en nuestros pacientes, se realizó una reorganización de nuestra actividad basada en 4 ejes:
- Mantener la asistencia en la atención domiciliaria: restringiendo las visitas a controles esenciales y fomentando el empleo de telemedicina y de controles telefónicos.
- Protección del equipo: con rotación periódica del equipo sanitario, instauración de teletrabajo en la medida en la que fuera posible y ampliando el equipo domiciliario con material de protección.
- Protección de los pacientes: limitando las visitas hospitalarias de nuestros pacientes y ampliando la visita en domicilio a pacientes que previamente recibían atención ambulatoria en nuestra Unidad.
- Apoyo en la crisis: ante la disponibilidad del equipo, profesionales del equipo participaron en otros recursos sanitarios (atención a residencias de adultos con discapacidad, asistencia en el hospital de emergencia de IFEMA, asistencia a otras Unidades del hospital…).
Esto se pudo hacer gracias a que, en gran medida, la repercusión clínica que tuvo en nuestros pacientes la infección por COVID-19 fue muy baja. Desde el inicio del estado de alarma se explicó a las familias las medidas de aislamiento y los signos de alarma a vigilar. Al estar los pacientes hospitalizados en domicilio, se restringió la realización de prueba PCR según las recomendaciones vigentes en ese momento a: 1. Situaciones en las que ingresa el paciente o este es una posibilidad, para garantizar las medidas de aislamiento 2. Infecciones respiratorias graves en función de la situación clínica del paciente. Durante los meses de Marzo a Junio se realizó esta prueba a aproximadamente 20 pacientes con hallazgo de un caso positivo en un paciente que ingresó por otro motivo. En general, los cuadros sospechosos, presentaron buena evolución. Tras la ampliación de los criterios diagnósticos por parte de las autoridades sanitarias, se ha extendido los criterios de realización de pruebas diagnósticas, que se realizan preferentemente en domicilio, observando que la mayoría de casos confirmados han sido pacientes asintomáticos, con cuadros sintomáticos leves en muchos casos con contacto estrecho con otros casos. No hemos observado ningún caso de infección grave por COVID-19 en nuestros pacientes.
Por encuadrar el cuadro dentro del enfoque paliativo, se trata de un paciente con una enfermedad grave, aunque actualmente estable; si bien existe una posibilidad de fallecimiento prematuro (ya ha tenido una infección respiratoria grave), esta parece remota y mantiene una calidad de vida bastante buena. No parece que haya pasado su punto de inflexión y por lo tanto la atención que presta la Unidad desde un punto de vista médico se centra fundamentalmente en el manejo de síntomas. De hecho, en este caso al problema puramente clínico que es su enfermedad se une de manera importante el componente socio-familiar derivado por la propia enfermedad.
En este caso, las medidas derivadas por la pandemia por COVID-19 junto con las características sociales de la unidad familiar de Manuel y la precipitación del ingreso de su madre ponen de relieve la necesidad de soporte en cuidados que necesitan pacientes como Manuel en su día a día. Se demuestra que la enfermedad en una fase previa al paso del punto de inflexión requiere de un abordaje integral de las necesidades del paciente y su familia.
Ante este caso, se planteó el dilema de qué recursos se podrían ofrecer al paciente y a su familia. Para ello se establecieron los siguientes aspectos:
- Los cuidados de Manuel, derivados de su enfermedad, requieren asistencia especializada, al implicar no solo cuidados básicos, sino también aspectos derivados de una enfermedad compleja (valoración postural, valoración motora y respiratoria…).
- Los puntos que la abuela no puede cubrir de los cuidados básicos de Manuel son fundamentalmente el aseo y las movilizaciones, así como la valoración clínica de Manuel.
- Delegar en el abuelo los cuidados de Manuel, suponía exponer a un paciente de riesgo a una posible infección por COVID-19.
- En el momento de producirse esta situación, Manuel no se encontraba en el programa de atención domiciliaria porque su situación clínica no indicaba que hubiese pasado el punto de inflexión. Sin embargo, por parte del equipo de la UAIPPM se acordó aumentar la atención en domicilio a pacientes seguidos en consulta de cara a evitar visitas hospitalarias. Esto incluía considerar recursos que pudiesen ayudar a la situación de Manuel.
- Para Manuel, era prioritario no ingresar en el hospital si su situación clínica lo permitía. Se entendió que este era el objetivo terapéutico por el que el equipo debía trabajar mientras la madre permaneciera ingresada.
Ingreso por claudicación familiar: este tipo de ingresos se realizan cuando la familia por distintas circunstancias (sobrecarga emocional, enfermedad…) no puede hacerse cargo de los cuidados de su hijo
En el equipo se plantearon varias soluciones posibles. Inicialmente se planteó la posibilidad de un ingreso por claudicación familiar(10). Este tipo de ingresos se realizan cuando la familia por distintas circunstancias (sobrecarga emocional, enfermedad…) no puede hacerse cargo de los cuidados de su hijo. Deben distinguirse de los ingresos por respiro(11), que son ingresos pactados con los padres de cara a aliviar la sobrecarga que producen los cuidados, sin necesidad de que exista una situación de claudicación. Ambos tipos de ingreso se encuadran dentro del paraguas de un ingreso social hospitalario. Esta opción se descartó al ir en contra del objetivo terapéutico principal.
Ingresos por respiro: ingresos pactados con los padres de cara a aliviar la sobrecarga que producen los cuidados, sin necesidad de que exista una situación de claudicación
Los ingresos por respiro son un recurso utilizado frecuentemente por nuestra Unidad. Cuando cualquier miembro del equipo detecta una posible necesidad, esta se comunica tanto al trabajador social responsable como al equipo hospitalario de la Unidad. Al ser un ingreso programado, se debe solicitar con un mínimo de 2 semanas de antelación. A veces la propia iniciativa parte de los padres que solicitan esta posibilidad a su equipo de atención domiciliaria responsable. Se pactan los tiempos y objetivos del ingreso y se repasan las medidas de cuidado habituales del paciente. Durante el ingreso, si estuviera indicado, el paciente podría recibir también tratamientos como fisioterapia motora o respiratoria. Se favorece que si los padres o cuidadores habituales no estuvieran presentes, el paciente pueda estar acompañado de voluntarios pudiendo también salir a pasear fuera del recinto del hospital (esto último no fue posible durante la pandemia por COVID-19).
En el caso de Manuel, otra opción que se valoró fue la posibilidad de contar con personal sanitario cualificado de respiro domiciliario a través de la colaboración económica de fundaciones y organizaciones sin ánimo de lucro. En Cuidados Paliativos Pediátricos a la hora de asumir la atención global de los pacientes, hay determinadas prestaciones que actualmente no están cubiertas por los Sistemas de Salud y que son necesarias para los pacientes: fisioterapia en domicilio, musicoterapia, servicios de cuidados puntuales (respiro) en domicilio… Esto ha hecho que en muchas regiones, se hayan establecido mecanismos de cooperación con entidades del tercer sector para apoyar a los pacientes y sus familias. En nuestro país, existen asociaciones de pacientes y familias, así como organizaciones no gubernamentales y fundaciones que colaboran en la organización y financiación de actividades para pacientes con este tipo de enfermedades, incluyendo una fundación cuya actividad se centra específicamente en promover y desarrollar los cuidados paliativos pediátricos, la Fundación Porque Viven. Entre sus prestaciones cuenta con un programa de respiro domiciliario atendido por enfermeras con formación en cuidados paliativos pediátricos. La coordinación con el equipo asistencial de la UAIPPM se establece a través de los trabajadores sociales de la Unidad, los cuales trasladan a la Fundación las necesidades detectadas por el equipo de la UAIPPM y acuerdan el régimen de cuidados que se puede establecer. En otro tipo de situaciones, los trabajadores sociales de la Unidad solicitan colaboración a aquellas entidades que, según su consideración, pueden estar interesadas en colaborar en algún tipo de actividad.
Durante la pandemia de COVID-19, la UAIPPM decidió incorporar a Manuel en su programa de atención domiciliaria, incluyendo visitas periódicas para valoración de síntomas y problemas clínicos. Además, mientras presentó síntomas compatibles con COVID-19, se monitorizó los síntomas del paciente, manteniéndose estable y sin signos de infección respiratoria grave. Ante el ingreso de su madre y con la imposibilidad de que su abuela asumiese todos los cuidados, se planteó la posibilidad de realizar un ingreso por claudicación, pero se descartó al ser contrario al objetivo terapéutico planteado por el propio paciente. A través de la financiación proporcionada por entidades del tercer sector se consiguió financiar a personal de enfermería y auxiliar de enfermería para hacer visitas de cuidado por la mañana (en caso de que no tuviese visita por el equipo de la UAIPPM ese día) a primera hora para vestirle, realizar los cuidados básicos y colocarle en su silla ortopédica y a última hora de la tarde para realizar el aseo, cuidados básicos y ayudar a Manuel y a su abuela. El personal sanitario formaba parte del equipo de la planta de hospitalización de la UAIPPM y se coordinaron sus visitas junto con su actividad habitual ante las bajas existentes por infecciones por COVID-19 en la sala de hospitalización. Finalmente, tras el alta de la madre y comprobar que podía hacerse cargo de los cuidados de Manuel, se dejó de prestar asistencia por parte de la Fundación, si bien Manuel mantuvo seguimiento domiciliario por la UAIPPM mientras se mantuvieron las restricciones de movilidad.
Este es un ejemplo del tipo de asistencia al que los equipos de Cuidados Paliativos Pediátricos se han tenido que enfrentar durante la pandemia por SARS-CoV-2. En la Unidad de Atención Integral Paliativa Pediátrica de Madrid, se ha registrado un bajo índice de casos sospechosos, presentando una baja incidencia de la enfermedad en nuestros pacientes que a su vez han sido asintomáticos o leves (detectados por necesidad de ingreso hospitalario en muchos casos). Esto ocurre a pesar de los problemas respiratorios que son altamente frecuentes en los pacientes atendidos por nuestra Unidad. Sin embargo, la necesidad de aislamiento, la afectación a sus cuidadores y la dificultad para movilizar a estos pacientes, ha puesto de relieve la necesidad de apoyo social, psicológico y en cuidados que tienen, no solo en pacientes con necesidades paliativas específicas, sino también en pacientes con enfermedades crónicas y complejidad.
Tablas y figuras
Tabla I. Clasificación de la Asociación de Padres de Niños con Enfermedad Terminal de Reino Unido (ACT)
|
ACT |
Subgrupo |
Definición |
Ejemplos |
Característica principal |
|
1 |
a |
Enfermedad que limita la vida en la que un tratamiento curativo es posible pero puede fallar |
Cáncer |
Curación posible |
|
b |
Situación amenazante para la vida de forma aguda en paciente previamente sano |
Sepsis |
Muerte es posible |
|
|
2 |
|
Enfermedades en las cuales hay una fase prolongada de tratamientos intensivos que pueden prolongar la vida y permiten actividades normales del niño, pero la muerte prematura es posible |
Fibrosis quística Distrofia Muscular Duchenne |
Fase de normalidad |
|
3 |
a |
Enfermedades progresivas sin posibilidades de tratamiento curativo en las que el tratamiento es exclusivamente paliativo |
Mucopolisacaridosis |
Implacable Evolución usual en años |
|
b |
Enfermedades progresivas sin posibilidades de tratamiento curativo en las que el tratamiento es exclusivamente paliativo |
Atrofia Muscular Espinal I Cancer metastásico |
Implacable Evolución usual en meses |
|
|
4 |
Situaciones no progresivas con alteraciones neurológicas severas las cuales pueden causar mayor susceptibilidad a complicaciones del estado de salud |
Parálisis cerebral infantil grave Síndromes polimalformativos |
Impredecible |
|
|
5 |
a |
Condición limitante de la vida diagnosticada prenatalmente |
Trisomías Anencefalia |
Cuidados paliativos |
|
b |
Condición amenazante o limitante diagnosticada tras el nacimiento |
Prematuridad extrema |
Diagnóstico no esperado. |
Bibliografía
1. WHO. WHO definition of palliative care. Available from: http://www.who.int/cancer/palliative/definition/en/ [Acceso Noviembre 2017].
2. Grupo de trabajo en el seno del Comité de Seguimiento y Evaluación de la Estrategia en Cuidados Paliativos del Sistema Nacional de Salud. Cuidados Paliativos Pediátricos en el Sistema Nacional de Salud: Criterios de Atención. Ministerio de Sanidad, Servicios Sociales e Igualdad, Centro de Publicaciones 2014. Disponible en: http://www.msps.es/organizacion/sns/planCalidadSNS/pdf/01-Cuidados_Paliativos_Pediatricos_SNS.pdf.
3. Chambers L, ACT-Association for Children’s Palliative Care. A guide to the development of children’s palliative care services. Bristol: ACT; 2009.
4. Craig F, Abu-Saad Huijer H, Benini F, Kuttner L, Wood C, Feraris PC, et al. [IMPaCCT: standards of paediatric palliative care]. Schmerz. 2008 Aug;22(4):401–8.
5. Haines ER, Frost AC, Kane HL, Rokoske FS. Barriers to accessing palliative care for pediatric patients with cancer: A review of the literature. Cancer. 2018 Jun 1;124(11):2278–88.
6. San Román Ortiz L, Martino Alba R. Enfoque Paliativo en Pediatría. Pediatr Integral. 2016;XX(2):131.e1-131.e7.
7. Arranz P. Intervención emocional en cuidados paliativos. Barcelona: Ariel; 2017.
8. Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Última actualización 06/12/2018. [Internet]. Disponible en: https://www.boe.es/buscar/act.php?id=BOE-A-2002-22188.
9. Rigal M, del Rincón Fernández C, Martino Alba R. Vivir (y morir) a mi manera. La atención a adolescentes en cuidados paliativos. Revista Adolescer. III(3):32–51.
10. Barahona Álvarez H, Viloria Jiménez A, Sánchez Sobrino M, Callejo Pérez MS. Detección del riesgo de claudicación en los cuidadores de pacientes ingresados en una Unidad de Cuidados Paliativos de Agudos. Medicina Paliativa [Internet]. 2012 Jul [cited 2020 Sep 28];19(3):100–4. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1134248X11000176.
11. Martínez, MF, Villalba, C, García, M. Programas de respiro para cuidadores familiares. Psychosocial Intervention [Internet]. 2001;10(1):7-22. Recuperado de: https://www.redalyc.org/articulo.oa?id=179818298002.
Problemas respiratorios en COVID-19
Problemas respiratorios en COVID-19
M.A. Zafra Anta.
Facultativo Especialista de Área en Pediatría en el Área de Neumopediatría del Hospital Universitario Fuenlabrada, Madrid.
Adolescere 2020; VIII (3): 56-63
Resumen
|
Se expone la patología respiratoria asociada a coronavirus COVID-19 mediante tres casos clínicos que presentan anosmia o neumonía. La mayoría de los adolescentes tienen un curso asintomático o leve-moderado; pero algunos pueden tener complicaciones o enfermedad grave, muy grave. Se revisan los factores de riesgo. Se hace una rápida revisión de cómo afecta en el aparato respiratorio el COVID-19 a los adolescentes, y se señalan algunos datos actuales conocidos sobre adolescentes con asma o con fibrosis quística. Palabras clave: Coronavirus; COVID-19; SARS-CoV-2; SARS-CoV-2 neumonía; Asma; Anosmia, Pediatría; Adolescente. |
Abstract
|
The respiratory pathology associated with coronavirus COVID-19 is described through three clinical cases that present anosmia or pneumonia. Most adolescents have an asymptomatic or mild to moderate course; however some may have complications or very severe illness. The risk factors are reviewed. A quick review is made of how COVID-19 affects the adolescent respiratory system, and some current data known about adolescents with asthma or cystic fibrosis are pointed out. Key words: Coronavirus; COVID-19; SARS-CoV-2; SARS-CoV-2 pneumonia; Asthma; Anosmia; Paediatrics; Adolescent. |
Introducción
En la actual pandemia por el nuevo Coronavirus (Severe Acute Respiratory Syndrome) Coronavirus 2, SARS Cov-2, que produce la enfermedad COVID-19, resulta necesaria una actualización continua
En la actual pandemia por el nuevo Coronavirus (Severe Acute Respiratory Syndrome) Coronavirus 2, SARS Cov-2, que produce la enfermedad COVID-19, resulta necesaria una actualización continua y estar alerta de la información que ofrecen las publicaciones y sociedades científicas.
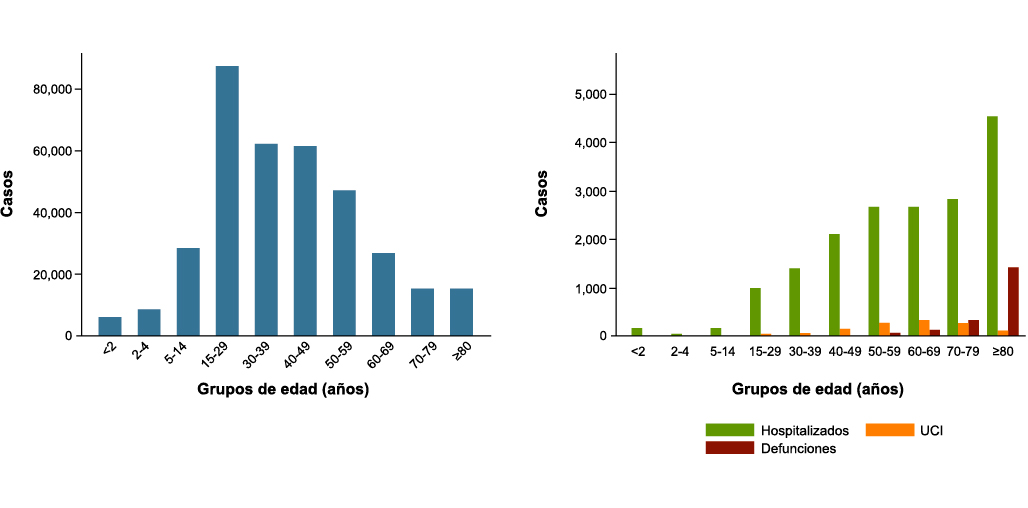
En la edad pediátrica, especialmente en los grupos de mayores de un mes de edad y menores de 10 años, se tiene menor riesgo de desarrollar síntomas graves o intensos por COVID-19 que en la edad adulta: hasta el 95% de todos los casos pediátricos son asintomáticos o tienen cursos clínicos leves o moderados(1). Sin embargo, a partir de los ocho-diez años se va incrementando progresivamente la probabilidad de padecer cuadros más graves. La explicación de la menor afectación de la COVID-19 en la edad pediátrica resulta de varios factores de la interacción del virus con el huésped, con la expresión de los receptores ACE 2, con la capacidad de determinar una respuesta hiperinflamatoria así como en el daño endotelial previo del individuo(1).
Caso 1. Alteración de olfato en varón de quince años
Se trata de un adolescente varón, de quince años de edad, que residía en la provincia de Madrid, en la fecha de mayo de 2020. La madre consultó telefónicamente a su médica de Atención Primaria pues su hijo parecía haber perdido el olfato, y quería saber la causa. Además el chico tenía molestias digestivas y había realizado dos deposiciones blandas. La consulta se desarrolló por conversación telefónica pues por la situación epidemiológica de pandemia de coronavirus COVID-19 en esas fechas los Centros de Salud no tenían acceso personal directo, en presencia, sino mediante un cribado y consulta telefónica.
Preguntado por la médica, el adolescente no fumaba y no tomaba o inhalaba otras drogas. No tenía fiebre. Posiblemente “había pasado el COVID” pues hacía un mes estuvo dos o tres días con dolor faríngeo leve, cansancio, sin otros síntomas, sin fiebre, esto a las dos semanas de que su padre fuera diagnosticado de COVID-19 leve, con fiebre de pocos días de duración, cefalea y tos, sin necesidad de ingreso, con test diagnóstico de PCR positivo. El adolescente refería que no se hizo el test de la PCR. Desde entonces creía que no percibía los olores apenas, pero tampoco le había llamado la atención.
La madre confirmó estos términos de la conversación telefónica de su hijo con la médica. Cuando destapó la cacerola de pescado cocinado de la que comió su hijo, refería que claramente olía mal, parecía estar en mal estado; era una comida preparada hacía unos días. Por tanto, la madre opinaba que su hijo había perdido el olfato: “Si no es por tabaco, será por el COVID-19”. La médica le dio consejos sobre observación (de exantemas en piel o dolor abdominal intenso o mareo) por lo que debería acudir a las urgencias hospitalarias; y ante una posible intoxicación alimentaria leve, le dio recomendaciones de dieta, hidratación y analgesia con paracetamol.
En dos días la madre y la médica establecieron nuevo contacto telefónico. El chico había evolucionado bien de su cuadro digestivo, sin datos de alarma o agravamiento. La madre preguntó si por la falta de olfato no debería acudir a un especialista ORL, que lo ha leído en Internet.
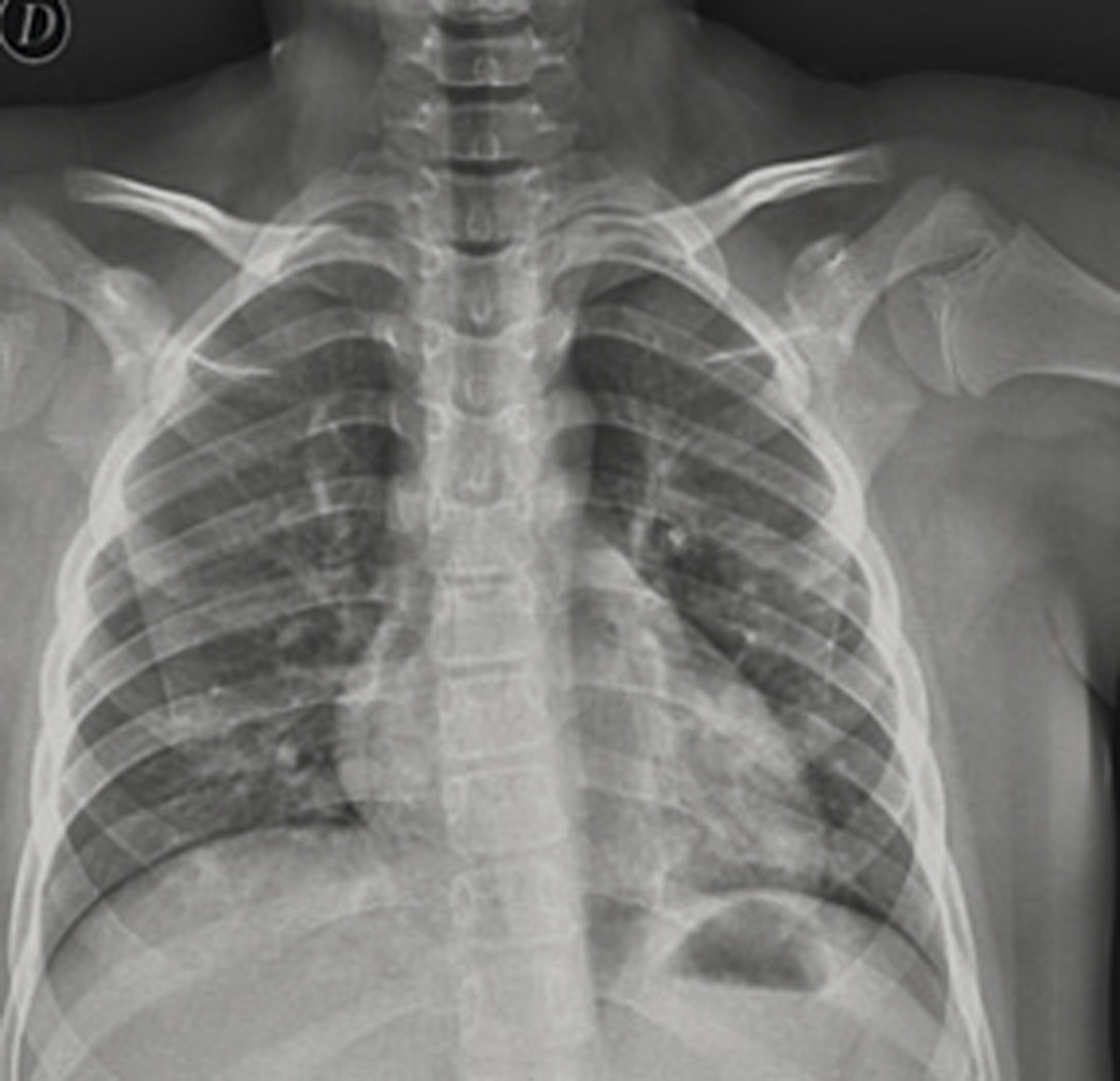
Caso 2. Fiebre de ocho días de duración, y tos en varón de diez años
Se trata de un adolescente varón, de diez años de edad, que vivía en una ciudad de la periferia de Madrid. En una fecha de septiembre de 2020, fue remitido a Urgencias hospitalarias por tener fiebre de ocho días de evolución, hasta 39ºC, además de tos seca, dolor faríngeo 3 días, disminución del apetito, náuseas y cansancio, sin diarrea. No tenía factores de riesgo de agravamiento de COVID-19. Había seguido consultas telefónicas con su pediatra de Atención Primaria, al tercer día de síntomas le había realizado una PCR para coronavirus, que resultó positiva, así como lo había sido la semana anterior también a los demás convivientes del domicilio, que tenían síntomas leves y contacto con otro familiar en una fiesta privada, donde se reunieron diez personas, que fueron seguidos en rastreo y con recomendaciones de aislamiento-cuarentena.
En Urgencias, a nuestro paciente de 10 años se le tomó la saturación pulsioximétrica (SpO2), normal, 97%, las constantes, sin taquipnea, taquicardia leve, con fiebre de 38,1ºC. La tensión arterial fue normal. La exploración fue normal, salvo muy aislados crepitantes en bases pulmonares. Se realizó analítica, que resultó en parámetros de normalidad: hemograma, gasometría, iones, creatinina, aminotransferasas, lactadodeshidrogenasa, creatínkinasa, coagulación, dímero D. No había elevación de la PCR (Proteína C Reactiva) ni de la procalcitonina (PCT). Se realizó radiografía simple de tórax posteroanterior. (Figura 1).
En la radiografía de tórax se apreciaban infiltrados basales tenues, sin derrame ni otros datos, compatible con infección por COVID-19.
Se decidió la hospitalización del paciente para observar evolución por los días sucesivos de fiebre, sin otro tratamiento que analgesia. Pasadas doce horas de ingreso, ya no volvió a presentar fiebre.
La monitorización de la SpO2 fue normal, no precisó oxigenoterapia. Recibió el alta hospitalaria en las 48 horas siguientes, con un control clínico y radiológico en 6 semanas, más los controles telefónicos y clínicos seriados por Atención Primaria.
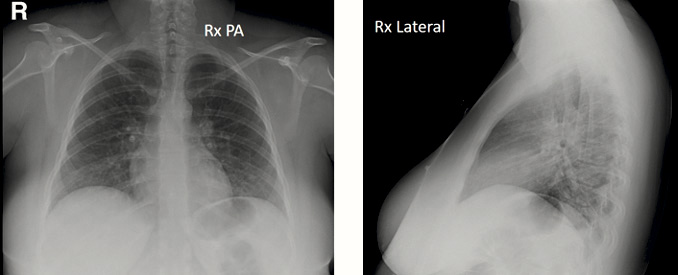
Caso 3. Fiebre, tos y dolor torácico en mujer de veintiún años
Se trata de una mujer de veintiún años de edad, que vivía en una ciudad de la periferia de Madrid. Acudió, en una fecha de septiembre de 2020, a urgencias hospitalarias por presentar desde las 48 horas previas tos, dolor torácico y sensación de dificultad respiratoria. Llevaba 7 días más con fiebre (total de nueve días), hasta 38,7ºC, además de mialgias y diarrea leve en número. Había seguido consultas telefónicas por su médico de familia, en Atención Primaria: al tercer día de síntomas le realizaron una PCR para coronavirus, que resultó positiva, y con recomendaciones de aislamiento pues vivía con su padre, que tiene factores de riesgo (hipertensión arterial y obesidad). Ella estaba tomando anovulatorios.
En urgencias del hospital se objetivó una SpO2 de 96%, en la exploración física tenía un índice de masa corporal de 33, sin taquipnea ni taquicardia, quizá una leve hipoventilación en las bases pulmonares.
Se realizó una radiografía simple de tórax en proyecciones PA y lateral (Figura 2).
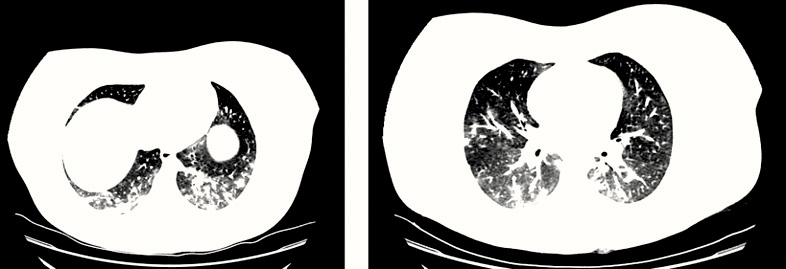
La analítica resultó en parámetros de normalidad: hemograma, gasometría, iones, creatinina, aminotransferasas, lactadodeshidrogenasa, creatínkinasa, albúmina, coagulación; todo, excepto el dímero D, que estaba elevado (982 ng/ml, siendo el rango de normalidad de 200 a 500), y la ferritina elevada, en 445 ng/ml. Había también leve-moderada elevación de PCR (6,63 mg/dl), pero no de la PCT (0,04 ng/ml). El electrocardiograma fue sin hallazgos patológicos. Se indicó la realización de angiotomografía computarizada de tórax por la clínica, analítica y los factores de riesgo de trombosis-tromboembolismo (medicación con anovulatorios y obesidad) (Figura 3). Se realizó el diagnóstico de bronconeumonía de extensión moderada y se descartó la presencia de tromboembolismo pulmonar.
Se recomendó el manejo ambulatorio con aislamiento domiciliario hasta nueva indicación de Atención Primaria, y la observación de signos de alarma para volver a consultar. Se prescribió antibioterapia oral (cefalosporina), corticoterapia oral, protector gástrico y analgesia. Se recomendó movilización, instrucciones de ejercicios y actividad, líquidos abundantes. La evolución fue favorable, sin complicaciones.
Discusión de los casos
La mayoría de las infecciones COVID-19 en pediatría son asintomáticas. La afectación respiratoria en el SARS-Cov2 o COVID-19 es la clínica más frecuente
La mayoría de las infecciones COVID-19 en pediatría son asintomáticas. La afectación respiratoria en el SARS-Cov2 o COVID-19 es la clínica más frecuente.
La disminución de la percepción del olfato se reconoce como uno de los síntomas más frecuentes en adultos, aunque no exclusivos de la infección por COVID-19. En una revisión de Walker et al(2) se expone que más del 50% de los pacientes sintomáticos con COVID-19 pierden el sentido del olfato, en adolescentes parece que el porcentaje es menor(1), un 10%. La fisiopatología apunta a una disfunción neurosensorial, no neuronal. La mayoría de los pacientes mejoran claramente antes de 4 semanas del inicio de los síntomas (más del 90%). Por tanto la mayoría de los pacientes con pérdida aguda de olfato en contexto de la actual pandemia no precisan más que establecer su diagnóstico de infección por coronavirus SARS Cov-2, el estatus de enfermedad y aislamiento hasta pasar la fase de contagiosidad(2), como en nuestro caso clínico. En el caso de infección por COVID-19 las recomendaciones respecto a la pérdida de olfato serían: ofrecer tranquilidad, hay controversia en cuanto al uso de corticoides nasales tópicos, pero no están contraindicados, no se usan corticoides sistémicos para esta indicación. Se deben dar consejos de seguridad: cuidado con las comidas caducadas, como en nuestro caso, cuidado con el humo, etc. A partir de las 2-4 semanas se recomienda iniciar un entrenamiento olfativo para ir recuperando el sentido del olfato.
Sin embargo, es crucial hacer un diagnóstico diferencial, por cuanto si no se trata de una infección COVID-19 hay que realizar estudios por el especialista ORL si dura más de 4-6 semanas, con nasofibroscopia, y se debe considerar la realización de tomografía facial-craneal, especialmente si hay signos-síntomas neurológicos asociados(2).
Los posibles mecanismos de causas de anosmia en general, pueden ser por alteración de conducción, neurosensorial o mixtas
Los posibles mecanismos de causas de anosmia en general, pueden ser por alteración de conducción, neurosensorial o mixtas (Tabla I).
Los síntomas más frecuentes de la COVID-19 en adolescentes son fiebre, cefalea, mialgias, dolor de garganta, tos y dificultad respiratoria(1). Entre los adolescentes se afectan por igual varones y chicas.
La neumonía en la edad pediátrica es menos frecuente o sintomática que en la edad adulta, y más leve que por encima de los 50-60 años. Tiene un componente de la propia infección vírica, con alteración citopática de los neumocitos; pero también tiene un componente inmunomediado, de inflamación, que puede desencadenar la llamada “tormenta inflamatoria” o estado hiperinflamatorio que desencadena la COVID-19 en los cuadros graves, con elevación de citosinas proinflamatorias (interleukinas IL-1, IL-6, TNF-alfa y otras)(1,3). No hay que olvidar que el SARS Cov-2 determina no solo una enfermedad respiratoria sino que es multisistémica.
No hay imagen radiológica patognomónica; pero sí es muy típica la afectación de lesiones nodulares difusas uni o bilaterales, más en las bases, tipo bronconeumonía
No hay imagen radiológica patognomónica; pero sí es muy típica la afectación de lesiones nodulares difusas uni o bilaterales, más en las bases, tipo bronconeumonía. En niños, en la práctica se solicita en muchas ocasiones solo la proyección posteroanterior (PA). Puede ser útil solicitar además de la proyección PA una proyección lateral, pues tiene más sensibilidad para el estudio de lesiones en las bases pulmonares. Las alteraciones son muy evidentes en la tomografía computarizada, incluso con radiografía de tórax simple normal o poco expresiva(4). La tomografía puede mostrar opacidades en imagen de “vidrio esmerilado” dispersas, localizadas subpleurales o extendidas de las lesiones subpleurales, también puede mostrar consolidación con signo de halo. La tomografía es útil para el estudio de complicaciones, y especialmente para la valoración de tromboembolismo pulmonar(3,4). Las complicaciones graves en la edad pediátrica son poco frecuentes; pero también existen(3). En un estudio de cohortes multinacional, multicentro, de niños y adolescentes con COVID-19 en Europa(5), publicado en septiembre de 2020, donde se recogía el registro de niños hospitalizados, se evaluaron 582 pacientes pediátricos. Tenían patología previa 25%. Ingresaron en la UCI el 13% de los hospitalizados. Precisaron ventilación mecánica el 4%, y solo un caso precisó Oxigenación de Membrana Extracorpórea (ECMO). Cuatro casos tuvieron evolución fatal, todos ellos eran mayores de 10 años de edad; de ellos dos no tenían patología previa. Algunos autores han clasificado los estados de la infección por COVID-19 según la gravedad: si no hay neumonía, si hay hipoxemia o no, o si hay afectación hiperinflamatoria y multisistémica(3,6).
En el manejo de las neumonías, hay que tener en cuenta que a la semana de inicio de los síntomas (6-10 días) puede haber un empeoramiento brusco inesperado
En el manejo de las neumonías, hay que tener en cuenta que a la semana de inicio de los síntomas (6-10 días) puede haber un empeoramiento brusco inesperado.
Los posibles factores de riesgo de agravamiento de infección COVID-19 a tener en cuenta en el manejo del paciente se citan en la Tabla II.
En la edad pediátrica, en aquellos casos con patología asociada de riesgo o si la evolución clínico-analítica así lo señala, no hay que olvidar la profilaxis de tromboembolismo pulmonar con enoxaparina(7,8). Las situaciones de riesgo vienen señaladas en el trabajo de la AEP: enfermedad oncológica activa, antecedentes familiares o personales de eventos tromboembólicos, obesidad, en pacientes con disfunción severa de ventrículo izquierdo (FE < 18 30%) o en pacientes graves con imposibilidad de deambulación, especialmente en niños mayores de 12 años y adolescentes. El embarazo en adolescentes también confiere especiales riesgos(7).
La “hipoxemia feliz”, o mejor “hipoxemia silenciosa”, consiste en que hay pacientes con trabajo respiratorio importante y con saturaciones bajas, que no tienen gran sensación de disnea
Respecto de la vigilancia de la dificultad respiratoria hay que señalar la llamada “hipoxemia feliz”, o mejor “hipoxemia silenciosa”, que es especialmente desconcertante y consiste en que hay pacientes con trabajo respiratorio importante y con saturaciones bajas, que no tienen gran sensación de disnea(9). Se les nota al hablar, por la disnea de esfuerzo, ello ha sido importante en la monitorización de la SpO2 con pulsímetros dactilares o en el seguimiento médico telefónico. Es posible que el coronavirus tenga una acción idiosincrásica sobre los receptores implicados en la quimiosensibilidad al oxígeno, o se reduce la respuesta del cerebro a la hipoxia(9).
Las recomendaciones actuales generales de ingreso y manejo en cuidados intensivos pediátricos (UCIP) pueden verse en la publicación de Kache et al(10).
En pacientes pediátricos con asma, las informaciones actuales es que, al menos en asma con buen control, la enfermedad COVID-19 no es más grave. En un estudio europeo, restrospectivo en un hospital de Estrasburgo(11), en una serie de casos, con 106 pacientes con neumonía, 23 con asma (4 eran <18 años) el asma no pareció incrementar el riesgo de padecer neumonía grave por SARS-CoV-2.
No había diferencias en estancia hospitalaria, ingreso en UCI, necesidades de O2. Además, la neumonía por SARS-CoV-2 no indujo una exacerbación grave de asma.
Aunque el asma en los niños es muy variable tanto en los desencadenantes como en la gravedad, la COVID no produce especialmente incremento de broncoconstricción, no produce más sibilancias
Aunque el asma en los niños es muy variable tanto en los desencadenantes como en la gravedad, la COVID no produce especialmente incremento de broncoconstricción, no produce más sibilancias.
No hay datos actualmente de ello. No se sabe por qué. Igual ocurría con el SARS Cov-1; pero otros coronavirus sí son desencadenantes de broncoespasmo.
Las posibles explicaciones de que el SARS Cov-2 no determine frecuentes sibilancias son las siguientes(12): Hay pocos receptores ACE2 en epitelio bronquial (sí en nasal y neumocitos), o bien, el empeoramiento de COVID-19 va asociado a un descenso de cifras de eosinófilos, que los pacientes con asma tienen incrementados habitualmente, o también que los corticoides inhalados solos o asociados a broncodilatadores inhiben la replicación, como el caso de coronavirus-229E humano, en parte por inhibir la expresión del receptor y/o la función endosomal y reducir la producción de citokinas (IL-6, IL-8). Por otro lado, la alergia, presente en muchos asmáticos, disminuye el IFN y la respuesta proinflamatoria de chemokinas en la vía aérea por los virus.
Respecto del control del asma, en el trabajo de Papadopoulos et al(12), se cita que la evitación de los desencadenantes y la adherencia al tratamiento parece que mejoraron el control del asma en los niños, incluso bajo la presión del confinamiento. Los niños/adolescentes con asma no parecen necesitar medidas profilácticas adicionales de la enfermedad coronavirus 2019 cuando el asma está bien controlada.
Durante la pandemia, los servicios de asma pediátrica limitaron las consultas y establecieron clínicas virtuales. El control del asma de sus pacientes se mantenía o incluso mejoraba, mientras que se consideraba que la adhesión al tratamiento era mayor.
En el contexto de la pandemia, hay que tener en cuenta que tanto el diagnóstico como el manejo del asma y otras infecciones respiratorias (realización de espirometría, test de esfuerzo, nebulizaciones de fármacos, etc.) pueden generar o dispersar aerosoles, y con ello aumentar la posibilidad de contagio. Hay que revisar y actualizar continuamente las recomendaciones de prevención de infección por coronavirus en las unidades de función pulmonar de los diferentes ámbitos asistenciales (como la Actualización del 20 de mayo 2020 en https://drive.google.com/file/d/1DQgTeca76H1VtkDg6-KhPqb-kOmVoLkl/view).
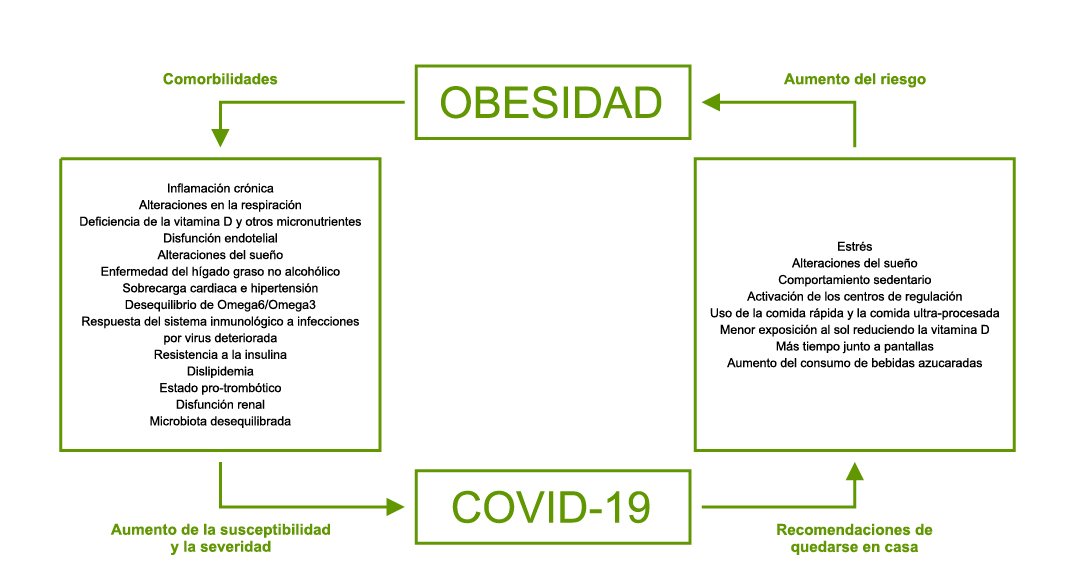
Hay que señalar otras patologías respiratorias como la fibrosis quística (FQ), en la que la COVID-19 podría determinar incremento de morbilidad y gravedad de los cuadros, además, la inmunosupresión relacionada con el trasplante de pulmón podría actuar como un factor de riesgo de mortalidad en pacientes con FQ. Hacen falta más estudios para valorar esto anterior. Véase la revisión de Mondéjar-López y cols(13) de la incidencia y resultados de una cohorte de seguimiento nacional, en España, ECFSPR (hasta mayo de 2020). Si bien solo 2 eran menores de 18 años. Ninguno de los pacientes no trasplantados e incluidos en el Registro Nacional ECFSPR ha muerto; tampoco el paciente que estaba trasplantado. Hasta esa fecha de mayo, la incidencia acumulada era aparentemente baja en comparación con la población general.
La actualización constante en los problemas respiratorios y la COVID-19 es necesaria para el manejo de estos pacientes, y nos deparará guías para su diagnóstico y tratamiento. También nos ofrece algunas informaciones inesperadas, como la de que la vacuna BCG podría ser un factor protector parcialmente de la gravedad(14), o si asistiremos a patología postCOVID, a secuelas, no solo psicológicas o sociales, sino derivadas de la activación inmunológica o de otros factores, como se vio históricamente con las pandemias de gripe o polio.
Tablas y figuras
Tabla I. Causas de anosmia en general
|
Anosmia predominantemente de conducción |
Anosmia predominantemente neurosensorial |
|
CAUSAS COMUNES Rinitis alérgica Rinosinusitis con o sin pólipos nasales Inhalación de drogas: cocaína y otras Desviación septal, obstrucción nasal CAUSAS MENOS COMUNES Granulomatosis Iatrogénica: medicación (IECA, otros), |
Postviral: COVID-19, gripe, rinovirus. Traumatismo craneoencefálico Trastornos psiquiátricos Tumores Tabaquismo Enfermedades endocrinas Inhalación de metales pesados y solventes Congénita (síndrome de Kallman) |
Referencia: Walker A, Pottinger G, Scott A, Hopkins C. Anosmia and loss of smell in the era of COVID-19. BMJ. 2020;370:m2808. Disponible en http://dx.doi.org/10.1136/bmj.m2808. Acceso: [29 de septiembre de 2020].
Tabla II. Factores de riesgo de agravamiento de infección COVID-19 en edad pediátrica-adolescente
|
Inmunodeprimidos |
|
|
Cardiopatías |
|
|
Patología respiratoria crónica |
|
|
Otros |
|
Tomado de referencias 3 y 8: Deville JG et al(3) y Asociación Española de Pediatría (AEP). Documento de manejo clínico del paciente pediátrico con infección por SARS-CoV-2(8).
Figura 1. Caso clínico dos. Varón de 10 años con fiebre
Radiografía de tórax PosteroAnterior. Se apreciaban infiltrados basales tenues, sin derrame ni otros datos.
Figura 2. Caso clínico tres. Mujer de 21 años con fiebre y dolor torácico. Radiografía simple de tórax
Radiografía de tórax en proyección PosteroAnterior izquierda de la imagen, y Lateral. Sin opacidades pulmonares visibles con esta técnica. Placa posteroanterior normal. Placa lateral escasamente inspirada.
Figura 3. Caso clínico tres. Mujer de 21 años con fiebre y dolor torácico. Angiotomografía
Angiografía en Tomografía Computadorizada de Tórax, dos cortes seleccionados. Compatible con bronconeumonía por COVID-19 de extensión moderada sin signos de derrame pleural. Afectación parenquimatosa bilateral con múltiples consolidaciones alveolares parcheadas mal definidas, de pequeño tamaño y morfología redondeada afectando a todos los lóbulos, predominio en los inferiores. Pequeñas dilataciones bronquiales, que provocan una leve distorsión del parénquima pulmonar. Sin evidencia de tromboembolismo pulmonar. No hay signos de hipertensión pulmonar ni sobrecarga de cavidades cardíacas derechas.
Bibliografía
1. Deville JG, Song F, Oullette CP, Edwards MS, Torchia MM. Coronavirus disease 2019 (COVID-19): Clinical and manifestadions and diagnosis in children. Post TW, ed. UpTo-Date. Waltham, MA: UpToDate Inc. https://www.uptodate.com Acceso: [6 de octubre de 2020].
2. Walker A, Pottinger G, Scott A, Hopkins C. Anosmia and loss of smell in the era of COVID-19. BMJ. 2020;370:m2808 Disponible en: http://dx.doi.org/10.1136/bmj.m2808. Acceso: [29 de septiembre de 2020].
3. Deville JG, Song F, Oullette CP, Edwards MS, Torchia MM. Coronavirus disease 2019 (COVID-19): Management in children. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. https://www.uptodate.com Acceso: [7 de octubre de 2020].
4. Xia W, Shao J, Guo Y, Peng X, Li Z, Hu D. Clinical and CT features in pediatric patients with COVID-19 infection: different points from adults. Pediatr Pulmonol. 2020;55 (5): 1169-1174.
5. Götzinger F, Santiago-García B, Noguera JA, Lanaspa M, Lancella L, Calò FI, et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. Lancet Child Adolesc Health. 2020; 4: 653–61.
6. Liguoro I, Pilotto C, Bonanni M, Ferrari ME, Pusiol A, Nocerino A, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur J Pediatr. 2020; 179 (7): 1-18.
7. Martinelli I, Ferrazzi E, Ciavarella A, Erra R, Iurlaro E, Ossola M, et al. Pulmonary embolism in a young pregnant woman with COVID-19. Thrombosis Research. 2020; 191: 36–37.
8. Asociación Española de Pediatría (AEP). Documento de manejo clínico del paciente pediátrico con infección por SARS-CoV-2. Disponible en: https://www.analesdepediatria.org/contenidos/pdf/Recomendaciones_pediatricas_COVID1.pdf?5. Acceso: [29 de septiembre de 2020].
9. Tobien MJ, Laghi F, Jubran A. Why COVID-19 Silent Hypoxemia Is Baffling to Physicians. Am J Respir Crit Care Med. 2020; 202 (3): 356-360. Disponible en: https://doi.org/10.1164/rccm.202006-2157CP. Acceso: [29 de septiembre de 2020].
10. Kache S, Chisti MJ, Gumbo F, Mupere E, Zhi X, Nallasamy K, et al. COVID-19 PICU guidelines: for high- and limited-resource settings. Pediatr Research. 2020. Disponible en: https://doi.org/10.1038/s41390-020-1053-9 Acceso: [7 de octubre de 2020].
11. Grandbastien M, Piotin A, Godet J Abessolo-Amougou I, Ederlé C, Enache I, et al. SARS-CoV-2 Pneumonia in Hospitalized Asthmatic Patients Did Not Induce Severe Exacerbation. Am Acad Allergy, Asthma Immunol. 2020; 8 (8): 2600-07.
12. Papadopoulos NG, Custovic A, Deschildre A, Mathioudakis AG, Phipatanakul W, Wong G, et al. Impact of COVID-19 on pediatric asthma: Practice adjustments and disease burden. J Allergy Clin Immunol: In Practice. 2020; 8 (8): 2592-2599.e3. Disponible en: https://www.sciencedirect.com/science/article/pii/S2213219820305997. Acceso: [29 de septiembre de 2020].
13. Mondéjar-López P, Quintana-Gallego E, Giron-moreno R, Cortell-Aznar I, Ruiz de Valbuena-Maiz M, Diab-Cáceres L, et al. Impact of SARS-CoV-2 infection in patients with cystic fibrosis in Spain: Incidence and results of the national CF-COVID19-Spain survey. Respiratory Medicine 170 (2020) 106062. Disponible en: https://www.resmedjournal.com/article/S0954-6111(20)30202-X/fulltext Acceso: [29 de septiembre de 2020].
14. Escobar LE, Molina-Cruz A, Barillas-Mury C. BCG vaccine protection from severe coronavirus disease 2019 (COVID-19). PNAS. 2020; 117 (30): 17720-26. Disponible en: https://www.pnas.org/lookup/suppl/ doi:10.1073/pnas.2008410117/-/DCSupplemental. Acceso: [29 de septiembre de 2020].
Neurocovid. Sintomatología neurológica asociada a infección por SARS-CoV-2 en niños
Neurocovid. Sintomatología neurológica asociada a infección por SARS-CoV-2 en niños
V. Soto Insuga.
Neuropediatría. Doctor en Medicina. Hospital Infantil Universitario Niño Jesús. Madrid.
Adolescere 2020; VIII (3): 55.e13-55.e19
Resumen
|
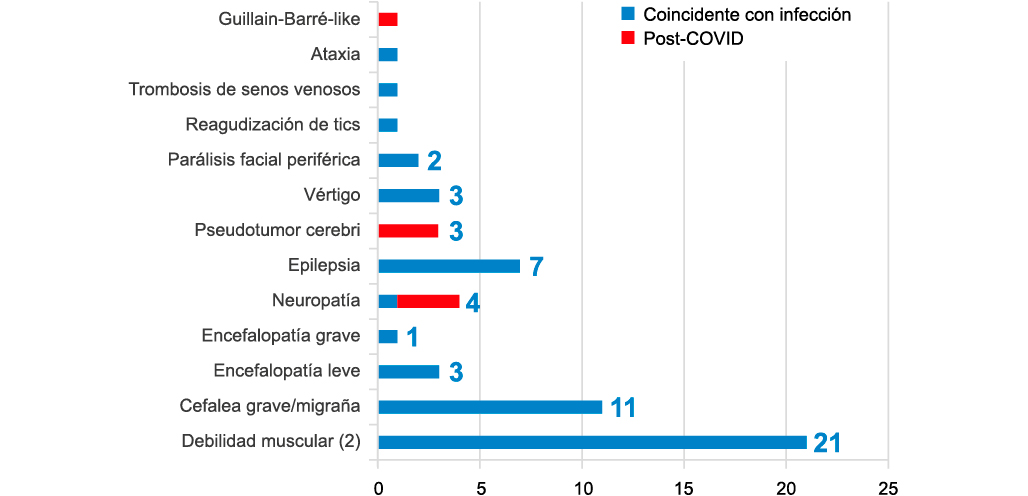
El virus SARS-CoV-2 al igual que otros coronavirus muestra un especial neurotropismo. Esta afectación directa a nivel del sistema nervioso central y periférico unido a su capacidad para activar una intensa respuesta inflamatoria y alterar la vascularización cerebral produce que la infección por SARS-CoV-2 se asocie a diferentes trastornos neurológicos. En adultos, se han descrito especialmente cuadros isquémicos (ictus, hemorragia y trombosis de senos venosos), encefalopatía, anosmia-disgeusia y en menor medida síndrome de Guillain Barre, debilidad muscular y cefalea. En niños destaca la escasa descripción en la literatura de síntomas neurológicos asociados a esta infección aparte de cuadros aislados de neuropatía desmielizante, encefalitis y encefalopatía con edema reversible del cuerpo calloso. En cambio, en el Registro Nacional de Síntomas Neurológicos en Niños asociados a la infección por SARS-CoV-2 (NeuroPedCovid) hemos descrito hasta Junio 2020, 45 niños con síntomas neurológicos que incluyen: debilidad muscular, encefalopatía, hipertensión intracraneal, neuropatías y crisis epilépticas sintomáticas agudas. Aún no conocemos la repercusión a nivel neurológico de la infección por SARS-CoV-2 en niños aunque hasta el momento una gran variedad de síntomas neurológicos parecen ser debidos a esta infección. Palabras clave: SARS-CoV-2; COVID-19; Síntomas neurológicos; Debilidad muscular; Encefalopatía. |
Abstract
|
The SARS-CoV-2 virus, like other coronaviruses, shows a special neurotropism. Its capacity to target the central and peripheral nervous system, together with its ability to activate an intense inflammatory response and alter cerebral vascularization, leads to the association of SARS-CoV-2 infection with various neurological disorders. In adults, ischemic conditions (stroke, hemorrhage and venous sinus thrombosis), encephalopathy, anosmia-dysgeusia and to a lesser extent Guillain Barre syndrome, muscle weakness and headache have been described. In children, the limited description in the literature of neurological symptoms associated with this infection apart from isolated cases of demyelinating neuropathy, encephalitis and encephalopathy with reversible edema of the corpus callosum stand out. On the other hand, in the National Registry of Neurological Symptoms in Children associated with SARS-CoV-2 infection (NeuroPedCovid) until June 2020, 45 children with neurological symptoms have been described, which include: muscle weakness, encephalopathy, intracranial hypertension, neuropathies and acute symptomatic epileptic crises. We still do not know the neurological impact of SARS-CoV-2 infection in children, although so far, a wide variety of neurological symptoms appear to be due to this infection. Key words: SARS-CoV-2; COVID-19; Neurological symptoms; Muscle weakness; Encephalopathy. |
Introducción coronavirus
Los coronavirus son virus de ácido ribonucleico (ARN) encapsulados que generalmente causan enfermedades respiratorias y digestivas en los humanos. Los dos virus recientemente reconocidos incluyen los causantes del síndrome de insuficiencia respiratoria aguda (SARS-CoV-1) y síndrome respiratorio del Este Medio (MERS-CoV). Sin embargo, en diciembre de 2019 surgió en Wuhan, China, el SARS-CoV-2, un virus cuyo análisis genómico muestra que comparte en un 50-80% características homólogas con el resto de coronavirus y que al igual que estos, muestra un marcado neurotropismo.
Patogenicidad de SARS-CoV-2
El SARS-CoV-2 puede producir afectación neurológica de diferentes maneras:
El SARS-CoV-2 puede producir afectación neurológica de diferentes maneras: por invasión directa, por afectación sistémica y por inflamación
Por invasión directa
Aunque actualmente no se ha podido detectar (de forma fiable) el ARN de SARS-CoV-2 a nivel del sistema nervioso central, se han propuesto varias vías de entrada a nivel cerebral. Una sería por vía hematógena mediante alteración de la barrera hemato-encefálica y otra por vía trans-sináptica en la que la afectación neurológica sería de forma retrógrada tras infección de las terminales de los nervios olfatorio (lo que podría explicar los síntomas de anosmia e hipogeusia) o del nervio vago (lo que podría relacionarse con la sintomatología gastrointestinal).
Para la entrada a la célula, el SARS-CoV-2 se une al receptor de la enzima convertidora de angiotensina 2 (ACER2). Se sabe que este ACER2 se detecta en neuronas, células gliales y células endoteliales cerebrales.
Por afectación sistémica
Los pacientes adultos que suelen presentar síntomas neurológicos relacionados con infección por SARS-CoV-2 son los que presentan infecciones más graves que requieren ingresos en unidades de cuidados intensivos. En estos casos, la hipoxia, las alteraciones metabólicas, la afectación cardiaca, muscular y la inmovilización son factores de riesgo independientes de afectación cerebral.
Por inflamación
Uno de los mecanismos fisiopatogénicos más conocidos de SARS-CoV-2 es su gran capacidad para provocar fenómenos inflamatorios mediante activación de una “tormenta de citoquinas”. Parece que los niveles elevados de IL-6, IL-10 y TNF-α están especialmente relacionados con el desarrollo de síntomas más graves. De hecho, tratamientos inmunoduladores como los corticoides o el tocilizumab (anti IL-6) se han propuesto como terapias eficaces. Asimismo la inflamación producida se asocia en gran medida a la aparición de síntomas isquémicos-vasculares secundarios a micro-macroangiopatía así como alteraciones en la coagulación(1).
Sintomatología neurológica asociada a SARS-CoV-2
Sintomatología otros coronavirus
El neurotropismo de otros coronavirus está ampliamente demostrado, de forma que se han relacionado de forma causal con enfermedades del sistema nervioso central y periférico, al igual que se ha demostrado su presencia en líquido cefalo-raquídeo (LCR) y/o biopsia cerebral. De esta forma, el SARS-CoV-1, el MERS-CoV y el OC43 que es un coronavirus estacional, han demostrado ser la causa de distintos trastornos neurológicos entre los que se incluyen: encefalitis, status epiléptico, neuropatía, cuadros de debilidad muscular y diferentes leucoencefalopatías tanto en niños como en adultos(2).
Síntomas neurológicos asociados a infección por SARS-CoV-2 en adultos
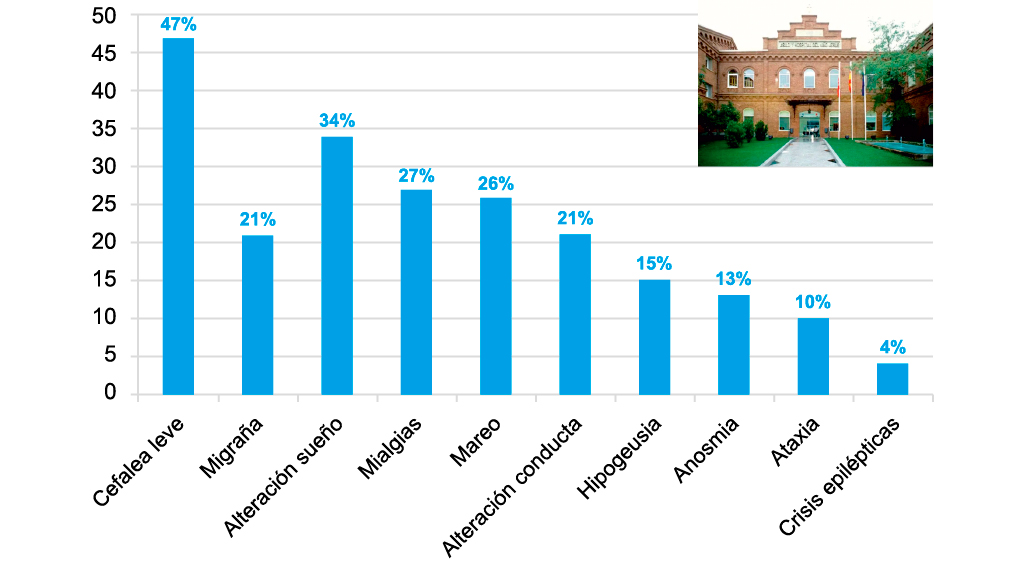
El primer estudio en el que se describen síntomas neurológicos es el realizado por Mao y colaboradores. Estos autores analizan de forma retrospectiva 214 adultos (media 52,7 años) ingresados en la provincia de Wuhan por infección SARS-CoV-2. Describen que el 36,4% presentaron durante la infección algún síntoma neurológico: 10,7% afectación muscular, 2,8% eventos cerebro-vasculares, 7,5% alteración de la conciencia, 16,8% mareo, 13,1% cefalea, 2,3% neuropatía y 0,5% epilepsia(3). En las siguientes series de pacientes con síntomas neurológicos publicadas se comprobó la frecuente asociación de SARS-CoV-2 con trastornos vasculares (isquémicos y/o hemorrágicos) y episodios de encefalitis.
<
Todos estos estudios comparten la conclusión de que los pacientes con cuadros más graves serán los más susceptibles de presentar algún trastorno neurológico
De hecho, en el registro nacional de Reino Unido publicado por Varatharaj y colaboradores en Abril 2020 en el que describen la patología neurológica de 153 pacientes (media 71 años) observaron que 62% habían presentado algún evento cerebrovascular (ictus o hemorraia) y 31% cuadros de encefalitis o encefalopatía(4). Asimismo, en la reciente serie publicada en Septiembre 2020 de 917 pacientes chinos adultos (media de 48,7 años) con infección por SARS-CoV-2 publicada por Xion et al volvieron a observar que entre aquellos que habían presentado síntomas neurológicos (3,5%) las alteraciones isquémicas-hemorrágicas y los cuadros de encefalopatía fueron frecuentes(5). Todos estos estudios comparten la conclusión de que los pacientes con cuadros más graves serán los más susceptibles de presentar algún trastorno neurológico.
Durante todo el año 2020 se han publicado casos aislados o series de pacientes con síntomas neurológicos relacionados con esta infección por coronavirus. Actualmente no se pueden extraer conclusiones definitivas, pero aparentemente parece que hay determinados síntomas neurológicos que se relacionan más con esta infección:
Es complicado poder demostrar la causalidad de esta infección en diferentes síntomas neurológicos debido a que uno de los mecanismos fisiopatogénicos es la activación inmune (que provoca que los síntomas no aparezcan inmediatamente tras el cuadro infeccioso)
- Síntomas que se relacionan con COVID: Encefalopatía, con un probable origen multifactorial de diversa presentación, desde cuadros de encefalitis con signos de piramidalismo (hasta en el 60% de pacientes en Unidades de Cuidados Intensivos) hasta casos de encefalopatía hemorrágica necrotizante. Accidentes cerebro-vasculares (ictus, hemorragia o trombosis de senos venosos), calculándose una incidencia del 2,5-7% en pacientes adultos con infección por coronavirus. Síntomas más leves, probablemente infradiagnosticados, como anosmia (20%) o hipogeusia (49,8%) que se identifican como característicos de esta infección(6).
- Síntomas con asociación por COVID no confirmada: Síndrome de Guillain-Barre; se han descrito 23 pacientes hasta la fecha, sin presentar diferencias respecto a otros polineuropatías asociadas a infecciones, siendo la de tipo desmielinizante la más frecuente. Cefalea con un componente multifactorial, en muchas ocasiones de características migrañosas. Hasta en un 10% de los pacientes se describen síntomas musculares tanto mialgias como debilidad. Síntomas psiquiátricos; las infecciones previas por SARS-Cov-1 y MERS-CoV se relacionaron con una alta frecuencia de cuadros de depresión (32%), trastorno de estrés postraumático (25%) y psicosis. Aunque no se han descrito aún en relación con SARS-CoV-2 son muchos los autores que recomiendan una valoración psicológica en aquellos pacientes que hayan sufrido infecciones graves por COVID-19.
- Síntomas no aparentemente relacionados con COVID: Epilepsia, en los estudios realizados no parece que la infección por SARS-CoV-2 provoque una alta incidencia de crisis sintomáticas agudas ni precipite la aparición de crisis en pacientes con epilepsia. Aunque hay casos descritos, no parace relacionarse con una mayor incidencia de enfermedades desmielinizantes u otros síntomas como tics, ataxia o vértigo. De todas maneras, en muchos casos es complicado poder demostrar la causalidad de esta infección en diferentes síntomas neurológicos debido a que uno de los mecanismos fisiopatogénicos es la activación inmune (que provoca que los síntomas no aparezcan inmediatamente tras el cuadro infeccioso), la presencia de casos asintomáticos y los efectos secundarios o interacciones de determinadas medicaciones empleadas para la infección como la hidroxi-cloroquina, azitromicina o el redemsivir entre otros(1).
Síntomas neurológicos asociados a infección por SARS-CoV-2 en niños
La pandemia COVID ha afectado a nivel neurológico a los niños de tres formas diferentes:
La pandemia COVID ha afectado a nivel neurológico a los niños de tres formas diferentes: por la propia infección, por “efecto distracción “ y por la situación del confinamiento
Afectación por la propia infección
Tras estos meses de pandemia destaca la escasa descripción de trastornos neurológicos en niños. En nuestro centro (Hospital Niño Jesús, Madrid) en cambio, hemos detectado un alto porcentaje de alteraciones neurológicas. De hecho, excluyendo los ingresos por causa oncológica y los menores de un mes de edad hasta Julio 2020, en el 16,6% de los niños hospitalizados, el motivo del ingreso fue algún trastorno neurológico.
Debido a la discrepancia entre lo reflejado en la literatura científica y lo observado en la clínica, y con la colaboración de múltiples hospitales a nivel nacional se ha puesto en marcha un Registro Nacional de Síntomas Neurológicos en Niños con Infección por SARS-CoV-2 (NeuroPedCovid)
Debido a esta discrepancia entre lo reflejado en la literatura científica y lo observado en la clínica, y gracias a la colaboración de múltiples hospitales a nivel nacional hemos puesto en marcha un Registro Nacional de Síntomas Neurológicos en Niños con Infección por SARS-CoV-2 (NeuroPedCovid). En la Figura 1 mostramos los resultados del registro obtenido tras “la primera ola” en Junio 2020 en el que describimos 45 niños (26 confirmados mediante detección de ARN viral con técnica PCR, 8 confirmado mediante serología y 6 pacientes en los que la infección la definimos como “probable” debido al ambiente epidémico y valores analíticos compatibles) con trastornos neurológicos relacionados con infección por SARS-CoV-2. Actualmente el registro sigue activo y abierto a cualquier sanitario que quiera participar.
Considerando lo descrito hasta el momento en la literatura, así como lo recogido en el registro NeuroPedCovid podemos identificar los siguientes síntomas relacionados con infección por SAR-CoV-2, que difieren en parte de las características que presentan los pacientes adultos:
Los síntomas relacionados con infección por SAR-CoV-2 en niños que difieren de las características de los pacientes adultos son: debilidad muscular, encefalopatía, neuropatía, pseudotumor cerebri y S. Guillain-Barré
- Debilidad muscular: aunque no descrito en literatura, hasta Julio 2020 hemos identificado 22 pacientes con un cuadro de debilidad muscular generalizada tras la infección que ocasionaba una impotencia funcional que no explicable por la astenia de la infección ni por la inmovilización durante sus ingresos en UCI. La mayoría requirió un tratamiento específico de fisioterapia, con una resolución del cuadro en menos de un mes, salvo en dos niños que desarrollaron un cuadro de miopatía del paciente crítico con una evolución más tórpida(7).
- Encefalopatía: en el registro de NeuroPedCovid hemos recogido 4 pacientes que presentaron una alteración del nivel de conciencia (en un paciente que presentó un síndrome inflamatorio multisistémico, esta alteración fue grave que requirió ingreso en UCI por la necesidad de sedación y ventilación mecánica). En los últimos meses se han descrito en la literatura cinco pacientes con un cuadro de encefalopatía asociado a síndrome inflamatorio multisistémico en relación con COVID-19 con unas características específicas en forma de una combinación de afectación a nivel del sistema nervioso central (alteración de la conciencia, afectación de pares craneales bajos y en ocasiones desarrollo de crisis epilépticas), sistema nervioso periférico (debilidad muscular y ausencia de reflejos osteo-tendinosos) y una imagen en resonancia de edema citotóxico reversible del cuerpo calloso(8).
- Neuropatía: aunque no se ha descrito hasta el momento, en NeuroPedCovid hemos descrito hasta 5 niños con afectación neuropática: uno con sospecha de neuralgia amiotrófica y 4 con parestesias uni/bilaterales con características de afectación de fibra fina que por su intensidad necesitaron tratamiento específico (amitriptilina o gabapentina).
- Pseudotumor cerebri: tampoco descrito en literatura científica. En cambio, en nuestro registro describimos tres pacientes de 5-6 años de edad que a los 15-20 días de una infección comprobada por SARS-CoV-2 desarrollaron un cuadro de hipertensión intracraneal que les ocasionó diplopía por parálisis del VI par craneal o pérdida de agudeza visual. Todos ellos evolucionaron de forma satisfactoria tras tratamiento con acetazolamida (en tres de ellos) o corticoterapia (en dos de ellos)(9).
- Otros trastornos neurológicos. Se han descrito hasta el momento dos niños de 11 y 15 años que desarrollaron un síndrome de Guillain Barré(10) y en nuestro centro se diagnosticó a una niña de 15 años que desarrolló un cuadro de hipertensión intracraneal secundaria a trombosis de los senos venosos.
- Aunque en el registro de NeuroPedCovid se describen hasta 7 pacientes en los que la infección desencadenó una crisis epiléptica (4 de estos niños no habían presentado previamente ninguna crisis), la infección por SARS-CoV-2 no parece relacionarse con un aumento de frecuencia ni intensidad de epilepsia diferente del de cualquier otra infección, describiéndose en las series de niños con infección por este coronavirus únicamente la incidencia de crisis sintomáticas agudas en el 0,7-3% de los mismos. Por ello actualmente no se recomienda una especial actuación o prevención ante el COVID-19 en niños con epilepsia.
La infección por SARS-CoV-2 no parece relacionarse con un aumento de frecuencia ni intensidad de epilepsia diferente del de cualquier otra infección
- Trastornos de sueño: el 34% de los pacientes ingresados en nuestro centro presentaron insomnio (66%) o una hipersomnia (33%) significativa. Además de la situación de ingreso y ansiedad en relación con la infección, el propio virus parece afectar al sistema circadiano mediante disregulación inmune y alteración de crono-reguladores como BMAL1(11).
- Hay diferentes síntomas neurológicos que no se pueden relacionar hasta el momento con COVID-19 aunque parece existir una relación clínica como es la parálisis facial periférica (de los 22 pacientes analizados en nuestra serie con parálisis facial periférica de inicio entre Marzo-Julio 2020, uno presentaba una infección por SARS-CoV-2).
La Figura 2 muestra la incidencia de síntomas neurológicos en niños con infección por SARS-CoV-2 hasta Julio 2020 destacando el alto porcentaje de cefaleas moderadas-graves de características migrañosas (en la mayoría de los casos en pacientes que no habían presentado cefaleas previas), así como de mareo y ataxia. El desarrollo de anosmia e hipogeusia, aunque menos descritas que en adultos
(13-15%), parecen ser síntomas específicos y característicos de infección.
Afectación por “efecto distracción”
Una de las amenazas que presenta la pandemia de COVID-19 es lo que los grupos de oncología han denominado como “el efecto de distracción”. Este efecto supone que, al desviar la atención preferente a los pacientes infectados por coronavirus, se disminuye la atención al resto de las enfermedades, entre ellas las enfermedades neurológicas.
“El efecto de distracción” supone que, al desviar la atención preferente a los pacientes infectados por coronavirus, se disminuye la atención al resto de las enfermedades, entre ellas las enfermedades neurológicas
Esta disminución en la atención neurológica ha afectado a todos los niveles de asistencia con lo que ha supuesto una gran morbilidad, especialmente en los niños. De esta manera desde Marzo 2020, especialmente durante los meses del confinamiento, hemos asistido a una disminución en las terapias de estimulación específicas, una demora en el inicio de determinados tratamientos inmunomoduladores y un retraso en el diagnóstico de síntomas neurológicos (en parte por el miedo de los padres a consultar en cualquier centro médico por el riesgo de infección).
Afectación por la situación de confinamiento
Las restricciones a la movilidad y la interacción social a las que estamos asistiendo desde el inicio de la pandemia suponen un desafío a la capacidad de resiliencia de los niños, debido a la pérdida de sus sincronizadores sociales, de sus hábitos y horarios habituales así como la secundaria a la ansiedad del núcleo familiar que supone un confinamiento. Muchos expertos advierten de las implicaciones neuro-psicológicas que supondrá para la infancia la situación actual: alteraciones en las habilidades cognitivas, motóricas, de lenguaje y en las funciones ejecutivas(12).
Muchos expertos advierten de las implicaciones neuropsicológicas que supondrá para la infancia la situación actual: alteraciones en las habilidades cognitivas, motóricas, de lenguaje y en las funciones ejecutivas
En este sentido, se ha detectado una mayor frecuencia de síntomas neurológicos relacionados con ansiedad (cefalea tensional, insomnio de mantenimiento y tics), al igual que muchos padres de niños con trastornos del neurodesarrollo (trastorno por déficit de atención e hiperactividad o trastorno del espectro autista entre otros) refieren un empeoramiento de la conducta y ansiedad.
Conclusiones. “Una buena y una mala noticia”
Aún no conocemos la repercusión a nivel neurológico de la pandemia COVID-19 en niños. Aparentemente lo descrito por la literatura hasta el momento es que, al igual que ocurre con los síntomas respiratorios, la sintomatología neurológica en niños es menos frecuente y menos grave que en adultos. Asimismo, el neurotropismo del SARS-CoV-2 no está completamente demostrado, de forma que no se ha podido aislar el ARN de este virus en LCR y hay autores que apuntan a que otros coronavirus afectaban de forma más predominante a nivel cerebral que el SARS-CoV-2. Estos autores calculan que si el porcentaje de afectación neurológica por SARS-CoV-2 fuera el mismo que presentaron otros coronavirus (MERS-CoV y SARS-CoV-1) en Agosto 2020 deberían haberse notificado 9.671 pacientes con trastornos neurológicos cuando en ese momento “solo” se habían descrito 1.805 casos.
A pesar de estos datos optimistas sobre la escasa repercusión neurológica en la infancia de esta infección, debemos tener en cuenta que en muchos de los casos de niños, la sintomatología neurológica puede que esté infradiagnosticada, que comenzamos a conocer cuadros específicos neurológicos en niños (encefalopatía con edema reversible del cuerpo calloso) y que aún no conocemos las posibles secuelas a medio-largo plazo de esta infección, habida cuenta de que muchos de los mecanismos fisiopatogénicos pueden provocar que la sintomatología neurológica aparezca transcurridos unos días, semanas o incluso meses tras la infección.
A pesar de los datos optimistas sobre la escasa repercusión neurológica en la infancia de esta infección, debemos tener en cuenta que en muchos de los casos de niños, la sintomatología neurológica puede que esté infradiagnosticada, o que tarde en aparecer
Por todo ello, actualmente ante una gran variedad de trastornos neurológicos en la infancia debemos considerar su posible relación con la infección por SARS-CoV-2.
Agradecimientos
Queremos agradecer a todos los neuropediatras que participan el Registro NeuroPedCovid*. Asimismo queremos recordar que este registro continúa activo y abierto para cualquier sanitario que quiera participar. En el caso en que quieran formar parte de este registro póngase en contacto con cualquiera de los dos investigadores principales del estudio (Verónica Cantarín o Víctor Soto) en el mail:
neurología.hnjs@salud.madrid.org.
*Neuropediatras que participan en el estudio: doctores Ruiz-Falcó, Gutierrez-Solana, García Peñas, Duat, López Marín, Cantarín, Bernardino, Jiménez, González Alguacil y Soto (Hospital Niño Jesús), doctor García Ron (Hospital Clínico San Carlos Madrid), doctora Chover (Hospital IMED Valencia), doctor Cuevas (Hospital Universitario Jaén), doctor García Campos (Hospital Toledo), doctora Fuentes (Hospital Clínico Santiago Compostela), doctora García (Fundación Alcorcón), doctora Paredes (Hospital Rey Juan Carlos Madrid), doctora Poch (Hospital La Rioja), doctores Llanos y Martín del Valle (Hospital Leganés), doctor Ortiz Medinaveita (Hospital Soria), doctores Paredes y Visa (Hospital Lleida), doctoras Pérez y Polanco (Hospital Gómez Ulla) y neuropediatras del Hospital Son Espases.
Tablas y figuras
Figura 1. Registro de trastornos neurológicos en niños con infección por SARS-CoV-2 (tras la “primera ola”, Registro NeuroPedCovid hasta Junio 2020)
Figura 2. Incidencia de síntomas neurológicos en niños ingresados en Hospital Niño Jesús por infección SARS-CoV-2 (actualizado hasta tras la “primera ola” Junio 2020).
Bibliografía
- Orsini A, Corsi M, Santangelo A, Riva A, Peroni D, Foiadelli T, et al. Challenges and management of neurological and psychiatric manifestations in SARS-CoV-2 (COVID-19) patients. Neurol Sci. 2020;41:2353-2366. Bibliografía recomendada.
- Ellul MA, Benjamin L, Singh B, Lant S, Michael BD, Easton A, et al. Neurological associations of COVID-19. Lancet Neurol. 2020 ;19:767-783.
- Mao L, Jin H, Wang M, Hu Y, Chen S, He Q, et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020;77:683-690.
- Varatharaj A, Thomas N, Ellul M, Davies NW, Pollak T, Tenorio E, et al. Neurological and neuropsychiatric complications of COVID-19 in 153 patients: a UK-wide surveillance study. Lancet Psychiatry. 2020;7:875-882.
- Xiong W, Mu J, Guo J, Lu L, Liu D, Luo J, et al. New onset neurologic events in people with COVID-19 in 3 regions in China. Neurology. 2020;95:1479-1487.
- Helms J, Kremer S, Merdji H, Clere-Jehl R, Schenck M, Kummerlen C, et al. Neurologic Features in Severe SARS-CoV-2 Infection. Engl J Med. 2020;382:2268-2270.
- Jiménez Lejido M, Soto Insuga V, Luján M, Cantarín V, Bernardino B, Mansilla Lozano D, et al. Critical Illness Polyneuromyopathy in a child with SARS-CoV 2 infection. Pendiente de aceptación para su publicación.
- Abdel-Mannan O, Eyre M, Löbel U, Bamford A, Eltze C, Hameed B, Hemingway C, et al. Neurologic and Radiographic Findings Associated With COVID-19 Infection in Children. JAMA Neurol 2020; e202687.
- Soto-Insuga V, Cantarín V, Solís I, Buendía S, Atenca M, Bernardino B, et al. Pseudotumor Cerebri Caused by SARS-CoV-2 Infection in a Boy. Journal of Pediatric Neurology 2020. DOI: 10.1055/s-0040-1715857.
- Khalifa M, Zakaria F, Ragab Y, Saad A, Bamaga A, Emad Y, et al. Guillain-Barré Syndrome Associated With Severe Acute Respiratory Syndrome Coronavirus 2 Detection and Coronavirus Disease 2019 in a Child. J Pediatric Infect Dis Soc. 2020;9:510-513.
- Meira E Cruz M, Miyazawa M, Gozal D. Putative contributions of circadian clock and sleep in the context of SARS-CoV-2 infection. Eur Respir J. 2020;55:2001-2023.
- Condie LO. Neurotropic mechanisms in COVID-19 and their potential influence on neuropsychological outcomes in children. Child Neuropsychol. 2020;26:577-596.
Adolescente con lesiones dermatológicas
Adolescente con lesiones dermatológicas
D. Andina Martínez, M. Bascuas Arribas, S. Vinagre Enríquez.
Servicio de Urgencias. Hospital Infantil Universitario Niño Jesús, Madrid.
Adolescere 2020; VIII (3): 39-44
Resumen
|
Se presenta el caso clínico de un adolescente de 13 años previamente sano, que presentó distintas lesiones en la piel durante el pico de la pandemia por coronavirus y una revisión posterior de la literatura publicada sobre el tema. Palabras clave: SARS-CoV-2; COVID-19; Exantemas; Perniosis; Eritema multiforme |
Abstract
|
The clinical case of a previously healthy 13-year-old adolescent who presented different skin lesions during the peak of the coronavirus pandemic is presented, followed by a review of the published literature on the subject. Key words: SARS-CoV-2; COVID-19; rashes; perniosis; Erythema multiforme. |
Consulta inicial
Los padres de un adolescente de 13 años consultan telefónicamente a finales del mes de marzo de 2020, por la aparición desde hace varios días de lesiones en la piel de predominio en brazos y piernas. Las lesiones son pruriginosas y refieren que no existe afectación de mucosas. Por lo demás refieren que su hijo presenta buen estado general sin otra sintomatología acompañante en el momento actual. En los días previos a la aparición de las lesiones refieren ligera tos y mucosidad que ya se ha resuelto. No ha presentado fiebre. El paciente no tiene ningún antecedente de interés y no ha tenido previamente ninguna enfermedad de la piel. Está correctamente vacunado, no habiendo recibido ninguna vacuna recientemente. No toma ninguna medicación actualmente y no presenta alergias medicamentosas conocidas.
Dado que el paciente presenta buen estado general sin ningún dato de alarma les indicamos a los padres que tomen fotografías de las lesiones y las envíen a una dirección de correo electrónico corporativa del hospital que se habilitó durante el tiempo que duro el estado de alarma para el envío de fotografías y otros documentos por parte de los padres si se consideraba necesario tras una consulta telefónica. Se recibe la siguiente fotografía de las lesiones que presenta el paciente. (Figura 1).
A diferencia del síndrome de Steven Johnson o una necrólisis epidérmica tóxica que se relacionan en la mayoría de los casos con toma de fármacos, el eritema multiforme suele estar en relación con infecciones
En las fotografías se objetiva un exantema maculo papuloso eritematoso pudiéndose objetivar la presencia de lesiones en diana. Dado que el paciente tiene buen estado general sin compromiso sistémico, la afectación se localiza en extremidades de forma simétrica respetando el tronco y no presenta lesiones en las mucosas, se establece el diagnóstico de eritema multiforme. Se descarta con los datos actuales que se trate de un síndrome de Steven Johnson (SST) o una necrolisis epidérmica toxica (NET), entidades que pueden presentar también lesiones en diana y con las que se debe establecer el diagnóstico diferencial.
A diferencia del SSJ o la NET que se relacionan en la mayoría de los casos con toma de fármacos, el eritema multiforme suele estar en relación con infecciones. Aunque las más frecuentemente descritas son Mycoplasma pneumoniae y Virus Herpes Simple, en el contexto epidemiológico actual no se descartó que se debiese a una infección por SARS-CoV-2, pero dada las limitaciones existentes en ese momento de la pandemia se decide no profundizar en el estudio etiológico. Se pauta tratamiento con antihistamínico oral y corticoides tópicos por el intenso prurito acompañante y durante los siguientes días se mantiene contacto telefónico con los padres de la paciente que realizan diariamente fotografías de las lesiones pudiendo observar la resolución de las mismas.
Segunda consulta
Varios días después de la resolución de las lesiones iniciales compatibles con eritema multiforme, los padres del paciente observan la aparición de nuevas lesiones en los dedos de los pies y de los talones. Inicialmente toman fotografías que envían al correo electrónico del hospital pero dado que el color de las mismas se torna violáceo aumenta su preocupación y deciden acudir al Servicio de Urgencias para valoración. A su llegada el paciente presenta buen estado general y la exploración física por aparatos es normal salvo por la presencia de las lesiones cutáneas referidas. Las constantes son normales para la edad. Se solicita a los padres consentimiento informado para la toma de fotografías del paciente. (Figuras 2 y 3. Lesiones acrales tipo perniosis).
El paciente presenta lesiones acrales localizadas en los dedos de los pies y ambos talones. Son lesiones maculares eritemato-violáceas, edematosas, alguna de ellas ulceradas y con descamación superficial. Dada las características de las lesiones y lo novedoso del cuadro se decide realizar una analítica de sangre con hemograma, bioquímica, coagulación y Dímero-D. Los resultados de las pruebas analíticas son normales. Aunque en el mes de abril de 2020 la prueba de reacción en cadena de la polimerasa (PCR) para SARS-CoV-2 se restringía a pacientes con cuadros graves que precisaban ingreso, se solicita permiso para realizar dicha prueba al paciente con objeto de tratar de filiar la etiología de las lesiones.
Tras realizarse la prueba PCR y dado el buen estado general y la normalidad de la exploración física y los resultados analíticos se decide dar de alta al paciente con el diagnóstico de “lesiones acrales eritemato-violáceas” y “caso sospechoso de infección por coronavirus”. Se indica aislamiento del paciente y cuarentena domiciliaria de todos los contactos estrechos.
Evolución y seguimiento en consulta de Dermatología
A las 24 horas se recibe el resultado del test PCR que es negativo para SARS-CoV-2. Se contacta telefónicamente con los padres para indicarles el resultado negativo de la prueba, aunque debido a la acumulación de casos similares que se están atendiendo en un corto periodo de tiempo en el Servicio de Urgencias se sigue considerando que las lesiones pueden deberse a una infección por coronavirus. Se decide citar para seguimiento en una semana.
En consulta de dermatología las lesiones presentan las mismas características y han aumentado ligeramente en extensión, por lo que se decide realizar una biopsia de las mismas tras solicitar el consentimiento informado. Se cita de nuevo en consulta en una semana para ver la evolución y retirada del punto de sutura.
En el control realizado la semana siguiente las lesiones han mejorado. Se explica a los padres que los hallazgos de la anatomía patológica son compatibles con perniosis, lo que comúnmente se conoce como “sabañones”. Quedan pendiente los estudios de inmunohistoquímica que se van a realizar conjuntamente con los Servicios de Anatomía Patológica de otros hospitales de la Comunidad de Madrid.
Se realizan controles telefónicos semanales y a través de las fotografías que envían los padres se observa la resolución de las lesiones sin necesidad de ningún tratamiento específico sistémico ni tópico. Finalmente se reciben los resultados del estudio de inmunohistoquímica y estos muestran positividad para SARS‐CoV‐2 en células endoteliales y en células epiteliales de las glándulas ecrinas lo que apoya la sospecha diagnóstica inicial.
Durante la segunda y tercera semana de abril de 2020 acuden al Servicio de Urgencias decenas de niños y adolescentes con lesiones similares a las descritas en este caso clínico. De forma conjunta, los profesionales del Servicio de Urgencias, Servicio de Dermatología y Servicio de Anatomía Patológica diseñan un proyecto de investigación que obtiene el aval del Comité de Ética del Hospital Infantil Universitario Niño Jesús y fruto de dicho trabajo se publican varios artículos cuyos resultados se resumen a continuación.
Discusión
Lesiones tipo perniosis (“sabañón”)
El primer artículo publicado es una revisión retrospectiva de los 22 primeros pacientes atendidos en el Servicio de Urgencias del Hospital Niño Jesús de Madrid entre el 6 y el 17 de abril de 2020(1). Todos presentan lesiones maculosas eritemato violáceas o purpúricas en los pies aunque tres pacientes presentan las mismas lesiones también en las manos. Se trata de 13 varones y 9 mujeres con una media de edad de 12 años (rango: 6-17). Las lesiones habían aparecido una mediana de 7 días antes de acudir al Servicio de Urgencias. En 12 de los casos referían un contacto estrecho domiciliario con un caso sospechoso de COVID-19 y en un caso el contacto estrecho era con un caso confirmado de COVID-19. Dos pacientes eran hermanos. Es importante apuntar que durante la primera oleada de la pandemia las pruebas PCR se restringían a cuadros que precisaban ingreso por lo que la mayoría de los casos sospechosos no se podían confirmar.
Respecto a la presencia de sintomatología sistémica, 9 de ellos referían sintomatología respiratoria previa de carácter leve (tos y/o rinorrea) previa al inicio de las lesiones mientras que 2 de ellos referían sintomatología digestiva leve en forma de dolor abdominal o diarrea. Además la mayoría de los pacientes referían síntomas locales en forma de prurito(9) o dolor(7). Se realizó analítica de sangre en 18 pacientes siendo normales todas las pruebas realizadas de coagulación, Dímero D, hemograma y bioquímica. Únicamente cabe reseñar un paciente con un valor elevado de Dímero D de 900 ng/ml cuando el valor normal del laboratorio es menor de 500 ng/ml pero que no tuvo ninguna significación clínica y en que el resto de las pruebas eran normales. Se realizó PCR para SARS-CoV-2 en 19 de los pacientes y solo en uno de ellos la prueba resultó positiva.
La sintomatología previa era respiratoria leve o digestiva en forma de dolor abdominal y diarrea
El seguimiento a todos ellos fue de forma presencial en la consulta de dermatología salvo en uno de ellos que solo se realizó seguimiento telefónico. Se practicó biopsia en 6 de los pacientes incluidos en el estudio, obteniéndose en todos ellos hallazgos de anatomía patológica compatibles con perniosis. El seguimiento de los pacientes mostró mejoría progresiva de las lesiones en todos ellos sin necesidad de tratamiento específico tópico ni sistémico con resolución de las mismas en un periodo de 6 a 8 semanas. Es importante señalar que algunos pacientes refirieron durante las primeras semanas de evolución de las lesiones periodos en que las lesiones eran más marcadas y el prurito o el dolor más intenso que mejoraban en días posteriores.
Durante el mes de mayo, al mismo tiempo que se publicaba este artículo, aparecieron otros artículos con series de pacientes pediátricos con lesiones similares tanto de España como de otros países(2,3). Todas las series mostraban hallazgos similares respecto a la epidemiología, clínica, resultados analíticos, hallazgos anatomopatológicos y evolución de las lesiones. En lo concerniente a los hallazgos microbiológicos la mayoría de los pacientes de las distintas series publicadas presentaban una PCR negativa para SARS-CoV-2. Además, en los trabajos que aportaban el resultado de test serológicos que medían anticuerpos Ig M e Ig G, estos también eran con frecuencia negativos.
Los hallazgos microbiológicos en la mayoría de los pacientes presentaban una PCR negativa, y en la mayoría unos anticuerpos también negativos
En el mes de junio fruto de un trabajo conjunto en el que participan, además de los profesionales del Hospital Niño Jesús, los Servicios de Anatomía Patológica de la Fundación Jiménez Díaz y del Hospital Doce de Octubre se publica un segundo artículo que aporta nuevas evidencias sobre la etiología de estas lesiones(4). Se incluyen siete pacientes con lesiones acrales (6 pacientes ya estaban incluidos en el anterior artículo y un paciente nuevo) a los que en el material de biopsia además de las técnicas habituales se practican técnicas de inmuno-histoquímica. Además, la muestra del último paciente incorporado a la serie se procesa para ser visualizada por microscopia electrónica.
El trabajo muestra como por técnicas de inmuno-histoquímica en todos los pacientes con lesiones pernióticas acrales se aprecia positividad para SARS‐CoV‐2 en células endoteliales y en células epiteliales de las glándulas ecrinas. Por último, en la muestra que se visualiza por microscopia electrónica se objetivan partículas de coronavirus en el citoplasma de células endoteliales. Dichos hallazgos apoyarían por tanto la implicación de SARS-CoV-2 en el daño endotelial que provoca el desarrollo de estas lesiones en niños, adolescentes y adultos jóvenes.
Respecto a los resultados negativos de las pruebas microbiológicas habituales, la negatividad frecuente de la técnica de PCR podría estar en relación con el momento de la realización de la prueba y el carácter leve del cuadro. Tanto si se toma como referencia el momento de la aparición de las lesiones cutáneas, o lo que sería más adecuado, el momento en que presentaron la sintomatología sistémica aquellos que la refirieron, se observa que prácticamente todas las pruebas PCR en los pacientes se realizan más de una semana después del inicio de la clínica por lo que en cuadros leves como este lo normal es que la PCR resultase ya negativa.
Por su parte, la negatividad de la serología podría deberse al tipo de técnica ya que en muchos artículos se utilizaron test rápidos que son menos sensibles, al momento de realización de la técnica ya que hay que tener en cuenta la evolución normal de los valores de Ig G así como al carácter leve del cuadro. Por último, es posible que el tipo de respuesta inmune generada en estos pacientes difiera en parte de la que presentan los pacientes que no desarrollan lesiones cutáneas. Respecto a esta posibilidad es interesante, la positividad para Ig A con negatividad para Ig G descrita en varios estudios recientes en pacientes con lesiones pernióticas acrales(5).
Sin embargo, cabe resaltar que sigue existiendo un profundo debate sobre la etiología de estas lesiones ya que otros autores han obtenido resultados distintos aplicando técnicas similares por lo que se está a la espera de que en los próximos meses nuevas evidencias aporten mayor certeza sobre la fisiopatología de estas lesiones(6).
Lesiones tipo eritema multiforme
Cuatro de los pacientes que presentaron lesiones pernióticas acrales presentaron antes de la aparición de estas lesiones o coincidiendo con la aparición de las mismas, lesiones compatibles con eritema multiforme y se recogieron en un tercer artículo(7). Estas lesiones se localizaban de forma simétrica en extremidades superiores e inferiores y de forma más marcada en codos, rodillas y dorso de manos. Eran pruriginosas y no asociaban lesiones en mucosas. Además de antihistamínicos orales, uno de los pacientes precisó tratamiento con corticoides tópicos y otro con corticoides orales por el intenso prurito acompañante.
Las lesiones tipo eritema multiforme se localizaron de forma simétrica en extremidades superiores e inferiores, y de forma más marcada en codos, rodillas y dorso de manos
El vínculo con la infección por SARS-CoV-2 se establece porque uno de los cuatro pacientes presentó PCR positiva, por la coincidencia en el mismo paciente de lesiones de perniosis y de eritema multiforme y por los hallazgos de inmuno-histoquímica obtenidos en los dos pacientes en los que se realizó biopsia de estas lesiones.
Otras lesiones
Desde el inicio de la pandemia se ha prestado especial atención a las lesiones dermatológicas que presentan los pacientes con infección por SARS-CoV-2. En población adulta un estudio multicéntrico español frecuentemente referenciado trató de clasificar los exantemas en cinco categorías: vesicular, urticarial, maculo-papular, livedo o necrosis y lesiones pernióticas(8).
En niños y adolescentes la literatura es más escasa y se trata en la mayoría de los artículos publicados de casos clínicos aislados, a excepción de las ya mencionadas series de pacientes con lesiones pernióticas acrales. De este modo se han descrito, en pacientes con infección confirmada por SARS-CoV-2, al igual que en adultos lesiones de urticaria aguda, exantemas maculo papulosos, exantemas vesiculares y exantemas maculo eritematosos(9,10,11).
Por último, es importante señalar que pueden aparecer lesiones cutáneas en los pacientes pediátricos afectos del Síndrome Inflamatorio Multisistémico Pediátrico vinculado a SARS-CoV-2 (SIM-PedS) por lo que en el contexto epidemiológico actual ante un niño o un adolescente con fiebre y lesiones cutáneas se debe incluir en el diagnóstico diferencial esta nueva entidad diagnóstica(12).
Ante un adolescente con fiebre y lesiones cutáneas se debe incluir en el diagnóstico diferencial del SIM-PedS
Tablas y figuras
Figura 1. Eritema multiforme
Figura 2. Lesiones acrales tipo perniosis
Figura 3. Lesiones acrales tipo perniosis
Bibliografía
- Andina D, Noguera-Morel L, Bascuas-Arribas M, Gaitero-Tristán J, Alonso-Cadenas JA, Escalada-Pellitero S, et al. Chilblains in children in the setting of COVID-19 pandemic. Pediatr Dermatol. 2020 May;37(3):406-411.
- Colonna C, Monzani NA, Rocchi A, Gianotti R, Boggio F, Gelmetti C. Chilblain-like lesions in children following suspected COVID-19 infection. Pediatr Dermatol. 2020 May;37(3):437-440.
- Cordoro KM, Reynolds SD, Wattier R, McCalmont TH. Clustered cases of acral perniosis: Clinical features, histopathology, and relationship to COVID-19. Pediatr Dermatol. 2020 May;37(3):419-423.
- Colmenero I, Santonja C, Alonso-Riaño M, Noguera-Morel L, Hernández-Martín A, Andina D, et al. SARS-CoV-2 endothelial infection causes COVID-19 chilblains: histopathological, immunohistochemical and ultrastructural study of seven paediatric cases. Br J Dermatol. 2020 Oct;183(4):729-737.
- Diociaiuti A, Giancristoforo S, Terreri S, Corbeddu M, Concato C, Ciofi Degli Atti M, et al. Are SARS-CoV-2 IgA antibodies in pediatric patients with chilblain-like lesions indicative of COVID-19 asymptomatic or paucisymptomatic infection? J Eur Acad Dermatol Venereol. 2020 Sep 13.
- Wetter DA. Illuminating, through immunohistochemistry, the link between SARS-CoV-2 and pernio (chilblains). Br J Dermatol. 2020 Oct;183(4):611.
- Torrelo A, Andina D, Santonja C, Noguera-Morel L, Bascuas-Arribas M, Gaitero-Tristán J, et al. Erythema multiforme-like lesions in children and COVID-19. Pediatr Dermatol. 2020 May;37(3):442-446.
- Galván Casas C, Català A, Carretero Hernández G, Rodríguez-Jiménez P, Fernández-Nieto D, Rodríguez-Villa Lario A, et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol. 2020 Jul;183(1):71-77.
- Genovese G, Colonna C, Marzano AV. Varicella-like exanthem associated with COVID-19 in an 8-year-old girl: A diagnostic clue? Pediatr Dermatol. 2020 May;37(3):435-436.
- Ortiz Madinaveitia S, Peñalver Penedo R, Romero Gil R, Serrano Madrid ML. Lesiones cutáneas en paciente con infección por SARS-COV-2 An Pediatr (Barc). 2020 Aug;93(2):144-145.
- Morey-Olivé M, Espiau M, Mercadal-Hally M, Lera-Carballo E, García-Patos V. Manifestaciones cutáneas en contexto del brote actual de enfermedad por coronavirus 2019. An Pediatr (Barc). 2020;92(6):374-375.
- Nijman RG, De Guchtenaere A, Koletzko B, Ross Russell R, Copley S, Titomanlio L, et al. Pedia-tric Inflammatory Multisystem Syndrome: Statement by the Pediatric Section of the European Society for Emergency Medicine and European Academy of Pediatrics. Front Pediatr. 2020 Aug 28;8:490. doi: 10.3389/fped.2020.00490. PMID: 32984206; PMCID: PMC7485110.
Urgencias: dolor abdominal y fiebre
Urgencias: dolor abdominal y fiebre
M.J. Martín Díaz.
Facultativo Especialista de Área en Pediatría en la Unidad de Urgencias del Hospital Universitario Infantil Niño Jesús, Madrid.
Adolescere 2020; VIII (3): 31-38
Resumen
|
La atención de todo paciente pediátrico en urgencias debe comenzar con una primera evaluación rápida a través del triángulo de evaluación pediátrica (TEP), que detectará los pacientes inestables. En este grupo de pacientes hay que continuar inmediatamente tomando las constantes vitales y valorando el ABCD para seguir lo antes posible con las medidas de estabilización adecuadas. Hay patologías que comparten síntomas y signos clínicos, precisando una estabilización inicial muy parecida, aunque es importante realizar un buen diagnóstico diferencial para establecer después un tratamiento específico. La actual pandemia por la infección por SARS-CoV-2, ha dejado en los niños y adolescentes un cuadro clínico denominado Síndrome Inflamatorio Sistémico Asociado a SARS-CoV-2 (en inglés las siglas PIMS), que comparte características con la enfermedad de Kawasaki, el síndrome de shock tóxico, el síndrome de activación macrofágica y cuadros de dolor abdominal y fiebre. Su diagnóstico se realiza con criterios clínicos y analíticos y se trata con inmunomoduladores, aunque es una patología todavía poco conocida, en la que seguramente van a ir surgiendo cambios a medida que aumenten los casos. Palabras clave: Dolor abdominal; Fiebre, Shock; PIMS (paediatric inflammatory multisystem syndrome); MIS-C (multisystem inflammatory syndrome in children); SIM (síndrome inflamatorio multisistémico). |
Abstract
|
The care of all pediatric patients in the ED should begin with a first rapid assessment through the pediatric assessment triangle (PAT), which will detect unstable patients. In this group of patients, it is necessary to immediately evaluate vital signs and assess the ABCD, followed as soon as possible with the appropriate stabilization measures. There are pathologies that share symptoms and clinical signs, requiring a very similar initial stabilization, although it is important to make a good differential diagnosis to later establish a specific treatment. In children and adolescents, the SARS-CoV-2 infection has revealed an entity called Paediatric inflammatory multisystem syndrome (PIMS), which shares similar characteristics with Kawasaki disease, toxic shock syndrome, macrophage activation syndrome and clinical pictures of abdominal pain and fever. Its diagnosis is made upon clinical and analytical criteria and it is treated with immunomodulators, although it is still a quite unknown pathology, in which changes will surely emerge as the cases increase. Key words: Abdominal pain; Fever; Shock; PIMS (pediatric inflammatory multisystem syndrome); MIS-C (multisystem inflammatory syndrome in children); SIM (multisystemic inflammatory syndrome). |
Motivo de consulta
Varón de 15 años de edad, que consulta en urgencias el 24 de agosto de 2020, por fiebre y dolor abdominal. En triaje presenta un triángulo de evaluación pediátrica (TEP) estable y se clasifica como un nivel de prioridad 3. Pasa a la consulta de urgencias, donde se procede a realizar una anamnesis completa, siguiendo el acrónimo SAMPLE (Simptoms, Alergies, Medicines, Past, Last intake, Events):
Síntomas: fiebre de hasta 40ºC, dolor abdominal, vómitos y diarrea de 72 horas de evolución. Está orinando poco.
Alergias: Sin alergias conocidas.
Fármacos: Ha tomado paracetamol e ibuprofeno para la fiebre. Ninguna medicación crónica.
Antecedentes personales: Previamente sano. Vacunado correctamente.
Última ingesta: No ha comido nada en las últimas 15 horas, ha tomado algo de agua con mala tolerancia.
Acontecimientos: pandemia de COVID-19. Vive con sus padres y 3 de sus 5 hermanos. Una hermana que no vive con ellos tuvo fiebre un mes antes, con PCR (reacción en cadena de la polimerasa) positiva a SARS-CoV-2 (no se realizó PCR al paciente ni sus convivientes, que han estado asintomáticos).
SE REALIZA UNA EXPLORACIÓN FÍSICA COMPLETA:
Peso: 58,1 kg. Tª (temperatura) 37,4ºC. TA (tensión arterial): 84/ 44 mm Hg. FC (frecuencia cardíaca): 101 lpm. Sat O2 (saturación de oxígeno) 96%. FR (frecuencia respiratoria) 18 rpm.
Buen estado general. Sin aspecto séptico. Mucosa oral pastosa. Palidez de mucosas (es de origen afrocaribeño y es difícil de valorar la coloración). Ictericia conjuntival. Relleno capilar de 2-3 segundos. Sin exantemas ni petequias. Auscultación cardiopulmonar: normal. Abdomen blando y depresible, doloroso de forma generalizada a la palpación, sin defensa; sin masas ni visceromegalias. Neurológico: consciente y orientado, no rigidez de nuca, signos meníngeos negativos. ORL: normal. Valoración del dolor (escala numérica): 7/ 10. Escala de Gorelick: 2-3.
SE REEVALÚA EL CASO: aunque había sido clasificado como un paciente estable, se objetiva después palidez que no se había apreciado en la valoración inicial y relleno capilar de 2-3 segundos. EL DIAGNÓSTICO SINDRÓMICO sería por tanto shock, con taquicardia e hipotensión arterial, por tanto shock descompensado.
EL SIGUIENTE PASO A SEGUIR SERÍA SU ESTABILIZACIÓN: canalizar una vía venosa periférica y comenzar a administrar suero salino fisiológico 20 ml/kg vía IV (intravenosa) en 10-15 minutos, administrar oxígeno en gafas nasales (aunque tiene una saturación de Os2 normal está indicado por estar en shock), y monitorizar (de forma continua la FC, y cada 5-10 minutos la TA, así como los signos clínicos de shock: estado mental, coloración, relleno capilar, sin olvidar la auscultación cardíaca y pulmonar, por el riesgo de sobrecarga de volumen, en especial en pacientes con signos de infección).
Se trata por tanto de un varón de 15 años, con un cuadro febril con síntomas abdominales, con signos de deshidratación y shock, en agosto de 2020, con el antecedente de un contacto estrecho hace 4 semanas con un paciente con COVID-19 confirmada.
Nos planteamos el DIAGNÓSTICO DIFERENCIAL con los cuadros más probables que pueden dar estos síntomas:
Gastroenteritis aguda con deshidratación. Sería la causa más probable por frecuencia. La mayoría de estos cuadros son de origen viral, con fiebre de menor grado y menos duración que en el caso que nos ocupa, aunque hay gastroenteritis invasivas de origen bacteriano que sí cursan con fiebre alta durante varios días.
Sepsis de origen abdominal. Los signos de inestabilidad hemodinámica que presenta el paciente podrían ser causa de la hipovolemia debida a la deshidratación, pero también podrían deberse a un cuadro séptico, que por los síntomas acompañantes, podría ser de origen intestinal.
Abdomen agudo (apendicitis aguda lo más frecuente). En los cuadros de abdomen agudo suele prevalecer el dolor abdominal sobre otros síntomas y signos como la fiebre, la diarrea y los vómitos. Aunque hay cuadros de evolución atípica, como los abscesos apendiculares encapsulados, en los que la fiebre alta puede ser el signo principal. En la exploración se encuentra el abdomen con dolor generalizado, aunque blando sin defensa ni otros signos de irritación peritoneal. Habrá que vigilar estrechamente la evolución de los síntomas y la exploración física y si es necesario solicitar pruebas complementarias para descartar un abdomen agudo.
En los cuadros de abdomen agudo suele prevalecer el dolor abdominal y signos como la fiebre, la diarrea y los vómitos
- COVID-19 (coronavirus disease 19). Aunque la infección aguda por SARS-CoV-2 puede cursar con síntomas digestivos y fiebre, no es lo más habitual en adolescentes. En todo caso la sintomatología de esta infección está demostrando ser muy variopinta y es obligado descartarla en el contexto epidemiológico en que se presenta el paciente. Hay que tener en cuenta el antecedente de un contacto estrecho en las semanas anteriores.
- Síndrome pediátrico inflamatorio multisistémico asociado a SARS-CoV-2 (PIMS-TV del inglés “paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2“). La fiebre alta, los síntomas abdominales, los signos de shock, el antecedente de un contacto estrecho ya hace más de 2 semanas con otro paciente con COVID-19 (lo cual hace más probable que nuestro paciente haya pasado una infección pauci o asintomática), deben hacernos pensar en esta patología. Por lo inespecífico de su presentación clínica, en especial en los casos que no son graves, habrá que buscar los criterios diagnósticos clínicos y analíticos.
Considerando principalmente estos diagnósticos, se solicitan las siguientes PRUEBAS COMPLEMENTARIAS:
- Hemograma, proteína C reactiva (PCR), procalcitonina (PCT), hemocultivo. En busca de datos de infección bacteriana y/o de inflamación sistémica. Se solicitan además urocultivo y coprocultivo a la espera de obtener muestras.
- Bioquímica sérica, dirigida a evaluar el grado de deshidratación y a comprobar si se cumplen los criterios de PIMS.
- Coagulación: por la posibilidad de que precise una intervención quirúrgica si se trata de un cuadro de abdomen agudo y también por la posibilidad de un PIMS.
- Ecografía abdominal: para descartar abdomen agudo.
- Pruebas de detección de infección por SARS-CoV-2: PCR y serología.
- EL PACIENTE PERMANECE EN OBSERVACIÓN. Tras el bolo inicial de suero salino fisiológico (SSF) presenta TA similar a la previa, con valores entre 80 y 85 mm de Hg de sistólica y en torno a 45 mm de Hg de diastólica, con FC de 100-110 lpm. Refiere que el dolor abdominal ha empeorado, está poco activo, nauseoso aunque no vomita ni realiza deposición. Se inicia tratamiento con cefotaxima IV por la posibilidad de un cuadro séptico.
Se obtienen los siguientes RESULTADOS DE LABORATORIO:
- Hematimetria: Hematocrito 40.4 % (37.3 – 47.3). Hemoglobina 13.2 g/dl (11 – 15.6). Leucocitos 14.84 x1000/µL (4.5 – 13). Neutrófilos 13.01 x1000/µL (1.5 – 8); 87.7 % (38 – 70). Linfocitos 0.67 x1000/µL (1.5 – 5.2); 4.5 % (28 – 48). Monocitos 0.66 x1000/µL (0.2 – 1); 4.5 % (0 – 5). Basófilos 0.04 x1000/µL (0 – 0.1); 0.3 % (0 – 1). Eosinófilos 0.11 x1000/µL (0.1 – 1); 0.7 % (0 – 3). Plaquetas 162 x1000/µL (150 – 400).
- Bioquímica Sérica: Glucosa 141 mg/dL (60 – 100). Urea 71.8 mg/dL (19 – 45). Creatinina 1.46 mg/dL (0.4 – 1). Gamma GT 52 U/L (8 – 50). Sodio 127 mEq/L (135 – 145). Potasio 5.1 mEq/L (3.5 – 5.5). Transaminasa GOT 184 U/L (15 – 47). Transaminasa GPT 80 U/L (13 – 44). PCR 40.92 mg/dl (0-0,5). PCT 30.68 ng/mL (0-0,5).
- Fibrinógeno 619 mg/dl. Tiempo de cefalina 33 segundos. Control tiempo de cefalina 26.4 segundos. Ratio de cefalina 1.25. Indice de Protrombina 81 % INR 1.13.
ANTE LA SOSPECHA DE PIMS SE AMPLÍAN LAS DETERMINACIONES ANALÍTICAS, dirigidas al diagnóstico de esta entidad:
- Gasometría venosa: pH 7.37, pCO2 39 mmHg, HCO3 22 mmol/l, BEb 2 mmol/l, Hb 12.3 g/dl, Na 133 mmol/l, K 4.4 mmol/l, Ca++ 1.15 mmol/l, Láctico 1.9 mmol/l, Glucosa 127 mg/dl.
- Albumina 3.7 g/dL Bilirrubina total 5.13 mg/dL (0.2 – 1.3). Bilirrubina conjugada 1.79 mg/dL (0 – 0.3). Creatin fosfoquinasa (CPK) 1324 U/L Lactatodeshidrogenasa (LDH) 307 U/L Troponina T alta sensibilidad( cTnT-hs) 647.4 ng/L Péptido natriurético cerebral (pro-BNP) 16211 pg/mL
Se realiza la ecografía abdominal: signos de ileítis y adenitis inespecíficas.
Con la sospecha de PIMS, se inicia tratamiento con metilprednisolona IV a 2 mg/kg/día. Permanece en observación monitorizado, con taquicardia y tensión arterial por debajo de los límites de la normalidad para su edad, llegando a mínimos de 70/ 43 mm de Hg, con FC de 110 lpm. Se repite otra expansión con SSF (20 ml/ kg) y se consulta con los especialistas en Cuidados Intensivos Pediátricos, decidiéndose su ingreso en su Unidad (UCIP).
Juicio clínico
La PCR para SARS-CoV-2 es positiva y la serología (test rápido) IgG +, IgM –
Evolución
En las primeras horas de su estancia en UCIP precisa de nuevo expansión de volumen (hasta 1,5 litros de SSF en total), con estabilización hemodinámica a partir de las 12 horas del ingreso. Se mantiene oxigenoterapia en gafas nasales a 2 lpm por los signos de shock y porque el paciente refiere sensación de dificultad respiratoria, pudiéndose retirar a las 12 horas. Se realiza una radiografía de tórax, donde no se aprecian infiltrados ni consolidaciones pulmonares; tampoco signos de sobrecarga cardíaca.
Se completa el estudio realizando un ecocardiograma, donde se encuentra una estructura y función cardíaca normales, con una fracción de eyección del 60%.
Se mantienen el tratamiento con cefotaxima y metilprednisolona iniciados en urgencias. Recibe además tratamiento con heparina de bajo peso molecular como profilaxis antitrombótica.
La función renal se normaliza con la administración de volumen. Alcanza un máximo en las cifras de troponina de 1324 ng/L a las 48 horas de su ingreso, con valoraciones diarias por cardiología, en las que se observa una función cardíaca normal de forma estable. Los datos de disfunción hepática (hipertransaminasemia con hiperbilirrubinemia), se normalizan a las 48 horas de ingreso.
Por la buena evolución clínica y analítica se disminuye la dosis de corticoides a las 36 horas de su ingreso y es dado de alta a sala de hospitalización el día 28 de agosto. Completa el tratamiento con 10 días de cefotaxima, siendo el hemocultivo, el urocultivo y el coprocultivo negativos. Es dado de alta a domicilio el día 4 de septiembre. Se indica continuar con la heparina a dosis profilácticas hasta completar 14 días tras realizar interconsulta con hematología. Se realiza control en consulta de cardiología el día 30 de septiembre, con ECG y ecocardiograma normales.
Discusión del caso
La atención de los pacientes pediátricos que consultan en urgencias debe comenzar por una evaluación rápida inicial, que se sistematiza con el Triángulo de Evaluación Pediátrica: valorar por la simple observación del paciente, sin necesidad siquiera de tocarlo, su función cerebral (Apariencia), su respiración (signos de dificultad Respiratoria: ruidos respiratorios anormales o presencia de tiraje) y su circulación (Color de piel y mucosas). La alteración de cualquiera de estos lados del triángulo nos alerta de estar ante un paciente inestable, con la posibilidad de los siguientes diagnósticos sindrómicos ya en la valoración inicial:
La atención de los pacientes pediátricos que consultan en urgencias debe comenzar por una evaluación rápida inicial, que se sistematiza con el Triángulo de Evaluación Pediátrica
Todos los lados normales: paciente estable.
- Apariencia alterada: disfunción del sistema nervioso central.
- Respiración alterada: dificultad respiratoria.
- Circulación alterada: shock.
- A + R alteradas: fallo respiratorio.
- A + C alteradas: shock descompensado (fallo circulatorio).
- A + R + C: fallo cardiorrespiratorio (riesgo de parada).
A continuación se realizará una valoración más profunda, comenzando por la toma de las constantes vitales (incluyendo siempre la glucemia en los pacientes con la apariencia alterada), y evaluando clínicamente estas funciones siguiendo la secuencia clásica del ABCD (vía aérea, respiración, circulación y función neurológica). Después (y si puede ser al mismo tiempo) hay que realizar una anamnesis completa y una exploración física detallada que nos ayuden a llegar a un diagnóstico más preciso. Ante cualquier signo de disfunción en esta evaluación, hay que estabilizar lo antes posible al paciente: los pacientes en shock precisan la canalización de al menos una vía venosa periférica y comenzar con la administración de volumen con cristaloides (excepto en los casos con signos de fallo cardíaco)(1).
Es fundamental monitorizar la evolución del paciente con las constantes vitales y con los signos clínicos. En este caso estaría indicado la monitorización continua de la FC, la toma programada y frecuente de la TA, el control de la diuresis y la reevaluación clínica (coloración, tiempo de relleno capilar, auscultación cardiopulmonar, nivel de consciencia).
Una vez que se llevan a cabo las medidas encaminadas a la estabilización del paciente, hay que tratar de llegar a un diagnóstico que nos conduzca a un tratamiento etiológico si existe, o por lo menos dirigido a una patología en concreto. Para ello en ocasiones se necesitan exploraciones complementarias orientadas según el diagnóstico diferencial que se plantee en cada caso.
La mayoría de los niños con infección por SARS-CoV-2 presentan síntomas leves. Sin embargo, después de la “primera ola” de la pandemia de la enfermedad por el SARS-CoV-2, se identificó un pequeño porcentaje de pacientes pediátricos que desarrolla una respuesta inflamatoria sistémica exagerada, haciendo preciso en la mayoría de los casos su atención en UCIP y soporte circulatorio de distinto nivel. Este síndrome ha sido denominado Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 (PIMS-TV) por el RCPCH (Royal College of Paediatrics and Child Health) de Reino Unido (es la terminología más aceptada en Europa)(2), y Multisystem Inflammatory Syndrome in Children (MIS-C) por los CDC (Centers of Diseases Control) de Estados Unidos(3), y se han establecido en ambas comunidades científicas, diferentes aunque similares, criterios para su definición. Desde abril de 2020 ha habido varias comunicaciones provenientes de distintos países, de niños y adolescentes afectados por este síndrome(4-9).
Tras la “primera ola” de la pandemia por el SARS-CoV-2, se identificó un pequeño % de pacientes pediátricos que desarrolla una respuesta inflamatoria sistémica exagerada. Este síndrome ha sido denominado Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 (PIMS-TV) por el Royal College of Paediatrics and Child Health de Reino Unido y Multisystem Inflammatory Syndrome in Children (MIS-C) por Centers of Diseases Control de Estados Unidos
Debido a que es una patología de nueva aparición, a que hay relativamente pocos casos descritos y a que no está aún probada su asociación con la infección por SARS-CoV-2, han surgido dudas sobre varios aspectos importantes: su prevalencia, las distintas formas de presentación, la gravedad con la que se puede presentar, su evolución natural y su adecuado tratamiento.
Destaca que esta nueva patología comparte características clínicas y analíticas con otras propias de la edad pediátrica: la enfermedad de Kawasaki (EK), el síndrome de shock tóxico estafilocócico y el síndrome de activación macrofágica. Hay otro grupo de pacientes en que se presenta como un cuadro abdominal con elevación marcada de los reactantes de fase aguda(10).
El síndrome inflamatorio multisistémico asociado a SARS-CoV-2 comparte clínica y analítica con la enfermedad de Kawasaki, el síndrome de shock tóxico estafilocócico y el síndrome de activación macrofágica
En mayo de 2020 se publicaron dos guías definiendo estos casos, una europea y otra americana, con el objeto de que los pediatras puedan estar alerta ante su aparición, hacer un diagnóstico y tratamiento tempranos, así como una derivación a centros con UCIP. La definición de PIMS, dada por el RCPCH de Reino Unido es(11):
- Niño o adolescente con fiebre persistente, inflamación (neutrofilia, elevación de proteína C reactiva PCR, linfopenia) y evidencia de fallo de la función de uno o más órganos (disfunción cardíaca, circulatoria, respiratoria, renal, digestiva o neurológica). Con alguna característica adicional en las que se pueden incluir niños que cumplen criterios de EK.
- Exclusión de infecciones que pueden producir estos cuadros, incluyendo infecciones bacterianas (sepsis, shock tóxico estafilocócico y estreptocócico), así como infecciones que causan miocarditis como los enterovirus.
- Pruebas de detección de SARS-CoV-2 positivas o negativas.
Todos los niños que cumplen criterios de PIMS, deben ser categorizados en dos fenotipos:
- Los casos Kawasaki-like. La clasificación dentro de este grupo se hace en función de los criterios diagnósticos aceptados internacionalmente de la American Heart Association, apoyándose más en la opinión de expertos que en aspectos biológicos, muy poco específicos.
- Los casos más inespecíficos.
Por su parte los CDC de EEUU agrupan las distintas formas clínicas en 3 grandes grupos:
- Presentación grave con shock, con o sin disfunción ventricular.
- Formas Kawasaki-like con evidencia de inflamación sistémica.
- Fiebre con signos inflamatorios, sin necesidad de soporte en UCIP.
La mayoría de estos niños tienen entre 8 y 11 años, con un ligero predominio en varones. Habitualmente son niños sanos previamente. Casi todos los casos descritos se presentan entre 2 y 6 semanas del pico de incidencia de infección por SARS-CoV-2. Esto, y que en la mayoría las pruebas de detección del virus (PCR a SARS-CoV-2) son negativas y las serológicas (Ig G) son positivas, hacen pensar que se trata de una respuesta inmune aberrante a la infección y no de un cuadro producido por la infección activa(10-13).
Los casos descritos se presentan entre 2 y 6 semanas del pico de incidencia por SARS-CoV-2, y tienen una edad entre 8 y 11 años, con ligero predominio en varones
La presentación clínica más frecuente es la fiebre, con síntomas abdominales y hallazgos típicos del síndrome de Kawasaki (exantema, inyección conjuntival, así como datos de laboratorio de inflamación aguda). La forma clínica depende de la edad: en el grupo de menor edad predominan las formas semejantes al síndrome de Kawasaki y en los adolescentes las formas con miocarditis como patología principal (un 73% en los casos entre 13 y 20 años). La afectación cardíaca es frecuente, sobre todo en los casos más graves, con elevaciones marcadas del péptido natriurético cerebral (brain natriuretic peptide BNP o por-BNP), en general por encima de 200 ng/L, y elevaciones leves-moderadas de la troponina(10,13).
La forma de presentación clínica en los adolescentes, es la miocarditis en los casos graves
En los últimos meses se han publicado distintas series de casos procedentes de distintos países: Reino Unido, Italia, España, Francia, Estados Unidos, Brasil(3-8). Aunque los casos descritos son similares clínica y epidemiológicamente, el tratamiento recibido no lo ha sido y todavía no se ha consensuado, debido fundamentalmente a la falta de evidencia científica en la cual apoyarse.
Una de las grandes preguntas que han surgido entre los pediatras es si el PIMS es una forma de EK desencadenada por el SARS-CoV-2. Varios autores son los que han comparado series de casos de EK previas a la pandemia de la COVID-19 con los casos aparecidos en los últimos meses. Las conclusiones son que estos últimos tienen mayor edad, tienen afectación cardíaca con más frecuencia, tienen valores de ferritina más altos, más leucocitosis, cifras de linfocitos menores, cifras de plaquetas menores, albúmina más baja, niveles más altos de troponina y de dímero D, y niveles de sodio plasmático también más bajos. También es más frecuente que no respondan a inmunoglobulina IV (Ig IV). Otra diferencia es la predilección de la raza asiática en la EK y la mayor afectación de pacientes con ascendencia afroamericana o afrocaribeña en el PIMS. Mientras que solo el 5% de los pacientes con EK presentan shock, lo hacen el 35-50% de los diagnosticados de PIMS(10).
En los pacientes en los que se sospeche esta entidad, hay que solicitar determinaciones analíticas básicas para comprobar si cumplen los criterios actualmente aceptados para el diagnóstico. Si se cumplen estos criterios, se realizarán otras exploraciones complementarias, consideradas de segundo nivel, para determinar el grado de afectación, así como para realizar un diagnóstico diferencial(1). La mayoría de los autores que han publicado sobre el tema, recomiendan un abordaje multidisciplinar, con la participación de pediatras generales, especialistas en enfermedades infecciosas, pediatras intensivistas, reumatólogos, cardiólogos e incluso hematólogos (en especial si se plantea utilizar tratamientos biológicos). Existe discrepancia en cuanto a si todos los casos con shock necesitan atención en hospitales con Unidades de Cuidados Intensivos, aunque por el riesgo de deterioro brusco la recomendación más extendida es que sí. El tratamiento a elegir depende del fenotipo de cada caso concreto (distinguiendo los casos similares a la EK de los tienen características más indefinidas), siendo determinantes también los factores de gravedad que presenten. En general, se propone un tratamiento por pasos, comenzando con Ig IV, seguida de corticoides (metilprednisolona vía IV) y finalizando con tratamientos biológicos para los casos que no responden bien a los anteriores. Estas recomendaciones están basadas en la experiencia de estos primeros meses de pandemia, pero habrá que ratificarlas o cambiarlas en función de la experiencia y los ensayos clínicos que se vayan acumulando en el futuro(2,3,10-13).
Este síndrome necesita un abordaje multidisplinar, con la participación de pediatras generales, especialistas en enfermedades infecciosas, pediatras intensivistas, reumatólogos, cardiólogos e incluso hematólogos
El diagnóstico y el tratamiento de estos pacientes se ha intentado sistematizar en guías clínicas, resumiéndose a continuación(2,3,14):
Diagnóstico
Pruebas de primer nivel: Hemograma. Proteína C reactiva. Procalcitonina si está disponible. Urea, creatinina, electrolitos. Función hepática.
Pruebas de segundo nivel. Si se cumplen los criterios de PIMS se continuará con las siguientes exploraciones, que además ayudarán a realizar un diagnóstico diferencial con otras patologías ya citadas:
- Gasometría con lactato, fibrinógeno, ferritina, dímero-D, troponina, péptido natriurético cerebral (pro-BNP), láctico deshidrogenasa (LDH).
- Pruebas de detección de SARS-CoV-2 (PCR o detección de antígenos) y pruebas serológicas para SARS-CoV-2.
- Toma de muestras para cultivos (punción lumbar solo si está indicado por la clínica); detección de infecciones virales que se incluyan en el diagnóstico diferencial.
- Electrocardiograma (ECG).
- Radiografía de tórax. Ecocardiograma. Ecografía abdominal en los niños con dolor abdominal importante (hay que descartar otros procesos, principalmente apendicitis).
Atención inicial
Llevar puesto el equipo de protección individual (EPI) adecuado.
Realizar las maniobras de resucitación estándar cuando esté indicado.
Extraer muestras para hemocultivo y comenzar antibioterapia empírica por la posibilidad de sepsis. Extraer muestras de sangre para determinaciones analíticas.
Consultar con los especialistas en UCIP en los pacientes inestables. En los pacientes estables hay que tener en cuenta que puede producirse un deterioro clínico rápido.
Monitorización cardiorrespiratoria (datos clínicos, FC, saturación de O2 y ECG de forma continua, TA).
ECG. Si es posible ecocardiograma de forma temprana (en función del contexto clínico y sanitario).
Evaluar:
- Evaluar la afectación multiorgánica: función renal, hepática, neurológica, etc.
- Si se plantea el inicio de tratamiento inmunomodulador, extraer las muestras analíticas indicadas antes de comenzar dicho tratamiento, así como obtener el consentimiento informado de los padres.
- Considerar Ig IV y ácido acetil salicílico si cumple criterios de Kawasaki.
- Considerar Ig IV si cumple criterios de síndrome de shock tóxico.
- Si cumple criterios de miocarditis, derivar a un centro con soporte adecuado.
Monitorización:
- Constantes vitales y anotación horaria de la evolución hasta que esté estable más de 12 horas.
- Monitorización estrecha para detectar cualquier empeoramiento cardíaco o respiratorio.
- Monitorización de signos de empeoramiento inflamatorio: empeoramiento de la fiebre, deterioro cardiorrespiratorio, empeoramiento de los síntomas digestivos, aumento de la hepatoesplenomegalia y/o las adenopatías, incremento del exantema, deterioro neurológico, ascenso de los reactantes de fase aguda, disminución de las series sanguíneas, hiponatremia o alteración de la función renal, ascenso o descenso del fibrinógeno, elevación de ferritina, elevación de triglicéridos, elevación de transaminasas y/o LDH, elevación de dímero D.
Tratamiento
Los fármacos antivirales están justificados solo en el contexto de ensayos clínicos controlados
En casos Kawasaki-like graves, se recomienda comenzar tratamiento con Ig IV y corticoides a la vez
Se basa en los siguientes principios generales:
- Estos pacientes deben ser tratados como sospecha de COVID.
- Comenzar antibioterapia empírica según los protocolos locales, asumiendo que puede tratarse de una sepsis hasta el resultado de los cultivos.
- Los casos leves-moderados pueden no ingresar en UCIP, pero por la posibilidad de deterioro rápido deben ingresar en un centro con UCIP.
- Los fármacos antivirales están justificados solo en el contexto de ensayos clínicos controlados.
- Considerar los fármacos inmunomoduladores (si no se tiene experiencia en estos tratamientos hay que consultar con los especialistas pediátricos adecuados según cada centro: reumatólogos, hematólogos, enfermedades infecciosas). La Ig IV se recomienda para todos los casos del grupo “Kawasaki-like”, pero no para los casos inespecíficos, los cuales pueden evolucionar bien sin ningún tratamiento cuando son leves. La metilprednisolona se considera tratamiento de segunda línea en ambos grupos. En los casos Kawasaki-like graves, se recomienda comenzar el tratamiento con Ig IV y corticoides a la vez. Hay consensos, como el del Grupo Español(13) en los que se deja abierta la posibilidad de comenzar con Ig IV o con corticoides en los casos inespecíficos. Considerando los efectos secundarios de ambos tratamientos puede haber casos en los que sea más adecuado comenzar con corticoides. La dosis de metilprednisolona no está bien establecida.
Se han utilizado dosis desde 2 mg/kg/día durante 5 días hasta 10-30 mg/kg/día durante 3 días en los casos graves. Los tratamientos biológicos se consideran de tercera línea, para pacientes que no responden a los anteriores. Hay consenso en que el infliximab es el más adecuado para los casos Kawasaki-like, no estando claro si este, el anakinra o el tolicizumab, son más convenientes en los casos inespecíficos(2,3,10-14). - En cuanto al tratamiento antiagregante, se recomienda aspirina a dosis bajas durante 6 semanas en los casos con fenotipo similar al Kawasaki.
- En cuanto a la indicación de profilaxis con anticoagulantes, se reserva para los pacientes de riesgo (movilidad restringida, obesidad, aneurismas coronarios gigantes, elevación importante del dímero D).
- Los pacientes con función cardíaca normal, estable, con más de 24 horas sin fiebre, pueden ser dados de alta del hospital.
- Se recomienda seguimiento una y 6 semanas después del alta hospitalaria, con ecocardiograma incluido, porque incluso en algún caso de evolución leve, se han descrito aneurismas coronarios posteriormente. Los casos con afectación más grave y sobre todo si han tenido disfunción cardíaca, precisan un control más estrecho y multidisciplinar.
Bibliografía
- Mendelson J. Emergency Department Management of Pediatric Shock. Emerg Med Clin North Am. 2018 May;36(2):427-440.
- Guidance: Paediatric multisystem inflammatory syndrome temporally associated with COVID-19. Royal College of Paediatrics and Child Health. 1 May 2020.
- Levin M. Childhood Multisystem Inflammatory Syndrome – A New Challenge in the Pandemic. N Engl J Med. 2020 Jul 23;383(4):393-395.
- Feldstein LR, Rose EB, Horwitz SM, Collins JP, Newhams MM, F. Son MB, et al. Overcoming COVID-19 Investigators; CDC COVID-19 Response Team. Multisystem Inflammatory Syndrome in U.S. Children and Adolescents. N Engl J Med. 2020 Jul 23;383(4):334-346.
- Cabrero-Hernández M, García-Salido A, Leoz-Gordillo I, Alonso-Cadenas JA, Gochi-Valdovinos A, González Brabin A, et al. Severe SARS-CoV-2 Infection in Children With Suspected Acute Abdomen: A Case Series From a Tertiary Hospital in Spain. Pediatr Infect Dis J. 2020 Aug;39(8):e195-e198.
- Whittaker E, Bamford A, Kenny J, Kaforou M, Jones CE, Shah P, et al. PIMS-TS Study Group and EUCLIDS and PERFORM Consortia. Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. JAMA. 2020 Jul 21;324(3):259-269.
- Verdoni L, Mazza A, Gervasoni A, Martelli L, Ruggeri M, Ciuffreda M, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet. 2020 Jun 6;395(10239):1771-1778.
- Pouletty M, Borocco C, Ouldali N, Caseris M, Basmaci R, Lachaume N, et al. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis. 2020 Aug;79(8):999-1006.
- Pereira MFB, Litvinov N, Farhat SCL, Eisencraft AP, et al; Pediatric COVID HC-FMUSP Study Group, Rossi Junior A, Delgado AF, Andrade APM, Schvartsman C, Sabino EC, Rocha MC, et al. Severe clinical spectrum with high mortality in pediatric patients with COVID-19 and multisystem inflammatory syndrome. Clinics (Sao Paulo). 2020;75:e2209.
- Elias MD, McCrindle BW, Larios G, Choueiter NF, Dahdah N, Harahsheh AS, et al. International Kawasaki Disease Registry. Management of Multisystem Inflammatory Syndrome in Children Associated with COVID-19: A Survey from the International Kawasaki Disease Registry. CJC Open. 2020 Sep 11.
- Harwood R, Allin B, Jones CE, Whittaker E, Ramnarayan P, Ramanan AV, et al; PIMS-TS National Consensus Management Study Group. A national consensus management pathway for paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi process. Lancet Child Adolesc Health. 2020 Sep 18: S2352-4642(20)30304-7.
- Levin M. Childhood Multisystem Inflammatory Syndrome – A New Challenge in the Pandemic. N Engl J Med. 2020 Jul 23;383(4):393-395.
- Ahmed M, Advani S, Moreira A, Zoretic S, Martínez J, Chorath K, et al. Multisystem inflammatory syndrome in children: A systematic review. EClinicalMedicine. 2020 Sep;26:100527. doi: 10.1016/j.eclinm.2020.100527. Epub 2020 Sep 4. PMID: 32923992; PMCID: PMC7473262.
- Grupo de redacción multidisciplinar conformado por la Asociación Española de Pediatría. Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC). Sociedad Española de Cuidados Intensivos Pediátricos (SECIP). Sociedad Española de Infectología Pediátrica (SEIP). Sociedad Española de Pediatría Hospitalaria (SEPHO). Sociedad Española de Reumatología pediátrica (SERPE). Sociedad Española de Urgencias de Pediatría (SEUP). Consenso nacional sobre diagnóstico, estabilización y tratamiento del Síndrome Inflamatorio Multisistémico Pediátrico vinculado a SARS-CoV-2 (SIM-PedS). An Pediatr (Barc). 27 de Julio de 2020.
Problemas nutricionales
Problemas nutricionales
J.M. Moreno Villares.
Director del Departamento de Pediatría. Clínica Universidad de Navarra, Madrid.
Adolescere 2020; VIII (3): 30e1-30e6
Resumen
|
Las repercusiones de la pandemia por el SARS-COVID-19 no se limitan a la afectación de los adolescentes infectados, en la que el manejo nutricional es similar al de otras infecciones respiratorias agudas, incluyendo el de aquellos pocos pacientes que precisaron ingreso en la UCP. Palabras clave: Infección respiratoria; Obesidad; Vitamina D; Actividad física. |
Abstract
|
The repercussions of the SARS-COVID-19 pandemic are not limited to the illness of infected adolescents, in which nutritional management is similar to that of other acute respiratory infections, including that of those few patients who required admission to the PICU. In this small group of patients, the existence of obesity has been identified to constitute a risk for greater severity. Prolonged confinement has meant modification of life habits, mainly food and physical activity. Not all these modifications have had a negative impact: the availability to dedicate more time to cooking, the possibility of eating as a family, and less consumption of fast food. Others however, such as increased intake of sugary foods or increased number of hours of sedentary lifestyle have had negative connotations. It is difficult to quantify the repercussions on health status, especially on body weight, nor on some groups of adolescents with chronic diseases, especially eating disorders. There is no specific food or nutrient with direct actions on the virus, although some epidemiological studies point to the role of vitamin D on immunity and the possibility of promoting it by increasing its plasma levels, although well designed clinical studies are necessary to confirm it. Key words: Respiratory infection; Obesity; Vitamin D; Physical activity; Covid-19. |
Introducción
La pandemia por SARS-CoV2 nos ha puesto delante de retos difícilmente imaginables hace apenas menos de un año. Nunca en tiempos tan recientes habíamos sido tan conscientes de nuestra vulnerabilidad, pero también de nuestra capacidad de responder adecuadamente si se trabaja en común, de una forma organizada y dirigida. La Medicina, la salud, ha vivido y vive en primera línea las consecuencias de la pandemia. Sabemos más que en el comienzo de la misma allá por finales de febrero de 2020: de sus efectos sobre el organismo y las consecuencias a corto y medio plazo. Abordar la pandemia ha supuesto también modificar nuestros hábitos de vida. No había experiencias sobre un confinamiento prolongado fuera de épocas de guerra o desastres naturales y siempre había ocurrido en ámbitos geográficos determinados y por periodos concretos.
En esta presentación abordaremos las repercusiones que la pandemia ha tenido y puede tener sobre la salud de los adolescentes, en especial en lo relacionado a su alimentación y a su estado nutricional. Finalizaremos la exposición revisando cuanto podemos hacer para mejorar la respuesta inmune por medio de los hábitos saludables.
Las repercusiones de la infección por
SARS-COVID-19 en el estado nutricional
El número de pacientes pediátricos que se vieron afectados en la primera ola de la pandemia es ciertamente desconocido, pues en los momentos iniciales se limitó la realización de test diagnósticos (fundamentalmente la Reacción en cadena de la Polimerasa, RT-qPCR) a aquellos pacientes con sintomatología grave y/o que requerían ingreso hospitalario. Afortunadamente el número de sujetos < 19 años ingresado fue bajo, y muy inferior el de aquellos que precisaron ingreso en la UCIP. En la fase actual de la epidemia es bastante similar (Figura 1).
Por lo tanto, salvo en los escasos adolescentes que padecieron un cuadro grave que obligara a un ingreso en UCI o un síndrome multinflamatorio sistémico (SMIS) asociado a COVID, cuyo manejo nutricional se escapa al objetivo de esta revisión, los niños y adolescentes con infección leve o moderada no vieron afectada de forma importante su situación nutricional ni precisaron modificaciones dietéticas específicas.
La Sociedad Europea de Cuidados Intensivos Pediátricos en colaboración con ESPEN está en el proceso de publicar unas recomendaciones sobre el abordaje nutricional del SMIS en su fase aguda y en su recuperación.
La obesidad como factor de riesgo de gravedad
Desde los primeros reportes publicados sobre la evolución de los pacientes infectados, se comprobó una incidencia más elevada y una gravedad mayor en los pacientes con obesidad. Qingxian et al fue el primero en comunicar que la obesidad se asociaba a un riesgo mayor de desarrollar neumonía(1).
En el grupo de 383 pacientes ingresados se evidenció que el riesgo de desarrollar neumonía grave era 2,42 veces mayor en los pacientes con obesidad cuando se comparaba con sujetos con normopeso. Simonnet et al analizaron 124 pacientes que ingresaron en la UCI. Aquellos con IMC > 35 kg/m2 tenían un riesgo 7 veces mayor de necesitar ventilación mecánica que aquellos con IMC < 25 (OR, 7.36; 95% CI, 1.63-33.14)(2). En el estudio de Petrelli et al en 4103 pacientes con COVID-19 en Nueva York, el 26,8% de los infectados tenían obesidad, pero en los ingresados el % subía al 39,8% (frente al 14,5% de los no-obesos). Tener un IMC > 40 kg/m2 constituyó el factor de riesgo de ser hospitalizado más potente (OR, 6.2; 95% CI, 4.2-9.3).
La obesidad se asocia a un mayor riesgo de desarrollar neumonía. Tener un IMC > 40 kg/m2 constituye el factor de riesgo más potente de ser hospitalizado
Los datos en población infantil y juvenil son más escasos, pero apuntan a mayor posibilidad de desarrollar una forma grave de la enfermedad en presencia de obesidad(3,4). Los mecanismos que relacionan ambas entidades son múltiples y hacen referencia tanto a la obesidad en sí como a sus comorbilidades (Figura 2). El interés potencial de esta asociación radica en el hecho de la creciente tasa de obesidad infanto-juvenil, que les hace susceptibles a distintas enfermedades, también a la mayor gravedad de algunas infecciones locales o sistémicas.
Las repercusiones del confinamiento
Con el fin de evitar la propagación de la pandemia en la mayoría de los países se inició un periodo de confinamiento, que en ocasión fue prolongado (hasta 3 o más meses) y que se ha seguido, en muchos lugares, de una limitación de las actividades fuera del domicilio. Comenzamos a conocer las repercusiones de este hecho tanto sobre los hábitos, en especial la alimentación, como sobre el estado nutricional de la población. Por una aparte, el confinamiento obligado se tradujo en mayor tiempo para poder cocinar y menor número de posibilidades de comer fuera de casa, al tiempo que la actividad física disminuyó considerablemente.
En una encuesta multinacional realizada en 820 adolescentes de 10 a 19 años que recoge en un cuestionario estandarizado las prácticas de consumo de alimentos antes y durante el confinamiento se observó un aumento en el número de veces en las que se consumían legumbres, frutas y verduras, pero también de alimentos fritos y de dulces y una disminución en el número de veces que consumían
comida rápida(5). En una muestra parcial del mismo estudio se evidenció un mayor consumo de alimentos ultra procesados y una marcada disminución de la actividad física(6).
En una encuesta en adolescentes antes y durante el confinamiento se observó un incremento en el consumo de legumbres, frutas, verduras y alimentos fritos y dulces, así como una disminución en comida rápida
No es sencillo encontrar datos contrastados sobre los efectos del confinamiento sobre el peso, a la luz de las modificaciones observadas en los estilos de vida. En la encuesta de He et al se observó que los individuos que no estaban especialmente preocupados por su peso fueron menos conscientes de la ganancia de peso durante el confinamiento que aquellos con un IMC ≥24(7). Otros estudios, sin embargo, no encuentran una diferencia en la ganancia de peso entre jóvenes universitarios durante la cuarentena a pesar de tener la apreciación contraria(8). Tener un carácter optimista y mantener niveles adecuados de actividad física son elementos “protectores” frente a las variaciones en el peso.
El confinamiento fue un gran reto para las personas con un trastorno de la conducta alimentaria.
Aumentó de forma considerable la preocupación por el peso, la comida, la impulsividad en la actividad física junto a los sentimientos de soledad, tristeza y pérdida de paz interior. El número de terapias disminuyó, aunque en algunos casos se sustituyó por videoconsultas o consultas telefónicas y abren una vía prometedora para el seguimiento y el apoyo a estos pacientes en tiempos difíciles(9). Las repercusiones de la pandemia en otros colectivos de adolescente con necesidades especiales han sido escasamente estudiadas.
En los trastornos de la conducta alimentaria el número de terapias disminuyó, aunque en algunos casos se sustituyó por videoconsultas o consultas telefónicas
¿Se puede mejorar la respuesta inmune desde la alimentación? Mitos y realidades
La relación entre nutrición e inmunidad es conocida desde antiguamente. El círculo vicioso desnutrición-infección- pobreza está en el origen de la mitad de los fallecimientos de los niños < 5 años en el mundo.
Una alimentación suficiente y equilibrada es esencial en el desarrollo del sistema inmune y, por tanto, en la defensa frente a la infección. Algunos nutrientes, como la vitamina A, D y E, minerales como el zinc y el selenio y la fibra y los ácidos grasos polinsaturados de cadena larga, tienen efectos sobre el sistema inmune. Una depleción de estos nutrientes (lo que se conoce como “hambre selectiva”) puede llevar a una disminución en la defensa frente a las infecciones y a un aumento en la carga de enfermedad. En virtud de este hecho, algunos autores sugieren aumentar los aportes de estos micronutrientes para disminuir el riesgo de infección (Tabla I)(10). Sin embargo, excepto para la vitamina D existen pocos estudios clínicos robustos concluyentes.
Otros componentes de la dieta como los polifenoles han sido y son objeto de investigación también, al bloquear la liberación de citoquinas inflamatorias(11).
Hablaremos con un poco más de detalle de la vitamina D. Además de ser una hormona implicada en numerosas funciones del organismo, la vitamina D es un importante modulador de la inmunidad innata y adaptativa. Se ha descrito la asociación entre niveles bajos de Vitamina D y un aumento en la susceptibilidad a las infecciones, pero su papel causal todavía es controvertido. En un metaanálisis ya clásico, Martineau et al demostraron que la suplementación con vitamina D protegía frente a las infecciones respiratorias agudas, en especial en los pacientes deficitarios en la misma (niveles de 25OH < 10 ng/ml)(12). Algunos trabajos señalan este mismo papel en el caso de las infecciones respiratorias agudas en población infanto-juvenil, pero con las mismas limitaciones a la hora de establecer una relación causal y, por tanto, indicar una recomendación.
La vitamina D es un importante modulador de la inmunidad innata y adaptativa. Se ha demostrado que la suplementación protegía frente a las infecciones respiratorias agudas, en especial en los deficitarios
Epidemiológicamente se ha observado una mayor incidencia de infección por COVID-19 y mayor gravedad en su presentación en los países con más alta prevalencia de sujetos con insuficiencia o deficiencia en vitamina D. Radujkovic et al, en un estudio observacional en 185 pacientes diagnosticados de infección por coronavirus, encontraron que los niveles medios de vitamina D eran inferiores en los pacientes que requirieron ingreso frente a los que no lo necesitaron. En los que ingresaron, los que eran vitamina D deficientes tenían una edad superior, la duración del ingreso fue mayor, así como la necesidad de ventilación. También los niveles de IL-6 (70,5 vs 29,7 pg/mL)(13).
No existen datos similares en población infantil o en adolescentes.
En los últimos años, no relacionados con la infección por COVID-19 pero si con las infecciones respiratorias, se ha evaluado la eficacia de algunos remedios tradicionales caseros como es el caso de la miel, la cebolla o la clásica sopa de pollo o de gallina, con resultados que, además de hacernos sonreír, nos muestran una cierta eficacia con escasos efectos adversos. No deberíamos, por tanto, desestimarlos alegremente. Sin embargo, no existen datos sobre su eficacia ni en la prevención ni en el tratamiento de la infección por COVID-19(14).
Conclusiones
Una pandemia como la que estamos viviendo supone un gran desafío para la comunidad científica.
El desarrollo de técnica de diagnóstico rápido y, sobre todo, la búsqueda de remedios eficaces para frenar la transmisión y para curar a los pacientes infectados, son un objetivo prioritario que debe buscarse en el marco de investigación rigurosa y que no ponga en riesgo la salud de la población.
Supone también una batalla frente al engaño y el fraude que surgen fácilmente cuando hay situaciones desesperadas y las alternativas que se ofrecen no cubren las expectativas de la población.
Algunos hechos son constatados: aunque en la población infantil y juvenil el número de casos que precisan hospitalización es bajo y aun inferior el de los que requieren ingreso en UCI, los pacientes con sobrepeso u obesidad tienen un mayor riesgo. En la prevención de esta o de futuras pandemias este es un argumento más para continuar trabajando porque los adolescentes sigan una dieta saludable y hagan actividad física diaria, sobre todo al aire libre. Una consideración especial tienen los adolescentes con trastornos de la conducta alimentaria. Las nuevas tecnologías de la información aplicadas a la salud (e-health) abren un campo prometedor en el seguimiento de estos pacientes.
Ningún nutriente específico por si solo ha demostrado eficacia en el tratamiento de la infección por COVID-19, aunque los datos preliminares apuntan al papel de la vitamina D. No parece, por tanto, descabellado garantizar un aporte suficiente en aquellos adolescentes con infección, en especial si presentan niveles insuficientes de 25-OH-vitD.
Ningún nutriente específico por si solo ha demostrado eficacia en el tratamiento de la infección por COVID-19, aunque los datos preliminares apuntan al papel de la vitamina D
Por último, los remedios naturales, pueden tener un escaso potencial terapéutico, pero forman parte del cuidar y sentirse cuidado que contribuyen en esta y en otras crisis al bienestar general. Pero este hecho no obvia la necesidad de realizar ensayos clínicos rigurosos en busca de remedios eficaces frente al virus.
Tablas y figuras
Tabla I. Ingestas recomendadas de nutrientes para mantener una función inmune óptima
|
Nutriente |
Justificación |
Recomendaciones |
|
Vitaminas y |
Las deficiencias en estos micronutrientes afectan negativamente la función inmune |
Dieta equilibrada. En caso de ingesta insuficiente suplemento de vitaminas y minerales |
|
Vitamina C |
Dosis ≥200 mg/día se asocian a niveles en sangre adecuados. Durante las infecciones aumentan las necesidades |
Ingesta diaria de 200 mg/día en individuos sanos. |
|
Vitamina D |
La suplementación diaria de vitamina D reduce el riesgo de infecciones respiratorias agudas |
Ingesta diaria de 2000 UI/día |
|
Zinc |
La deficiencia de zinc se asocia a infecciones respiratorias y diarreas en niños |
8-11 mg/día |
|
Ácidos grasos n-3 |
Efecto anti-inflamatorio |
Ingesta diaria de 250 mg/día |
Figura 1. Distribución del número de casos por grupos de edad y situación clínica. Casos de COVID 19 notificados a la Red Nacional de Vigilancia Epidemiológica con inicio de los síntomas y diagnóstico posterior al 10 de mayo de 2020
Tomado del Informe nº 44. Situación de COVID-19 en España. Casos diagnosticados a partir 10 de mayo. Informe COVID-19. 16 de septiembre de 2020. Equipo COVID-19. RENAVE. CNE. CNM (ISCIII)).
Figura 2. Relaciones entre obesidad y enfermedad por SARS-CoV2
Bibliografía
- Qingxian C, Fengjuan C, Fang L, Xiaohui L, Tao W, Qikai W, et al. Obesity and COVID-19 severity in a designated hospital in henzhen, China (3/13/ 2020). Lancet. 2020: https://ssrn.com/abstract¼3556658. https://doi.org/10.2139/ssrn.3556658.
- Simonnet A, Chetboun M, Poissy J, Raverdy V, Noulette J, Duhamel A, et al. High prevalence of obesity in severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) requiring invasive mechanical ventilation [published online ahead of print April 9, 2020]. Obesity (Silver Spring), https://doi.org/10.1002/oby.22831.
- Zhang F, Xiong Y, Wei Y, Hu Y, Wang F, Li G, et al. Obesity predisposes to the risk of higher mortality in young COVID-19 patients. J Med Virol. 2020, http://dx.doi.org/10.1002/jmv.26039 [Epub ahead of print].
- Kass DA, Duggal P, Cingolani O. Obesity could shift severe COVID-19 disease to younger ages. Lancet. 2020 May 16;395(10236):1544-1545. doi: 10.1016/S0140-6736(20)31024-2. Epub 2020 May 4. PMID: 32380044; PMCID: PMC7196905.
- Ruiz-Roso MB, de Carvalho Padilha P, Mantilla-Escalante DC, Ulloa N, Brun P, Acevedo-Correa D, et al. Covid 19 Confinement and Changes o Adolescent´s Dietary Trends in Italy, Spain, Chile, Colombia and Brazil. Nutrients. 2020 Jun 17;12(6):1807. doi: 10.3390/nu12061807. PMID: 32560550; PMCID: PMC7353171.
- Ruíz-Roso MB, de Carvalho Padilha P, Matilla-Escalante DC, Brun P, Ulloa N, Acevedo-Correa D, et al. Changes of Physical Activity and Ultra-Processed Food Consumption in Adolescents from Different Countries during Covid-19 Pandemic: An Observational Study. Nutrients. 2020 Jul 30;12(8):2289. doi: 10.3390/nu12082289.
- He M, Xian Y, Lv X, He J, Ren Y. Changes in Body Weight, Physical Activity, and Lifestyle During the Semi-lockdown Period After the Outbreak of COVID-19 in China: An Online Survey. Disaster Med Public Health Prep. 2020 Jul 14:1-6. doi: 10.1017/dmp.2020.237. Epub ahead of print. PMID: 32660669; PMCID: PMC7385320.
- Keel PK, Gomez MM, Harris L, Kennedy GA, Ribeiro J, Joiner TE. Gaining “The Quarantine 15:” Perceived versus observed weight changes in college students in the wake of COVID-19. Int J Eat Disord. 2020 Aug 28:10.1002/eat.23375. doi: 10.1002/eat.23375. Epub ahead of print. PMID: 32856752; PMCID: PMC7461524.
- Schlegl S, Maier J, Meule A, Voderholzer U. Eating disorders in times of the COVID-19 pandemic-Results from an online survey of patients with anorexia nervosa. Int J Eat Disord. 2020 Aug 25:10.1002/eat.23374. doi: 10.1002/eat.23374. Epub ahead of print. PMID: 32841413; PMCID: PMC7461418.
- Calder PC, Carr AC, Gombart AF, Eggersdorfer M. Optimal Nutritional Status for a Well-Functioning Immune System Is an Important Factor to Protect against Viral Infections. Nutrients. 2020 Apr 23;12(4):1181. doi: 10.3390/nu12041181. PMID: 32340216; PMCID: PMC7230749.
- Messina G, Polito R, Monda V, Cipolloni L, Di Nunno N, Di Mizio G, et al. Functional Role of Dietary Intervention to Improve the Outcome of COVID-19: A Hypothesis of Work. Int J Mol Sci. 2020 Apr 28;21(9):3104. doi: 10.3390/ijms21093104. PMID: 32354030; PMCID: PMC7247152.
- Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, Bergman P, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017 Feb 15;356:i6583. doi: 10.1136/bmj.i6583. PMID: 28202713; PMCID: PMC5310969.
- Radujkovic, A, Hippchen T, Tiwari-Heckler S, Dreher S, Boxberger M, Merle U. Vitamin D Deficiency and Outcome of COVID-19 Patients. Nutrients 2020, 12, 2757.
- Thota SM, Balan V, Sivaramakrishnan V. Natural products as home-based prophylactic and symptom management agents in the setting of COVID-19 [published online ahead of print, 2020 Aug 17]. Phytother Res. 2020;10.1002/ptr.6794. doi:10.1002/ptr.6794.
Cómo tratar el acné en la adolescencia
Cómo tratar el acné en la adolescencia
H Fernández Llaca. Dermatólogo. Hospital Valdecilla Santander
Adolescere 2014;II (2): 129
El acné es una de las enfermedades más frecuentes en el ser humano. Aparece fundamentalmente entre los 12 y los 20 años afectando del 85-95% de los adolescentes. Representa el 15% de las consultas médicas. No es exclusivo de la adolescencia dado que el 12-20% de mujeres de más de 25 años pueden presentar acné. Más frecuente al padecer ovario poliquístico, hiperandrogenismo, hipercortisolismo y pubertad precoz. En estos casos el acné suele ser más resistente a los tratamientos habituales.
Tiene una etiopatogenia compleja, en la que influyen la genética, alteraciones de la glándula sebácea, colonización por propionibacterium acnés y los andrógenos.
Sus manifestaciones clínicas son bien conocidas: comedones, pápulas, pápulo-pústulas y nódulos. Existen múltiples variantes del acné clásico así como erupciones acneiformes.
El tratamiento de elección son los queratolíticos, antibióticos tópicos y sistémicos y la isotretinoína entre otros.
A través de la presentación de varios casos de acné en adolescentes con distintos grados de severidad, se comenta qué tipos de tratamientos serían los más adecuados a cada caso, cual es la forma correcta de realizarlos y en qué tipo de recomendaciones se debería insistir para que los tratamientos resulten más eficaces. Finalmente se analiza que hay de cierto o no en muchos de los ¨mitos¨ que suelen acompañar a este tipo de enfermedades.
El adolescente cansado
El Adolescente cansado
M.A. Salmerón Ruiz
Pediatra. Unidad de Medicina del Adolescente del Hospital Universitario La Paz. Madrid
Adolescere 2013; II (2): 85-94
Enfermedad actual: Adolescente mujer de 18 años de edad, en seguimiento desde septiembre del 2005 por astenia progresiva que cursa en brotes de diversa intensidad (le impide ir al colegio, tiene que quedarse en la cama, no puede incluso peinarse o caminar más de 500 metros). Si se fuerza tarda días en recuperarse. Dificultad para concentrarse, Mareos con palidez y glucemia normal.
Consigue ir al colegio hasta Abril 2006, pero lo interrumpe por que se agota. Consigue aprobar el curso y mejora algo durante el verano.
En septiembre del 2006 el cansancio es más intenso, va al colegio en silla de ruedas, los periodos de agotamiento son de 7-10 días con periodos libres de 2-3 días. Consigue ir al colegio por la mañana y 3 días al Conservatorio, toca el fagot. Está mejor por la tarde, duerme mal y no descansa, le cuesta levantarse por la mañana
Los mareos son más frecuentes, con glucemias normales.
Antecedentes familiares: abuela materna y dos tías por rama materna con diabetes mellitus tipo 1.
Antecedentes personales:
• Leucemia linfoblástica aguda B común con riesgo intermedio a los 8 años de edad. Precisa interrupción del tratamiento quimioterápico con metrotexate por toxicidad hepática, neurológica e intolerancia a los hidratos de carbono (en diciembre del 2004). Finaliza tratamiento en abril del 2005. Sin sintomatología hasta el momento actual.
• Síndrome mononucleósico un mes antes del inicio de la astenia.
Pruebas complementarias:
• Estudio inmunológico:
o Anti ENAs (AntiSm. RNP, SS-A, SSB, bcl-70, Jo1) Negativo
o Anti DNA nativo: Negativo
o Anti cardiolipina IgG IgM: Negativo
o ANA: 1/160 (Indeterminado, repetido al año, negativo)
o Ac Antireceptor Acetil-Colina: Negativo
o Ac Anticanales del calcio de bajo voltaje: Negativo
• Serologías
o HIV, Hepat B y C: Negativo
o CMV: Negativo
o EBV: EarlyAg+, anti VCA e IgM: Neg PCR EBV: Neg
o Parvovirus B19: IgG positivo
• Estudio endocrinológico
o T4 libre, TSH, LH, FSH, Prolactina: Normales
o ACTH, Cortisol: Normal
o Glucemia: 81 mg/dl
o HbA1c: Normal
o Péptido C: 1.6 ng/ml (VN 0.5-3.5)
o Sobrecarga de glucemia: respuesta de glucosa e insulina normales
• Amonio: Normal
• CPK: Normal
• Ionotest: 45mEq ClNa
• Zinc: Normal
• EEG: Normal
• RNM Cráneo y Médula: Normal
• EMG: Normal
• ECG y ECO-Cardio: Normal
• Espirometría: Normal
• Tóxicos en Orina: Negativos
• Eco pancreática: Normal
• Octreoscan: Normal
• Mesa Basculante: predominio de la actividad simpática adrenérgica y colinérgica
Tratamiento
Se inicia tratamiento con propanolol, fluorhidrocortisona, midodrina y desmopresina. Se mantiene estable, mejoran los mareos.
Se queja de hipersudoración de palmas y plantas.
Evolución
Consigue asistencia parcial al colegio y al conservatorio los sábados, pero el cansancio va aumentando en intensidad, empeora con la menstruación, obteniendo respuesta a anticonceptivos orales combinados.
El curso 2011-12 lo hace con tutores domiciliario, consigue presentarse a selectividad y sigue en el conservatorio. Mantiene buenas relaciones sociales, aunque está limitada porque no aguanta el salir hasta tarde.
En enero del 2011 mayor cansancio, mareos y asocia dolor en cadera Izq y pierna “dormida” con sensación de frialdad, sin cambios de color, no disestesia, desaparece en 1 mes espontáneamente, se realiza RNM craneal y columna, EMG y Eco Doppler que son normales.
En noviembre del 2011, inicia sensación de plenitud progresiva tras las comidas, saciedad precoz, reflujo y eructos, no dificultad para la deglución ni estreñimiento. Se solicita tránsito EGD, Gastroscopia y pH-metría que son normales, y una manometría esofágica que es informada como trastorno motor de cuerpo esofágico, con un 50% de ondas ineficaces en tercio distal. Esfinter superior hipertenso con buena función y coordinación faringo-esofágica, y el esfínter inferior normotenso con buena función. Por lo que se decide iniciar tratamiento con cisapride sin obtener respuesta.
En junio del 2011 La dificultad para la deglución empeora teniendo gran dificultad para la ingesta de sólidos. Presenta hipersudoración en manos y pies, el cansancio está estable, pero si se fuerza presenta disminución de fuerza en extremidades inferiores. Humor más inestable y aumento de ansiedad. Se inicia tratamiento con Rituximab, obteniendo mejoría evidente hasta la fecha.
Introducción
El síndrome de fatiga crónica (SFC) se caracteriza por un profundo e incapacitante cansancio, que conlleva una importante reducción de la actividad previa del paciente, tanto personal, social como educativa o laboral.
Recientemente el término de SFC está siendo sustituido por el de Encefalomielitis Miálgica (EM), debido a que la definición del SFC se centra en el cansancio y en una duración concreta de los síntomas y el cansancio crónico es un síntoma común en la mayoría de las enfermedades crónicas.
El SFC se define por un profundo e incapacitante cansancio, no debido al ejercicio y que no se alivia con el reposo de al menos 6 meses de duración, que conlleva una importante reducción de la actividad previa del paciente, tanto personal, social, educativa o laboral.
Además, debe de acompañarse de 4 o más de los siguientes síntomas:
• Dificultades de concentración y pérdida de memoria.
• Faringitis recurrentes.
• Adenopatías.
• Dolor muscular.
• Dolor articular.
• Jaquecas de nueva aparición.
• Sueño no reparador.
• Fatiga tras el esfuerzo (físico o mental) que persiste más de 24 horas después del mismo.
Debido al potencial impacto, tanto social como educativo, en niños y adolescentes existe el consenso que 6 meses es demasiado tiempo para el diagnóstico y se ha propuesto que sea de 8 semanas a 3 meses.
La EM se define como una enfermedad neurológica adquirida con disfunciones globales complejas con alteraciones en el sistema inmune, endocrino y nervioso.
El cansancio, la fatiga y el sueño son una queja muy frecuente en la adolescencia. Hasta un 70% de los adolescentes refieren tener demasiado sueño y estar cansados durante el día. La mayoría de las veces esto es debido a un déficit crónico de horas de sueño, a una mala “higiene” del mismo, a una actividad diaria excesiva y/o factores estresantes. En ocasiones, puede deberse a razones médicas o psicológicas.
Es importante distinguir entre los que tan sólo necesitan “reorganizar” sus horarios, los que precisan evaluación y tratamiento, bien sea médico o psiquiátrico, y los que pueden padecer un SFC o EM.
Epidemiología
El Síndrome de Fatiga Crónica afecta 4 veces más a las mujeres, fundamentalmente entre los 40 y 50 años, sin distinción de raza y con una mayor prevalencia en niveles socioeconómicos menos favorecidos. Es menos frecuente en niños, aunque puede presentarse a cualquier edad, y dentro de la edad pediátrica es más frecuente en adolescentes que en niños.
La prevalencia en la población general adulta varía, dependiendo de los estudios, entre el 0,007 y el 2,8% y del 0,006 al 3,0% en Atención Primaria. Las cifras son menores para los niños, en Inglaterra es entre 0,05% y 0,1% con predominio dentro de los adolescentes.
Aunque pueden existir casos familiares, no existe evidencia de que sea transmisible, sino más bien que pueda haber una predisposición genética, siendo necesarios mayores estudios para determinar este extremo.
La duración media de la enfermedad es de 37 a 49 meses y parece que la recuperación total es más frecuente en adolescentes que en los adultos, aunque existe un 5-10% de niños y jóvenes que persisten sensiblemente afectados durante años.
Etiología
La etiología no está clara, habiéndose sugerido múltiples teorías centrándose inicialmente en el posible origen en una infección viral o en un trastorno psiquiátrico. Posteriormente, se han identificado múltiples anomalías de muy distinta índole, como alteraciones en la función cerebral, en la estructura del sueño, en las respuestas neuroendocrinas, en el sistema inmune o en los perfiles psicológicos.
La relación entre todas estas anomalías no está clara, sugiriendo que la etiología de este síndrome es multifactorial y compleja y que algunos determinantes pueden desencadenarlo y otros perpetuarlo, siendo posible que existan además algunos factores genéticos, puesto que en los escasos estudios realizados hay una mayor prevalencia del síndrome de fatiga crónica entre familiares de pacientes y una mayor correlación entre gemelos monocigóticos que en la población general.
Algunos estudios de neuroimagen utilizando SPECT han demostrado un menor flujo cerebral con anomalías de perfusión (hipoperfusión) comparados con la población control o con pacientes con depresión. En estudios de gemelos, no se han demostrado diferencias del flujo cerebral entre el sano y el que padece el Síndrome de Fatiga Crónica. Aunque los estudios de RNM y SPECT consiguen demostrar varias anomalías en estos pacientes, el significado de las mismas no está claro.
Las alteraciones neuropsicológicas son las que más interfieren y afectan a los pacientes. Más del 85% de los pacientes se quejan de dificultad para concentrarse, de memoria y atención, los distintos estudios no consiguen demostrar resultados concluyentes, tan sólo un pequeño déficit en el proceso de la información y de la memoria de trabajo y que globalmente mantienen su capacidad cognitiva e intelectual. Sin duda, la coexistencia de estrés o patología psiquiátrica puede contribuir.
Las alteraciones neuroendocrinas son frecuentes, hasta un tercio de los pacientes tienen hipocortisolismo de origen central y alteraciones serotoninérgicas. La administración de agonistas de la serotonina produce un aumento en los niveles de prolactina en comparación con los controles o pacientes con depresión.
La alteración de la actividad autonómica y su implicación en el Síndrome de Fatiga Crónica no está clara, aunque algunos pacientes presentan hipotensión ortostática que puede demostrarse con el test de la mesa basculante y que mejora tras su adecuado tratamiento
Se han propuesto múltiples agentes infecciosos, Epstein-Barr, Herpes-6, Coxackie B, HTLV-II, retrovirus y enterovirus como causantes del SFC, pero no se ha logrado obtener ninguna evidencia que lo justifique; de hecho, algunos pacientes no tienen ninguna prueba analítica de infección viral y los ensayos terapéuticos con aciclovir o interferon no han sido beneficiosos.
Los pacientes con SFC manifiestan una mayor dificultad para dormirse, con un mayor número de despertares y con siestas diurnas más frecuentes que la población control, los estudios polisomnográficos no han demostrado alteraciones consistentes y la alteración no se correlaciona con la severidad del cansancio.
Criterios clínicos
Existen múltiples criterios diagnósticos consensuados por distintos grupos, en el 2011 se publicaron los criterios internacionales de la EM que se muestran en la tabla 1.
Clínica
La fatiga es la queja fundamental del paciente con una instauración brusca, típicamente tras un episodio “gripal”. Tras este episodio, los pacientes refieren que cualquier esfuerzo, físico o mental, aumenta el cansancio, lo que interfiere con su actividad diaria, que tiene que ser disminuida en más del 50% de lo que hacían previamente.
Algunos pacientes pueden tener una instauración de los síntomas de manera más insidiosa y una fluctuación de la intensidad de los mismos a lo largo del tiempo.
Además de la fatiga muestran otros síntomas: alteraciones del sueño siendo no reparador, agitado y con insomnio de conciliación, cambios de apetito con fluctuaciones del peso, inestabilidad térmica con sudores nocturnos, escalofríos e intolerancia al frío o al calor, mareos, palpitaciones e hipotensión ortostática, colon irritable, dolor abdominal, fotofobia y dolor ocular, cambios de humor, irritabilidad o ansiedad, suelen padecer una intolerancia y mayor sensibilidad al alcohol y medicamentos.
Diagnóstico diferencial
El diagnóstico diferencial hay que realizarlo con:
a. Enfermedades endocrinas
i. Enfermedad de Addison
ii. Enfermedad de Cushing
iv. Diabetes Mellitus
v. Hipertiroidismo
vi. Hipotiroidismo
b. Enfermedades hematológicas y oncológicas
i. Anemia
ii. Cáncer
c. Enfermedades infecciosas
i. Hepatitis crónicas (VHB, VHC)
ii. VIH
iii. Síndrome mononucleósico (VEB, CMV, VH6)
iv. Enfermedad de Lyme
v. Tuberculosis
d. Enfermedades neurológicas
i. Esclrerosis múltiple
ii. Narcolepsia
iii. Enfermedad de Parkinson (en adultos)
iv. Demencia (en adultos)
e. Enfermedades psiquiátricas
i. Trastornos de la conducta alimentaria
ii. Trastorno bipolar
iii. Depresión mayor
iv. Esquizofrenia
v. Trastorno somatomorfo
vi. Abuso de sustancias
f. Enfermedades reumatológicas
i. Polimiositis
ii. Atritis reumatoide
iii. Síndrome de Sjögren
iv. LES
v. Artritis de la temporal
g. Otras
i. Enfermedad celiaca
ii. Embarazo
iii. Fallo cardiaco
iv. Toxicidad por metales pesados
v. Apnea del sueño
vi. Efectos secundarios a fármacos
vii. Deficiencias vitamínicas
Pruebas complementarias
El diagnóstico del SFC es un diagnóstico de exclusión.
En todos los pacientes se debe realizar una historia clínica y una exploración física cuyo principal objetivo es descartar otras patologías y detectar síntomas de alarma como el dolor precordial, dolor e inflamación de articulaciones, pérdida de peso acompañado de adenopatías o dificultad respiratoria.
Existe debate acerca de las pruebas complementarias que deben solicitarse en estos pacientes. La finalidad de dichas pruebas es descartar otras enfermedades ya que no existen alteraciones analíticas específicas en los pacientes con FC.
Según la CDC los pacientes con la sospecha de FC se les debería realizar una evaluación inicial que consista en: historia clínica, exploración física y una analítica básica (hemograma, bioquímica con iones incluido el fósforo, función renal y hepática, TSH y T4 libre). Evidencia C.
Además, la Guía NICE (National Institute for Health and Clinical Excellence) aconseja solicitar: drogas en orina, FR, ANAs, IgA, Ac antiendomisio y serologías si el paciente refiere clínica reciente compatible con infección viral o síndrome mononucleósico.
Tratamiento
Al no existir una etiología claramente definida, con un cuadro con unas manifestaciones heterogéneas y de diagnóstico difícil, no existen unas recomendaciones claras para su tratamiento, que básicamente se centra en el alivio de los síntomas y la mejoría de la función. Todos los pacientes con SFC o EM deben recibir tratamiento sintomático de sus comorbilidades (Evidencia C).
Es básico el lograr una comprensión por parte de la familia de la naturaleza del cuadro y conseguir una alianza terapéutica adecuada, estableciendo un plan de seguimiento con objetivos graduales, coordinando la actuación de otros especialistas si son necesarios y con el colegio. La normalización del sueño y de la alimentación es una labor ineludible, así como lograr un progresivo aumento de la actividad.
Los estudios solo han demostrado como tratamiento que mejore la fatiga y la ansiedad, y favorece la incorporación del paciente a la vida social y laboral, la terapia cognitivo conductual y el ejercicio físico gradual (Evidencia A).
Tablas y figuras
Tabla I. Criterios diagnósticos del Síndrome de Fatiga Crónica (SFC)
|
I. Oxford (Sharpe et al 1991) • La fatiga es el síntoma central • Comienzo concreto • Cansancio incapacitante que afecta al funcionamiento tanto físico como mental. • La fatiga debe de estar presente un mínimo de 6 meses durante más del 50% del tiempo. • Pueden existir otros síntomas con dolor muscular o alteraciones del humor y el sueño. Excluye A. Pacientes con enfermedades que produzcan fatiga crónica B. Pacientes con diagnóstico activo de esquizofrenia, abuso de substancias, depresión, trastorno del comportamiento alimentario. |
|
II. US Centre for Disease Control (CDC) 1994 1. Fatiga incapacitante, evaluada y no explicable clínicamente, de nueva aparición, persistente o recurrente, de al menos 6 meses de duración. No es resultante del esfuerzo físico. No mejora con el reposo en cama. Causa una reducción significativa de la actividad realizada previamente por el paciente. 2. Asociación de 4 o más de los siguientes síntomas durante 6 meses consecutivos y no presentes antes de la aparición de la fatiga • Dificultades de concentración o de memoria • Faringitis • Adenopatías dolorosas • Dolor Muscular • Dolor articular sin inflamación • Jaquecas • Sueño no reparador • Fatiga tras el ejercicio (>24 horas) Exclusiones: • Enfermedad que justifique la fatiga • Depresión, activa o previa, con rasgos psicóticos, trastorno bipolar, esquizofrenia, demencia o trastornos del comportamiento alimentario • Abuso de substancias entre 2 años antes de la aparición de la fatiga y en cualquier momento después • Obesidad severa. No son excluyentes: • Enfermedades que se definen por su sintomatología y no pueden demostrarse mediante pruebas complementarias (Fibromialgia,trastorno ansiedad etc.) • Enfermedades con el tratamiento adecuado • Enfermedades ya tratadas (Enfermedad de Lyme) • Hallazgos aislados insuficientes para justificar un diagnóstico de exclusión |
|
III. Canadian Definitions (Carruthers 2003) Para el diagnóstico del Síndrome de Fatiga Crónica se deben de cumplirse los criterios 1 al 4 y 7, y 2 o más de las manifestaciones del 5 y al menos 1 síntoma de las 2 categorías incluidas en el punto 6. 1. Fatiga 2. Fatiga o malestar tras el ejercicio 3. Trastorno del sueño 4. Dolor 5. Síntomas neurológicos/cognitivos confusión, dificultad para concentrase y memoria reciente, dificultad para el proceso de la información, clasificación y recuerdo de las palabras, dislexia intermitente, alteraciones de la percepción y sensibilidad, ataxia, desorientación. 6. Al menos 1 síntoma de las 2 categorías siguientes: • Manifestaciones autonómicas: Inestabilidad ortostática, POTS, hipotensión postural, vértigo, palidez extrema, alteraciones intestinales o vesicales con o sin Colon Irritable o disfunción vesical, palpitaciones, inestabilidad vasomotora, irregularidades respiratorias. • Manifestaciones Neuroendocrinas: Pérdida de la estabilidad termostática, intolerancia al frío/calor, anorexia o apetito anormal, fluctuaciones de peso marcadas, hipoglucemia, pérdida de la adaptación y tolerancia al estrés, con empeoramiento de la sintomatología con el mismo y con una recuperación muy lenta e inestabilidad emocional • Manifestaciones Inmunológicas: adenopatías dolorosas, faringitis, síntomas gripales, malestar general, aparición de nuevas alergias o cambio en el status de las antiguas, hipersensibilidad a los medicamentos y/o productos químicos 7. La enfermedad persiste al menos 6 meses en adultos y 3 en niños |
|
IV. Myalgicencephalomyelitis: International Consensus Criteria (2011) Para cumplir criterios es necesario cumplir todos los criterios de la Extenuación Neuroinmune Después del Ejercicio (A), al menos 3 categorías de las manifestaciones neurológicas (B) al menos 3 de la categoría de manifestaciones inmunologícas/gastrointestinales/Genitourinarias (C), 1 de las categorías detrasporte/producción de energía (D). A. Extenuación Neuroinmune Después del Ejercicio (ENDE) se define como una alteración en la restauración de energía en el proceso realzar una actividad, cansacio y descanso. a. El cansacio puede ser debilitante y pueden existir recidivas b. Se considera típica la exacerbación después del ejercicio, que puede ser inmediata o retrasarse durante horas o días. c. El periodo de recuperación es prolongado (24 horas o más). d. Las recidivas pueden durar días o semanas. e. Existe un nivel bajo de fatigabilidad física y mental, con reducción sustancial del nivel de actividad previo a la enfermedad. B. Manifestaciones neurológicas a. Afectación neurocognitiva b. Dolor c. Trastorno del sueño d. Trastornos neurosensoriales, perceptuales y motores. C. Manifestaciones inmunologícas/gastrointestinales/Genitourinarias a. Síntomas gripales recurrentes o crónicas, aparecen o empeoran con el ejercicio. b. Susceptibilidad a las infecciones víricas con periodos de recuperación prolongada. c. Síntomas gastrointestinales. d. Síntomas genitourinarios e. Hipersensibilidad a alimentos, fármacos o sustancias químicas. D. Alteraciones en el trasporte/producción de energía a. Sistema cardiovascular b. Sistema respiratorio c. Pérdida de estabilidad térmica d. Falta de tolerancia a las temperaturas extremas. NO existen criterios en adolescecentes pero se acepta que suelen no cumplir el espectro completo de síntomas observados en adultos, siendo el síntoma central la ENDE. |
Bibliografía
1. Casas Rivero J. Síndrome de fatiga crónica. Pediatr Integral 2009;XIII(3):277-284.
2. Yancey J.R, Thomas S.M, Chronic Fatigue Syndrome:Diagnosis and Treatment. Am Fam Physician. 2012;86(8):741-746.
3. Carruthers BM, van de Sande MI, De Meirleir KL, et al. Myalgic encephalomyelitis: International Consensus Criteria. J Internal Medicine 2011; 270: 327–338.
4. Brown R.T. El adolescente cansado. En: Hidalgo Vicario M.I, Redondo Romero A.M, Castellano Barca G. Medicina de la adolescencia atención integral. 2º Ed. Madrid: Ergon; 2012. P. 621-24.
5. Zhang L, Gough J, Christmas D, et al. Microbial infections in eight genomic subtypes of chronic fatigue syndrome/myalgic encephalomyelitis. J Clin Pathol. 2010;63(2):156-164.
6. Heim C, Nater UM, Maloney E, Boneva R, Jones JF, Reeves WC. Childhood trauma and risk for chronic fatigue syndrome: association with neuroendocrine dysfunction. Arch Gen Psychiatry. 2009;66(1):72-80.
7. White PD, Goldsmith KA, Johnson AL, et al.; PACE trial management group. omparison of adaptive pacing therapy, cognitive behaviour therapy, graded exercise therapy, and specialist medical care for chronic fatigue syndrome (PACE): a randomised trial. Lancet. 2011;377(9768):823-836.
8. Price JR, Mitchell E, Tidy E, Hunot V. Cognitive behavior therapy for chronic fatigue syndrome in adults. Cochrane Database Syst Rev. 2008;(3):CD001027.
9. National Institute for Health and Clinical Excellence. Chronic fatigue syndrome/myalgic encephalomyelitis (or encephalopathy): diagnosis and management of CFS/ME in adults and children. NICE clinical guideline 53. 2007.
Trastornos de sueño. Síndrome de Retraso de Fase (SRF)
Trastornos de sueño. Síndrome de Retraso de Fase (SRF)
M. Merino Andreu (1,2) y A Martínez Bermejo(1,3)
(1) Unidad Pediátrica de Trastornos de Sueño.(2) Unidad de Neurofisiología Clínica Infantil.(3) Servicio de Neurología Infantil. Hospital Universitario La Paz. Madrid
Adolescere 2013; II (2): 76-84
Daniel M. C. tiene 13 años y ha sido un buen estudiante hasta hace 1 año. Desde entonces sus profesores comentan que se encuentra muy distraído y parece “ausente”, quedándose dormido algunas veces en clase. Un día su tutora le pregunta si ha dormido bien y Dani responde que sí pero, habitualmente, cuesta quedarse dormido por la noche. Cuando se acuesta, como está despierto, aprovecha para chatear con los amigos. Los fines de semana y en vacaciones se encuentra mejor porque puede despertarse tarde por la mañana. Sus padres, alarmados porque ha suspendido 5 asignaturas, hablan con su tutora, quien les comenta el problema del sueño de Dani, por lo que acuden a su pediatra.
Su médico, después de hacerle una historia médica muy detallada, le entrega una serie de cuestionarios, tras realizarle algunas pruebas sencillas (ECG, analítica con hemograma, bioquímica rutinaria, metabolismo férrico y hormonas tiroideas), le entrega un folio con un cuadrante en el que debe señalar cuándo duerme y cuándo está despierto, lo que come, si toma alguna medicación y cuándo, si hace ejercicio, etc. Dani le entrega el siguiente esquema:
Dos semanas mas tarde vuelve a ver a Dani y le comenta que el problema que tiene se debe a un desajuste de su “reloj biológico” con el ciclo día-noche, iniciando un tratamiento con melatonina y ciertas modificaciones de sus hábitos diarios (debe sentarse en clase cerca de la ventana, le recomienda realizar deporte al comienzo del día, no debe tomar sustancias estimulantes como café-cocacola-té, debe evitar usar dispositivos electrónicos después de las 20h, etc). Su pediatra insiste en que tome la melatonina siempre a la misma hora, aproximadamente, y antes de la cena, lo que sorprende a su padre, que también ha tomado melatonina para dormir tras volver de un viaje a EEUU pero pocos minutos antes de acostarse.
Introducción
El sueño es un estado fisiológico activo, cíclico y reversible que juega un papel fundamental en el desarrollo infantil y sus problemas en la infancia y la adolescencia son motivos frecuentes de consulta. Los trastornos del sueño en los niños, a diferencia de lo que ocurre generalmente en la edad adulta, pueden tener implicaciones negativas tanto en el desarrollo infantil (conducta, rendimiento escolar, crecimiento) y en la calidad de vida de sus familiares. La preferencia por un determinado horario de sueño del niño o cronotipo determina los horarios de sueño regulados de forma intrínseca y los padres deben conocer el cronotipo de sus hijos porque condicionará en muchas ocasiones la duración del sueño y la actitud familiar frente al sueño. Este cronotipo está regulado por el llamado “marcapasos circadiano”, localizado en los núcleos supraquiasmáticos en el diencéfalo, quienes a su vez controlan la aparición del sueño a través de la melatonina, cuya secreción depende de la luz percibida por la retina.
Uno de los tipos de trastornos de sueño son los trastornos del ritmo circadiano, en los que la cantidad y calidad del sueño son normales, pero ocurren en un momento incorrecto de acuerdo con los horarios socialmente admitidos y habituales. En la población pediátrica el cuadro más habitual es el síndrome de retraso de fase, en el que el paciente tiende a dormirse y despertarse más tarde.
Síndrome de Retraso de Fase (SRF)
Descripción
El síndrome de retraso de fase (SRF) es una alteración del ritmo circadiano del sueño que consiste en un retraso estable del período de sueño nocturno habitual, caracterizado por insomnio a la hora de acostarse y dificultad para despertarse por la mañana en el momento deseado, que provoca somnolencia diurna excesiva(1). Habitualmente, las personas con SRF son incapaces de conciliar el sueño hasta altas horas de la madrugada y no pueden despertar hasta últimas horas de la mañana o por la tarde. Durante sus horarios de sueño preferidos, la duración del sueño y la calidad son generalmente normales. Los problemas de insomnio y somnolencia diurna se originan cuando los pacientes deben ceñirse a un horario social o laboral que obligan a avanzar el inicio del sueño o de la vigilia, siendo muy dificultoso o casi imposible levantarse a la hora estipulada. Durante los días laborales, no suelen dormir más de 2-5 horas por noche, pero es muy característico que el fin de semana compensen la privación crónica de sueño alargando el periodo de sueño. En los periodos vacacionales, libres de límites horarios, vuelven a retrasar su ritmo de sueño sin presentar insomnio ni somnolencia.
Por la imposibilidad de seguir unos horarios regulares de estudio ni de trabajo, suelen ser jóvenes a los que se les califica de noctámbulos o de vagos, y generalmente son mal considerados dentro del contexto sociofamiliar. El índice de depresión, pérdida de apetito y de concentración es alto, así como la presencia de trastornos afectivos en relación a su problema. Como consecuencia sufren un aumento de problemas escolares, laborales, sociales y de salud(2). A su vez, el SRF se relaciona en muchas ocasiones con psicopatología asociada(3).
Prevalencia
El síndrome de retraso de fase (SRF) es el trastorno más frecuente del ritmo circadiano y suele comenzar a manifestarse en la segunda década de la vida. La prevalencia es de un 0.3%-0.17% en la población general y de un 7-16% entre adolescentes y adultos jóvenes. En más de un 40% de los casos se asocia a historia familiar.
Etiopatogenia
Su etiología es desconocida y se han sugerido diferentes hipótesis:
• Periodo circadiano intrínseco más prolongado de lo habitual.
• Anomalías de la curva de respuesta a la luz. De hecho, la hipersensibilidad a la luz vespertina puede ser un factor precipitante o que favorece la cronificación del retraso de la fase del sueño(4).
• Imposibilidad para adelantar la fase del sueño de forma natural(5).
• Menor capacidad para compensar la privación crónica de sueño(6).
Factores de riesgo
1. EDAD: En los adolescentes existe un retraso habitual del ciclo vigilia-sueño, con tendencia a acosarse tarde, y presentando somnolencia diurna excesiva durante el horario escolar y a dormir más de lo habitual durante los fines de semana(7). Esta fase retardada de sueño presente en los adolescentes responde a factores psicosociales propias de la edad (aumento de actividades nocturnas con disminución de la influencia del control paterno) y fisiológicas (como el retraso en la secreción de melatonina, dim light melatonin onset, DLMO(2). El SRF es muy raro en ancianos, con una prevalencia del 3%.
2. GENÉTICA: En mamíferos, el reloj circadiano esta controlado por genes activadores o promotores y represores que regulan el ritmo vigilia-sueño(8). La expresión de estos genes (“clock-gene”) determina las preferencias para establecer el periodo principal de sueño. En el SRF suele existir una agregación familiar y se piensa que este problema tiene un condicionante genético, con una modificación del gen Per3(9) mientras que el gen CK1 epsilon ejerce una función protectora para desarrollar un SRF(10).
3. SEXO: En un estudio realizado para analizar las preferencias “matutinas-vespertinas” en estudiantes, se han apreciado diferencias, siendo más frecuente la preferencia “vespertina” en varones(11).
4. EXPOSICIÓN LUMÍNICA: Se ha propuesto que una de las razones por las que algunas personas desarrollan un SRF es que no se exponen a la luz diurna por la mañana y/o aumentan la exposición a la luz al final del día. Además, se ha relacionado la depresión estacional con menor intensidad de la luz diurna, especialmente al amanecer.
En resumen, en los adolescentes existe una tendencia a retrasar el episodio de sueño nocturno pero no se conoce exactamente cuanto influyen los factores exógenos y endógenos. Aunque muchos jóvenes con horarios de sueño retrasados son capaces de adaptarse a un horario convencional cuando es preciso, es cierto que los síntomas de SRF, retraso estable del ciclo vigilia sueño, aparecen por primera vez a esta edad(12). No está claro si el SRF representa el extremo cuantitativo de la fase retardada de adolescentes o corresponde a una entidad clínica distinta.(13)
Métodos diagnósticos en el síndrome de retraso de fase
La sospecha diagnóstica del SRF se realiza en base a la historia clínica del paciente con queja crónica de insomnio, por un retraso estable del período de sueño nocturno habitual. Estas alteraciones de sueño se asocian a repercusiones en el funcionamiento diurno. Su diagnóstico definitivo se basa en el análisis de los marcadores de fase del sistema circadiano. Estos parámetros pueden determinarse mediante técnicas subjetivas y objetivas.
Métodos Objetivos
Actigrafía: Los actímetros son pequeños aparatos que se sujetan a la muñeca o tobillo y registran el movimiento del sujeto, niño o adulto, en su entorno habitual. La posibilidad de monitorizar a los sujetos, sin que se precise su colaboración activa, durante largos periodos de tiempo, y con dispositivos no invasivos, es la principal ventaja de esta técnica(14).
Polisomnografía (PSG): Es el registro simultaneo de la actividad eléctrica cerebral, los movimientos oculares y el tono muscular en mentón, junto con otras variables biológicas (ECG, respiración, etc). La PSG no es necesaria para el diagnóstico del SRF, pero se realizará cuando se sospeche la coexistencia de patologías de sueño primarias que puedan empeorar el SRF como un síndrome de apneas del sueño o un síndrome de piernas inquietas.
Marcadores de la Fase Circadiana:
1. Determinación de Melatonina: La determinación en muestras seriadas de plasma o saliva del momento preciso en el que se activa la secreción de melatonina (dim light melatonin onset, DLMO) es un excelente marcador de fase del sistema circadiano. Normalmente el DLMO se registra alrededor de las diez de la noche. Los pacientes con SRF sin embargo, presentan DLMO bastante más tardíos(15).
2. Termometría: El registro de temperatura central se considera, junto con el del ritmo de melatonina, el mejor marcador de fase del sistema circadiano. Sin embargo, la dificultad de este procedimiento radica en su carácter invasivo y molesto, por lo que se han desarrollado técnicas alternativas. Una de estas es la medida de la temperatura de la piel de la muñeca. Durante el sueño, la temperatura de la piel aumenta, mientras que esta desciende durante los periodos de actividad. Su principal limitación son las modificaciones debidas a las condiciones térmicas ambientales(16).
Variables integradas. Análisis del ritmo TAP (temperatura, actividad y posición).
Este método unifica la información proporcionada por los ritmos de temperatura, actividad y posición permite detectar con gran precisión los episodios de sueño y determinar la fase del sistema circadiano(17).
Métodos subjetivos
Diarios de Sueño: consiste en anotaciones diarias de las horas cuando sucede el sueño.
Es el método más difundido pero su cumplimentación supone una carga para los evaluados; niños o adultos y evaluadores; los padres cuando se trata de niños menores de 8 años. Figura 1.
Cuestionario Matutinidad-Vespertinidad (M-V): son cuestionarios para la determinación de las preferencias horarias de los sujetos clasificándolos en matutinos o vespertinos. El de Horne y Ostberg fue el original y los Social Rhythm Metric (SRM) y el Munich Chrono Type Questionnaire (MCTQ) son variantes de éste. El cronotipo con preferencia vespertina va unido con un patrón de sueño retrasado o irregular(18), aunque no hay suficiente evidencia para recomendarlo como herramienta de rutina para el diagnóstico del SRF(19).
Anamnesis: Las variables que deben obtenerse para el diagnóstico de SRF son: hora de irse a la cama, hora inicio del sueño, número y duración de despertares de >5 minutos de duración y horarios de sueño. Existen datos que orientan al diagnóstico de SRF:
• Las diferencias entre semana y los fines de semana pueden ser la clave de sospecha de la presencia de un SRF sobre todo en niños y adolescentes
• Cuando no sea posible registrar el sueño sin limitaciones de horarios y en los días de entre semana el inicio del sueño esté retrasada de forma considerable y los fines de semana se duerma más de dos horas respecto al sueño total de entre semana se debe sospechar la presencia de un Síndrome de Retraso de Fase.
Diagnóstico diferencial del síndrome de retraso de fase
El síndrome de retraso de fase de sueño (SRF) debe diferenciarse de aquellos patrones de sueño variantes de la normalidad, sobre todo en adolescentes y adultos jóvenes que presentan una preferencia para mantener un horario de sueño retrasado sin alteración en su funcionamiento o rendimiento (preferencia circadiana vespertina).
Las actividades personales y sociolaborales que se realizan a última hora de la tarde pueden perpetuar y exacerbar el retraso de la fase de sueño. Unos hábitos de sueño inapropiados juegan un papel importante en el desarrollo y el mantenimiento de un patrón de sueño retrasado.
El SRF debe diferenciarse de otras causas que provocan una dificultad en el inicio y/o mantenimiento del sueño:
• Insomnio. En el SRF, cuando el paciente puede acostarse en su horario deseado, la conciliación y el mantenimiento del sueño es normal. Sin embargo, los pacientes con insomnio tienen dificultad para iniciar el sueño independientemente de la hora de irse a dormir y el sueño suele ser fragmentado.
• Síndrome de piernas inquietas. Los síntomas del síndrome de piernas inquietas (p.ej. sensaciones desagradables en las piernas al ir a la cama que mejoran con el movimiento,…) frecuentemente se asocian con dificultad para iniciar el sueño.
• Trastornos psiquiátricos. Diferentes condiciones psiquiátricas se asocian con dificultad para conciliar el sueño, pero el patrón sueño-vigilia característico del SRF no suele estar presente en estas situaciones (p. ej. depresión, trastorno bipolar, trastornos de ansiedad).
• Destacar que algunos trastornos como el trastorno por déficit de atención e hiperactividad (TDAH) y los trastornos del desarrollo pueden presentan una resistencia al ir a la cama y una latencia de sueño prolongada, en relación a un retraso de fase de sueño.
Tratamiento
Edited by Foxit Reader
Copyright(C) by Foxit Corporation, 2005-2009
For Evaluation Only
El objetivo del tratamiento es alinear el reloj circadiano con el ciclo luz –oscuridad de 24 horas deseado. Una aplicación correcta de las normas de higiene del sueño así como la identificación y tratamiento de alteraciones médicas o psiquiátricas concomitantes son las bases para la corrección del SRF. Aunque la cronoterapia, la luminoterapia, y la farmacoterapia son tratamientos adicionales útiles en el SRF(15), se debe cuidar de forma minuciosa la higiene y hábitos del sueño, evitando sustancias estimulantes, ejercicio físico intenso y en general, cualquier actividad que pueda causar una excesiva activación en las últimas horas de la tarde. También hay que disminuir la intensidad lumínica en las horas previas al acostarse y aumentarla al máximo al levantarse, con especial cuidado en la utilización de aparatos electrónicos (ordenadores, móviles, consolas, TV,…) antes de acostarse, ya que pueden provocar un retardo en la conciliación del sueño y progresivamente un retardo de fase.
Cronoterapia
Se recomienda un retraso progresivo de 2-3 horas diarias de los horarios de acostarse y levantarse durante 5-6 días sucesivos, permitiendo al episodio mayor de sueño desplazarse hasta la hora deseada. Este cambio va supeditado a una gran adherencia de rutinas de sueño -vigilia y buenas prácticas de higiene del sueño: se deben evitar las siestas y el horario de las comidas y el ejercicio físico se han ir ajustando al nuevo horario cada día, entre otras. Si bien la cronoterapia ha demostrado ser un tratamiento eficaz en condiciones de laboratorio(20), fuera de éstas, existen muchos factores que limitan la efectividad y aplicabilidad de este método El problema principal es que son necesarios varios días para ajustar el horario, lo que puede resultar difícil y pesado para los pacientes e interferir en sus horarios académicos y laborales, ya que algunos días el episodio principal de sueño es durante el día, con riesgo de exposición a la luz en el tiempo circadiano inadecuado.
Se han descrito otras alternativas, aunque los resultados suelen ser peores. Una posibilidad es adelantar de forma progresiva, 30-60 min, la hora de acostarse y levantarse o dormir durante 6 días en los horarios habituales, después un día sin dormir y al día siguiente adelantar la hora de acostarse y levantarse en 90 minutos. Así sucesivamente hasta llegar a la hora deseada.
Luminoterapia
La luz tiene un rol determinante en la restauración del ritmo circadiano. La administración de luz brillante por la mañana provoca un avance de fase de los ritmos circadianos en el SRF mientras que la administración nocturna incrementa el retraso de fase. La luminoterapia por tanto, consiste en la exposición a la luz durante las primeras horas de la mañana y evitarla a últimas horas de la tarde. La duración y la intensidad de la exposición tienen que ser individualizada, y se debe ir ajustando según la respuesta del paciente. Por ejemplo se puede utilizar de forma inicial 2 horas de luminoterapia al levantarse a 2.500 lux, o exposiciones más intensas durante menos tiempo (10.000 lux durante 30-40 minutos). Existen lámparas especiales de luminoterapia, entre 5.000 y 10.000 lux, que además filtran los dañinos rayos ultravioletas(15, 21) Siguiendo la curva de respuesta de fase (PRC) humana tras la administración a un pulso de luz, los mayores beneficios se obtendrán inmediatamente después del mínimo de temperatura corporal (CT min o T nadir), que suele ser unas dos horas después del inicio del sueño. Como medir la temperatura clínicamente no siempre es fácil, lo más recomendable suele ser realizar la luminoterapia nada más levantarse según la fase circadiana endógena estimada a partir de los diarios de sueño recogidos durante los días previos.
La luminoterapia no se debe realizar en pacientes con retinopatía, fotosensibilidad, manía y tendencia migrañosa. Un examen oftalmológico previo es recomendable en pacientes con alteraciones oculares y/o retinianas antes de comenzar la luminoterapia. Los efectos secundarios son poco frecuentes, pero puede aparecer cefalea, irritación ocular, nauseas, sequedad ocular y dérmica, eritema y precipitación de estados hipomaniacos en pacientes con trastorno bipolar.
Melatonina
La administración de melatonina exógena produce cambios de fase en el reloj circadiano interno, siendo la PCR de melatonina casi la opuesta a la PCR de exposición a la luz. La administración de melatonina vespertina (3-5 mg) es eficaz en producir un avance de fase y en disminuir la latencia de sueño. Sin embargo, como con la luminoterapia, no existen unas guías estandarizadas respecto al tiempo, dosis o duración del tratamiento. En la práctica clínica suele administrarse entre 5-7 horas antes de acostarse, ya que estudios controlados han determinado que el mayor avance de fase se produce cuando se administra melatonina exógena 6 horas antes del dim Light melatonin onset (DLMO)(22) (inicio del ascenso de melatonina con la atenuación vespertina de la luz).
La administración de melatonina a dosis mayores que las dosis supra fisiológicas (>0,5 mg), si bien no producen cambios cronobiológicos mayores, sí pueden presentar un efecto hipnótico concomitante, favorable para el tratamiento del SRF. La utilización en el SRF ha de ser breve, entre 1-3 meses, ya que los tratamientos duraderos han demostrado una mayor tendencia a volver al retraso de fase una vez se suspende el tratamiento. Como terapia única, su efecto es menor que el de la luminoterapia pero la combinación de fototerapia por la mañana y melatonina vespertina parece ser una modalidad terapéutica mucho más eficaz. En este caso se recomienda la administración de melatonina 12 horas antes de la exposición a la luz(23).
Hay que recordar que la utilización de la melatonina no está aprobada por la FDA y EMEA para el tratamiento del retraso de fase, si bien existen numerosos estudios que demuestran su eficacia y seguridad. Debe evitarse en embarazadas y lactantes.
En la actualidad no existe un consenso sobre cómo utilizar estas distintas terapias. En el 2007, la Academia Americana de Medicina del sueño establece unos parámetros guía para el diagnóstico y tratamiento del SRF, basados en la evidencia(15):
1. Diagnóstico: Determinación de la fase circadiana del sueño mediante diarios de sueño o actimetría durante un mínimo de 7 días.
2. Tratamiento:
- Intervenciones comportamentales en todos los casos y de carácter permanente.
- Luminoterapia por la mañana, 2-3 horas antes o al levantarse.
- Administración de melatonina (3-5 mgs) vespertina unas 5-6 horas antes de acostarse.
Tablas y figuras
Figura 1. Agenda o diario de sueño
Bibliografía
1 American Academy of Sleep Medicine. International classification of sleep disorders (ICSD-2). Diagnostic and coding manual. 2005; Westchester,IL.
2 Carskadon, MA, Wolfson, AR, Acebo, C, Tzischinsky, O, and Seif er, R. Adolescent sleep patterns, circadian timing, and sleepiness at a transition to early school days. Sleep 1998;21:871-1.
3 Dagan, Y, Stein, D, Steinbock, M, Yovel, I, and Hallis, D. Frequency of delayed sleep phase syndrome among hospitalized adolescent psy chiatric patients. Journal of psychosomatic research 1998;45:15-20.
4 Aoki, H, Ozeki, Y, and Yamada, N. Hypersensitivity of melatonin suppression in response to light in patients with delayed sleep phase syndrome. Chronobiology International 2001;18:263-71.
5 Ozaki, S, Uchiyama, M, Shirakawa, S, and Okawa, M. Prolonged interval from body temperature nadir to sleep offset in patients with delayed sleep phase syndrome. Sleep 1996;19:3640.
6 Uchiyama, M, Okawa, M, Shibui, K, Liu, X, Hayakawa, T, Kamei, Y, and Takahashi, K. Poor compensatory function for sleep loss as a pathogenic factor in patients with delayed sleep phase syndrome. Sleep 2000;23:553-8.
7 Pin Arboledas G, Cubel Alarcón M, Martin González G, Lluch Roselló A, Morell Salort M. Habits and problems with sleep from 6 to 14 years in the Valencian community. Children’s own view. An Pediatr (Barc). 2011;74(2):103-15.
8 Wisor JP, O’Hara BF, Terao A, Selby CP, Kilduff TS, Sancar A, Edgar DM, Franken P. A role for cryptochromes in sleep regulation. BMC Neurosci. 2002;3:20.
9 Ebisawa T, Uchiyama M, Kajimura N, Mishima K, Kamei Y, Katoh M, et al. Association of structural polymorphisms in the human period3 gene with delayed sleep phase syndrome. EMBO Rep. 2001;2:342–346.
10 Ebisawa T. Circadian rhythms in the CNS and peripheral clock disorders: human sleep disorders and clock genes. J Pharmacol Sci. 2007;103(2):150-4.
11 Adan A, Natale V. Gender differences in morningness-eveningness preference. Chronobiology International. 2002;19:709–20.
12 Gradisar M, Gardner G, Dohnt H. Recent worldwide sleep patterns and problems during adolescence: a review and meta-analysis of age, region, and sleep. Sleep Med. 2011 12(2):110-8.
13 Saxvig IW, Pallesen S, Wilhelmsen-Langeland A, Molde H, Bjorvatn B. Prevalence and correlates of delayed sleep phase in high school students. Sleep Med. 2012 13(2):193-9.
14 Morgenthaler T, Alessi C, Friedman L, Owens J, Kapur V, Boehlecke B, et al. Practice parameters for the use of actigraphy in the assessment of sleep and sleep disorders: an update for 2007. Sleep. 2007a;30:519–29.
15 Rahman SA, Kayumov L, Tchmoutina EA, Shapiro CM. Clinical efficacy of dim light melatonin onset testing in diagnosing delayed sleep phase syndrome. Sleep Med. 2009 May;10(5):549-55.
16 Sarabia JA, Rol MA, Mendiola P, Madrid JA. Circadian rhythm of wrist temperature in normal-living subjects – A candidate of new index of the circadian system. Physiol Behav 2008; 95: 570–80.
17 Ortiz-Tudela E, Martinez-Nicolas A, Campos M, Roll MA, Madrid JA. A New Integrated Variable Based on Thermometry, Actimetry and Body Position (TAP) to Evaluate Circadian System Status in Humans. PLoS Computational Biology 2010; 6(11): e1000996.
18 Giannotti F, Cortesi F, Sebastini T et al. Circadian preference, sleep and daytime behaviour in adolescence. J Sleep Res 2002;11:191-9.
19 Morgenthaler T, Lee-Chiong T, Alessi C, Friedman L; Aurora N; Boehlecke B et al. Practice Parameters for the Clinical Evaluation and Treatment of Circadian Rhythm Sleep Disorders.An American Academy of Sleep Medicine Report. Sleep Med 2007b;30(11): 1445-59.
20 Czeisler CA, Richardson GS, Coleman RM, Zimmerman JC, et al. Chronotherapy: resetting the circadian clocks of patients with delayed sleep phase insomnia. Sleep 1981;4:1-21.
21 Sack l, Auckley D, Auger R, Carskadon M, Wright K, Vitiello M, Zhdanova I. Circadian Rhythm Sleep Disorders: Part II, Advanced Sleep … Disorder, Delayed Sleep Phase Disorder, Free-Running Disorder, and Irregular Sleep-Wake Rhythm. Sleep 2007;30:1484-1501.
22 Mundey K, Benloucif S, Harsanyi K, Dubocovich ML, et al. Phasedependent treatment of delayed sleep phase syndrome with melatonin. Sleep 2005;28:1271-1278.
23 Revell, V.L., H.J. Burgess, et al. Advancing human circadian rhythms with afternoon melatonin and morning intermittent bright light. J Clin Endocrinol Metab 91(1) 2006: 54–59.
Trastorno por déficit de atención e hiperactividad con comorbilidad. Trastorno específico del aprendizaje
Trastornos específicos del aprendizaje y trastorno por déficit de atención / hiperactividad
D. Martín Fernández-Mayoralas, A.L. Fernández-Perrone, A. Fernández-Jaén
Unidad de Neurología Infanto-Juvenil. Hospital Universitario Quirón Madrid. Pozuelo de Alarcón. Madrid
Adolescere 2013; II (2): XX
Introducción
El trastorno por déficit de atención / hiperactividad (TDAH) es el trastorno neuropsiquiátrico más común en la infancia. Su pronóstico depende, entre otros factores, de su detección temprana y de la presencia o no de diferentes comorbilidades, esto es, en la presencia de más de un diagnóstico que se da en un individuo simultáneamente. Una de las comorbilidades más frecuentes en la que queremos centrar la presente revisión, es la de los trastornos específicos del aprendizaje (TEAP). Los niños con TDAH tienen un riesgo mayor que sus coetáneos de tener dificultades académicas, siendo las exigencias atencionales significativamente mayores en la etapa de educación primaria que en las etapas previas, donde los síntomas de hiperactividad y/o impulsividad son prioritarios a la hora de que los padres demanden atención médica. El bajo rendimiento académico es debido, en parte, a las propias dificultades organizativas, de planificación, priorización, atención y precipitación de la respuesta que obedecen a las alteraciones de las funciones ejecutivas (memoria de trabajo e inhibición de la respuesta) propias del TDAH; las dificultades que comportan los trastornos específicos del aprendizaje frecuentemente asociados, como es la dislexia, se suman en la repercusión académica. En general, las niñas con TDAH muestran una menor presencia de trastornos del aprendizaje asociados y mejores habilidades en la capacidad lectora, hecho que influye en su infradiagnóstico.
Cerca del 80% de los casos con TDAH sin tratamiento tiene bajo rendimiento académico, siendo este hecho, uno de los principales motivos de consulta y de fracaso escolar. Aproximadamente un 45% de los paciente con TDAH padecen algún TEAP. Según el Manual diagnóstico y estadístico de los trastornos mentales, texto revisado (DSM-IV-TR), los TEAP son, por orden de frecuencia: 1) trastorno de la lectura o dislexia (dificultad para leer), 2) trastorno de la expresión escrita o disgrafía (dificultad para escribir), 3) trastorno del cálculo o discalculia (dificultad para las matemáticas) y 4) trastorno del aprendizaje no especificado. La afectación debe ser específica, focalizada y precisa, es decir, se logran evidenciar errores en la ejecución que alteran de forma significativa el desempeño escolar. Estos errores son permanentes en todos los contextos y no se vinculan con procesos didácticos a los cuales haya sido sometido el sujeto. Dada esta elevada comorbilidad, la evaluación completa del TDAH en niños y adolescentes debe incluir una valoración de los trastornos psiquiátricos y del aprendizaje que puedan estar asociados. La presencia de comorbilidad condiciona la presentación clínica, el pronóstico, el plan terapéutico y la respuesta al tratamiento.
En el DSM-IV-TR se proponen los siguientes criterios diagnósticos para los TEAP:
1. El rendimiento en lectura, cálculo o expresión escrita es sustancialmente inferior (dos desviaciones típicas) al esperado por edad, escolarización y nivel de inteligencia, evaluado a través de pruebas normativas.
2. Los problemas de aprendizaje interfieren significativamente en el rendimiento académico o las actividades de la vida cotidiana que requieren lectura, cálculo o escritura.
3. Los trastornos del aprendizaje deben diferenciarse de variaciones en el rendimiento escolar, o de dificultades debidas a falta de oportunidades educativas, escolarización o métodos de enseñanza deficientes o factores culturales.
4. Si hay presencia de déficit auditivo, visual, retraso mental, trastorno generalizado del desarrollo o trastorno de la comunicación, se diagnostica trastorno del aprendizaje si el rendimiento académico es significativamente inferior al que se espera, según el trastorno presente.
La exploración neuropsicológica en niños y adolescentes con TDAH resulta útil para conocer el perfil de habilidades y dificultades en el funcionamiento cognitivo y la comorbilidad con trastornos específicos del aprendizaje. Es importante identificar a los niños con TEAP durante su evaluación y a veces durante el seguimiento, pues esta identificación va a permitir planificar intervenciones psicoeducativas y en ocasiones farmacológicas adecuadas, para proporcionar un mejor pronóstico, lo que implica un trabajo y coordinación de tipo multidisciplinar.
Trastorno de la lectura
Es el TEAP más frecuente. En las muestras de TDAH se detecta dislexia en el 25%-50% de los individuos. Inversamente, el 33% de niños disléxicos presentan TDAH. Estos porcentajes evidencian la necesidad de evaluar, de manera rutinaria, las habilidades escolares, especialmente las competencias lectoras, de los niños con TDAH y, a su vez, evaluar la presencia de síntomas de inatención, hiperactividad e impulsividad en los niños con TEAP. En el DSM-IV-TR se proponen los siguientes criterios diagnósticos para el trastorno de la lectura:
1. El rendimiento en lectura, medido mediante pruebas de precisión o comprensión normalizadas y administradas individualmente, se sitúa sustancialmente por debajo de lo esperado, dados la edad cronológica del sujeto, su coeficiente de inteligencia y la escolaridad propia de su edad.
2. La alteración de la lectura interfiere significativamente el rendimiento académico o las actividades de la vida cotidiana que exigen habilidades para ésta.
3. Si hay un déficit sensorial, las dificultades para la lectura exceden de las habitualmente asociadas para él.
La coexistencia de TDAH y dislexia ha generado un gran número de hipótesis que intentan explicar la naturaleza de esta asociación. Ambos trastornos tiene un elevado componente genético; en concreto, el gen del receptor α-2A adrenérgico -ADRA2A-, entre otros, es un factor de riesgo para padecer ambos trastornos simultáneamente. Algunos autores consideran que el TDAH subtipo predominantemente inatento asocia este padecimiento con mayor frecuencia que el TDAH de tipo combinado, aunque este aspecto no podemos considerarlo como seguro con las investigaciones actuales. La experiencia nos hace comprobar diariamente que el trastorno de la lectura puede estar asociado frecuentemente con cualquiera de ambos subtipos. Existen dos modelos que tratan de dar una respuesta al porqué de esta asociación: el modelo de la doble disociación propone el déficit fonológico como déficit cognitivo nuclear de la dislexia, lo cual está aceptado casi universalmente por la mayor parte de la comunidad científica. Esta teoría fonológica sostiene que el déficit básico, responsable de la dificultad para el aprendizaje de la lectura, consiste en una dificultad para asociar grafemas (letras) con fonemas (representaciones mentales de los sonidos básicos del habla que permiten la distinción entre las palabras). Tanto la región parietal posterior del hemisferio izquierdo, donde se ubican las representaciones fonológicas como el área fusiforme (occipitotemporal inferior), o “área visual de las palabras” parecen estar involucradas en estos procesos. La teoría fonológica se sustenta básicamente en el mal rendimiento de las personas disléxicas en tareas que requieren activar la conciencia fonológica (manipulación de los fonemas y segmentación de las palabras en fonemas). El modelo de la doble disociación parte de que el procesamiento fonológico es automático y apenas requiere gasto de economía cognitiva. La fuerte evidencia a favor de la teoría fonológica había contribuido a generalizar la opinión de que el procesamiento fonológico es automático y apenas requiere soporte atencional (lo que a todas luces es falso, dado que los defectos en la inhibición de respuesta típicos del TDAH han sido también descritos en los sujetos con dislexia), siendo la baja memoria de trabajo y la dificultad para mantener la atención subsidiarias del déficit inhibitorio propio del TDAH. El modelo del déficit múltiple, aplicado a la dislexia, toma como punto de partida su comorbilidad y viene avalado por evidencias provenientes de estudios cognitivos (tales como la prueba de claves de la escala de inteligencia de Wechsler para niños o los test de ejecución continuada, así como la evaluación de la memoria fonológica, como componente de la memoria de trabajo), genéticos y de neuroimagen. Este modelo propone identificar en la dislexia un déficit en la conciencia fonológica, la memoria de trabajo verbal y la fluidez verbal (a su vez asociada a la velocidad de procesamiento), es decir, tiene de base ciertos componentes propios de la disfunción ejecutiva, altamente presente en los niños con TDAH, lo que hace que con mayor facilidad se dé lugar a un patrón de comorbilidad. Los niños con TDAH y dislexia muestran alteraciones importantes en todas o varias de estas funciones, por lo que parecen existir factores de riesgo compartidos por ambos padecimientos. Además, en los casos más graves de dislexia existe un fuerte impacto sobre los niveles de inteligencia verbal o general, medidos por los test de inteligencia. A nuestro juicio, y dada la gran heterogeneidad clínica de los pacientes que asocian trastorno de la lectura y TDAH, estos modelos no deberían ser excluyentes.
Por lo tanto, el TDAH y la dislexia comparten déficits básicos en las funciones ejecutivas (memoria de trabajo y bajo control inhibitorio) y la velocidad de procesamiento que involucran a estructuras corticales tales como: la corteza parietal posterior (estructura fonológica, vía indirecta), la corteza occipitotemporal (identificación visual de la palabra, vía directa) y el área de Broca (articulación o subarticulación de la palabra), en el lóbulo frontal. En la medida en que una palabra resulta familiar, se prescinde del análisis fonológico, más lento que el reconocimiento visual, pero cuando el sistema posterior resulta poco eficiente, como ocurre en los disléxicos (o en cualquier individuo que está empezando a leer), interviene el área de Broca, que mediante una subarticulación de la palabra, amplifica el mensaje fonológico y, consecuentemente, la lectura. Dado que la corteza prefrontal —implicada en mecanismos atencionales— activa el sistema lector dorsal, la lectura se ve facilitada o interferida por las capacidades atencionales.
El TDAH y la dislexia son trastornos con un alto componente genético; la gran prevalencia de ambos trastornos, la enorme variabilidad de los genes involucrados (genes diferentes pueden dar lugar a fenotipos parecidos y viceversa, un mismo gen/genes pueden dar lugar a fenotipos muy diferentes) y la presencia habitual de varios genes de susceptibilidad simultáneos (herencia poligénica) explica el extenso espectro fenotípico que suelen mostrar estos trastornos. La etiología de ambos trastornos, por lo tanto, es multifactorial (no es suficiente un factor etiológico aislado), e implica la interacción de múltiples factores de riesgo (es posible que ciertos déficits auditivos o visuales puedan contribuir a modular la expresión del déficit lector) y factores protectores (por ejemplo, un alto cociente intelectual), tanto genéticos como ambientales.
El psicopedagogo debe establecer, además del historial personal, médico y pedagógico del alumno, su cociente intelectual y las características de su perfil neuropsicológico. La evaluación psicopedagógica consiste en valorar el nivel del niño o adolescente en áreas básicas como lectura, escritura y matemáticas para determinar si éstas se encuentran de acuerdo a su edad, escolaridad y capacidades. Se puede obtener información cualitativa sobre el estilo de aprendizaje del niño.
El WISC-IV (Escala de inteligencia de Wechsler para niños IV edición) es el test de inteligencia más empleado y recomendado, por la amplia información que proporcionan sus subtests (comprensión verbal, razonamiento perceptivo, memoria de trabajo y velocidad de procesamiento) y la posibilidad de establecer un perfil, que permite conocer las fortalezas y debilidades del funcionamiento cognitivo.
Deben realizarse pruebas de lecto−escritura en el idioma natural: el TALE (Test de Análisis de Lectura y Escritura) y preferiblemente el PROLEC (Batería de evaluación de los procesos lectores), permiten una análisis detallado por niveles de edad y escolarización de los problemas que aparecen en todas las áreas y modos de la lecto−escritura. El TALE analiza escritura (caligrafía, copia, dictado y redactado) y lectura (de letras, sílabas palabras, texto y comprensión lectora). Existen dos tipos de PROLEC, el PROLEC-R y el PROLEC-SE; el primero, para primaria, analiza, entre otras cosas, identificación de letras, nombre y sonido de las letras, diferenciar palabras y pseudopalabras, procesos léxicos, procesos sintácticos y procesos semánticos; el PROLEC-SE, para secundaria, analiza ítems similares, adaptado a una mayor edad. Si se considera necesario por la mayor incidencia de problemas de lenguaje, se pueden igualmente evaluar los procesos lingüísticos; para ello pueden ser útiles test como el ITPA (test Illinois de Aptitudes Psicolingüísticas) o el PLON- R (Prueba de Lenguaje Oral de Navarra); este último, es apropiado para el screening o detección rápida del desarrollo del lenguaje oral entre los 3 y los 6 años. Parelalemente, los test de atención pueden ser igualmente útiles en la evaluación neuropsicológica; los test de ejecución continuada -CPT (continuos performance test)- o las tareas go/nogo baremadas son los que han mostrado mayor sensibilidad y especificidad. De ser necesario pueden realizarse otras tareas (viso-espaciales, de memoria, etcétera).
El abordaje psicopedagógico de los trastornos específicos de la lectura, corresponde al psicólogo, psicopedagogo o logopeda formado en esta materia. La dislexia es un trastorno crónico cuyas peores consecuencias se darán coincidiendo con la escolarización y la obtención de los diferentes objetivos académicos. Sin embargo la mayoría de las técnicas de mejora de las capacidades lectoras se basan, sobre todo, en la mejora de las habilidades fonológicas del paciente. Resulta de vital importancia que el niño disléxico reciba, desde la manifestación de los primeros síntomas, una intervención psicopedagógica con el fin de minimizar las consecuencias y llevar al máximo nivel de competencia posible sus propios recursos lecto-escritores. En términos generales, el tratamiento se dirige a corregir, mediante métodos psicopedagógicos específicos, las alteraciones verbales y de lecto-escritura, trabajando con preferencia las más afectadas. Cuando existan asociados problemas de articulación, trastornos neurológicos o de personalidad, será preciso contar además con tratamientos de logopedia, neuropsiquiatría y psicología. Existe en la actualidad gran cantidad de material específico en el mercado para la recuperación de la dislexia. Dicho material suele estructurarse en orden de dificultad y también por edades. Independientemente del trabajo efectuado en la escuela o por parte de los diferentes profesionales, es necesaria la participación activa de los padres en el tratamiento.
Desde el punto de vista médico, el metilfenidato es efectivo en el tratamiento de los niños con TDAH y trastornos del aprendizaje. De hecho, este fármaco mejora aspectos básicos de la dislexia en niños con TDAH. Keulers et al compararon el efecto del metilfenidato sobre la lectura en tres grupos: TDAH con dislexia, TDAH sin dislexia y grupo control sin TDAH. Hallaron que el grupo con dislexia mejoraba significativamente más en lectura que el grupo TDAH y control. Bental y Tirosh, al estudiar los efectos del metilfenidato en 25 niños diagnosticados de TDAH y dislexia, hallaron una clara mejoría en la precisión para la lectura de palabras y pseudopalabras. Por estos motivos, además de una monitorización sobre la atención, podría ser adecuado monitorizar la respuesta en las habilidades lectoras en niños con TDAH y dislexia asociada, puesto que es altamente probable encontrar una mejoría. Además, ante la duda terapéutica en un TDAH con sintomatología leve, la comorbilidad con dislexia puede ser un factor determinante para iniciar el tratamiento con medicación para el TDAH. Actualmente se están obteniendo datos muy positivos, tal y como documentan Sumner et al, con el otro fármaco utilizado en el tratamiento del TDAH: la atomoxetina.
Trastorno de la expresión escrita
En general, los resultados indican que la escritura de los niños con TDAH es peor que la de los niños sin TDAH. Aproximadamente la mitad de los sujetos con TDAH de tipo combinado presentan disgrafía. Dado que el 33-47% de los niños con TDAH también cumplen criterios de trastorno del desarrollo de la coordinación (TDC), es posible que éste influya en la capacidad escritora del paciente. Según el DSM-IV, el TDC se define como un rendimiento pobre en las actividades dependientes de la coordinación, por debajo de lo esperado a la edad cronológica y/o cociente intelectual, interfiriendo de forma significativa en su rendimiento y actividad cotidiana. No debe estar justificado por enfermedades médicas (parálisis cerebral, patología muscular, entre otras) o sensoriales. Se manifiesta clínicamente por torpeza motora, problemas en los deportes, retraso en la adquisición de algunos hitos madurativos motores, disgrafía, etcétera. Ya en las primeras descripciones de pacientes con TDAH, o en las primeras definiciones de la disfunción cerebral mínima, se incluían a las manifestaciones motoras propias del TDC, lo que de alguna manera refleja su elevada frecuencia en el TDAH. Por otro lado, del mismo modo que los pacientes con TDAH tienen más errores en operaciones básicas matemáticas por el propio problema atencional, como veremos posteriormente, también muestran con frecuencia una cierta torpeza inherente a su inatención o impulsividad.
El término “disgrafía” hace mención al componente “motor” de la escritura, y tiende a emplearse en referencia a la ilegibilidad de la letra. Los niños con TDAH manifiestan más dificultades en la coordinación motora fina y por tanto en la escritura. Ésta última es una habilidad muy compleja que abarca una mezcla de habilidades cognitivas de tipo táctil, propio y visoperceptiva, de coordinación, y de forma aún más importante, de planificación motora y atención sostenida.
Tradicionalmente, la investigación sobre la escritura en niños con TDAH se ha focalizado en aspectos cualitativos de la letra, tales como la legibilidad global, precisión, espaciado y uniformidad, basándose su análisis en la impresión subjetiva del evaluador. Por otro lado, cuanto más intenso o severo es el déficit de atención, peor es la coordinación fina y la grafía, y peor el contenido de la escritura.
Los niños con TDAH, con independencia del subtipo, muestran posturas incorrectas con más frecuencia que los niños sin este problema; este mal control postural puede influir en la grafía o el trazado. La falta de control motor fino puede producir errores en la escritura (p.e. tamaño incorrecto o mala colocación de letras). Los niños con TDAH (más a mayor grado alto de inatención) parecen tener problemas en diversos aspectos relacionados con la falta de control motor fino, que pueden influir en la manipulación del lápiz (pueden utilizar estrategias compensatorias como bloquear los dedos en extensión o empuñar el lápiz). Estos problemas en la coordinación fina se describen en el 30-50% de los pacientes con TDAH.
En la década de los 80, se acuñó en países nórdicos el término DAMP (acrónimo de “déficits in attention, motor control and perception”) para recoger un grupo de pacientes especial con TDAH y TDC. Este problema estaba presente de forma severa en el 1-2% de los escolares, y se observaba más levemente en otro 3-6%. No es infrecuente que estos chicos asocien problemas en su competencia social, problemas en su comunicación (dificultades pragmáticas del lenguaje), ubicándose en algunos casos en un terreno gris entre el TDAH de predominio inatento y el síndrome de Asperger.
En una esfera más pedagógica, aparece el término TANV (trastorno de aprendizaje no verbal). Este término engloba pacientes con dificultades en la integración visual, táctil y motora. A nivel cognitivo, muestran habilidades lingüísticas conservadas, pobre grafismo, malas habilidades viso-espaciales, dificultades en el razonamiento matemático y la aritmética, mala coordinación, y con mucha frecuencia déficit de atención y baja competencia social.
Al igual que el DAMP, el TANV no está incluido en el DSM-IV, su prevalencia es desconocida y se solapa tanto con el DAMP como con el TDAH de predominio inatento asociado a TDC. Es indudable la presencia en las consultas especializadas de ciertos endofenotipos clínicos encuadrables en estos trastornos, motivo por el que se han descrito en este tema.
La calidad de la grafía o la postura-habilidad para la escritura, pueden valorarse en la propia consulta o a través de la valoración de trabajos escolares, sin embargo, el PROESC (Evaluación de los procesos de escritura, se realiza a alumnos de primaria), permite analizar la escritura mediante la realización de dictado de sílabas, palabras, pseudopalabras y frases. También incluye la escritura de un cuento y redacción de textos.
El tratamiento farmacológico del TDAH no difiere atendiendo a la presencia o no de torpeza o alteraciones visoperceptivas. Sin embargo, se ha demostrado en numerosos estudios como el empleo del metilfenidato mejora la coordinación motora, la postura del paciente con TDAH y su grafía. En general, los estudios documentan una mejoría en las habilidades escritoras cuando los niños con TDAH reciben metilfenidato, a través del análisis de la legibilidad, la exactitud y la precisión, la coordinación óculo-manual o la psicomotricidad fina. Respecto a la atomoxetina, aunque este tratamiento ha demostrado recientemente mejorar la comprensión y decodificación léxica, no hay literatura relacionada con su potencialidad en la mejora de la escritura.
Trastorno del cálculo y de las matemáticas
En ocasiones, en la literatura consultada, el “trastorno del aprendizaje de las matemáticas” se superpone a la “discalculia o trastorno del cálculo del desarrollo”, lo que no es del todo exacto, dado que, en nuestra opinión, se trata de dos procesos muy diferentes y el segundo no es solamente una forma más leve del primero. Un 25-30% de los pacientes con TDAH presentan trastorno del cálculo o de las matemáticas. La discalculia está muy relacionada con el TDAH, los síntomas de disatención pueden producir claros despistes durante las operaciones aritméticas. Del mismo modo, la impulsividad es un síntoma que penaliza la realización tanto las operaciones aritméticas como los problemas más complejos.
Estadísticamente el sexo femenino y la presencia de un TDAH de predominio inatento se relacionan con mayores problemas en las matemáticas. De igual forma, la presencia de un TDC, un DAMP o un TANV comórbido al TDAH, influencian claramente la probabilidad de aparición de problemas en el desempeño de las matemáticas dado que las alteraciones visoperceptivas (hemisferio derecho) se vinculan con la habilidad para las matemáticas. La medicación para mejorar los síntomas del TDAH ha demostrado una mejoría clara y evidente en el desempeño de las matemáticas, especialmente y de forma inmediata en el caso del cálculo. Más aún, el comienzo tardío del tratamiento farmacológico en los pacientes con TDAH se asocia con un empeoramiento académico en el área de las matemáticas.
Bibliografía
1. Fernández-Jaén A, Martín Fernández-Mayoralas D. Medicamentos estimulantes en el tratamiento del trastorno por déficit de atención/hiperactividad. JANO. 2010; 1.761: 69-72.
2. Martín Fernández-Mayoralas D, Fernández-Jaén A. Trastorno por déficit de atención/hiperactividad. Acta Pediatr Esp. 2010; 68: 167-172.
3. Fernández-Jaén A, Martín Fernández-Mayoralas D, Calleja-Pérez B, Muñoz-Jareño N. Eficacia sostenida del metilfenidato de liberación osmótica: estudio en 266 casos. Rev Neurol. 2009; 48: 339-345.
4. Grupo de Trabajo de la Guía de Práctica Clínica sobre el Trastorno por Déficit de Atención con Hiperactividad en Niños y Adolescentes. Guía de Práctica Clínica sobre el Trastorno por Déficit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Agència d’Informació, Avaluació i Qualitat (AIAQS) de Cataluña. Barcelona: Ministerio de Ciencia e Innovación, 2010.
5. Wigal SB, Chae S, Patel A, Steinberg-Epstein R. Advances in the treatment of attention-deficit/hyperactivity disorder: a guide for pediatric neurologists. Semin Pediatr Neurol. 2010; 17: 230-236.
6. Wolraich M, Brown L, Brown RT, DuPaul G, Earls M, Feldman HM, et al. ADHD: clinical practice guideline for the diagnosis, evaluation, and treatment of attention-deficit/hyperactivity disorder in children and adolescents. Pediatrics. 2011; 128: 1.007-1.022.
7. Dupaul GJ, Gormley MJ, Laracy SD. Comorbidity of LD and ADHD: Implications of DSM-5 for Assessment and Treatment. J Learn Disabil. 2013;46:43-51.
8. Zoëga H, Rothman KJ, Huybrechts KF, Ólafsson Ö, Baldursson G, Almarsdóttir AB et al. A population-based study of stimulant drug treatment of ADHD and academic progress in children. Pediatrics. 2012;130:e53-62.
Libro recomendado
Barkley RA. Attention-Deficit Hyperactivity Disorder. 3ª ed. The Guilford Press, NY, 2006.