Embarazo en la adolescencia. Aspectos a tener en cuenta
Embarazo en la adolescencia. Aspectos a tener en cuenta
B. Castro Martín *, B. Martínez Montoro **, M. Panal Cusati **
*Médico Adjunto del Servicio de Reproducción HULP. Responsable de la Unidad de Ginecología de la Infancia y Adolescencia.
** Residente de 3º año del Servicio de Obstetricia y Ginecología HULP.
Adolescere 2013; II (2): 57-68
Resumen
|
En las adolescentes, el embarazo es una situación sumamente particular que plantea múltiples preguntas y no menos problemas: — de índole médica: aumento del índice de abortos, descubrimiento tardío del embarazo, cuyo seguimiento es deficiente o nulo, parto prematuro, mortalidad perinatal elevada, etc. — de índole social: rechazo de la familia, interrupción de la escolaridad, consumo de drogas, abandono del recién nacido, etc. Con frecuencia esta situación es la misma que había vivido la propia madre de la adolescente, quien lamentablemente transmite un esquema idéntico a su descendencia. |
Presentamos el caso de una paciente de 17 años que acude a la consulta obstétrica del área refiriendo gestación. Entre sus antecedentes personales destacan una escoliosis congénita y un episodio de meningitis vírica a los 13 años de edad, no cuenta alergias medicamentosas conocidas ni cirugías previas. La menarquia se había producido a los 14 años y sus ciclos menstruales hasta la fecha, eran irregulares.
Como antecedentes familiares la paciente destaca el fallecimiento de su padre en accidente de tráfico y la Diabetes Mellitus tipo 1 padecida por su abuela materna.
A la anamnesis niega consumo de alcohol u otras sustancias tóxicas. Su exploración física no muestra hallazgos relevantes, las constantes son normales y por fecha de la última menstruación, la edad gestacional estimada son 7 semanas.
Tras realizar la petición de las pruebas complementarias pertinentes se cita a la paciente para un nuevo control 3 semanas después. En dicha visita se confirma la gestación ecográficamente así como la datación de la misma y se programa el seguimiento del embarazo a partir de entonces con controles mensuales hasta la semana 36 de gestación y la realización de las ecografías y analíticas recomendadas por la Sociedad española de Ginecología y Obstetricia.
La paciente acude regularmente a las consultas programadas y el embarazo transcurre de manera normal sin incidencias. Las pruebas de screening y las ecografías no revelan alteraciones fetales.
A las 40 semanas y 3 días la paciente ingresa por urgencias de la maternidad de nuestro hospital por trabajo de parto y rotura de membranas con líquido meconial. Tras 7 horas de dilatación cervical se produce el parto mediante Fórceps de Kjelland para abreviar expulsivo por riesgo de pérdida de bienestar fetal. El recién nacido, varón, presenta buenos signos de vitalidad y un test de Apgar, al minuto y a los 5 minutos, de 7 y 9 puntos respectivamente. Su peso es de 3570 g y el ph arterial de 7,25, no siendo necesaria más que una reanimación fetal tipo I.
El puerperio transcurre sin incidencias, se instaura a lactancia materna, y la paciente es dada de alta tras 72 horas de cuidados postparto con la citación oportuna en consultas externas de suelo pélvico y las recomendaciones para su seguimiento en zona.
Si bien lo reflejado hasta ahora sería un caso poco relevante o incluso atípico, por la normalidad del mismo a pesar de la juventud de la gestante, encontramos algo interesante al revisar la historia clínica de la paciente: su historia neonatal.
La paciente, nuestra actual gestante, había nacido a las 34 semanas de gestación fruto del segundo embarazo de su madre, quien con 21 años, había sido madre adolescente de su primer hijo a los 19 años y contaba así mismo, con una IVE en el periodo transcurrido entre ambos partos.
Dicho embarazo, controlado aunque no deseado, había transcurrido con consumo de marihuana durante el primer trimestre y contaba en su historia con un intento autolítico de la madre a las 8 semanas de gestación. La gestante presentaba serologías negativas para VIH y VHC a pesar de que refería que el padre del feto que gestaba, quien no era su actual pareja, tenía positividad serológica para estas dos enfermedades transmisibles.
El parto había transcurrido mediante cesárea a las 34 semanas de embarazo, previa rotura prematura de membranas a la 31ª semana. La recién nacida había presentado un peso de 2000 g., adecuado para la edad gestacional, y había requerido ingreso durante casi dos semanas en la unidad de cuidados intensivos neonatales.
Introducción
El embarazo en la adolescencia se define como aquel embarazo que ocurre antes de finalizar el desarrollo somático completo (1, 2).
Es difícil evaluar el impacto real del embarazo en esta etapa dado que “adolescencia” resulta a efectos prácticos un término demasiado impreciso, al igual que también lo es a efectos estadísticos. Adolescencia resulta un término cualitativo, que atañe a lo biológico y puede concernir a lo legal y que en medicina por influencia anglosajona se suele asimilar a “teenagers”. La OMS fija sus límites entre los 10 y los 20 años (3).
La adolescencia es un periodo de transición en el cual las adolescentes constituyen un grupo muy heterogéneo de por sí, tanto si se consideran las distintas franjas de edad, como sus momentos de desarrollo, sus experiencias, su madurez afectiva y psicológica o sus condiciones de vida. El hecho de que la biología haga posible el embarazo en dicho periodo no lleva implícito que el proceso madurativo haya culminado.
En general, los expertos coinciden en que si la mujer tiene menos de 15 años, hay que considerar un riesgo médico directamente ligado a la edad, mientras que en las de más edad, los criterios pronóstico fundamentales serán los socioeconómicos(3). (Figura.1.)
Cada vez en mayor medida, los embarazos durante la adolescencia generan preocupación porque tienden a perpetuar la pobreza y el aislamiento social de la mujer y sus hijos. (Figura. 2.)
El grado de educación es probablemente el factor más importante en términos de riesgo reproductivo y riesgo perinatal. Existen metaanálisis que demuestran que la edad deja de ser un factor de riesgo por sí mismo y son la contención social, el control perinatal y el estado nutricional los que favorecen o disminuyen el riesgo perinatal (Figura 3.). Un estudio reciente, realizado en Canadá, ha demostrado una vez más como los recién nacidos de nulíparas de 19 años o menores presentan resultados perinatales adversos al compararlo con un grupo control de recién nacidos de madres entre 20 y 29 años. En este trabajo el riesgo de parto pretérmino en el grupo de estudio fue 4,5 veces mayor, y el riesgo de defectos congénitos y muerte infantil se multiplicaron por 1,8 y 3,8 respectivamente(4).
Pero mientras la mayoría de los estudios acerca del embarazo en adolescentes consideran la franja de edad mencionada, un estudio tailandés publicado recientemente, trata de evaluar la influencia de la edad en el grupo de adolescentes “extremadamente jóvenes” y arrojan resultados perinatales de un grupo de madres de 16 años o menores.
La anemia, las alteraciones cardiacas, la patología tiroidea y las alteraciones pulmonares fueron significativamente más frecuentes en el seguimiento de sus embarazos. Las complicaciones gestacionales como la diabetes gestacional, la placenta previa, el parto pretérmino o el menor peso al nacer de sus recién nacidos, también alcanzaron diferencias estadísticamente significativas respecto al grupo control de gestantes entre 20 y 29 años(5).
El embarazo en la adolescencia suele considerarse pues, como una situación de riesgo, peligrosa, inapropiada e inadecuada para los intereses de los jóvenes, particularmente por afectar en mayor medida a adolescentes que viven en la pobreza en países poco desarrollados. Mientras que las tasas de fertilidad descienden alarmantemente en los países desarrollados, no podemos decir lo mismo en estos grupos jóvenes de países en desarrollo especialmente en territorios subsaharianos y sudeste asiático, lo cual supone una situación de preocupación mundial a nivel sociocultural dado que perpetúa el modelo de pobreza extrema durante generaciones(6).
De cualquier modo, hay que tener en cuenta que no siempre el embarazo en la adolescencia es una situación problemática o de alto riesgo y cuando no lo es, es importante que se mantenga una actitud adecuada por parte de los profesionales médicos para que el modelo de abordaje no se elabore bajo un concepto de enfermedad porque ello podría provocar situaciones iatrogénicas. Así mismo, en los casos en los que el contexto biológico, psicológico o social en los que se produzca el embarazo adolescente, aconsejen considerarlo como alto riesgo, deberán manejarse con destreza en manos de grupos multidisciplinares, dada la dificultad del comportamiento adolescente así como los problemas de salud específicos de este grupo de edad; para atender necesidades que, si se obvian, puedan derivar en complicaciones.
Desarrollo del embarazo
Consulta Preconcepcional
Este acto médico no suele tener lugar cuando el embarazo es accidental pero ya comentamos que la gestación puede aparecer como fruto de un proyecto de pareja en el seno de determinadas culturas.
En la consulta preconcepcional tendremos que realizar una buena historia clínica de la adolescente que permita identificar posibles riesgo y valorar su madurez. Deberemos repasar el calendario vacunal (que puede experimentar variaciones según los países), y valorar la necesidad de recomendaciones específicas al respecto.
Es aconsejable solicitar una analítica preconcepcional, con hemograma y bioquímica básicas. También unas serologías para lúes, toxoplasma, rubeola, VHC, VHB y VIH.
Si no existiera inmunidad, se recomienda la vacunación frente a rubeola, varicela, VHB y tétanos(3).
Debemos investigar sobre la existencia de enfermedades o alteraciones hereditarias, especialmente en culturas que permitan uniones consanguíneas, hábitos o uso de sustancias adictivas, mundo laboral y/o exposiciones ambientales. Es buen momento para tratar de promover estilos de vida saludables en la pareja y también para prescribir ácido fólico.
Prueba de embarazo
La solicitud de una prueba de embarazo por parte de una adolescente debe constituir inequívocamente una señal de alarma para el personal sanitario. Aunque el resultado sea negativo refleja la convicción o sospecha por parte de la joven de haber podido estar embarazada, y habrá que calibrar el contexto que originó la demanda de la prueba y ver si esa situación está ya resuelta o si es el momento de iniciar una conducta profiláctica.
En caso de ser positiva, habrá que realizar con la mayor brevedad posible, un cálculo preciso de la edad gestacional así como una evaluación global de la adolescente embarazada.
Precisaremos una historia clínica detallada y habrá que considerar su nivel socio-educativo, las expectativas vitales, la autoestima, los antecedentes psiquiátricos, los recursos económicos. Conviene conocer las características de la familia, su sustento económico y social, así como las de su pareja.
Hemos de tener en cuenta que las adolescentes no son simplemente embazadas muy jóvenes si no que cada una tiene un grado de vulnerabilidad, que pasan por distintas fases con la susceptibilidad propia de su edad así como de los efectos socioculturales y económicos del momento. Cuando un embarazo se produce accidentalmente la mujer puede sentir una fuerte ambivalencia emocional y debemos actuar con cautela. Se debe perseguir el objetivo de que sea la propia protagonista quien active por sí misma sus mecanismos de decisión. Este tipo de actuaciones requieren de una sólida formación clínica y humanística así como el desarrollo de una serie de habilidades que permitan el correcto manejo clínico de estructuras a veces, muy complicadas, de ahí que si no se poseen dichas aptitudes es aconsejable transferir la tarea a otro colega mejor cualificado(7).
Embarazo
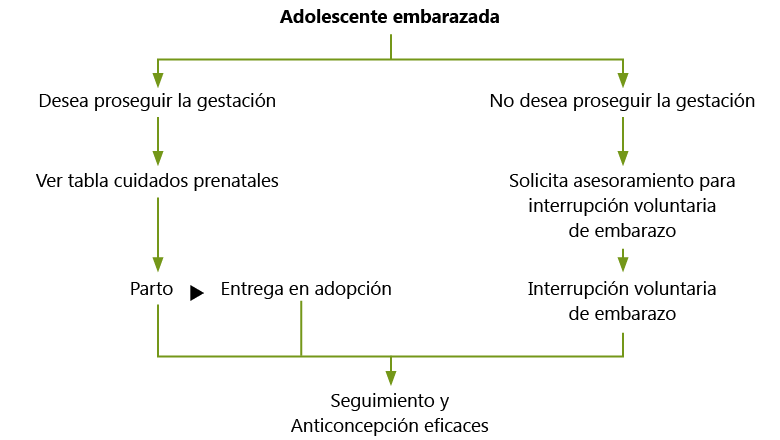
La adolescente puede querer proseguir la gestación bien por deseo de procreación bien porque, aún no queriendo ser madre, no quiera, no pueda interrumpir el embarazo.
En el primer caso debe ponerse la adolescente en contacto con los grupos de asistencia pre y posnatal existentes en la comunidad y emplear el tiempo de gestación para ayudarle a asumir la maternidad. Cuando la decisión es dar el recién nacido en adopción, se deberá buscar el soporte psicológico adecuado así como ayuda para estructurar los servicios sociales y legales. Esta situación es emocionalmente más compleja, menos frecuente en nuestro medio, y puede crear alteraciones conductuales de índole diversa si no se maneja de forma adecuada por personal especializado.
El primer objetivo para un buen control prenatal es conseguir involucrar a la madre. Ha de intentarse evitar cambios en el profesional que atienda a la adolescente, quien debe mostrar tacto, respecto, discreción así como evitar olvidos y establecer empatía con ella. Se valorará según los casos establecer grupos de vigilancia médica en programas de apoyo si fuese preciso(3).
Cuidados prenatales
El control de la gestación debería iniciarse en el primer trimestre y dentro de este, lo antes posible. En la primera visita debería estructurarse un enfoque de riesgo así como una evaluación de la adolescente embarazada (Figura. 3.). Tras esta, se recomienda citar una nueva visita en 7-15 días y posteriormente cada 4 semanas hasta la 36ª semana de gestación. Las citas deberán establecerse semanalmente desde la 38 ª semana de embarazo. De cualquier modo se recomienda accesibilidad a la consulta y los profesionales para que la adolescente consulte sus dudas.
Siguiendo las recomendaciones de la Sociedad Española de Obstetricia y Ginecología (SEGO) podemos valorar la aplicación de las siguientes actitudes preventivas: (Tabla I)
Aspectos diana
Nutrición
El incumplimiento de una correcta nutrición es una de las principales características de la adolescencia. La dieta en estas etapas suele ser pobre en vitaminas A, E y folatos así como en oligoelementos, déficit que suele ir paralelo al incremento de la consideración de “riesgo”. El peso inicial de la gestante suele ser también menor de lo adecuado y dado que ella se encuentra todavía en periodo de desarrollo hace fácilmente previsible la necesidad frecuente de suplementos nutricionales. Ha de tenerse en cuenta que en adolescentes obesas son igualmente posibles estas carencias.
Hábitos tóxicos
Habrán de evaluarse en cada consulta (tabaco, alcohol, café, fármacos y tóxicos). Trataremos de realizar consejo sobre los que fueran necesarios y con el personal adecuado.
Del mismo modo deberemos prestar atención a:
- Prevención de trastornos de salud mental
- Violencia doméstica
- Vacunas
- Gamma globulina anti-D
- Fomentar e instruir en Lactancia Materna
Por ser todos ellos puntos especialmente vulnerables en las gestantes de este grupo de edad.
Organización del seguimiento. Estructuración de las visitas
Para la organización en consulta recomendamos el seguimiento de las recomendaciones propuestas por la SEGO (ver Tabla. 2.), teniendo en cuenta que todas estas serán adaptables a los requerimientos específicos que pueda requerir la situación individual de cada paciente.
Desde la semana 38 de gestación deberán continuarse controles semanales con idéntica estructura hasta la semana 41ª en la que se programará, si no ha ocurrido entonces, la finalización del embarazo.
Control postparto
Será fundamente mantener adherida a la madre adolescente en la etapa puerperal. Deben programarse, incluso desde la última visita obstétrica, las consultas posteriores al parto para evaluar el curso del puerperio y poder detectar anomalías en la recuperación de la adolescente. Es importante evaluar su estado emocional así como el manejo de la joven madre con el recién nacido.
Si se diagnosticó diabetes gestacional será preciso reevaluar la tolerancia a la glucosa. Se recomienda revisar el calendario vacunal por si fuera preciso alguna profilaxis o dosis de recuerdo e igualmente la profilaxis de inmuno-incompatibilidad Rh es preciso revisarla y si se cree necesaria, administrarla preferentemente dentro de las primeras 72 horas que siguen a la exposición(3).
Otro punto importante a tener en cuenta en este periodo es que hasta en un 20% de estas madres adolescentes se produce una segunda gestación que hemos de intentar prevenir.
Estas adolescentes son peores usuarias de anticoncepción que sus pares que no tienen una gestación previa, pero parece que el papel fundamental en este porcentaje lo juega la persistencia de factores de riesgo ya identificados(8).
Las estrategias de prevención frente a nuevas gestaciones deberán incidir en varios ámbitos. Se buscará generar promotores de salud entre pares intentando alcanzar un adecuado clima grupal. Es importante tratar de acompañar a la familia y proporcionar educación formal e informal en ello puede ayudarnos un seguimiento postparto pertinaz.
Se recomienda elegir anticonceptivos lo más eficaces posible teniendo en cuenta la realidad de la pareja y advertir sobre la no protección frente al nuevo embarazo de la lactancia materna sino se cumplen los requisitos necesarios como las tomas nocturnas regladas, amenorrea, etc. Los anticonceptivos con sólo gestágeno y los dispositivos intrauterinos pueden constituir una buena alternativa si no están contraindicados.
Interrupción voluntaria del embarazo
Si la adolescente no desea seguir el embarazo y opta por la interrupción voluntaria (IVE), deberá buscarse el asesoramiento adecuado. La despenalización de la IVE en España(9)ha permitido mayor aceptación social de la misma al reconocer estos casos entre sus supuestos. Para solicitar la IVE es necesaria la autorización expresa de la adolescente así como la de un adulto en calidad de padre o tutor de la joven.
Es imprescindible que estos casos sean atendidos por personal especializado y cualificado para aquello, así mismo como que los tiempos de espera y la accesibilidad a estos servicios sean fáciles para la paciente.
Serán necesarios grupo y Rh así como las pruebas complementarias que el profesional considere oportunas para descartar factores que puedan suponer una complicación posterior. Cuando un aborto se decide con soporte afectivo y puede realizarse con un mínimo intervalo de tiempo, la pérdida que comporta puede superarse como ocurre con tantas otras pérdidas y la mayoría de expertos coinciden que si así sucede, puede producir menos transtornos en la adolescente que proseguir la gestación o entregar al recién nacido en adopción.
Del mismo modo que tras el parto, tras una IVE deberá concertarse una entrevista con la adolescente para la elección de un método de anticoncepción eficaz que evite conductas repetitivas.
Iniciativas sociales
Parece fundamental la constitución de una sólida red socio-sanitaria, con una potente base educativa, para tratar de mejorar la atención y el futuro de madres y padres adolescentes así como para la prevención de embarazos en este grupo. Así mismo es necesario fortalecer la creación de programas sociales educativos y sanitarios para conseguir estrategias de prevención más efectivas.
El embarazo en adolescentes resulta costoso para estas y para la sociedad, tanto a corto como a medio y largo plazo, y es por ello, que todos nosotros, como profesionales sanitarios y como ciudadanos, debemos implicarnos en la resolución de este problema social.
Tablas y figuras
Tabla I.
Se estimulara a la adolescente para que consulte lo que necesite. Valorando las complicaciones posibles se puede incidir en los cuidados específicos que las eviten
|
EVIDENCIA para la aplicación de diferentes actividades preventivas en los/as adolescentes |
|
|
Modificado de National Guideline Clearighouse, 2004 |
|
Tabla II
|
Tabla CUIDADOS PRENATALES |
||||
|
SG |
Anamnesis |
Examen Físico |
Pruebas complementarias |
|
|
20ª-24ª |
Puesta al día. Valoración de factores de riesgo |
TA Peso Exploración pélvica: AU – MF – PF5 – FCF6 |
Estudio urinario de rutina con tiras reactivas para proteinas, glucosa y cuerpos cetónicos |
|
|
26ª-28ª |
Puesta al día. Valoración de factores de riesgo |
TA Peso Exploración pélvica: AU – MF – PF – FCF |
Hemoglobina, hematocrito Coombs indirecto* Serologías* Test de O’Sullivan* Estudio urinario de rutina con tiras reactivas para proteínas, glucosa y cuerpos cetónicos |
|
|
30ª-32ª |
Puesta al día. Valoración de factores de riesgo |
TA Peso Exploración pélvica: AU – MF – PF – FCF |
Hemoglobina, hematocrito Serología hepatitis B Resto serologías* Test de O’Sullivan (de 32ª a 36ª SG) Estudio urinario de rutina con tiras reactivas para proteínas, glucosa y cuerpos cetónicos |
Ecografía de 3er trimestre (de 32ª a 36ª SG) |
|
34ª-36ª |
Puesta al día. Valoración de factores de riesgo |
TA Peso Exploración pélvica: AU – MF – PF – FCF |
Estudio urinario de rutina con tiras reactivas para proteinas, glucosa y cuerpos cetónicos Cultivos vaginal y rectal para streptococo beta-hemolítico (de 35ª a 37ª SG) |
|
|
38ª |
Puesta al día. Valoración de factores de riesgo |
TA Peso Exploración pélvica: AU – MF – PF – FCF – NST |
Estudio urinario de rutina con tiras reactivas para proteinas, glucosa y cuerpos cetónicos |
|
|
1 TA = Tensión arterial; 2 IMC = Índice de masa corporal; 3 AU = Altura uterina (valoración del crecimiento fetal); 4 MF = Movimientos fetales; 5 PF = Valoración de la posición fetal; 6 FCF = Frecuencia cardíaca fetal; 8 non stress test; * en caso de factores de riesgo; ** según laboratorio de referencia |
||||
Figura 1
|
Desarrollo de embarazo en las adolescentes |
|
|
Aspectos médicos |
Aumento de mortalidad y morbilidad perinatal de los hijos de madres |
|
Aumento de crecimiento intrauterino restringido, sobre todo si ha habido maternidad precedente y aún más si el período intergenésico es inferior a 6 meses |
|
|
Mayor frecuencia de anemia ferropénica |
|
|
Menor riesgo de toxemia, partos distócicos, cesáreas y malformaciones fetales |
|
|
Con un correcto seguimiento obstétrico:
|
|
|
Otros aspectos |
Franja de edad |
|
Diferencias entre chicas de la misma edad |
|
|
Nivel socioeconómico |
|
|
Hábitos:
|
|
Figura 2
|
Consecuencias del embarazo en adolescentes |
|
Interrupción de su desarrollo Interrupción de los estudios Recursos limitados para ejercer la maternidad |
|
Matrimonio prematuro Mayor multiparidad entre las madres adolescentes Pobreza Estigma de ilegitimidad Depresión Embarazo adolescente recurrente de una generación a otra |
|
En madres menores de 16 años: Soldadura precoz de cartílagos Desmineralización ósea en caso de lactancia materna |
Figura 3
Bibliografía
1. Scholl TO, Hediger ML, Salmon RW, Belsky DH, Ances IG. Association between low gynecological age and preterm birth. Paediatr Perinat Epidemiol 1989;3(4): 357-66.
2. Kurth F, Bélard S, Mombo-Ngoma G, Schuster K, Adegnika AA, Bouyou-Akotet MK, et al. Adolescence as risk factor for adverse pregnancy outcome in Central Africa–a cross-sectional study. PLoS One 2010;5(12):e14367.
3. Embarazo en la Adolescencia. Ginecología en la Adolescencia. Protocolos de la Sociedad Española de Ginecología y Obstetricia. www.prosego.com.
4. Shrim A, Ates S, Mallozzi A, Brown R, Ponette V, Levin I, et al. Is young maternal age really a risk factor for adverse pregnancy outcome in a canadian tertiary referral hospital? J Pediatr Adolesc Gynecol 2011;24(4):218-22.
5. Chantrapanichkul P, Chawanpaiboon S, Adverse pregnancy outcomes in cases involving extremely young maternal age, Int J Gynecol Obstet (2012), http://dx.doi.org/10.1016/j.ijgo.2012.08.024
6. Pinto e Silva JL, Garanhani Castro Surita F. Gravidez na adolescência: situação atual. Rev bras ginecol obstet. 2012; 34(8):347-50
7. Delgado M. La fecundidad joven y adolescente en España. Granada: Universidad de Granada; 2000.
8. Canetti A. Los embarazos consecutivos en la adolescencia. Revista Uruguaya de Gineclogía de la Infancia y Adolescencia, 2000; 2 (2): 51- 64.
9. Dirección General de a Salud. Área Mujer Niñez. Normas de Atención Integral de la Salud en la Adolescencia. Montevideo: Ministerio de Salud Pública; 2003.