Trastornos de sueño. Síndrome de Retraso de Fase (SRF)
Trastornos de sueño. Síndrome de Retraso de Fase (SRF)
M. Merino Andreu (1,2) y A Martínez Bermejo(1,3)
(1) Unidad Pediátrica de Trastornos de Sueño.(2) Unidad de Neurofisiología Clínica Infantil.(3) Servicio de Neurología Infantil. Hospital Universitario La Paz. Madrid
Adolescere 2013; II (2): 76-84
Daniel M. C. tiene 13 años y ha sido un buen estudiante hasta hace 1 año. Desde entonces sus profesores comentan que se encuentra muy distraído y parece “ausente”, quedándose dormido algunas veces en clase. Un día su tutora le pregunta si ha dormido bien y Dani responde que sí pero, habitualmente, cuesta quedarse dormido por la noche. Cuando se acuesta, como está despierto, aprovecha para chatear con los amigos. Los fines de semana y en vacaciones se encuentra mejor porque puede despertarse tarde por la mañana. Sus padres, alarmados porque ha suspendido 5 asignaturas, hablan con su tutora, quien les comenta el problema del sueño de Dani, por lo que acuden a su pediatra.
Su médico, después de hacerle una historia médica muy detallada, le entrega una serie de cuestionarios, tras realizarle algunas pruebas sencillas (ECG, analítica con hemograma, bioquímica rutinaria, metabolismo férrico y hormonas tiroideas), le entrega un folio con un cuadrante en el que debe señalar cuándo duerme y cuándo está despierto, lo que come, si toma alguna medicación y cuándo, si hace ejercicio, etc. Dani le entrega el siguiente esquema:
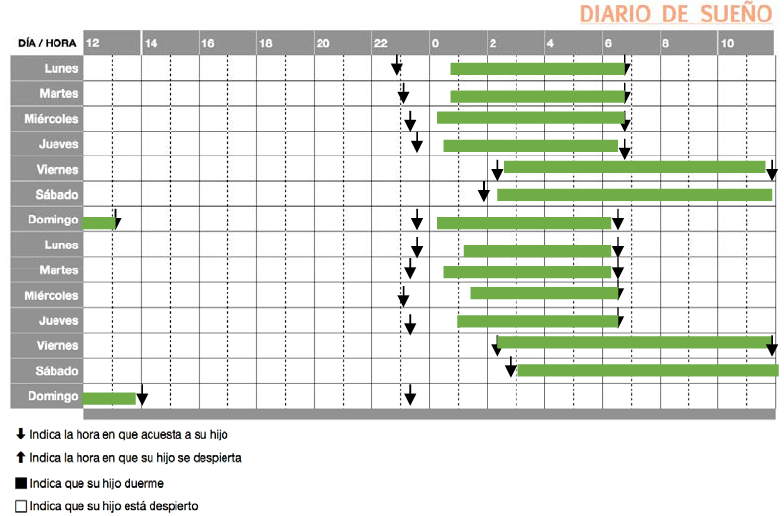
Dos semanas mas tarde vuelve a ver a Dani y le comenta que el problema que tiene se debe a un desajuste de su “reloj biológico” con el ciclo día-noche, iniciando un tratamiento con melatonina y ciertas modificaciones de sus hábitos diarios (debe sentarse en clase cerca de la ventana, le recomienda realizar deporte al comienzo del día, no debe tomar sustancias estimulantes como café-cocacola-té, debe evitar usar dispositivos electrónicos después de las 20h, etc). Su pediatra insiste en que tome la melatonina siempre a la misma hora, aproximadamente, y antes de la cena, lo que sorprende a su padre, que también ha tomado melatonina para dormir tras volver de un viaje a EEUU pero pocos minutos antes de acostarse.
Introducción
El sueño es un estado fisiológico activo, cíclico y reversible que juega un papel fundamental en el desarrollo infantil y sus problemas en la infancia y la adolescencia son motivos frecuentes de consulta. Los trastornos del sueño en los niños, a diferencia de lo que ocurre generalmente en la edad adulta, pueden tener implicaciones negativas tanto en el desarrollo infantil (conducta, rendimiento escolar, crecimiento) y en la calidad de vida de sus familiares. La preferencia por un determinado horario de sueño del niño o cronotipo determina los horarios de sueño regulados de forma intrínseca y los padres deben conocer el cronotipo de sus hijos porque condicionará en muchas ocasiones la duración del sueño y la actitud familiar frente al sueño. Este cronotipo está regulado por el llamado “marcapasos circadiano”, localizado en los núcleos supraquiasmáticos en el diencéfalo, quienes a su vez controlan la aparición del sueño a través de la melatonina, cuya secreción depende de la luz percibida por la retina.
Uno de los tipos de trastornos de sueño son los trastornos del ritmo circadiano, en los que la cantidad y calidad del sueño son normales, pero ocurren en un momento incorrecto de acuerdo con los horarios socialmente admitidos y habituales. En la población pediátrica el cuadro más habitual es el síndrome de retraso de fase, en el que el paciente tiende a dormirse y despertarse más tarde.
Síndrome de Retraso de Fase (SRF)
Descripción
El síndrome de retraso de fase (SRF) es una alteración del ritmo circadiano del sueño que consiste en un retraso estable del período de sueño nocturno habitual, caracterizado por insomnio a la hora de acostarse y dificultad para despertarse por la mañana en el momento deseado, que provoca somnolencia diurna excesiva(1). Habitualmente, las personas con SRF son incapaces de conciliar el sueño hasta altas horas de la madrugada y no pueden despertar hasta últimas horas de la mañana o por la tarde. Durante sus horarios de sueño preferidos, la duración del sueño y la calidad son generalmente normales. Los problemas de insomnio y somnolencia diurna se originan cuando los pacientes deben ceñirse a un horario social o laboral que obligan a avanzar el inicio del sueño o de la vigilia, siendo muy dificultoso o casi imposible levantarse a la hora estipulada. Durante los días laborales, no suelen dormir más de 2-5 horas por noche, pero es muy característico que el fin de semana compensen la privación crónica de sueño alargando el periodo de sueño. En los periodos vacacionales, libres de límites horarios, vuelven a retrasar su ritmo de sueño sin presentar insomnio ni somnolencia.
Por la imposibilidad de seguir unos horarios regulares de estudio ni de trabajo, suelen ser jóvenes a los que se les califica de noctámbulos o de vagos, y generalmente son mal considerados dentro del contexto sociofamiliar. El índice de depresión, pérdida de apetito y de concentración es alto, así como la presencia de trastornos afectivos en relación a su problema. Como consecuencia sufren un aumento de problemas escolares, laborales, sociales y de salud(2). A su vez, el SRF se relaciona en muchas ocasiones con psicopatología asociada(3).
Prevalencia
El síndrome de retraso de fase (SRF) es el trastorno más frecuente del ritmo circadiano y suele comenzar a manifestarse en la segunda década de la vida. La prevalencia es de un 0.3%-0.17% en la población general y de un 7-16% entre adolescentes y adultos jóvenes. En más de un 40% de los casos se asocia a historia familiar.
Etiopatogenia
Su etiología es desconocida y se han sugerido diferentes hipótesis:
• Periodo circadiano intrínseco más prolongado de lo habitual.
• Anomalías de la curva de respuesta a la luz. De hecho, la hipersensibilidad a la luz vespertina puede ser un factor precipitante o que favorece la cronificación del retraso de la fase del sueño(4).
• Imposibilidad para adelantar la fase del sueño de forma natural(5).
• Menor capacidad para compensar la privación crónica de sueño(6).
Factores de riesgo
1. EDAD: En los adolescentes existe un retraso habitual del ciclo vigilia-sueño, con tendencia a acosarse tarde, y presentando somnolencia diurna excesiva durante el horario escolar y a dormir más de lo habitual durante los fines de semana(7). Esta fase retardada de sueño presente en los adolescentes responde a factores psicosociales propias de la edad (aumento de actividades nocturnas con disminución de la influencia del control paterno) y fisiológicas (como el retraso en la secreción de melatonina, dim light melatonin onset, DLMO(2). El SRF es muy raro en ancianos, con una prevalencia del 3%.
2. GENÉTICA: En mamíferos, el reloj circadiano esta controlado por genes activadores o promotores y represores que regulan el ritmo vigilia-sueño(8). La expresión de estos genes (“clock-gene”) determina las preferencias para establecer el periodo principal de sueño. En el SRF suele existir una agregación familiar y se piensa que este problema tiene un condicionante genético, con una modificación del gen Per3(9) mientras que el gen CK1 epsilon ejerce una función protectora para desarrollar un SRF(10).
3. SEXO: En un estudio realizado para analizar las preferencias “matutinas-vespertinas” en estudiantes, se han apreciado diferencias, siendo más frecuente la preferencia “vespertina” en varones(11).
4. EXPOSICIÓN LUMÍNICA: Se ha propuesto que una de las razones por las que algunas personas desarrollan un SRF es que no se exponen a la luz diurna por la mañana y/o aumentan la exposición a la luz al final del día. Además, se ha relacionado la depresión estacional con menor intensidad de la luz diurna, especialmente al amanecer.
En resumen, en los adolescentes existe una tendencia a retrasar el episodio de sueño nocturno pero no se conoce exactamente cuanto influyen los factores exógenos y endógenos. Aunque muchos jóvenes con horarios de sueño retrasados son capaces de adaptarse a un horario convencional cuando es preciso, es cierto que los síntomas de SRF, retraso estable del ciclo vigilia sueño, aparecen por primera vez a esta edad(12). No está claro si el SRF representa el extremo cuantitativo de la fase retardada de adolescentes o corresponde a una entidad clínica distinta.(13)
Métodos diagnósticos en el síndrome de retraso de fase
La sospecha diagnóstica del SRF se realiza en base a la historia clínica del paciente con queja crónica de insomnio, por un retraso estable del período de sueño nocturno habitual. Estas alteraciones de sueño se asocian a repercusiones en el funcionamiento diurno. Su diagnóstico definitivo se basa en el análisis de los marcadores de fase del sistema circadiano. Estos parámetros pueden determinarse mediante técnicas subjetivas y objetivas.
Métodos Objetivos
Actigrafía: Los actímetros son pequeños aparatos que se sujetan a la muñeca o tobillo y registran el movimiento del sujeto, niño o adulto, en su entorno habitual. La posibilidad de monitorizar a los sujetos, sin que se precise su colaboración activa, durante largos periodos de tiempo, y con dispositivos no invasivos, es la principal ventaja de esta técnica(14).
Polisomnografía (PSG): Es el registro simultaneo de la actividad eléctrica cerebral, los movimientos oculares y el tono muscular en mentón, junto con otras variables biológicas (ECG, respiración, etc). La PSG no es necesaria para el diagnóstico del SRF, pero se realizará cuando se sospeche la coexistencia de patologías de sueño primarias que puedan empeorar el SRF como un síndrome de apneas del sueño o un síndrome de piernas inquietas.
Marcadores de la Fase Circadiana:
1. Determinación de Melatonina: La determinación en muestras seriadas de plasma o saliva del momento preciso en el que se activa la secreción de melatonina (dim light melatonin onset, DLMO) es un excelente marcador de fase del sistema circadiano. Normalmente el DLMO se registra alrededor de las diez de la noche. Los pacientes con SRF sin embargo, presentan DLMO bastante más tardíos(15).
2. Termometría: El registro de temperatura central se considera, junto con el del ritmo de melatonina, el mejor marcador de fase del sistema circadiano. Sin embargo, la dificultad de este procedimiento radica en su carácter invasivo y molesto, por lo que se han desarrollado técnicas alternativas. Una de estas es la medida de la temperatura de la piel de la muñeca. Durante el sueño, la temperatura de la piel aumenta, mientras que esta desciende durante los periodos de actividad. Su principal limitación son las modificaciones debidas a las condiciones térmicas ambientales(16).
Variables integradas. Análisis del ritmo TAP (temperatura, actividad y posición).
Este método unifica la información proporcionada por los ritmos de temperatura, actividad y posición permite detectar con gran precisión los episodios de sueño y determinar la fase del sistema circadiano(17).
Métodos subjetivos
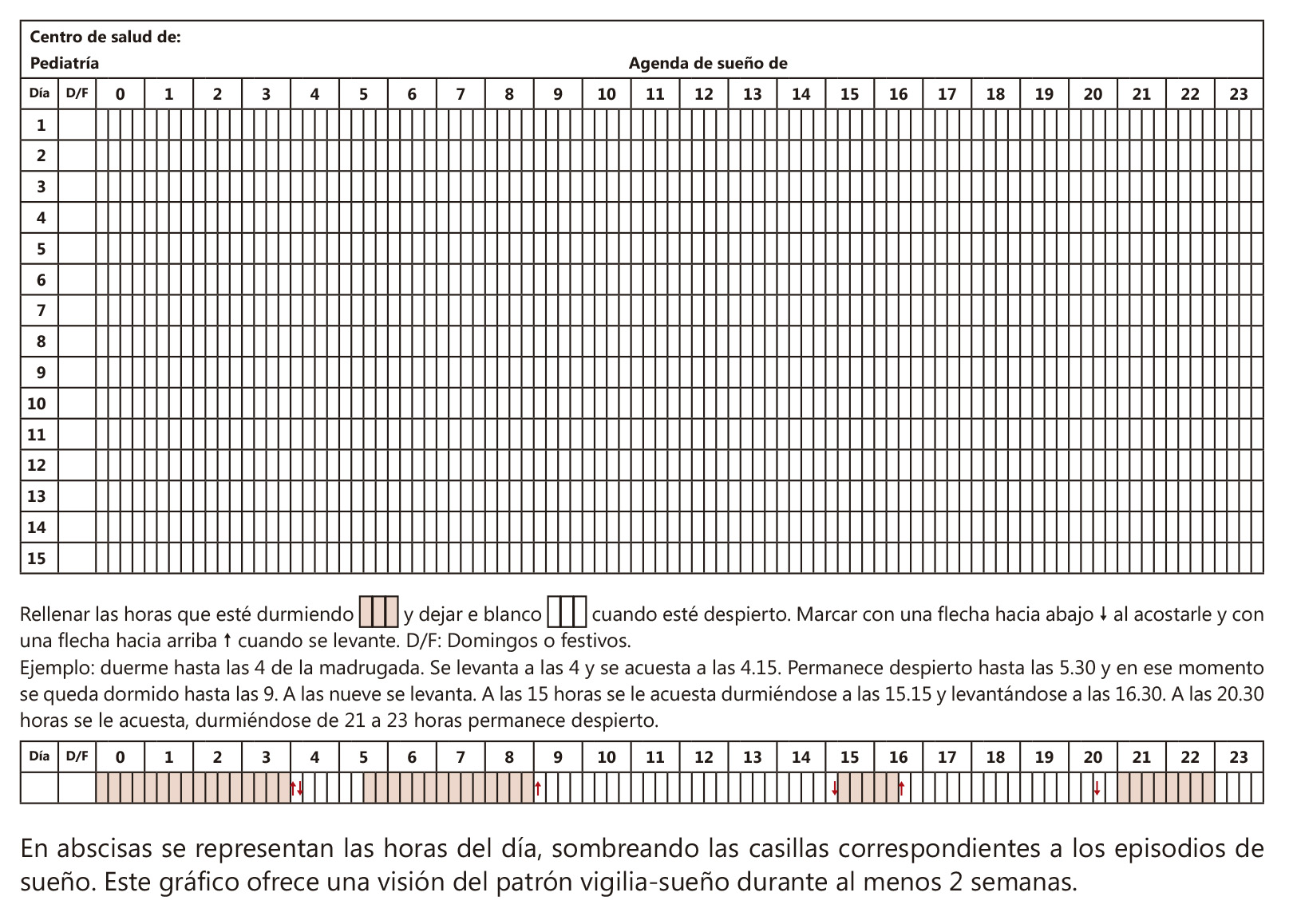
Diarios de Sueño: consiste en anotaciones diarias de las horas cuando sucede el sueño.
Es el método más difundido pero su cumplimentación supone una carga para los evaluados; niños o adultos y evaluadores; los padres cuando se trata de niños menores de 8 años. Figura 1.
Cuestionario Matutinidad-Vespertinidad (M-V): son cuestionarios para la determinación de las preferencias horarias de los sujetos clasificándolos en matutinos o vespertinos. El de Horne y Ostberg fue el original y los Social Rhythm Metric (SRM) y el Munich Chrono Type Questionnaire (MCTQ) son variantes de éste. El cronotipo con preferencia vespertina va unido con un patrón de sueño retrasado o irregular(18), aunque no hay suficiente evidencia para recomendarlo como herramienta de rutina para el diagnóstico del SRF(19).
Anamnesis: Las variables que deben obtenerse para el diagnóstico de SRF son: hora de irse a la cama, hora inicio del sueño, número y duración de despertares de >5 minutos de duración y horarios de sueño. Existen datos que orientan al diagnóstico de SRF:
• Las diferencias entre semana y los fines de semana pueden ser la clave de sospecha de la presencia de un SRF sobre todo en niños y adolescentes
• Cuando no sea posible registrar el sueño sin limitaciones de horarios y en los días de entre semana el inicio del sueño esté retrasada de forma considerable y los fines de semana se duerma más de dos horas respecto al sueño total de entre semana se debe sospechar la presencia de un Síndrome de Retraso de Fase.
Diagnóstico diferencial del síndrome de retraso de fase
El síndrome de retraso de fase de sueño (SRF) debe diferenciarse de aquellos patrones de sueño variantes de la normalidad, sobre todo en adolescentes y adultos jóvenes que presentan una preferencia para mantener un horario de sueño retrasado sin alteración en su funcionamiento o rendimiento (preferencia circadiana vespertina).
Las actividades personales y sociolaborales que se realizan a última hora de la tarde pueden perpetuar y exacerbar el retraso de la fase de sueño. Unos hábitos de sueño inapropiados juegan un papel importante en el desarrollo y el mantenimiento de un patrón de sueño retrasado.
El SRF debe diferenciarse de otras causas que provocan una dificultad en el inicio y/o mantenimiento del sueño:
• Insomnio. En el SRF, cuando el paciente puede acostarse en su horario deseado, la conciliación y el mantenimiento del sueño es normal. Sin embargo, los pacientes con insomnio tienen dificultad para iniciar el sueño independientemente de la hora de irse a dormir y el sueño suele ser fragmentado.
• Síndrome de piernas inquietas. Los síntomas del síndrome de piernas inquietas (p.ej. sensaciones desagradables en las piernas al ir a la cama que mejoran con el movimiento,…) frecuentemente se asocian con dificultad para iniciar el sueño.
• Trastornos psiquiátricos. Diferentes condiciones psiquiátricas se asocian con dificultad para conciliar el sueño, pero el patrón sueño-vigilia característico del SRF no suele estar presente en estas situaciones (p. ej. depresión, trastorno bipolar, trastornos de ansiedad).
• Destacar que algunos trastornos como el trastorno por déficit de atención e hiperactividad (TDAH) y los trastornos del desarrollo pueden presentan una resistencia al ir a la cama y una latencia de sueño prolongada, en relación a un retraso de fase de sueño.
Tratamiento
Edited by Foxit Reader
Copyright(C) by Foxit Corporation, 2005-2009
For Evaluation Only
El objetivo del tratamiento es alinear el reloj circadiano con el ciclo luz –oscuridad de 24 horas deseado. Una aplicación correcta de las normas de higiene del sueño así como la identificación y tratamiento de alteraciones médicas o psiquiátricas concomitantes son las bases para la corrección del SRF. Aunque la cronoterapia, la luminoterapia, y la farmacoterapia son tratamientos adicionales útiles en el SRF(15), se debe cuidar de forma minuciosa la higiene y hábitos del sueño, evitando sustancias estimulantes, ejercicio físico intenso y en general, cualquier actividad que pueda causar una excesiva activación en las últimas horas de la tarde. También hay que disminuir la intensidad lumínica en las horas previas al acostarse y aumentarla al máximo al levantarse, con especial cuidado en la utilización de aparatos electrónicos (ordenadores, móviles, consolas, TV,…) antes de acostarse, ya que pueden provocar un retardo en la conciliación del sueño y progresivamente un retardo de fase.
Cronoterapia
Se recomienda un retraso progresivo de 2-3 horas diarias de los horarios de acostarse y levantarse durante 5-6 días sucesivos, permitiendo al episodio mayor de sueño desplazarse hasta la hora deseada. Este cambio va supeditado a una gran adherencia de rutinas de sueño -vigilia y buenas prácticas de higiene del sueño: se deben evitar las siestas y el horario de las comidas y el ejercicio físico se han ir ajustando al nuevo horario cada día, entre otras. Si bien la cronoterapia ha demostrado ser un tratamiento eficaz en condiciones de laboratorio(20), fuera de éstas, existen muchos factores que limitan la efectividad y aplicabilidad de este método El problema principal es que son necesarios varios días para ajustar el horario, lo que puede resultar difícil y pesado para los pacientes e interferir en sus horarios académicos y laborales, ya que algunos días el episodio principal de sueño es durante el día, con riesgo de exposición a la luz en el tiempo circadiano inadecuado.
Se han descrito otras alternativas, aunque los resultados suelen ser peores. Una posibilidad es adelantar de forma progresiva, 30-60 min, la hora de acostarse y levantarse o dormir durante 6 días en los horarios habituales, después un día sin dormir y al día siguiente adelantar la hora de acostarse y levantarse en 90 minutos. Así sucesivamente hasta llegar a la hora deseada.
Luminoterapia
La luz tiene un rol determinante en la restauración del ritmo circadiano. La administración de luz brillante por la mañana provoca un avance de fase de los ritmos circadianos en el SRF mientras que la administración nocturna incrementa el retraso de fase. La luminoterapia por tanto, consiste en la exposición a la luz durante las primeras horas de la mañana y evitarla a últimas horas de la tarde. La duración y la intensidad de la exposición tienen que ser individualizada, y se debe ir ajustando según la respuesta del paciente. Por ejemplo se puede utilizar de forma inicial 2 horas de luminoterapia al levantarse a 2.500 lux, o exposiciones más intensas durante menos tiempo (10.000 lux durante 30-40 minutos). Existen lámparas especiales de luminoterapia, entre 5.000 y 10.000 lux, que además filtran los dañinos rayos ultravioletas(15, 21) Siguiendo la curva de respuesta de fase (PRC) humana tras la administración a un pulso de luz, los mayores beneficios se obtendrán inmediatamente después del mínimo de temperatura corporal (CT min o T nadir), que suele ser unas dos horas después del inicio del sueño. Como medir la temperatura clínicamente no siempre es fácil, lo más recomendable suele ser realizar la luminoterapia nada más levantarse según la fase circadiana endógena estimada a partir de los diarios de sueño recogidos durante los días previos.
La luminoterapia no se debe realizar en pacientes con retinopatía, fotosensibilidad, manía y tendencia migrañosa. Un examen oftalmológico previo es recomendable en pacientes con alteraciones oculares y/o retinianas antes de comenzar la luminoterapia. Los efectos secundarios son poco frecuentes, pero puede aparecer cefalea, irritación ocular, nauseas, sequedad ocular y dérmica, eritema y precipitación de estados hipomaniacos en pacientes con trastorno bipolar.
Melatonina
La administración de melatonina exógena produce cambios de fase en el reloj circadiano interno, siendo la PCR de melatonina casi la opuesta a la PCR de exposición a la luz. La administración de melatonina vespertina (3-5 mg) es eficaz en producir un avance de fase y en disminuir la latencia de sueño. Sin embargo, como con la luminoterapia, no existen unas guías estandarizadas respecto al tiempo, dosis o duración del tratamiento. En la práctica clínica suele administrarse entre 5-7 horas antes de acostarse, ya que estudios controlados han determinado que el mayor avance de fase se produce cuando se administra melatonina exógena 6 horas antes del dim Light melatonin onset (DLMO)(22) (inicio del ascenso de melatonina con la atenuación vespertina de la luz).
La administración de melatonina a dosis mayores que las dosis supra fisiológicas (>0,5 mg), si bien no producen cambios cronobiológicos mayores, sí pueden presentar un efecto hipnótico concomitante, favorable para el tratamiento del SRF. La utilización en el SRF ha de ser breve, entre 1-3 meses, ya que los tratamientos duraderos han demostrado una mayor tendencia a volver al retraso de fase una vez se suspende el tratamiento. Como terapia única, su efecto es menor que el de la luminoterapia pero la combinación de fototerapia por la mañana y melatonina vespertina parece ser una modalidad terapéutica mucho más eficaz. En este caso se recomienda la administración de melatonina 12 horas antes de la exposición a la luz(23).
Hay que recordar que la utilización de la melatonina no está aprobada por la FDA y EMEA para el tratamiento del retraso de fase, si bien existen numerosos estudios que demuestran su eficacia y seguridad. Debe evitarse en embarazadas y lactantes.
En la actualidad no existe un consenso sobre cómo utilizar estas distintas terapias. En el 2007, la Academia Americana de Medicina del sueño establece unos parámetros guía para el diagnóstico y tratamiento del SRF, basados en la evidencia(15):
1. Diagnóstico: Determinación de la fase circadiana del sueño mediante diarios de sueño o actimetría durante un mínimo de 7 días.
2. Tratamiento:
- Intervenciones comportamentales en todos los casos y de carácter permanente.
- Luminoterapia por la mañana, 2-3 horas antes o al levantarse.
- Administración de melatonina (3-5 mgs) vespertina unas 5-6 horas antes de acostarse.
Tablas y figuras
Figura 1. Agenda o diario de sueño
Bibliografía
1 American Academy of Sleep Medicine. International classification of sleep disorders (ICSD-2). Diagnostic and coding manual. 2005; Westchester,IL.
2 Carskadon, MA, Wolfson, AR, Acebo, C, Tzischinsky, O, and Seif er, R. Adolescent sleep patterns, circadian timing, and sleepiness at a transition to early school days. Sleep 1998;21:871-1.
3 Dagan, Y, Stein, D, Steinbock, M, Yovel, I, and Hallis, D. Frequency of delayed sleep phase syndrome among hospitalized adolescent psy chiatric patients. Journal of psychosomatic research 1998;45:15-20.
4 Aoki, H, Ozeki, Y, and Yamada, N. Hypersensitivity of melatonin suppression in response to light in patients with delayed sleep phase syndrome. Chronobiology International 2001;18:263-71.
5 Ozaki, S, Uchiyama, M, Shirakawa, S, and Okawa, M. Prolonged interval from body temperature nadir to sleep offset in patients with delayed sleep phase syndrome. Sleep 1996;19:3640.
6 Uchiyama, M, Okawa, M, Shibui, K, Liu, X, Hayakawa, T, Kamei, Y, and Takahashi, K. Poor compensatory function for sleep loss as a pathogenic factor in patients with delayed sleep phase syndrome. Sleep 2000;23:553-8.
7 Pin Arboledas G, Cubel Alarcón M, Martin González G, Lluch Roselló A, Morell Salort M. Habits and problems with sleep from 6 to 14 years in the Valencian community. Children’s own view. An Pediatr (Barc). 2011;74(2):103-15.
8 Wisor JP, O’Hara BF, Terao A, Selby CP, Kilduff TS, Sancar A, Edgar DM, Franken P. A role for cryptochromes in sleep regulation. BMC Neurosci. 2002;3:20.
9 Ebisawa T, Uchiyama M, Kajimura N, Mishima K, Kamei Y, Katoh M, et al. Association of structural polymorphisms in the human period3 gene with delayed sleep phase syndrome. EMBO Rep. 2001;2:342–346.
10 Ebisawa T. Circadian rhythms in the CNS and peripheral clock disorders: human sleep disorders and clock genes. J Pharmacol Sci. 2007;103(2):150-4.
11 Adan A, Natale V. Gender differences in morningness-eveningness preference. Chronobiology International. 2002;19:709–20.
12 Gradisar M, Gardner G, Dohnt H. Recent worldwide sleep patterns and problems during adolescence: a review and meta-analysis of age, region, and sleep. Sleep Med. 2011 12(2):110-8.
13 Saxvig IW, Pallesen S, Wilhelmsen-Langeland A, Molde H, Bjorvatn B. Prevalence and correlates of delayed sleep phase in high school students. Sleep Med. 2012 13(2):193-9.
14 Morgenthaler T, Alessi C, Friedman L, Owens J, Kapur V, Boehlecke B, et al. Practice parameters for the use of actigraphy in the assessment of sleep and sleep disorders: an update for 2007. Sleep. 2007a;30:519–29.
15 Rahman SA, Kayumov L, Tchmoutina EA, Shapiro CM. Clinical efficacy of dim light melatonin onset testing in diagnosing delayed sleep phase syndrome. Sleep Med. 2009 May;10(5):549-55.
16 Sarabia JA, Rol MA, Mendiola P, Madrid JA. Circadian rhythm of wrist temperature in normal-living subjects – A candidate of new index of the circadian system. Physiol Behav 2008; 95: 570–80.
17 Ortiz-Tudela E, Martinez-Nicolas A, Campos M, Roll MA, Madrid JA. A New Integrated Variable Based on Thermometry, Actimetry and Body Position (TAP) to Evaluate Circadian System Status in Humans. PLoS Computational Biology 2010; 6(11): e1000996.
18 Giannotti F, Cortesi F, Sebastini T et al. Circadian preference, sleep and daytime behaviour in adolescence. J Sleep Res 2002;11:191-9.
19 Morgenthaler T, Lee-Chiong T, Alessi C, Friedman L; Aurora N; Boehlecke B et al. Practice Parameters for the Clinical Evaluation and Treatment of Circadian Rhythm Sleep Disorders.An American Academy of Sleep Medicine Report. Sleep Med 2007b;30(11): 1445-59.
20 Czeisler CA, Richardson GS, Coleman RM, Zimmerman JC, et al. Chronotherapy: resetting the circadian clocks of patients with delayed sleep phase insomnia. Sleep 1981;4:1-21.
21 Sack l, Auckley D, Auger R, Carskadon M, Wright K, Vitiello M, Zhdanova I. Circadian Rhythm Sleep Disorders: Part II, Advanced Sleep … Disorder, Delayed Sleep Phase Disorder, Free-Running Disorder, and Irregular Sleep-Wake Rhythm. Sleep 2007;30:1484-1501.
22 Mundey K, Benloucif S, Harsanyi K, Dubocovich ML, et al. Phasedependent treatment of delayed sleep phase syndrome with melatonin. Sleep 2005;28:1271-1278.
23 Revell, V.L., H.J. Burgess, et al. Advancing human circadian rhythms with afternoon melatonin and morning intermittent bright light. J Clin Endocrinol Metab 91(1) 2006: 54–59.



