Tumores benignos y malignos en la adolescencia
Tumores benignos y malignos en la adolescencia
J. Cabello Blanco
Sección Traumatología Infantil. Hospital Universitario La Paz. Madrid.
Fecha de recepción: 22-09-2021
Fecha de publicación: 31-10-2021
Adolescere 2021; IX (3): 60-67
Resumen
|
Los tumores musculoesqueléticos en la edad pediátrica presentan unas características radiológicas que nos permiten diferenciar entidades benignas de malignas. El conocimiento de dichos patrones es necesario para establecer un protocolo de actuación para el pediatra que lo detecte. Los tumores de hueso tienen distintos orígenes histológicos. Los malignos más frecuentes son el osteosarcoma y el sarcoma de Ewing, cuyo tratamiento es multimodal con quimioterapia neoadyuvante, cirugía de preservación de extremidad cuando es posible y adyuvancia postcirugía. Con estos protocolos se logran supervivencias cercanas al 70% a 5 años. Palabras clave: Palabras clave: Tumor óseo; Osteosarcoma; Ewing. |
Abstract
|
Pediatric musculoskeletal tumors exhibit radiological characteristics that allow us to differentiate benign from malignant entities. Pediatricians need to be aware of the radiological behavior to better address the subsequent studies required in those patients. Bone tumors have various histological origins. The most frequent malignant bone tumors in the pediatric age are osteosarcoma and Ewing sarcoma. Treatment is multimodal beginning with neoadjuvant chemotherapy, limb sparing surgery when feasible and postsurgical chemotherapy. These protocols have allowed survivorship to rise up to 70% after 5 years. Key words: Bone tumor; Osteosarcoma; Ewing. |
Introducción
Los tumores óseos benignos son mucho más frecuentes que los malignos
Los tumores musculoesqueléticos en la edad pediátrica son particulares por su epidemiología y por los desafíos reconstructivos únicos por la presencia de fisis y la previsión de hueso longitudinal y en diámetro. La perspectiva del traumatólogo en los tumores óseos en la edad pediátrica se centra en la imagen radiológica de la radiología simple para orientar el caso y en muchos casos diagnosticarlo. Es por eso que se dará importancia a la imagen radiológica en este tema ya que será la primera herramienta diagnóstica del pediatra en el abordaje diagnóstico de los tumores musculoesqueléticos. Clasificaremos los tumores en función de su comportamiento y nos permitirá decidir la actitud o urgencia que adoptar al respecto.
El equipo multidisciplinar de los profesionales implicados en el comité de sarcomas será necesario para el diagnóstico y tratamiento de las entidades malignas para lograr la supervivencia del paciente y, respetando el principio anterior, lograr la mejor funcionalidad del miembro afecto con la cirugía conservadora del miembro o la amputación.
Epidemiología
El tumor óseo diagnosticado como hallazgo radiológico más frecuente es el defecto fibroso cortical
La incidencia es muy variable según el tipo al que nos refiramos. Sin duda los más frecuentes son los benignos, pero como muchas veces se diagnostican como hallazgo casual, no somos conscientes de su incidencia real. Estaríamos de acuerdo que los defectos fibrosos son la entidad más frecuente, seguidos de los osteocondromas. En la población adolescente los tumores óseos malignos más
frecuentes son el osteosarcoma y el sarcoma de Ewing. Menos frecuentes que los de origen óseo, de los de partes blandas, el tumor maligno más frecuente es el rabdomiosarcoma. Lo que sí podemos afirmar es que la edad de incidencia es entre los 5 y los 25 años. La patología tumoral maligna de origen óseo supone el 6% de los casos tratados en un servicio de oncología pediátrica.
Los tumores malignos de origen óseo más frecuentes en adolescentes son osteosarcoma y sarcoma de Ewing (sin clara predominancia)
No hay una clara afectación por sexos aunque se describe ligeramente mayor incidencia en varones. La localización más frecuente es en miembros inferiores, en concreto alrededor de la rodilla.
Fisiopatología
Los sarcomas son tumores derivados del mesodermo embrionario y por lo tanto habrá tumores óseos, de tejido adiposo, vascular, fibroso, cartilaginoso… Es decir, tendremos tumores tanto en el tejido óseo como en tejidos blandos(1,2).
Se ha descrito algún tumor benigno que puede metastatizar manteniendo histología benigna y por el contrario benignos que pueden transformarse a malignos
Los tumores se clasifican histológicamente según el tejido del que se originan (Tabla I). Existen formas benignas y malignas. Se describe algún tumor benigno que puede metastatizar manteniendo histología benigna y por el contrario benignos que pueden transformarse a malignos. Las lesiones pseudotumorales las solemos estudiar dentro del grupo de tumores musculoesqueléticos. La OMS en su última actualización de 2020 diferencia 9 grupos (Tabla I).
Entre los tumores de partes blandas la clasificación también se basa en el subtipo histológico. Son tumores menos frecuentes que los de origen óseo. La clasificación es compleja y excede el objetivo de esta publicación(2). No obstante, es notable que en las últimas revisiones se da más importancia a los hallazgos en patología molecular y genética que a las características descriptivas radiológicas y microscópicas usadas previamente. Estas alteraciones moleculares nos permiten mejorar la precisión del diagnóstico e identificar dianas terapéuticas.
El sistema de clasificación de Enneking distingue tumores óseos benignos y malignos(3). A los benignos les asigna números arábigos:
- 1: Inactivos
- 2: Activos
- 3: Agresivos
A los malignos les asigna números romanos, y a la localización A (intracompartimental) o B (extracompartimental):
- I: bajo grado
- II: alto grado
- III: metastásicos
Clínica
La presentación clínica más frecuente es con dolor y masa palpable. Los malignos generalmente cursan con impotencia funcional, dolor nocturno y síndrome constitucional. Un flexo progresivo y doloroso de rodilla nos debe alertar de una masa creciendo en región de fémur distal con afectación de estructuras posteriores. Son muchas entidades distintas y alguna tiene su peculiaridad. Los defectos fibrosos son asintomáticos, los quistes óseos en ocasiones debutan con fracturas, los osteocondromas son masas sólidas no dolorosas.
Cabe destacar que hasta un 30% de los sarcomas de Ewing pueden tener fiebre por lo que el diagnóstico diferencial con la osteomielitis puede suponer un reto que, a menudo, necesita de la biopsia para resolverlo.
Diagnóstico
La radiografía simple será nuestra primera aproximación. Debemos recordar que servirá para orientarnos pero en la mayoría de los casos es necesario la anatomía patológica o la citogenética para llegar al diagnóstico definitivo.
Los patrones radiológicos geográficos son propios de entidades benignas
Existen unos patrones radiográficos descritos por Lodwick(4) y modificados posteriormente(5) que analizan la destrucción ósea, la reacción perióstica, la mineralización de la matriz tumoral, el tamaño y la forma de la lesión. Se describen en la Tabla II y hay ejemplos en las Figuras 1, 2 y 3.
Los patrones agresivos apolillados y permeativos son propios de entidades malignas
Nos referiremos a “reacción perióstica” como la nueva osificación desde el periostio en defensa de la agresión oncológica. Se verá como líneas paralelas a la diáfisis (“en capas de cebolla”) o bien en patrones más agresivos que rompen la cortical y el periostio más rápidamente, siguen la dirección de la masa hacia fuera del hueso, dando calcificaciones perpendiculares a la cortical (en “sol naciente”). Si el periostio levantado calcifica hasta el hueso se forma una zona triangular “triángulo de Codman”.
Sin duda la resonancia magnética (RM) del compartimento completo (para detectar una posible “skip metástasis”) será necesaria para evaluar la masa de partes blandas y la afectación de estructuras adyacentes. La invasión de paquetes vasculonerviosos puede ser limitante para una cirugía segura y con buena función resultante, por ejemplo. La repetición de la RM a mitad y a final del tratamiento tienen interés para medir la disminución de masa y, por lo tanto, la efectividad de la quimioterapia elegida.
La TAC se usa en despistaje de metástasis pulmonares y en lesiones pequeñas muy inflamatorias (mucho edema en la RM) como el osteoma osteoide. También nos permite generar modelos 3D para el desarrollo de implantes (prótesis) a medida.
La gammagrafía con Tc-99 se emplea para el diagnóstico de extensión. Están ganando popularidad los estudios PET/TAC ya que podrían tener más sensibilidad que la gammagrafía en la detección de metástasis axiales(6).
El sistema más popular en traumatología de estadiar los tumores óseos es el de Enneking que considera los grados de agresividad (G0 benignos, G1 bajo grado y G2 alto grado), la extensión local que está relacionada con la resecabilidad (T1 intracompartimental, T2 extracompartimental) y la presencia o no de metástasis (M0, M1).
Los tumores benignos serían “G0”, y es de interés comprender los tres comportamientos que vemos en los pacientes:
- Latentes: radiológicamente estables, bien encapsuladas (osteoma).
- Activas: clínicamente dan síntomas (osteoma osteoide, quiste óseo simple…).
- Agresivas: sintomáticas y erosión progresiva de hueso hasta hacerse extracapsulares o incluso extracompartimentales (quiste óseo aneurismático, tumor de células gigantes…).
Para los tumores de partes blandas es más popular el sistema TNM de la “American Joint Committee on Cancer, AJCC”, que considera su localización primaria (tronco y extermidades, retroperitoneo, cabeza y cuello, vísceras), el tamaño (de 5 cm en 5 cm) y el grado de agresividad(7).
Tratamiento
El tratamiento de las lesiones benignas suele ser la observación en las latentes, el tratamiento percutáneo en las activas y la resección intralesional ampliada en las agresivas
El esquema de tratamiento de las lesiones benignas suele ser la observación en las latentes, el tratamiento percutáneo en las activas (radioablación en el osteoma osteoide) o la resección intralesional ampliada en las agresivas. Por su frecuencia cabe destacar que en el fibroma no osificante la actitud es expectante salvo que por su tamaño genere fragilidad ósea. El quiste óseo simple sí genera fragilidad por el tamaño que alcanza, suele requerir cirugía. El osteocondroma se reseca si molesta.
Las resecciones serán marginales, amplias y radicales.
La amputación no es mejor que la conservación de miembro si la cirugía está bien indicada
- La marginal implica quedarse potencialmente con tumor en el borde de la resección y será indicada normalmente en tumores benignos. El ejemplo de resección marginal que usamos más frecuentemente es la resección intralesional ampliada. Supone abrir una ventana amplia en el hueso para poder extraer el contenido, fresar las paredes y aplicar un agente citotóxico local (fenol o agua oxigenada). El defecto restante se reconstruye con injerto óseo y en ocasiones se puentea con una placa de ostesíntesis para prevenir la fractura mientras que se incorpora el injerto (meses).
- Las resecciones amplias son las que permiten un margen de tejido sano. A nivel quirúrgico consideramos dos tipos: intercalar (en la diáfisis del hueso) y articular (en el extremo del hueso). A su vez las articulares serán intrarticular: si resecamos un lado de la articulación (osteosarcoma de fémur distal que no infiltre la articulación) o bien extrarticular: cuando el tumor infiltra la articulación y debemos resecar los dos lados de una articulación sin meternos en la articulación.
- La resección radical supone la amputación de la extremidad. Hoy día intentamos cirugía de preservación de extremidad siempre que sea posible ya que no hay mayor supervivencia en la amputación siempre que la cirugía de conservación de miembro esté bien indicada. Los tumores que afectan a tibia distal y pie suelen tener peores opciones reconstructivas y la amputación ofrece muy buenos resultados a niveles distales.
El tratamiento de los tumores malignos es multimodal y se beneficia de equipos multidisciplinares
En tumores malignos el esquema de tratamiento es multimodal, habitualmente con quimioterapia preoperatoria (neoadyuvancia), resección y posteriormente quimioterapia. La quimioterapia neoadyuvante permite que masas inoperables pasen a ser resecables. El análisis de la pieza quirúrgica permite determinar un porcentaje de necrosis y por lo tanto una eficacia de la quimioterapia elegida. Por ejemplo, en osteosarcoma, una respuesta histológica de 90% o más se asocia a aumento de supervivencia libre de enfermedad.
La radioterapia no es útil en el osteosarcoma. Sin embargo, sí está indicada en el sarcoma de Ewing no resecable o en aquellos que no se puede garantizar un borde libre.
La supervivencia en osteosarcoma y sarcoma de Ewing es del 70% en los que no tienen metástasis al diagnóstico y de 10-40% en los metastásicos al diagnóstico
La poliquimioterapia ha permitido pasar de cifras de supervivencia a 5 años de 16% hasta el 62-70% actual(8). Las cifras de supervivencia mejoran con tres fármacos respecto al uso de dos, sin embargo no mejoran usando cuatro fármacos. Para osteosarcoma localizado se emplea el esquema MAP (metotrexate, adriamicina y cisplatino). Ifosfamida y etopósido también han demostrado utilidad. A pesar del tratamiento, en torno a un 40% desarrollarán metástasis durante el tratamiento. Mientras que para el osteosarcoma localizado al diagnóstico, la supervivencia está en torno a 70%, si el debut es metastásico baja al 10-40%.
En sarcoma de Ewing se usan dos protocolos. El VAC/IE (vincristina, adriamicina, ciclofofamida, ifosfamida, etopóxido) se usa más en EE.UU. y el VIDE (vincristina, ifosfamida, doxorrubicina, etopóxido) más en Europa. Las tasas de supervivencia son similares a las expuestas para osteosarcoma.
Antes de empezar los tratamientos de quimioterapia se les ofrece a las familias la preservación de semen o de ovocitos.
Tablas y figuras
Tabla I. Clasificación de los tumores según el grupo histológico al que pertenecen
|
Origen |
Benignos |
Intermedios |
Malignos |
|
Óseo |
|
|
|
|
Cartilaginoso |
|
|
|
|
Fibroso |
|
|
|
|
Osteoclásticos |
|
|
|
|
Vascular |
|
|
|
|
Notocorda |
|
||
|
Otros tumores mesenquimales |
|
|
|
|
Origen |
|
||
|
Sarcomas indiferenciados de células redondas |
|
||
Las siglas en la columna de células redondas hacen referencia a la traslocación genética.
Tabla II. Clasificación de Lodwick con las modificaciones de Madewell de imágenes de radiología simple de las lesiones líticas óseas
|
Grado |
Descripción |
|
IA |
Lesión geográfica con borde esclerótico |
|
IB |
Lesión geográfica sin borde esclerótico |
|
II |
Geográfica pero mal definida en algún margen |
|
IIIA |
Erosiona cortical o es progresiva en rx seriadas |
|
IIIB |
Apolillado o permeativo |
|
IIIC |
No se ve en rx simple (sí en otras técnicas) |
Tabla III. Estadiaje tumores malignos según Enneking
|
Estadío |
Grado |
Extensión local |
|
IA |
Bajo |
T1 |
|
IB |
Bajo |
T2 |
|
IIA |
Alto |
T1 |
|
IIB |
Alto |
T2 |
|
III |
Cualquiera si hay presencia de metástasis regionales o a distancia |
|
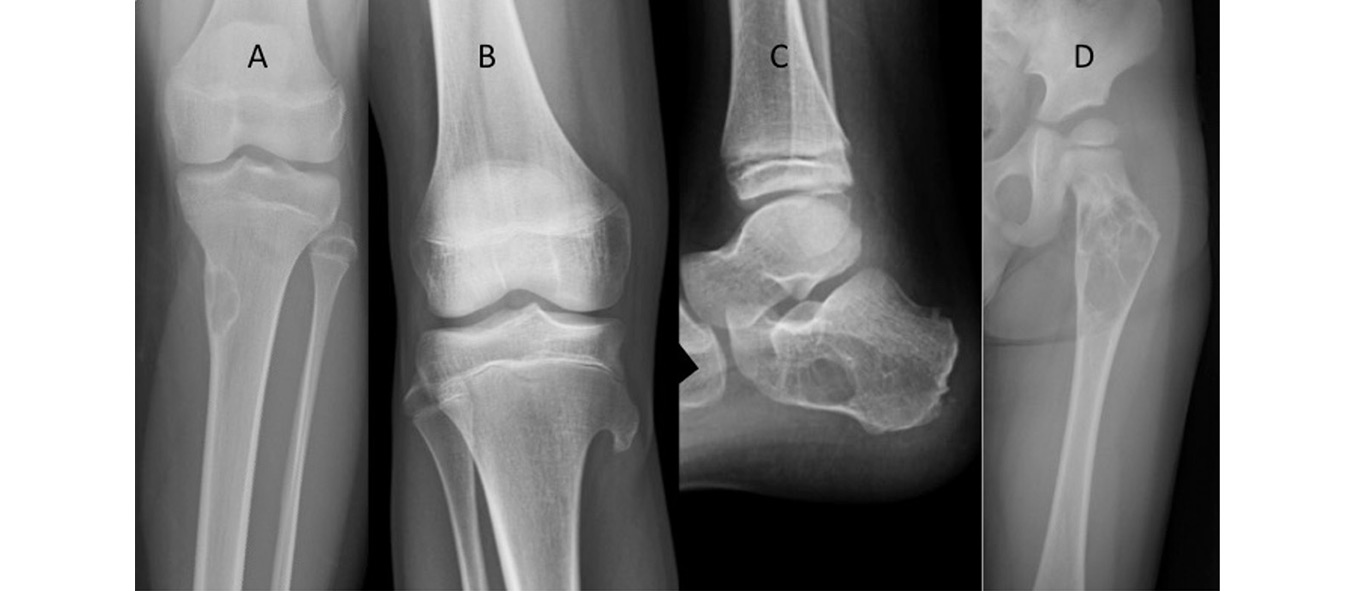
Figura 1. Imágenes radiológicas de diversas patologías benignas
A: lesión geográfica con borde esclerótico, IA (fibroma no osificante). B: lesión exofítica no lítica con continuidad de corticales (osteocondroma). C: lesión lítica sin claro borde escleroso y mal definida en anterior, patrón II (quiste óseo simple de calcáneo). D: lesión lítica multiloculada que erosiona cortical y con bordes mal definidos que es progresiva en radiografías seríadas, patrón IIIA (quiste óseo simple).
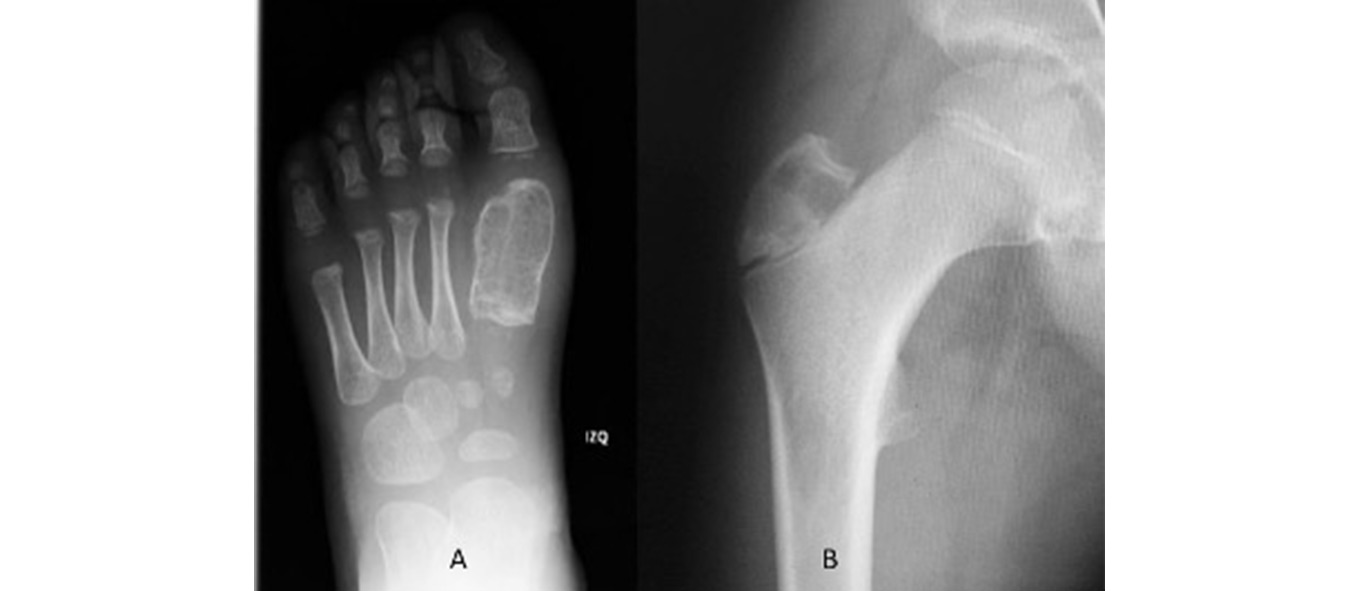
Figura 2. Imágenes radiológicas de patología benigna agresiva
A: lesión lítica insuflante que adelgaza cortical y deforma la estructura normal del hueso, patrón IIIA (quiste óseo aneurismático). B: lesión epifisaria lítica geográfica mal definida, sin borde escleroso y mal definida en proximal, patrón tipo II (condroblastoma epifisario).
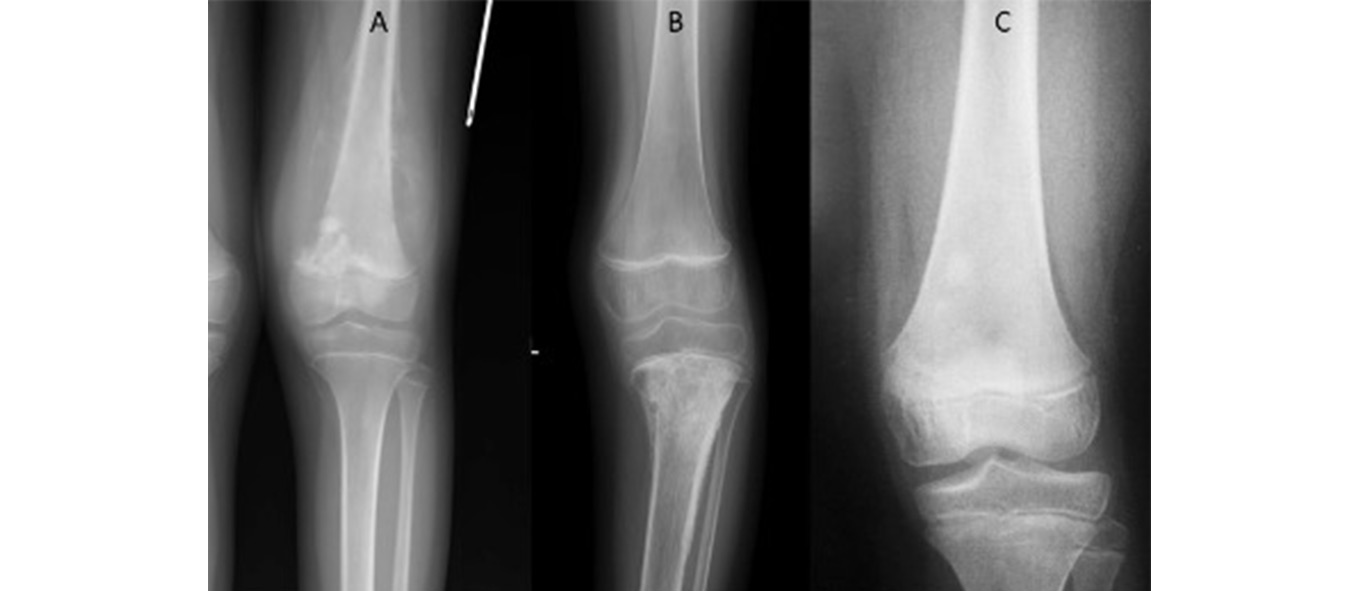
Figura 3. Imagen de radiología simple de patología maligna
A: lesión lítica y blástica metafisaria medial, permeativa y con elevación perióstica desde proximal por medial y lateral, con calcificaciones filiformes perpendiculares al hueso “en sol naciente” y triángulo de Codman, patrón IIIB (osteosarcoma). B: patrón permeativo con fractura patológica asociada en metáfisis tibial, patrón IIIB (sarcoma de Ewing).
C: imagen que fácilmente pasa desapercibida en metáfisis medial del fémur, blástica en dos nódulos separados, patrón IIIC (osteosarcoma “empezando”).
Bibliografía
1. Choi JH, Ro JY. The 2020 WHO Classification of Tumors of Bone: An Updated Review. Adv Anat Pathol [Internet]. 2021 May 1;28(3):119–38. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/33480599.
2. Kallen M, Hornick J. The 2020 WHO Classification: What’s New in Soft Tissue Tumor Pathology? Am J Surg Pathol. 2020;Publish Ah(00):1–23.
3. Enneking WF, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma. 1980. Clin Orthop Relat Res. 2003;(415):4–18.
4. Lodwick GS. Radiographic diagnosis and grading of bone tumors, with comments on computer evaluation. Proc Natl Cancer Conf [Internet]. 1964;5:369–80. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/5856167.
5. Caracciolo JT, Temple HT, Letson GD, Kransdorf MJ. A modified Lodwick-Madewell grading system for the evaluation of lytic bone lesions. Am J Roentgenol. 2016;207(1):150–6.
6. Hurley C, McCarville MB, Shulkin BL, Mao S, Wu J, Navid F, et al. Comparison of (18) F-FDG-PET-CT and Bone Scintigraphy for Evaluation of Osseous Metastases in Newly Diagnosed and Recurrent Osteosarcoma. Pediatr Blood Cancer [Internet]. 2016;63(8):1381–6. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/27082077.
7. Tanaka K, Ozaki T. New TNM classification (AJCC eighth edition) of bone and soft tissue sarcomas: JCOG Bone and Soft Tissue Tumor Study Group. Jpn J Clin Oncol. 2019;49(2):103–7.
8. Anninga JK, Gelderblom H, Fiocco M, Kroep JR, Taminiau AHM, Hogendoorn PCW, et al. Chemotherapeutic adjuvant treatment for osteosarcoma: Where do we stand? Eur J Cancer [Internet]. Elsevier Ltd; 2011;47(16):2431–45. Disponible en: http://dx.doi.org/10.1016/j.ejca.2011.05.030.
Bibliografía recomendada
– The WHO Classification of Tumours Editorial Board. WHO Classification of Tumours Soft Tissue and Bone Tumours, 5th ed. Lyon: IARC Press; 2020.