Trastornos respiratorios durante el sueño en el adolescente
Trastornos respiratorios durante el sueño en el adolescente
G. Pin Arboledas, M. Morell Safort, L. Mompo Marabotto, A. Lluch Rosello*
Unidad de Pediatría Integral Q Valencia. Unidad Valenciana del Sueño Hospital Quirón Valencia. (*)Centro de Salud Ingeniero Joaquin Benlloch. Valencia
Fecha de recepción: 1 de Septiembre 2013
Fecha de publicación: 30 de octubre 2013
Adolescere 2013; I (3): 29-66
Resumen
|
El síndrome de apnea-hipopnea del sueño constituye una entidad prevalente y de alto impacto sanitario. La hipoxia intermitente asociada a la fragmentación del sueño y a la hipercapnia episódica parecen ser la clave fisiopatológica que explicaría la respuesta inflamatoria sistémica y el subsiguiente daño multisistémico presente en estos pacientes. Se asocia con ronquido, trastornos del sueño y comorbilidades metabólicas, cardiovasculares, alteraciones del crecimiento y desarrollo así como alteraciones cognitivo conductuales. El diagnóstico y tratamiento oportunos es fundamental para la evolución del proceso. Palabras clave: apnea, hipopnea, hipoxia, ronquido |
Abstract
|
The obstructive sleep apnea-hypopnea syndromes (SAHS) is a prevalent condition having high health care impact. The intermittent hypoxia associated to sleep fragmentation and episodic hypercapnia seems to be the pathophysiological key to explain the systemic inflammatory response and subsequent multisystem harm present in these patients. It is associated with snoring, sleep disorders, metabolic comorbidities, cardiovascular problems, impaired growth and cognitive development and behavioral disorders. The diagnosis and treatment is essential for the evolution of the process. Key words: apnea, hypopnea, hypoxia, snoring |
Introducción
El síndrome de apneas-hipopneas del sueño (SAHS) es un trastorno respiratorio del sueño, caracterizado por una obstrucción parcial prolongada de la vía aérea superior y/u obstrucción intermitente completa que interrumpe la ventilación normal durante el sueño y los patrones normales del mismo. Se asocia habitualmente con síntomas que incluyen el ronquido y trastornos del sueño1.
Su prevalencia en la adolescencia es desconocida; entre el 5 y el 14,8% de los adolescentes de 13 años roncan2 y éstos, sin importar la intensidad del índice de apneas-hipopneas (IAH) o la presencia de obesidad, tienen peor calidad de vida y más síntomas depresivos que los adolescentes no roncadores. La mala calidad del sueño debida al SAHS puede traducirse en fatiga durante el día con mayores problemas de concentración, irritabilidad, humor depresivo y disminución del interés por las actividades diarias. Estos síntomas diurnos, en ocasiones, provocan dificultades en otros aspectos de la vida como la relación con la familia y sus compañeros o la participación en actividades físicas y deportivas3.
Concepto de Trastorno Respiratorio del Sueño
Los TRS son una alteración progresiva, aunque con una lenta progresión. La historia de aumento de resistencia de la vía aérea en la época prepuber puede, en ocasiones, facilitar la aparición en la adolescencia de retrognatia al alterar la relación mandibulocraneal.
Los Trastornos Respiratorios del Sueño (TRS) constituyen un proceso dinámico que se inicia con el ronquido habitual, continúa con el Aumento de Resistencia de la Vías Aéreas Superiores, la hipoapnea obstructiva y puede terminar con el S. de Apnea-Hipopnea del Sueño.
Es un proceso dinámico resultado de la combinación de factores estructurales y neuromusculares y no únicamente consecuencia de alteraciones estructurales.
La historia de aumento de resistencia de la vía aérea en la época prepuber puede, en ocasiones, facilitar la aparición en la adolescencia de retrognatia al alterar la relación mandibulocraneal. Esta relación mandibulocraneal puede verse agravada si coexisten otras alteraciones craneofaciales como el estrechamiento o la deficiencia sagital mandibular.
Los TRS son una alteración progresiva, aunque con una lenta progresión4.
Fisiopatología
Durante la vigilia, la vía aérea permanece abierta de manera activa. En presencia de SAHS aumenta la acción de los músculos dilatadores de la vía aérea superior (VAS) (geniogloso) para mantenerla abierta.
Los eventos de apnea-hipopnea ocasionan oscilaciones en el sistema simpático-parasimpático y un patrón repetitivo de desoxigenación seguido de reoxigenación que junto con los episodios de isquemia y reperfusión favorecen la aparición de radicales libres y cambios oxidativos.
Durante el sueño, se produce una disminución de la actividad de estos músculos dilatadores favoreciendo el colapso así como una merma de los neurotransmisores que controlan las motoneuronas de la VAS originados a partir de la serotonina.
La vibración ocasionada por el ronquido y/o los cambios de presión intraluminal de la VAS durante el sueño propician cambios en la propia VAS: Existe evidencia de denervación del músculo palatino y de infiltrado inflamatorio tanto en la mucosa como en los músculos del paladar blando. Esto fundamenta más todavía el concepto del SAHS como un proceso dinámico y progresivo que se inicia con el ronquido habitual y obliga a un diagnostico precoz como elemento necesario y fundamental de la medicina pública y preventiva.
Las consecuencias fisiopatológicas del SAHS se producen, pues, por diferentes mecanismos:
— La fragmentación del sueño y los arousal juegan un importante papel en la excesiva somnolencia presente en muchos pacientes.
— Los eventos de apnea-hipopnea ocasionan oscilaciones en el sistema simpático-parasimpático y un patrón repetitivo de desoxigenación seguido de reoxigenación que junto con los episodios de isquemia y reperfusión favorecen la aparición de radicales libres y cambios oxidativos.
— Estos cambios ocasionan daños en las neuronas del hipocampo y en las neuronas promotoras de la vigilia que pueden ser, en parte, responsables de los problemas de aprendizaje y de la somnolencia residual presente en algunos pacientes tras el tratamiento5.
— Algunos datos (de estudios con muestras pequeñas) apuntan hacia la mejoría del control de la glucosa en pacientes obesos con diabetes tipo 2 tras el tratamiento del SAHS lo que parece indicar que el SAHS es un componente que integra el síndrome metabólico junto con la obesidad visceral, la hipertensión, hiperlipidemia y resistencia a la insulina6. El TRS se detecta en el 25% de los adolescentes de 13 años con s. metabólico y sólo en el 4% de los adolescentes sin s. metabólico. Comparados con los adolescentes sin s. metabólico, los adolescentes con s. metabólico tienen desaturaciones nocturnas más intensas y menos eficiencia del sueño pero no muestran diferencias en el índice de arousal, porcentaje de sueño profundo, tiempo medio de sueño en días escolares o ronquido habitual. Existe una asociación lineal (p < 0.001) entre el s. metabólico y el IAH: a mayor intensidad de IAH mayor probabilidad de presentar s. metabólico de manera que una análisis de regresión lineal con el s. metabólico como variable demuestra que los adolescentes con TRS tienen una OR mayor de 7 de presentar s. metabólico frente a los adolescentes sin TRS y mismo nivel de peso (7.74; 95% CI, 3.10, 19.35)7.
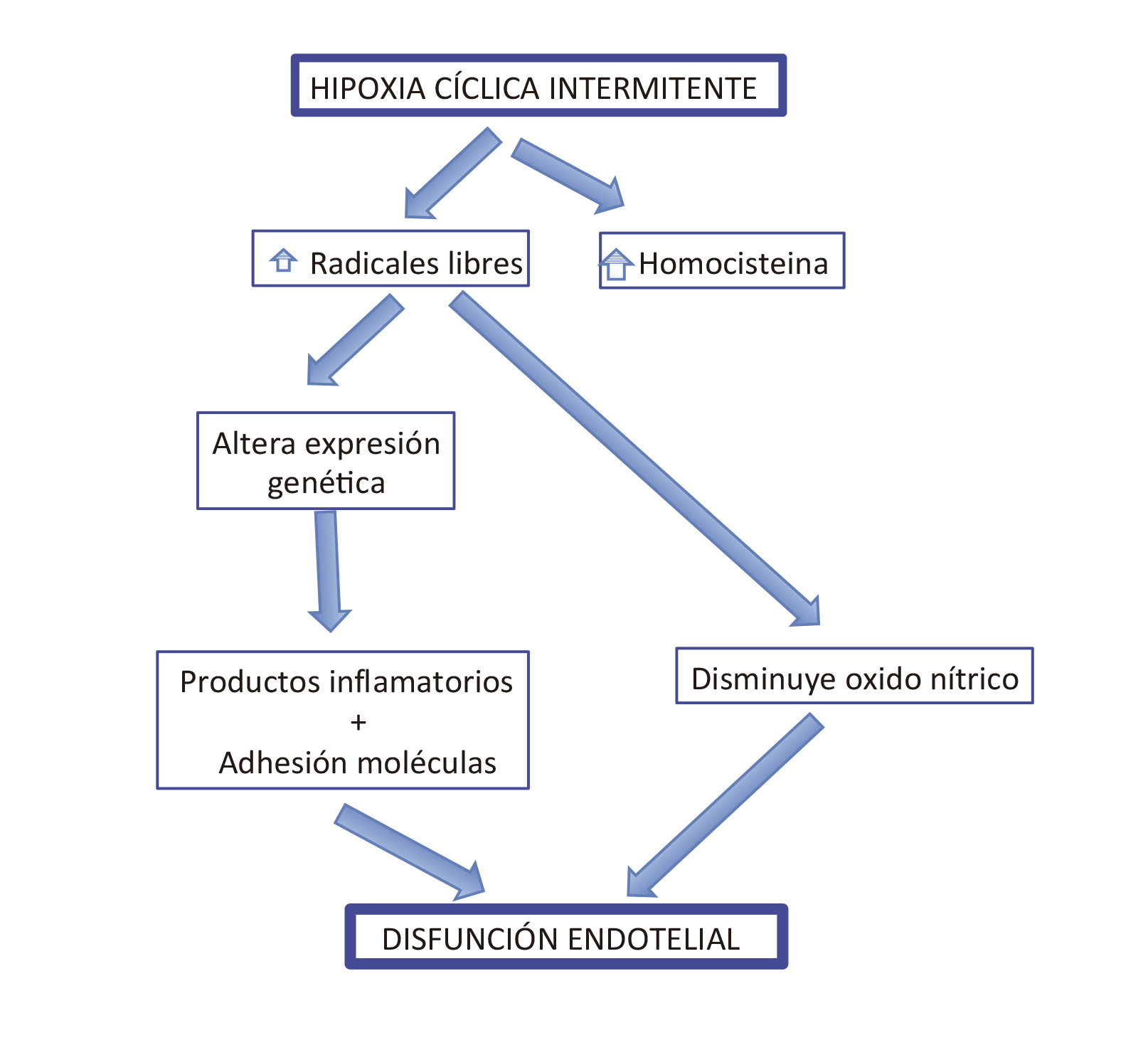
En la FIGURA 1 (modificada de la referencia 5) se resume la fisiopatología de las consecuencias cardiovasculares.
Clínica
Existen una serie de factores de riesgo para que un adolescente presente SAHS:
— Obesidad.
— Alteraciones craneofaciales específicas (Teacher-Collins, Secuencia Pierre-Robin).
— Retrognatia.
— Problemas nasales: desviación de tabique, rinitis alérgica.
— Alteraciones endocrinas: hipotiroidismo/acromegalia.
— S. de Riñón poliquístico.
— S. Down.
— Antecedentes familiares de SAHS.
— APOε4. (apolipoproteina ε4 (Apoε4), juega papel importante en el metabolismo lipídico).
El adolescente con ronquido sólo en agudizaciones o infecciones de VAS debe ser controlado evolutivamente en asistencia primaria. Sin embargo, la sospecha clínica de TRS en un adolescente exige la derivación a la Unidad de Sueño. o al centro de referencia
La TABLA 1 resume la clínica compatible con SAHS en el adolescente:
El adolescente con ronquido sólo en agudizaciones o infecciones de VAS debe ser controlado evolutivamente en asistencia primaria. Sin embargo, la sospecha clínica de TRS en un adolescente exige la DERIVACIÓN A LA UNIDAD DE SUEÑO o al centro de referencia más apropiado según las posibilidades en nuestra zona de trabajo, en un intento de disminuir las consecuencias mórbidas. Esta derivación puede seguir tres modalidades:
1. Normal no urgente.
Presencia de ronquido continúo (no sólo en agudizaciones) y alguna de las siguientes circunstancias:
a. Pausas respiratorias observadas durante el sueño.
b. Aumento del esfuerzo respiratorio durante el sueño.
c. Posturas anómalas para dormir (hiperextensión de cuello, dormir en cuclillas).
d. Sueño inquieto nocturno y sudoración nocturna.
e. Dificultad para despertar por las mañanas a pesar de un tiempo total de sueño y horarios regulares.
f. Cansancio al levantarse y requerimiento de sueño diurno.
g. Obesidad.
h. Respiración bucal diurna, voz nasal, facies adenoidea.
i. Hipertrofia amigdalar.
2. Preferente / urgente
Si además de lo anterior presenta uno de los siguientes:
a. Infecciones ORL de repetición e hipertrofia adenoamigdalar importante.
b. Deterioro de la memoria, concentración y alteraciones del comportamiento.
c. Retraso de crecimiento y bajo desarrollo pondero-estatural.
d. Malformaciones craneofaciales y síndromes polimarformativos.
e. Hipertensión arterial sistémica.
f. Síndrome Metabólico.
3.- Urgente
a. Datos de Cor Pulmonare inexplicados por otra causa, en ausencia de cardiopatía congénita.
b. Fracaso Cardiorrespiratorio.
c. Saturación de oxigeno diurna ≤ 92% o presencia de cianosis cutánea.
Diagnóstico
Los pasos diagnósticos ante un adolescente en el que se sospecha la presencia de SAHS deben realizarse con prontitud e incluyen:
1. Historia personal y familiar. Anamnesis.
2. Exploración física completa, con especial atención a la anatomía craneofacial y de las vías aéreas altas.
Si persiste la sospecha existen dos opciones en función de las disponibilidades de nuestro medio:
3. Exploración ORL: nasofaringoscopia.
ó de manera preferible:
4. Estudio de sueño nocturno en una Unidad de Sueño:
A este nivel existen diferentes técnicas diagnósticas, siendo la técnica de elección la Polisomnografía nocturna (PSG) realizada en el laboratorio de sueño.
En 2007 la Academia Americana de Medicina del Sueño (AASM) publica las reglas para codificación de las variables neurofisiológicas y cardiorrespiratorias de la PSG, tanto en los adultos como en los niños. La PSG nocturna consiste en el registro continuo y supervisado del estado de vigilia y de sueño espontáneo, mediante el registro de:
a. Variables neurofisiológicas: Electroencefalograma, electrooculograma, electromiograma tibial y submentoniano. Permite la valoración de los estadios de sueño y la arquitectura de sueño.
b. Variables cardiorrespiratorias con registro de:
b.1. Flujo oro-nasal: Para la valoración de eventos respiratorios: apneas, hipopneas y limitaciones al flujo, mediante termosensores o cánulas nasales.
b.2. Esfuerzo respiratorio: Para la clasificación de los eventos respiratorios en centrales, obstructivos o mixtos mediante bandas piezoeléctricas torácicas y abdominales o pletismografía de impedancia.
b.3. Valoración del intercambio gaseoso: Saturación de oxigeno por Pulsioximetría y medida del CO2 espirado o trascutáneo.
b.4. Frecuencia cardiaca.
b.5. Ronquido.
b.6. Posición corporal.
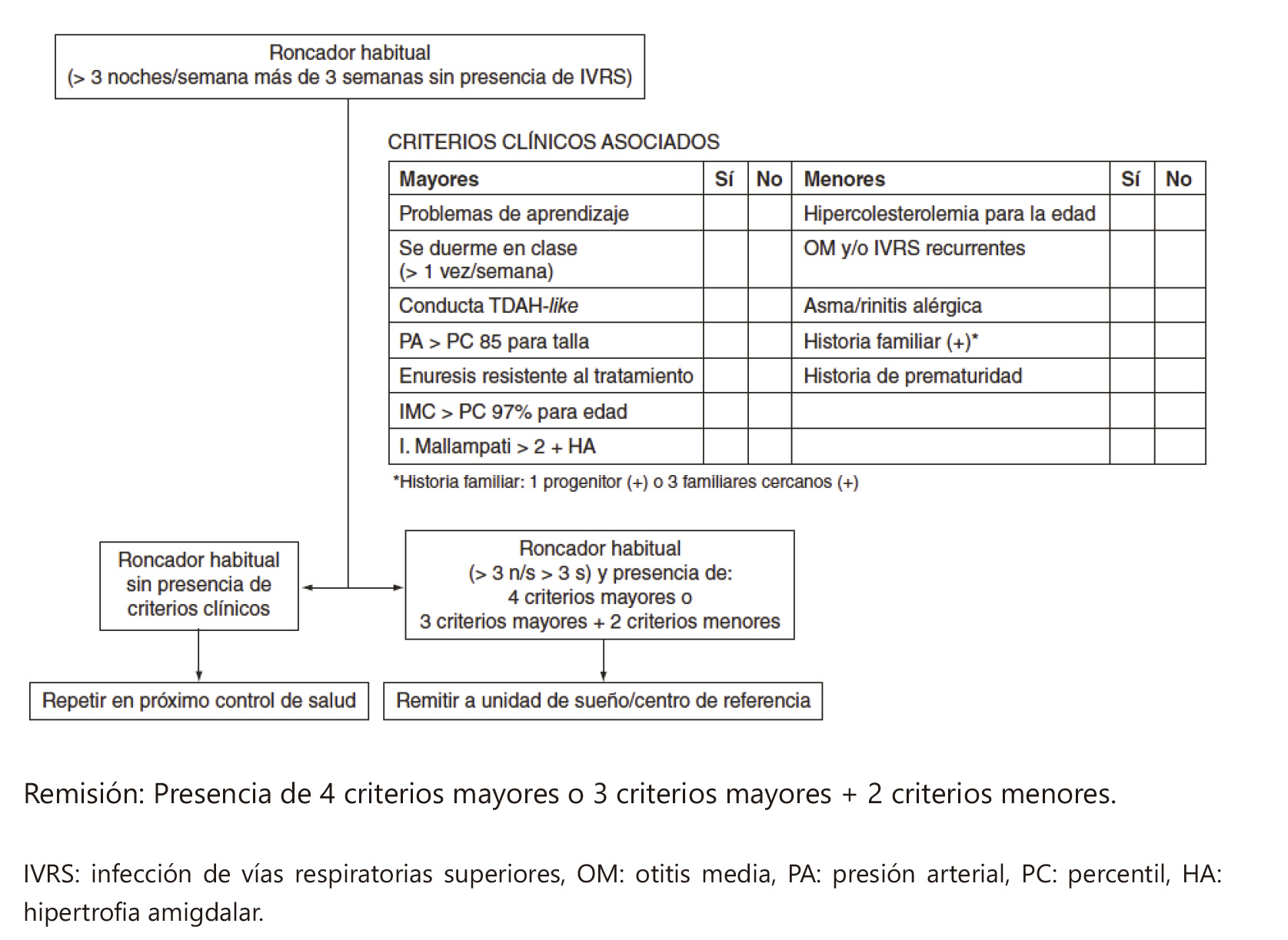
Se define a un adolescente como roncador habitual a aquel que en ausencia de clínica de infección de vías aéreas superiores ronca más de tres noches por semana más de tres semanas.
Dada la edad de los pacientes, requiere un entorno específico adecuado y adaptarse al horario de los adolescentes, requiriendo además personal entrenado tanto en la realización de la técnica como en su interpretación.
2.1.- Consideraciones técnicas (AASM):
2.1.1. El sensor utilizado para detectar la ausencia de flujo para la identificación de las apneas es el termístor oronasal.
2.1.2. El sensor utilizado para la identificación de las hipopneas es la cánula de presión nasal.
2.1.3. El sensor aceptado para la detección de esfuerzo respiratorio es el catéter esofágico o la pletismografía de impedancia calibrada o sin calibrar.
2.1.4. El sensor para la detección de saturación de oxígeno es la pulsioximetría.
2.1.5. Para valorar la hipoventilación alveolar se acepta la monitorización de CO2 trascutáneo o el end-tidal CO2.
Los criterios de la AASM para la identificación de apneas y su clasificación, de hipopneas, de limitaciones al flujo, hipoventilación nocturna y de respiración periódica en niños y adolescentes se resumen en la TABLA II:
Existen, no obstante, alternativas a la PSG como la poligrafía respiratoria (PR):
Diferentes estudios han intentado buscar alternativas diagnósticas a la PSG mediante la utilización de cuestionarios basados en el espectro de manifestaciones clínicas, registros de audio-video, pulsioximetría nocturna o PSG de siesta diurna, pero la gran variabilidad de resultados obtenidos con bajas sensibilidades hace que en la práctica clínica diaria se siga considerando a la PSG como la técnica diagnóstica de referencia. En este sentido en el año 2002 la Academia Americana de Pediatría realiza una revisión de las publicaciones realizadas en niños entre 2 y 18 años desde 1966 al año 2000 concluyendo que la evaluación clínica, incluyendo los cuestionarios tiene baja sensibilidad y baja especificidad para el diagnóstico de SAHS en niños, no siendo útiles para diferenciar el ronquido primario del SAHS. Se han desarrollado otros cuestionarios, como el cuestionario de Chervin, validado en castellano8, con mejores valores predictivos, siendo útil para la orientación diagnóstica posterior. La PSG de siesta diurna es útil si el resultado es positivo para SAHS, pero un resultado negativo no excluye SAHS y requiere la realización de una PSG nocturna completa. Algo similar ocurre con la Pulsioximetría, en la que incluso un resultado positivo debe ser interpretado con cautela y previa exclusión de enfermedades respiratorias que pueden dar lugar a falsos positivos. La Poligrafía Respiratoria, aceptada como alternativa para el diagnóstico de SAHS en el adulto, en el niño no había sido adecuadamente validada.
Los sistemas portátiles o de poligrafía respiratoria, son sistemas diseñados inicialmente para su utilización en el domicilio y que típicamente incluyen la medida de variables cardiorrespiratorias pero no de variables neurofisiológicas, pudiendo incluir: flujo oronasal (generalmente medido con termístor y/o cánula nasal) esfuerzo respiratorio (torácico y/o abdominal), saturación de oxigeno por Pulsioximetría, posición corporal, ronquido y frecuencia cardiaca). Son técnicas no vigiladas y que no permiten intervención durante su realización.
La ATS (American Thoracic Society) reconoce que la poligrafía cardiorrespiratoria sería una técnica prometedora requiriéndose investigación al respecto. Varios autores sugieren que el empleo de criterios clínicos junto con una exploración minuciosa de la vía aérea superior, un video domestico y una PR con un equipo validado es una buena alternativa para el diagnóstico de certeza de niños con sospecha clínica de SAHS. En nuestro país la PR ha sido validada por el grupo de Mari Luz Alonso en Burgos9.
En base a los conocimientos actuales, “el Grupo de Consenso Español de Síndrome de Apneas/Hipopneas durante el sueño” acepta un índice de apneas obstructivas entre 1 y 3 como línea de corte de la normalidad.
El algoritmo resumen las posibilidades diagnósticas10:
Tratamiento
En la adolescencia, al igual que en el adulto, la jerarquía de la intervención de adenoamigdalectomía desciende en las prioridades terapéuticas en relación con la etapa prepúber; en dicha etapa, conseguirá la normalización del cuadro respiratorio nocturno, de la sintomatología diurna y la reversión en muchos casos de las complicaciones cardiovasculares, alteraciones neurocognitivas, retraso en el crecimiento y enuresis hasta en el 78% de los casos como media.
Las alternativas terapéuticas a esta edad las podemos resumir:
1. Observación: La evolución natural del SAHS es el empeoramiento y no la curación espontánea. Grado de recomendación C.
Es necesario reconocer que muchos de los estudios de la evolución natural son retrospectivos y observacionales (series de casos).
2. La disminución de peso mejora los patrones respiratorios, la calidad del sueño y la somnolencia diurna. Grado de recomendación: C.
Con la disminución del IMC se observa un incremento del sueño REM (1-10%), del sueño profundo y disminución de la somnolencia diurna. Los estudios que lo fundamentan son retrospectivos y observacionales (series de casos).
3. Presión Positiva Continua en la Vía Aérea (CPAP):
El mayor problema del CPAP es la adherencia al tratamiento. Su media de uso a los 13 años en las pocas series en las que se ha podido estudiar es de 7.0 cada noche en el 73% de las noches de la semana y durante 18 meses.
En cuanto a los factores pronósticos de la adherencia al CPAP, conocemos que ni los factores demográficos ni el tipo de CPAP son índices pronósticos satisfactorios; por el contrario, parece ser que algunos factores relacionados con la gravedad previa del SAHS podrían ser índices pronósticos de adherencia futura (aunque los datos a este respecto son escasos actualmente). Esto es importante, porque incluso tasas de adherencia mínimas (57% de media) al tratamiento con CPAP proporcionan una mejoría estable del rendimiento escolar cuando se compara con un grupo de adolescentes con menor tasa de adherencia aunque desconocemos si una mayor adherencia individual proporciona mejorías más intensas en el desenvolvimiento diurno11,12. En adolescentes jóvenes la terapia posicional reduce el Índice de ApneaHipopnea pero su eficacia es menor que la eficacia del CPAP, por lo que no debe recomendarse salvo en casos excepcionales. Grado de recomendación C.
4. La estimulación de la musculatura relacionada con la apnea no es recomendable. Grado de recomendación C.
5. Los dispositivos de avance mandibular reducen las apneas y mejoran la somnolencia subjetiva, mejoran la calidad de vida y se recomiendan para el tratamiento del SAHS moderado. Grado de recomendación: A.
Los tratamientos de ortodoncia como avances mandibulares y expansión maxilar pueden reducir los eventos respiratorios con mejoría de la respiración y menor esfuerzo ventilatorio y disminución y/o desaparición del ronquido habitual y la respiración bucal13.
6. Los sistemas de dilatación nasal no se recomiendan para mejorar el trastorno respiratorio o la arquitectura del sueño. Grado de recomendación: D.
7. La cirugía nasal como única terapia no es recomendable para el tratamiento del SAHS. Grado de recomendación: C.
8. Los corticoides intranasales mejoran el SAHS leve-moderado en los adolescentes con rinitis y/o obstrucción de la VAS por hipertrofia adenoamigdalar. Grado de recomendación: B.
Los antagonistas de receptores de los leucotrienos actuarían como agentes antiinflamatorios y, por tanto, reduciendo el volumen total del tejido linfoideo en la vía aérea superior, conduciendo a una mejoría de los TRS en los niños14.
Los corticoides intranasales pueden ser recomendados como terapia coadyudante.
10. En pacientes con hipertrofia adenoamigdalar la adenoamigdalectomía es recomendable. Grado de recomendación: C.
En el adolescente obeso, la circunferencia abdominal, como indicador de la grasa abdominal, es un buen predictor clínico de la eficacia de la adenoamigdalectomía en el tratamiento del SAHS15.
Las adenoidectomias realizadas antes de los 20 años de edad presentan una OR de incremento de prevalencia de Infarto de miocardio a lo largo de la vida del 1.44 (95% IC, 1.04-2.01), probablemente debido a cambios sutiles en la función inmunológica que pueden alterar el riesgo cardiovascular posterior; sin embargo, aquellas realizadas a partir de los 20 años no se relacionan con este incremento probablemente por la pérdida del papel inmunológico del tejido adenoideo16.
La reducción por radiofrecuencia no es una opción recomendable. Nivel de recomendación: D.
11. Los dispositivos de avance mandibular son tan eficientes como el CPAP en los pacientes con SHAS que no toleran el tratamiento con CPAP, especialmente en los que no presentan sobrepeso-obesidad o presentan otra patología. Grado de recomendación: B.
12. En adolescentes con micrognatia y/o hipoplasia facial la cirugía ósea es una alternativa. Nivel de recomendación: C.
Tablas y figuras
Tabla I. Clínica del SAHS en el adolescente
|
SINTOMAS NOCTURNOS |
SINTOMAS DIURNOS |
|
Ronquido continuo (no sólo en agudización) |
Respiración normal |
|
Pausas Respiratorias observadas |
Respiración bucal diurna, voz nasal, facies adenoidea |
|
Respiración ruidosa |
Hipertrofia amigdalar |
|
Respiración bucal |
Dismorfias faciales (retrognatia, micrognatia, macroglosia, hipoplasia medio-facial) |
|
Aumento del esfuerzo Respiratorio (Retracción supraesternal / intercostal) |
Dificultad para despertar, cansancio al levantarse, cefaleas matutinas somnolencia diurna |
|
Sudoración nocturna |
Alteraciones del comportamiento (somnolencia, agresividad, escaso rendimiento escolar) |
|
Posturas anómalas para dormir (hiper-extensión cuello) |
Síndrome Metabólico |
|
Sueño inquieto nocturno |
Obesidad |
|
Cianosis |
Refuerzo del segundo tono cardiaco |
|
Enuresis nocturna |
Hipertensión arterial sistémica |
Tabla II. Eventos respiratorios nocturnos
|
APNEA OBSTRUCTIVA |
1. Duración del evento equivalente a dos ciclos respiratorios 2. El evento se asocia a caída de la amplitud de la señal ≥ 90% durante mas del 90% del total del evento 3. Persistencia o Aumento del esfuerzo respiratorio durante el periodo de descenso del flujo oronasal 4. Duración: desde el final de la última respiración normal hasta el inicio de la primera respiración que recupera el nivel basal |
|
APNEA MIXTA |
1. Duración del evento equivalente a dos ciclos respiratorios 2. El evento se asocia a caída de la amplitud de la señal ≥ 90% 3. Ausencia de esfuerzo inspiratorio en la primera parte del evento seguido de resolución del esfuerzo inspiratorio antes del final del evento |
|
APNEA CENTRAL |
Ausencia de esfuerzo inspiratorio durante todo el evento y uno de los siguientes criterios: 1. Duración del evento durante al menos 20 sg. 2. Duración del evento al menos el tiempo equivalente a 2 ciclos respiratorios y asociado con arousal, despertar o desaturación ≥3% 3. Apnea central equivalente a dos ciclos respiratorios pero menor de 20 sg que sigue a ronquido, suspiro, evento respiratorio o arousal no debe ser codificada, salvo que cause arousal, despertar o desaturación ≥ 3% |
|
HIPOPNEA |
Debe de cumplir todos los siguientes: 1. Descenso en la amplitud de la señal de la cánula nasal o de señal alternativa ≥ 50% comparada con la amplitud basal 2. Duración: Al menos el tiempo equivalente a dos ciclos respiratorios 3. La caída en la amplitud de la cánula nasal debe durar ≥90% de todo el evento respiratorio comparado con la amplitud precedente al evento 4. El evento está asociado con un arousal, despertar o desaturación ≥ 3% |
|
RERA |
Debe cumplir los criterios 1 o 2: 1. Con cánula nasal debe cumplir: – Caída discernible en la amplitud de la señal de la cánula, al menos de un 50% comparada con el nivel basal – Flattening en la onda de presión nasal – El evento se acompaña de ronquido, respiración ruidosa, elevación en PCO2 end-tidal o trascutáneo o evidencia visual de aumento de esfuerzo respiratorio – La duración del evento debe ser al menos el tiempo equivalente a dos ciclos respiratorios 2. Con Catéter Esofágico debe cumplir: – Aumento progresivo del esfuerzo respiratorio durante el evento – El evento se acompaña de ronquido, respiración ruidosa, elevación en el PCO2 end-tidal o trascutáneo o evidencia visual de aumento de esfuerzo respiratorio – La duración del evento debe ser al menos el tiempo equivalente a dos ciclos respiratorios |
|
HIPOVENTILACIÓN |
CO2 > 50 mmHg durante >25% del Tiempo Total de Sueño, medido por End-Tidal CO2 o CO2 trascutáneo |
|
RESPIRACIÓN PERIÓDICA |
Presencia de > 3 episodios de apneas centrales de al menos > 3 segundos de duración separadas por no más de 20 segundos de respiración normal. |
RERA : Despertares asociados a esfuerzo respiratorio (RERA, del inglés respiratory effort related arousals)
Son episodios no acompañados de desaturación de oxígeno, en los que se observa caída del flujo inspiratorio con aumento del esfuerzo respiratorio, finalizados por un despertar o arousal.
Figura I. Fisiopatología de las consecuencias cardiovasculares
Bibliografia
1. American Academy of Pediatrics. Clinical practice guideline: Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics 2002;109:704-12.
2. Delasnerie-Laupetre N, Patois E, Valatx JL, Kaufmann F, Alperovitch A. Sleep, snoring and smoking in high school students. J Sleep Res. 1993;2:138-42.
3. M.L. Alonso-Álvarez et al. Documento de consenso del síndrome de apneas-hipopneas durante el sueño en niños Arch Bronconeumol. 2011;47(Supl 5):2-18
4. Arens R, Marcus CL. Pathophysiology of upper airway obstruction: a developmental perspective. Sleep. 2004;27:997–1019.
5. Allan I. Pack. Advances in Sleep-disordered BreathingAm J Respir Crit Care Med Vol 173. pp 7–15, 2006.
6. Babu AR, Herdegen J, Fogelfeld L, Shott S, Mazzone T. Type 2 diabetes, glycemic control, and continuous positive airway pressure in obstructive sleep apnea. Arch Intern Med 2005;165:447–452.
7. Redline, Storfer-Isser, Rosen, et al.: Metabolic Syndrome and Pediatric Sleep Apnea. Am J Respir Crit Care Med Vol 176. pp 401–408, 2007.
8. Tomás Vila M, Miralles Torres A, Beseler Soto B. Versión española del Pediatric Sleep Questionnaire. Un instrumento útil en la investigación de los trastornos del sueño en la infancia. Análisis de su fiabilidad. An Pediatr (Barc). 2007;66:121-8.
9. Alonso ML,Teran J, Cordero JA,Navazo A, Ordax E, Masa JF, Pelayo R. Fiabilidad de la poligrafía respiratoria para el diagnóstico del síndrome de apneas-hipopneas durante el sueño en los niños. Arch Bronconeumol 2008,44: 318-23.
10. Alonso-Álvarez ML, Merino-Andreu M, Canet T, Estivill E, Fernández-Julia E, Gozal D et al. Documento de consenso del síndrome de apneas-hipopneas durante el sueño en niños. Arch Bronconeumol.2011;47, supl 5: 2-18.
11. C. Uong E, Epperson M, Bathon S, Jeffe D. Adherence to Nasal Positive Airway Pressure Therapy Among School-aged Children and Adolescents With Obstructive Sleep Apnea Syndrome. Pediatrics 2007; 120(5): e1203-1211.
12. Beebe DW, Byars KC (2011) Adolescents with Obstructive Sleep Apnea Adhere Poorly to Positive Airway Pressure (PAP), but PAP Users Show Improved Attention and School Performance. PLoS ONE 6(3): e16924. doi:10.1371/journal.pone.0016924.
13. Barros Schütz T C; Dominguez GC; Pradella Hallinan M; Abrahao Cunha T;Tufik S. Class II correction improves nocturnal breathing in adolescents. Angle Orthodontist, 2011; 81 (2): 222-228
14. Kheirandish L, Goldbart AD, Gozal D. Intranasal steroids and oral leukotriene modifier therapy in residual sleep-disordered breathing after tonsillectomy and adenoidectomy in children. Pediatrics. 2006;117:e61-6.
15. Nino G,Gutierrez MJ, Ravindra A, Nino CL, Rodriguez-Martinez CE. Abdominal adiposity correlates with adenotonsillectomy outcome in obese adolescents with severe obstructive sleep apnea. Pulmonary Medicine.2012:351037. doi: 10.1155/2012/351037.
16. Janszky I, Mukamal KJ, Dalman C, et al. Childhood appendectomy, tonsillectomy, and risk for premature acute myocardial infarction–a nation wide population-based cohort study. Eur Heart J. 2011;32(18):2290-6.