Descubriendo la hidradenitis supurativa en el paciente adolescente
Descubriendo la hidradenitis supurativa en el paciente adolescente
A. Martorell.
Servicio de Dermatología. Hospital de Manises, Valencia.
Fecha de recepción: 07-02-2022
Fecha de publicación: 28-02-2022
Adolescere 2022; X (1): 64-72
Resumen
|
En los últimos años la hidradenitis supurativa ha cobrado un especial interés entre la comunidad dermatológica. Los avances alcanzados tanto en su etiopatogenia como en el manejo de esta enfermedad han hecho que unidades específicas estén trabajando de forma multidisplinar para dar respuesta personalizada a este grupo de pacientes. Esta enfermedad, que muestra una especial predilección por mujeres adolescentes, es considerada como un proceso significativamente infradiagnosticado, generando el consecuente retraso y favoreciendo la progresión de la misma en un grupo significativo de casos, que en ocasiones requieren de cirugías mutilantes para alcanzar el control de síntomas. En el presente artículo analizaremos las claves clínico patológicas que permitirán al lector comprender mejor una patología que marcará el futuro de muchos de nuestros adolescentes.. Palabras clave: Adolescente; Hidradenitis; Acné inversa; Manejo; Retraso. |
Abstract
|
In recent years hidradenitis suppurativa has gained special interest among the dermatological community. The advances achieved both in its etiopathogenesis and in the management of this disease have led to the creation of multidisciplinar care units with the aim of providing personalized response to these cases. This disease, which shows a special predilection for adolescent women, is considered a significantly underdiagnosed process, generating the consequent delay and favoring its progression in a significant group of cases, which sometimes require mutilating surgeries in order to achieve symptom control. In this article, we will analyze the clinical pathological keys that will allow the reader to better understand a pathology that will define the future of many of our adolescents. Key words: Adolescent, Hidradenitis; Acne inversa; Management; Delay. |
Definiendo la hidradenitis supurativa
La Hidradenitis Supurativa (HS), también conocida como hidrosadenitis supurativa, o acné inverso, se ha definido como una enfermedad cutánea inflamatoria crónica, recurrente y debilitante, que habitualmente se presenta tras la pubertad con lesiones profundas, inflamadas y dolorosas, afectando a las áreas corporales con presencia de glándulas apocrinas, siendo las regiones más frecuentemente afectadas la axilar, inguinal y anogenital (definición de Dessau, First International Conference on Hidradenitis Suppurativa, 30 marzo-1 abril, 2006, Dessau, Alemania)(1).
La Hidradenitis Supurativa es una enfermedad cutánea inflamatoria, crónica, recurrente y debilitante, que habitualmente se presenta tras la pubertad con lesiones profundas, inflamadas y dolorosas, afectando a las áreas corporales con presencia de glándulas apocrinas, siendo las regiones más afectadas la axilar, inguinal y anogenital
A esta entidad se la ha conocido históricamente en la literatura científica como enfermedad de Verneuil, dado que fue este cirujano francés quien a mediados del siglo XIX relacionó la enfermedad con las glándulas apocrinas y la denominó HS. En 1975 fue atribuida la patogenia a la oclusión del folículo pilosebáceo y se la relacionó, por tanto, con otras enfermedades como el acné conglobata, la celulitis disecante del cuero cabelludo o el sinus pilonidal, formando parte inicialmente de la tríada y posteriormente de la tétrada de oclusión folicular. En 1996 se introdujo el término acné invertido y hasta la actualidad, y de forma paralela al conocimiento de los mecanismos etiopatogénicos implicados, la denominación de la entidad ha sido motivo de controversia en la literatura. Algunos autores sostienen que con los conocimientos recientes en relación a la patogenia de la enfermedad probablemente ninguno de los términos mencionados sea el más adecuado para definirla(1).
Una enfermedad muy presente en edad pediátrica
Diversas publicaciones citan una proporción de entre el 1% y el 4% de personas afectadas por la HS, basándose en los datos obtenidos del estudio realizado por Jemec y colaboradores en la población danesa en la década de los 90(2). Recientemente, un estudio realizado en Alemania mostró una incidencia del 0,03%, con tasas de prevalencia superiores en el género femenino(2).
La HS muestra 3 picos fundamentales de inicio de enfermedad: el primer grupo incluiría a pacientes de edades comprendidas entre los 6 y 12 años (Grupo A, infantil). El segundo muestra su debut entre los 13 y los 18 años (Grupo B, adolescencia). Por último, un tercer grupo debutaría en edad adulta, a partir de los 20-25 años (Grupo C, forma adulta)(3,4).
Si bien es cierto que la mayoría de los pacientes son diagnosticados a partir de los 18 años, también lo es que existe un retraso evidente en el mismo, lo que provoca que aquellos casos con capacidad de progresión y de generación de lesiones irreversibles lleguen a las consultas en una situación compleja.
Se han realizado varios estudios en los que se ha intentado analizar la prevalencia de la HS en series infantiles. Datos recientes sugieren que hasta un 8% de los pacientes con hidradenitis debutan antes de la edad de los 13 años(1-4). En un reciente estudio realizado en USA las formas infantiles (grupos A y B) mostraron una incidencia de 2,7 por 100.000 personas-año(3). En la misma línea, Garg y colaboradores realizaron un análisis sobre una cohorte de pacientes en la que la población pediátrica (<18) solo representaba 1.020 de 47.620 casos documentados en USA con una prevalencia estandarizada de 0,02%, considerablemente baja en comparación con la variante adulta (grupo C). De forma significativa, el estudio mostró que en la raza africana americana estaban afectos con mayor frecuencia(5).
Desde el punto de vista de las variantes pediátricas (Grupos A y B), la mayoría de las pacientes son niñas (3,8:1 ratio chicas/chicos)(4), siendo más frecuente Grupo A en varones y Grupo B en niñas(6).
Descubriendo el origen de la hidradenitis supurativa
La Hidradenitis Supurativa es una enfermedad inflamatoria del folículo pilosebáceo en la que existe un desequilibrio del sistema inmunológico, en una persona predispuesta genéticamente(1).
La causa de la HS no está del todo clara, pero se sabe que es multifactorial. En la adolescencia se ha identificado una predisposición familiar, que ocurre hasta en el 21,2%, sin asociación con el inicio precoz de la enfermedad
La causa de la HS no está del todo clara, pero se sabe que es multifactorial. La genética juega un papel importante, ya que más de un 40% de los pacientes con HS tienen historia familiar de la enfermedad, pero no se ha encontrado concordancia en estudios con hermanos gemelos homocigóticos(2). En las formas infantiles y adolescentes se ha identificado una predisposición familiar, que ocurre hasta en el 21,2%, sin asociación con el inicio precoz de la enfermedad(6).
El principal efecto de la fisiopatología de la HS implica la oclusión y la consiguiente inflamación del folículo piloso. Estas condiciones, junto con la falta de regulación inmunológica innata y adaptativa, se convierten en elementos clave para el desarrollo de la enfermedad. La oclusión folicular conduce a la dilatación, seguida de la ruptura del folículo, lo que da lugar a que el contenido folicular, incluidas la queratina y las bacterias, se derrame en la dermis circundante e induzca una vigorosa respuesta quimiotáctica de los neutrófilos y los linfocitos. El infiltrado celular inflamatorio causa la formación de abscesos, lo que lleva a la destrucción de la unidad pilosebácea y, eventualmente de otras estructuras anexas adyacentes(7). Así, podría entenderse como una tríada de oclusión folicular, que se trata de una oclusión reincidente, y en lo que además se suma la infección bacteriana(7).
La comprensión de la inflamación en la hidradenitis supurativa la proporciona el inflamasoma, que está formado por un grupo de complejos proteicos que reconoce los estímulos que controlan la producción de citoquinas proinflamatorias que regulan aspectos importantes de la inflamación, la reparación de los tejidos y la muerte de estos. El ensamblaje del inflamasoma se induce por la desregulación de las señales endógenas y exógenas que dan lugar a la liberación de IL-1β
La comprensión de la inflamación en la hidradenitis supurativa la proporciona el inflamasoma. El inflamasoma está formado por un grupo de complejos proteicos que reconoce los estímulos que controlan la producción de citoquinas proinflamatorias que regulan aspectos importantes de la inflamación, la reparación de los tejidos y la muerte de estos. El ensamblaje del inflamasoma se induce por la desregulación de las señales endógenas y exógenas que dan lugar a la liberación de IL-1β. Entre las señales endógenas se encuentran el receptor Notch, la gamma secretasa y los polimorfismos del factor de necrosis tumoral α, las hormonas endógenas, la resistencia a la insulina y los signos de estrés metabólico, como la elevación de la glucosa extracelular(7).
Entre las señales exógenas se encuentran el tabaco, la adiposidad visceral y el microbioma. Los inflamasomas también son capaces de reconocer señales de peligro, como los patrones moleculares asociados a los patógenos, lo que demuestra el importante papel que desempeñan los mecanismos inmunológicos innatos(7).
Las vías moleculares que siguen al ensamblaje del inflamasoma incluyen la producción de caspasa-1, que descompone la pro-IL-1β inactiva en IL-1β activa y eleva otras contrapartes de las citoquinas, como el Factor de necrosis tumoral (TNFα)(7).
La IL-1β juega un papel fundamental en la perpetuación de la inflamación. El perfil de las citoquinas en la hidradenitis supurativa ha propuesto la participación de numerosos mediadores. El análisis tisular ha demostrado una elevación de los niveles de IL-1β, 12, 17, 23 y del TNFα; mientras que el análisis sérico ha demostrado una elevación de los niveles de interleucina-1b, 6 y 17 y del TNFα(8).
Estudios recientes han demostrado que las vías de la IL-12/Th-1, y la IL-23/Th-17 se expresan en la piel en la hidradenitis supurativa, en la mucosa del colon en la enfermedad de Crohn y la piel que tiene presencia de psoriasis, lo que indica un punto en común en la patogénesis de estas condiciones autoinflamatorias(6).
También se ha estudiado la posible asociación con una función defectuosa de los queratinocitos(9), como la influencia del ambiente microbiótico del folículo piloso y de la glándula apocrina(12).
¿Qué factores predisponen a la HS?
Aspectos genéticos
Si bien se ha estimado que, aproximadamente el 40% de los pacientes tiene familiares afectos, no se ha encontrado concordancia en estudios con hermanos gemelos homocigóticos(2), aunque el patrón de herencia más frecuentemente observado es autosómico dominante.
Se han identificado algunos genes implicados en el desarrollo de la enfermedad, que se encuentran situados en los locus 1p21.1-1q25.3(10).
Distintas mutaciones inactivantes han sido identificadas en los genes presenilina I (PSENI), potenciador de presenilina II (PSENEN) y nicastina NCSTN, en grupos de pacientes que presentaban formas clínicas graves y atípicas(10).
Interleuquina 1β
En estudios sobre muestras de tejido de piel con lesiones, y con muestras de tejido sano perilesional, se ha observado una elevación significativamente mayor de IL-1β en la piel lesional que en la sana (31 veces superior) y, también, concentraciones más elevadas en piel con HS que con psoriasis.
Además, existe una correlación entre los niveles de interleuquina 1β (IL-1β) y la severidad de los síntomas(1-3).
Factor de necrosis tumoral α
Aunque la disparidad entre los distintos estudios publicados en cuanto al papel del FNT-α es alta, sí se ha demostrado la elevación de esta molécula y de su m-ARN en biopsias de piel con lesión y sin lesión, siendo los valores cuantificados hasta 5 superiores en la hidradenitis supurativa en comparación con la psoriasis(1).
Microbioma
El microbioma humano, o flora microbiana, está compuesto por el conjunto de microorganismos que viven en el ser humano de forma simbiótica. Las alteraciones en el microbioma se han relacionado con el desarrollo de enfermedades autoinmunes como la enfermedad inflamatoria intestinal(1).
Algunos estudios han demostrado la presencia del biofilm (comunidades complejas de microorganismos recubiertas de un polímero extracelular que les ayuda a retener el alimento y a protegerse de agentes tóxicos(22)) en los folículos pilosos y en los sinus de los trayectos fistulosos de la hidradenitis supurativa(23).
Aunque no se ha terminado de dilucidar qué papel desempeña el biofilm en el desarrollo de la enfermedad, parece lógico pensar que ante una colonización bacteriana, facilitada por el desequilibrio en los péptidos antimicrobianos, encontremos un estímulo para la cascada inflamatoria y la producción de citoquinas a partir del reconocimiento de patógenos por los receptores Toll-like (TLR) de los macrófagos(23).
¿Qué factores actúan como desencadenantes en la edad infantil?
Tabaco
Se estima que, entre un 70% y un 89% de pacientes que sufren la hidradenitis supurativa, son fumadores(11).
Diferentes estudios observan que la nicotina secretada en el sudor induce la hiperplasia epitelial infundibular a través de la señalización autocrina y paracrina de la acetilcolina, y sus receptores en las células circundantes, al tiempo que también se regulan los propios receptores de la acetilcolina dentro del infundíbulo folicular.
El papel de la nicotina en el desencadenamiento del síndrome de hipersensibilidad sigue siendo especulativo. Los receptores nicotínicos de acetilcolina, los ligandos naturales de la nicotina, pueden encontrarse en todas las células supuestamente implicadas en la patogénesis de la HS, incluidos los queratinocitos, granulocitos neutrófilos, linfocitos y macrófagos(11).
Se ha demostrado que la nicotina secretada en el sudor induce la hiperplasia epitelial infundibular a través de la señalización autocrina y paracrina de la acetilcolina y sus receptores en las células circundantes, al tiempo que también se regulan los propios receptores de la acetilcolina dentro del infundíbulo folicular. Se cree que el efecto combinado da lugar a una hiperqueratosis infundibular con una eventual oclusión y ruptura del folículo piloso(11).
La nicotina del tabaco estimula la sobreproducción de IL-10(7), y se relaciona con la disfunción de la vía de señalización de la γ-secretasa y Notch(11).
En el caso de las formas infantiles, este factor desencadenante es infrecuente dada la baja tasa de fumadores activos. Sin embargo, comienza a existir evidencia de que el tabaquismo pasivo puede ser de crucial importancia en estas edades, por lo que esta debe de ser igualmente combatida(12).
Obesidad
En formas infantiles la obesidad es una comorbilidad que se asocia con mayor progresión de la enfermedad así como la pubertad precoz(1,3). Esta comorbilidad aparece con frecuencia en diferentes series, como la holandesa (59%)(12-13)..
Se considera más un factor exacerbante que desencadenante. El síndrome metabólico, al igual que en otros trastornos autoinmunes, parece estar relacionado de forma estadísticamente significativa con la HS. Los estudios que tratan de demostrar el hiperandrogenismo primario como causa de la enfermedad son confusos por el hecho de que la mayoría de esos pacientes son obesos, lo que refuerza aún más el papel de la obesidad como factor de exacerbación(12). Además, se debe de tener en cuenta que la obesidad influye en la irritación mecánica de los pliegues de la piel, la oclusión y la maceración.
Factores endocrinológicos
En edades infantiles, la pubertad precoz o adrenarquia prematura son dos alteraciones bien descritas en diferentes series de casos(13-14) y a las que debe de prestarse atención a fin de realizar una derivación a endocrinología si fuera necesario.
¿Qué síntomas caracterizan a esta enfermedad?
Los síntomas de la HS incluyen nódulos subcutáneos dolorosos que pueden producir abscesos dérmicos profundos después de su ruptura, evolucionando a fístulas (actualmente llamados túneles) y, eventualmente, a cicatrices remanentes(3). Las lesiones de HS aparecen principalmente en la región axilar e inguinal, pero también en las regiones perianal, perineal e (infra) mamaria(1,2).
Los síntomas de la HS incluyen nódulos subcutáneos dolorosos que pueden producir abscesos dérmicos profundos después de su ruptura, evolucionando a fístulas y, eventualmente, a cicatrices remanentes. Las lesiones de HS aparecen principalmente en la región axilar e inguinal, pero también en las regiones perianal, perineal e (infra) mamaria
Esta enfermedad perjudica de forma severa la calidad de vida del paciente, ya que además de ser un proceso patológico de elevada importancia, su repercusión no es únicamente psicológica, sino que también lleva asociada una limitación física, de las relaciones interpersonales, de autoestima y de la percepción de la imagen personal y pública. A la afectación física y emocional, hay que sumar el estigma y aislamiento provocado, no solo por la supuración y el olor que generan las lesiones, sino también por el hecho de tratarse de una enfermedad desconocida, y por lo tanto invisible para la sociedad(2).
El 87,4% de los pacientes que sufren esta enfermedad, afirman que la HS afecta a su vida diaria y más de un 31% que le afecta gravemente. Los principales síntomas que sufren son: dolor, supuración, afectación de la movilidad y mal olor(2).
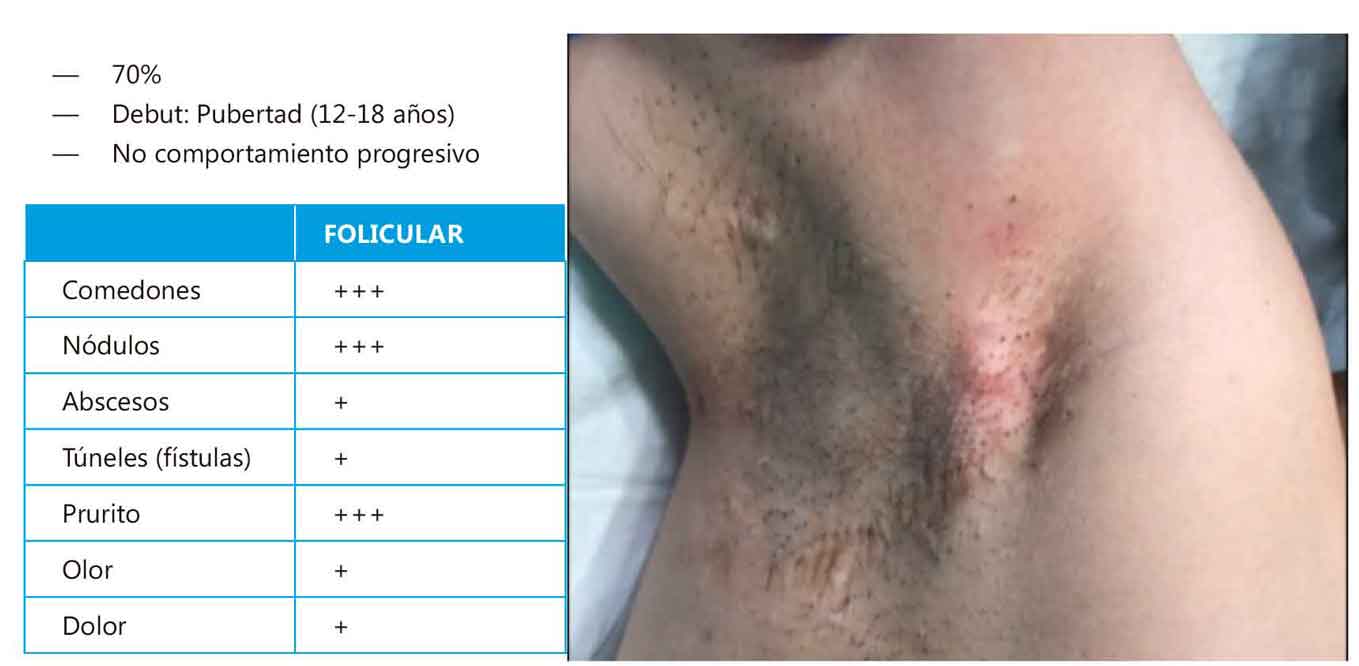
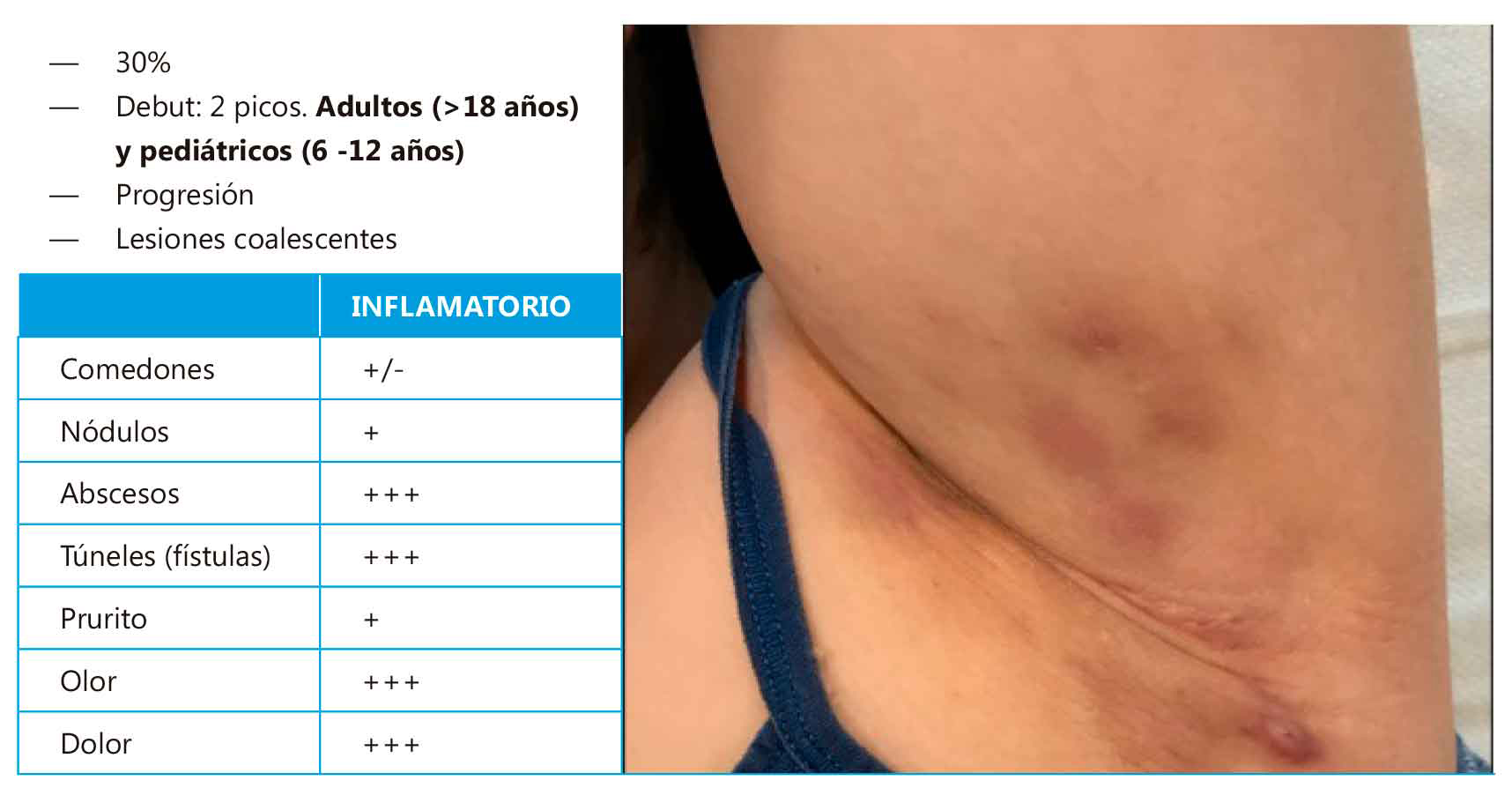
Martorell y cols definen 3 fenotipos clínicos de HS con implicación pronóstica. De ellos, la forma más prevalente en la población adolescente (grupo B) es la variante folicular
En comparación con la forma adulta, la forma infantil muestra mismo tipo y distribución de las lesiones elementales. Recientemente Martorell y colaboradores definen 3 fenotipos clínicos de HS con implicación pronóstica. De ellos, la forma más prevalente en la población adolescente (grupo B) es la variante folicular (Figura 1), mientras que la variante inflamatoria aparece con mayor tendencia en edades infantiles (grupo A) (Figura 2). La correcta definición del fenotipo resulta clave para establecer un diagnóstico y tratamiento precoz que permita frenar la evolución y la carga de enfermedad en edad adulta.
¿Qué comorbilidades asocian los pacientes con HS en edad infantil?
Las comorbilidades psiquiátricas representan un importante impacto en la calidad de vida de los niños(2-3,15), incluyendo depresión, trastorno de déficit de atención e hiperactividad, ansiedad y autismo(15).
Otras comorbilidades de la HS incluyen la psoriasis y el acné vulgar, así como la presencia de sinus pilonidal, acantosis nigricans y dermatitis atópica(2,15).
Situaciones como desórdenes hormonales, como la adrenarquia prematura, la pubertad precoz, la hiperplasia adrenal congénita o el ovario poliquístico pueden actuar de desencadenantes de la progresión(13-15). A su vez, Choi y colaboradores(13) añaden la asociación del grupo A de HS con desórdenes metabólicos como la diabetes mellitus, la hiperlipemia y la hipertensión.
En la misma linea, la HS infantil ha sido asociada a condiciones autoinflamatorias y autoinmunes como la artritis reumatoide, y otros desórdenes inflamatorios(13).
En la Tabla I se resumen aquellos puntos clave para la realización de la historia clínica de estos pacientes.
¿Qué complicaciones puede generar una HS no tratada en edad infantil?
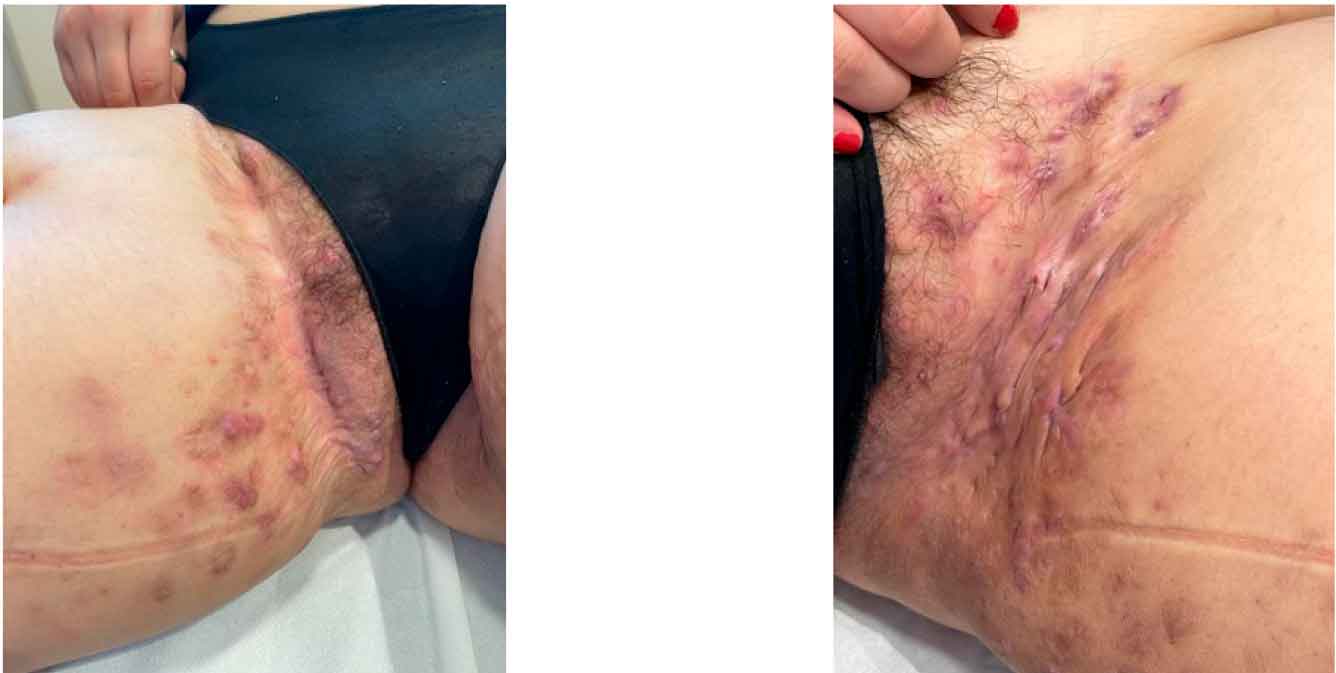
La progresión de la enfermedad es una situación en la que las lesiones avanzan desde el estado de nódulo, pasando por la fase de absceso y finalizando en el estado de túnel y cicatriz en menos de 12 meses, con tendencia a la formación de tejido cicatricial sintomático que obliga en muchos casos a proceder a la realización de cirugías mutilantes (Figura 3).
Por lo tanto, la prevención de aquellos factores considerados de riesgo para la progresión de la enfermedad resultará clave para cambiar la historia de la enfermedad.
Las complicaciones de la HS incluyen anemia, linfedema y formación de tractos fibrosos que pueden comprometer la movilidad y determinados órganos como la vejiga o el recto
Al igual que los adultos, los niños con HS sufren las mismas complicaciones, incluyendo anemia, linfedema y formación de tractos fibrosos que pueden comprometer movilidad y determinados órganos como la vejiga o el recto(15).
¿Qué opciones terapéuticas existen para el manejo de la HS infantil?
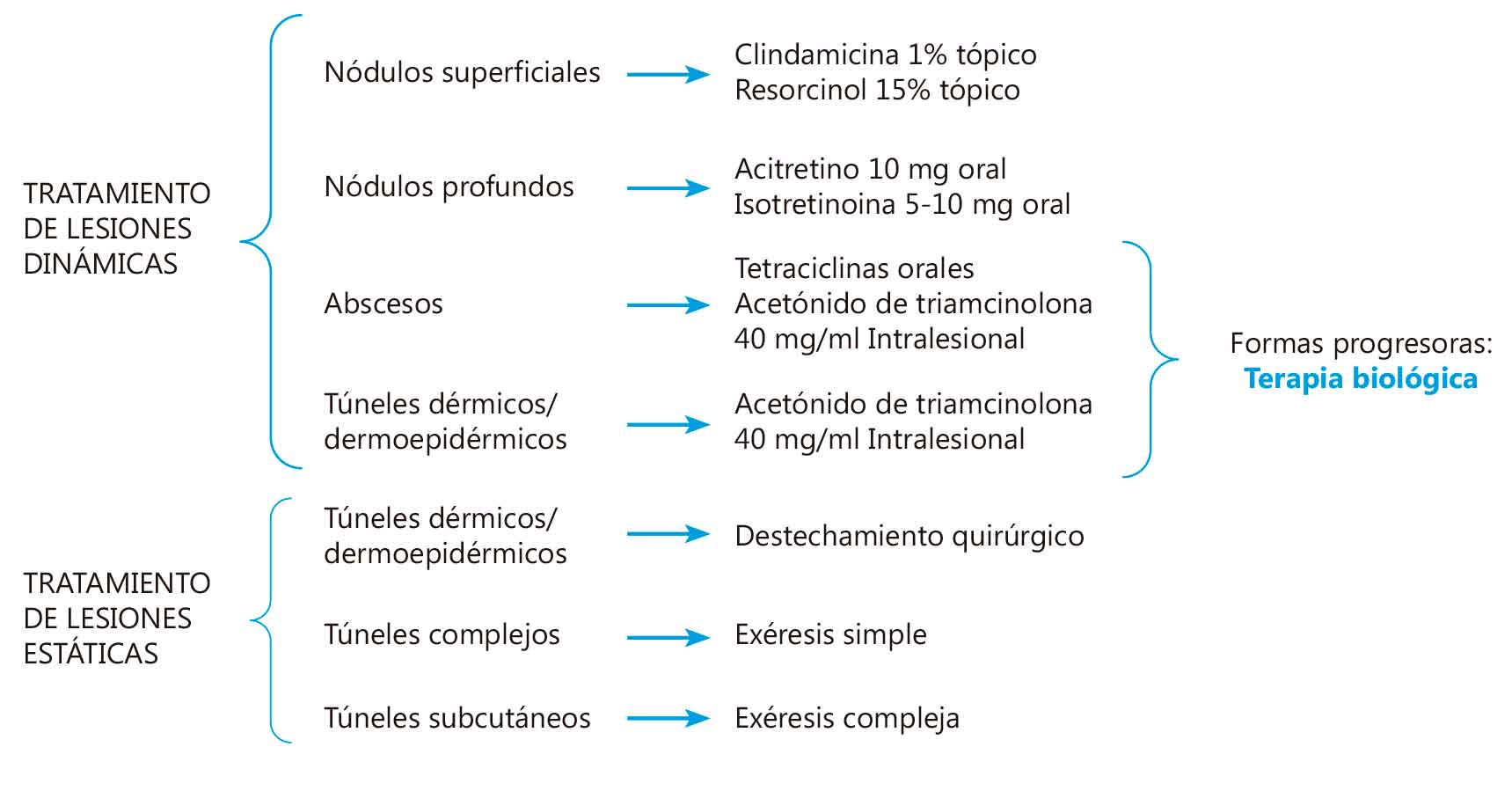
El tratamiento de la HS infantil, al igual que la del adulto, se precisa de un tratamiento encaminado a controlar las lesiones dinámicas, estáticas y las comorbilidades asociadas.
Las lesiones dinámicas son aquellas lesiones inflamatorias capaces de responder al tratamiento médico, y que incluyen los nódulos, los abscesos y las fistulas/túneles en su fase más incipiente sin componente cicatricial.
Las lesiones estáticas son aquellas estructuras tunelizadas cicatriciales que producen síntomas en los pacientes, en los que la cirugía es la opción eficaz.
El manejo de las comorbilidades juega un papel fundamental en alcanzar un adecuado control en la frecuencia de brotes de la enfermedad.
De forma simplicada se resume el manejo en la Figura 4.
Dentro de las terapias biológicas, Adalimumab es un fármaco anti TNF alfa que ha mostrado recientemente su capacidad para reducir la progresión de las formas inflamatorias a fases cicatriciales(16).
Se presenta como la única opción aprobada para el manejo de la enfermedad a partir de los 12 años, con una posología de 80 mg semana 0, y 40 mg desde semana 1 cada 2 semanas. En caso necesario, la dosis puede aumentarse a una posología de mantenimiento de adulto, que es de 40 mg cada semana u 80 mg cada dos semanas.
Conclusiones
La HS infantil y del adolescente es una entidad infradiagnosticada en el campo de la dermatología pediátrica, que conlleva mayores tasas de comorbilidades asociadas, acné conglobata, obesidad, y trastornos de ansiedad en comparación a la HS adulta
La HS infantil y del adolescente es una entidad infradiagnosticada en el campo de la dermatología pediátrica, que conlleva mayores tasas de comorbilidades asociadas (acné vulgaris [510%]), acné conglobata (45,9%), obesidad (33,7%), y trastornos de ansiedad (33,6%) en comparación a la HS adulta. Estos pacientes, que requieren del recurso de uso de puertas de urgencias con una mayor frecuencia comparado con la demanda de la población adulta (35,6% vs 28,2%; P < .001; and 18,1% vs 13,4%; P < .001; respectivamente)(13), hace que como médicos tengamos que estar más atentos frente a una patología en la que una detección precoz y un manejo adecuado puede cambiar vidas.
Tablas y figuras
Tabla I. Puntos clave en la historia clínica dermatológica del paciente con HS pediátrica(13)
|
HISTORIA CLÍNICA |
||
|
||
|
PRUEBAS COMPLEMENTARIAS A LA HISTORIA CLÍNICA |
||
|
Analítica con:
|
Si síntomas de enfermedad
Si síntomas articulares sospechosos de proceso inflamatorio:
|
Si signos de pubertad precoz
|
Figura 1. Fenotipo folicular
Figura 2. Fenotipo inflamatorio
Figura 3. Progresión de un fenotipo inflamatorio a un estadio Hurley III
Niña de 15 años con Hidradenitis Supurativa Severa (Hurley III).
Figura 4. Algoritmo de tratamiento de la HS pediátrica
Bibliografía
1. Martorell A, García-Martínez FJ, Jiménez-Gallo D, Pascual JC, Pereyra-Rodriguez J, Salgado L, et al. An Update on Hidradenitis Suppurativa (Part I): Epidemiology, Clinical Aspects, and Definition of Disease Severity. Actas Dermosifiliogr [Internet]. 2015;106(9):703-15. Disponible en: http://dx.doi.org/10.1016/j.ad.2015.06.004.
2. Kirsten N, Petersen J, Hagenström K, Augustin M. Epidemiology of hidradenitis suppurativa in Germany – an observational cohort study based on a multisource approach. J Eur Acad Deramtol Venereol 2020; 34:174-179. doi: 10.1111/jdv.15940.
3. Zouboulis CC, Benhadou F, Byrd AS, Chandran NS, Giamarellos-Bourboulis EJ, Fabbrocini G, et al. What causes hidradenitis suppurativa?-15 years after. Exp Dermatol. 2020 Dec;29(12):1154-1170. doi: 10.1111/exd.14214. PMID: 33058306.
4. Martorell A, Jfri A, Koster SBL, Gomez-Palencia P, Solera M, Alfaro-Rubio A, et al. Defining hidradenitis suppurativa phenotypes based on the elementary lesion pattern: results of a prospective study. J Eur Acad Dermatol Venereol. 2020 Jun;34(6):1309-1318. doi: 10.1111/jdv.16183. Epub 2020 Feb 16. PMID: 31919904.
5. Garg A, Wertenteil S, Baltz R, Strunk A, Finelt N. Prevalence estimates for hidradenitis suppurativa among children and adolescents in the United States: a gender and age adjusted population analysis. J Invest Dermatol 2018;138:2152-6. doi: 10.1016/j.jid.2018.04.001.
6. Braunberger TL, Nicholson CL, Gold L, Nahhas AF, Jacobsen G, Parks-Miller A, et al. Hidradenitis suppurativa in children: The Henry Ford experience. Pediatr Dermatol. 2018 May;35(3):370-373. doi: 10.1111/pde.13466. Epub 2018 Mar 25. PMID: 29575194.
7. Vekic DA, Frew J, Cains GD. Hidradenitis suppurativa, a review of pathogenesis, associations and management. Part 1. Australas J Dermatol. 2018;59(4):267-77. doi: 10.1111/ajd.12770.
8. Van Der Zee HH, De Ruiter L, Van Den Broecke DG, Dik WA, Laman JD, Prens EP. Elevated levels of tumour necrosis factor (TNF)-α, interleukin (IL)-1β and IL-10 in hidradenitis suppurativa skin: A rationale for targeting TNF-α and IL-1β. Br J Dermatol. 2011;164(6):1292-8. doi: 10.1111/j.1365-2133.2011.10254.x.
9. Banerjee A, McNish S, Shanmugam VK. Interferon-gamma (IFN-γ) is Elevated in Wound Exudate from Hidradenitis Suppurativa. Immunol Invest [Internet]. 2017;46(2):149-58. doi: 10.1080/08820139.2016.1230867.
10. Li A, Peng Y, Taiclet LM, Tanzi RE. Analysis of hidradenitis suppurativa-linked mutations in four genes and the effects of PSEN1-P242LfsX11 on cytokine and chemokine expression in macrophages. Hum Mol Genet. 2019;28(7):1173-82. doi: 10.1093/hmg/ddy414.
11. Micheletti R. Tobacco smoking and hidradenitis suppurativa: associated disease and an important modifiable risk factor. Br J Dermatol. 2018;178(3):587-8. doi: 10.1111/bjd.16261.
12. Seivright J, Collier E, Grogan T, Shih T, Hogeling M, Shi VY, et al. Pediatric Hidradenitis Suppurativa: Epidemiology, Disease Presentation, and Treatments. J Dermatolog Treat. 2021 May 31:1-10. doi: 10.1080/09546634.2021.1937484. Epub ahead of print. PMID: 34057384.
13. Choi E, Ooi XT, Chandran NS. Hidradenitis suppurativa in pediatric patients. J Am Acad Dermatol. 2022 Jan;86(1):140-147. doi: 10.1016/j.jaad.2020.08.045. Epub 2020 Aug 18. PMID: 32822788.
14. Hallock KK, Mizerak MR, Dempsey A, Maczuga S, Kirby JS. Differences Between Children and Adults With Hidradenitis Suppurativa. JAMA Dermatol. 2021 Sep 1;157(9):1095-1101. doi: 10.1001/jamadermatol.2021.2865. PMID: 34379074; PMCID: PMC8358812.
15. Seivright JR, Collier E, Grogan T, Hogeling M, Shi VY, Hsiao JL. Physical and psychosocial comorbidities of pediatric hidradenitis suppurativa: A retrospective analysis. Pediatr Dermatol. 2021 Sep;38(5):1132-1136. doi: 10.1111/pde.14765. Epub 2021 Aug 31. PMID: 34463372; PMCID: PMC8578297.
16. Marzano AV, Genovese G, Casazza G, Moltrasio C, Dapavo P, Micali G, et al. Evidence for a ‘window of opportunity’ in hidradenitis suppurativa treated with adalimumab: a retrospective, real-life multicentre cohort study. Br J Dermatol. 2021 Jan;184(1):133-140. doi: 10.1111/bjd.18983. Epub 2020 Apr 13. PMID: 32119111.