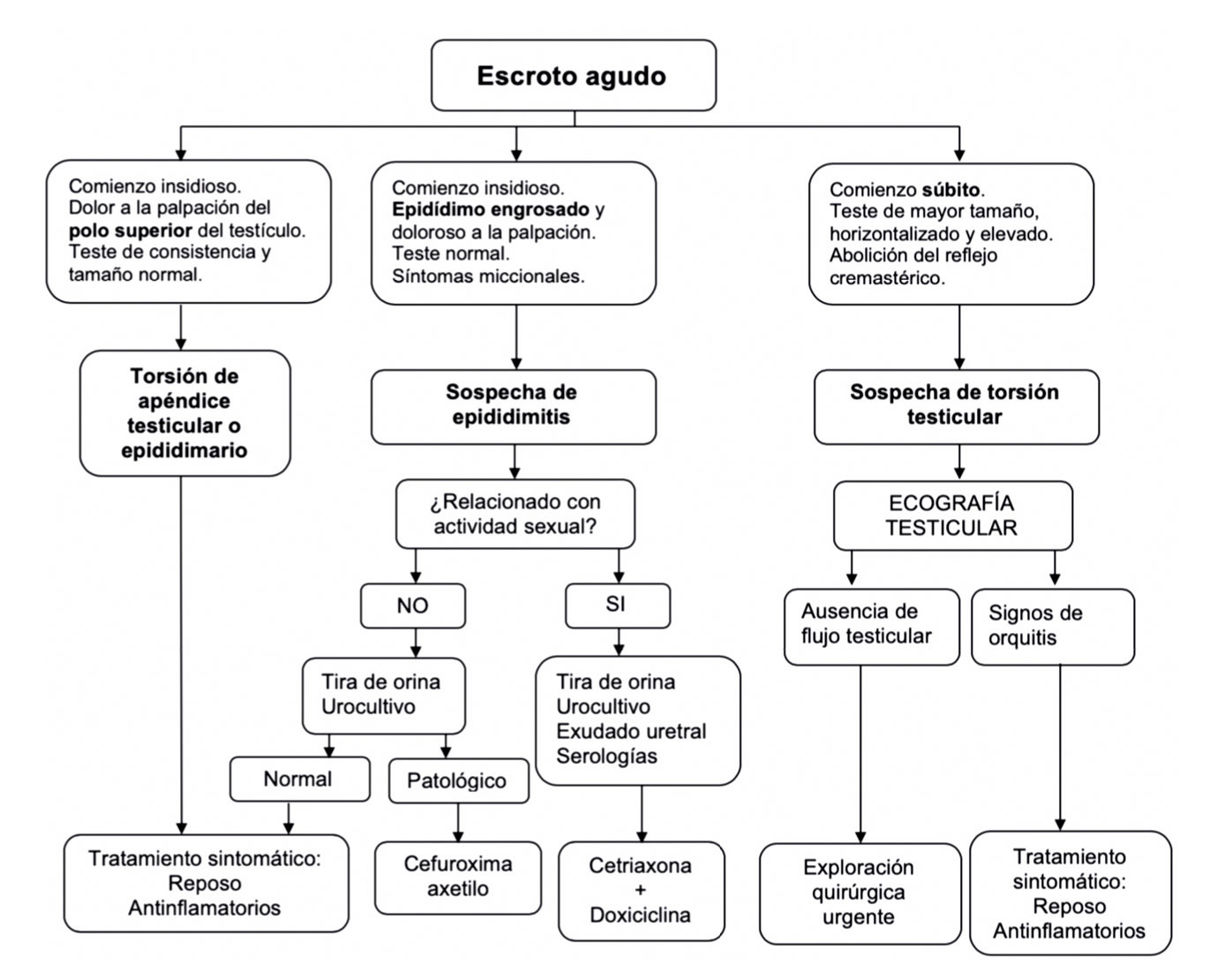
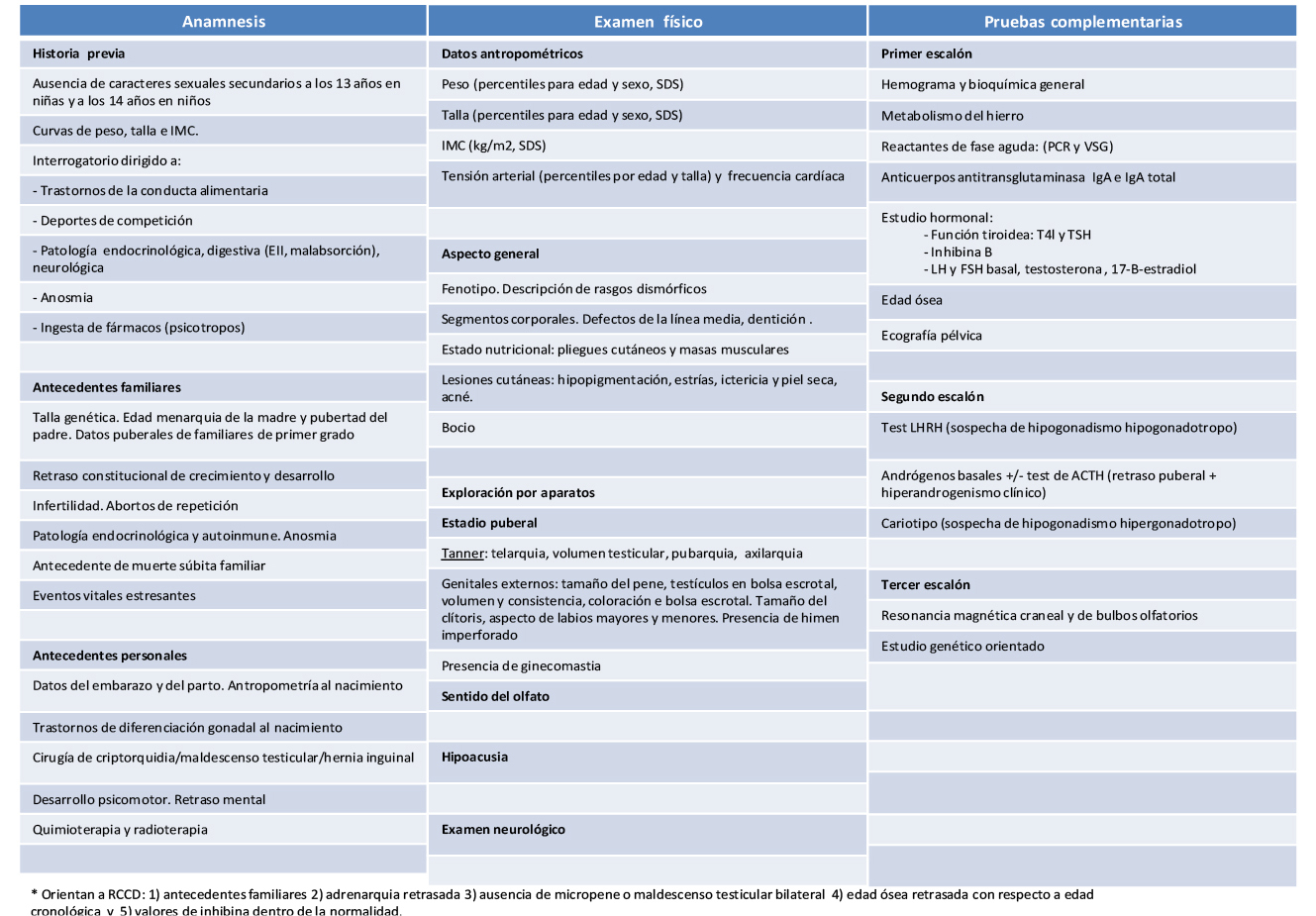
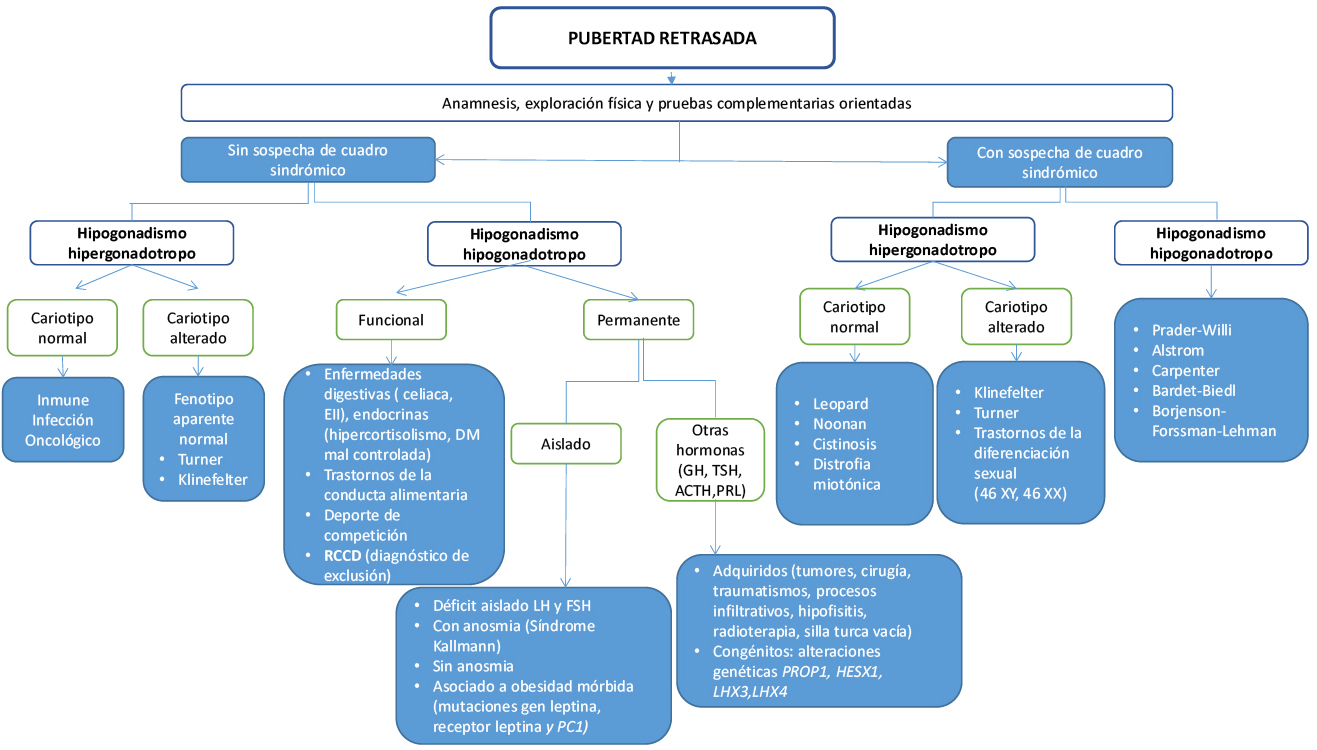
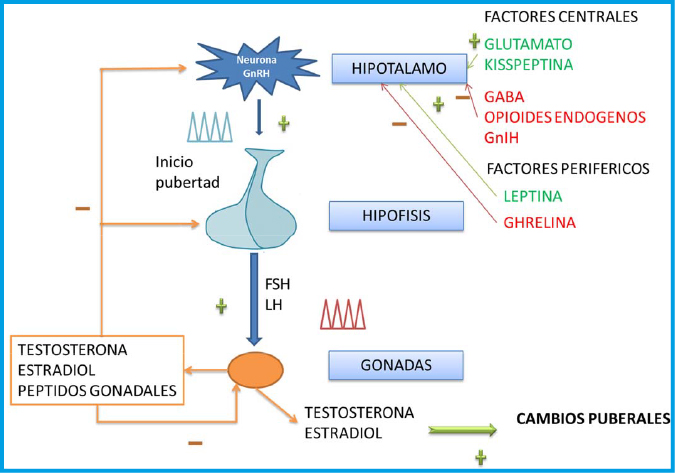
Valoración auxológica básica en el adolescente
J. Pozo Román(1,2,3), B. Corredor Andrés B(1), L. Travieso Suárez(1).
(1)Servicios de Pediatría y Endocrinología. Hospital Infantil Universitario Niño Jesús. Instituto de Investigación La Princesa. Madrid. (2)Universidad Autónoma de Madrid. Departamento de Pediatría. (3)CIBER Fisiopatología de la obesidad y nutrición. Instituto de Salud Carlos III. Madrid.
Fecha de recepción: 5 de febrero 2017
Fecha de publicación: 28 de febrero 2017
Adolescere 2017; V (1): 50-69
Resumen
|
La auxología es la ciencia que estudia el crecimiento y desarrollo, un campo de conocimiento que utiliza múltiples metodologías, entre las que la antropometría es una de las más sencillas y útiles en la práctica clínica. Los cambios puberales se inician a una edad muy variable, que depende de factores genéticos y ambientales, son sexualmente dimórficos y afectan, fundamentalmente: al crecimiento, a la composición corporal y a la maduración sexual, valorada esta, habitualmente, mediante el estadiaje de Tanner. El fenómeno más característico del crecimiento puberal es el “estirón puberal”, cuyo inicio y amplitud se ve influenciada por el sexo y el tempo de maduración. El IMC es un excelente índice de obesidad y malnutrición; si bien, su interpretación en la pubertad debería hacerse en función del grado de maduración alcanzado. La edad ósea es el mejor indicador de la maduración biológica y se correlaciona mejor que la edad cronológica con la mayoría de los parámetros antropométricos (talla, velocidad de crecimiento, IMC, masa ósea, edad de inicio puberal, edad de la menarquia, expectativas de talla adulta…), especialmente durante la pubertad; de hecho, la edad ósea está implicada en la mayoría de los métodos de predicción de talla adulta.
Palabras clave: auxología, pubertad, estirón puberal, índice de masa corporal, IMC.
|
Abstract
|
Auxology is the science that studies growth and development, a field of knowledge that uses multiple methodologies, among which anthropometry is one of the most simple and useful in clinical practice. Pubertal changes begin at a very variable age, depending on genetic and environmental factors, being sexually dimorphic and they fundamentally affect: growth, body composition and sexual maturation, being the latter usually assessed by Tanner staging. The most characteristic phenomenon of pubertal growth is the “pubertal spurt”, whose onset and amplitude is influenced by sex and tempo of maduration BMI is an excellent index of obesity and malnutrition, although its interpretation at puberty should be made according to the degree of maturation achieved. Bone age is the best indicator of biological maturation and it correlates better than chronological age with most anthropometric parameters (height, growth velocity, BMI, bone mass, pubertal onset age, age of menarche, final height…), especially during puberty; in fact, bone age is employed by most adult height prediction methods.
Key words: auxology, puberty, adolescent growth spurt, Tanner stage, body mass index, BMI.
|
Introducción
La pubertad es el periodo del desarrollo humano en el que tienen lugar los cambios biológicos y somáticos que marcan la diferencia entre la infancia y la edad adulta. Es un proceso madurativo de límites muy imprecisos, que se inicia con la aparición de los caracteres sexuales secundarios y finaliza, una media de 4-5 años después, cuando se ha alcanzado la talla adulta, la maduración sexual completa y la capacidad reproductora. La adolescencia es un proceso madurativo de límites todavía más amplios e imprecisos que la pubertad; ya que, se inicia con ella, pero finaliza cuando el sujeto ha alcanzado, además de los cambios físicos propios de la pubertad, los cambios emocionales, psicológicos, sociales y mentales que llevan al sujeto a comportarse como un adulto. La OMS define la adolescencia, como: el periodo de crecimiento y desarrollo humano que se produce después de la niñez y antes de la edad adulta, entre los 10 y los 19 años.
La edad ósea es el mejor indicador de la maduración biológica de un sujeto y se correlaciona mejor que la edad cronológica con la mayoría de los parámetros antropométricos (talla, velocidad de crecimiento, IMC, masa ósea, edad de inicio puberal, edad de la menarquia…), especialmente durante la pubertad
Desde el punto de vista endocrinológico, el inicio de la pubertad supone la reactivación del eje hipotálamo-hipófiso-gonadal (HHG) y el incremento consiguiente de la producción de esteroides sexuales (ES), principalmente testosterona en el varón y estradiol en la mujer, que son los responsables finales del desarrollo de los caracteres sexuales secundarios(1). Los ES estimulan la secreción de hormona de crecimiento (GH) y el incremento consiguiente de factor de crecimiento semejante a la insulina número 1 (IGF-1); ambos actúan, junto con los ES, de forma sinérgica para inducir el estirón puberal (EP). Los estrógenos, tanto en niñas como en niños (aromatización de testosterona), parecen ser los principales responsables del incremento de GH que se produce en la pubertad, así como del posterior cierre de las placas de crecimiento. En los últimos años, se ha hecho también evidente el papel de la leptina, como hormona que relaciona la nutrición y el balance energético con el crecimiento y el desarrollo puberal; de forma que, esta hormona liberada por el tejido adiposo estaría implicada en los mecanismos que regulan la ganancia ponderal normal, el inicio de la pubertad y en el dimorfismo sexual en la composición corporal.
Desde el punto de vista clínico, en las niñas, suele ser la telarquia, y en los varones, el incremento del volumen testicular, los primeros signos que heraldan el inicio de la pubertad.
La auxología (del griego auxein –crecimiento– y logos –ciencia–) es la ciencia que estudia el crecimiento y desarrollo(2), un campo de conocimiento que utiliza múltiples metodologías, entre las que la antropometría es una de las más sencillas, pero de enorme utilidad en la práctica clínica y en la que nos vamos a centrar a lo largo del artículo. Los cambios somáticos que se producen durante la pubertad, objeto de la valoración auxológica en el adolescente, son sexualmente dimórficos y afectan, fundamentalmente: al crecimiento en altura, al crecimiento diferencial de determinados segmentos corporales, a la composición corporal y a la maduración sexual.
Antropometría básica
El término “antropometría” hace referencia al estudio comparativo de las medidas del cuerpo humano. La talla, el peso y, en los primeros años de vida, el perímetro cefálico son los parámetros antropométricos más importantes. Su utilización en la valoración del crecimiento de un niño conlleva tres pasos sucesivos: 1) su medición o cálculo, empleando una estricta metodología(3-5); 2) la comparación de los datos recogidos con estándares de referencia adecuados para la población estudiada (sexo, etnia, país de origen); y 3) su análisis e interpretación posterior en función de la historia familiar y personal del niño, de los datos aportados por la exploración general y de su ritmo o grado de maduración.
La comparación de un determinado índice antropométrico con estándares de referencia nos permite determinar si el sujeto está o no dentro de los límites de la variación normal, lo que expresaremos, en el caso de parámetros de distribución normal, como percentiles (P) o desviaciones estándar de la media (SDS o Z-Score). La SDS (Z) sería la diferencia entre el valor del parámetro que queremos calcular (X) y la media de ese parámetro para una determinada población (µ) dividida por la desviación típica o estándar (σ) de ese parámetro para la población dada: Z= (X -µ)/ σ. Según las propiedades de una distribución normal: entre ± 1 SDS, se encontraría el 68 % de la población; entre ± 2 SDS, el 97,7 % de la población; y entre ± 3 SDS, aproximadamente, el 99,7 % de la población. Como norma general: “cuanto más alejado esté un parámetro de la media, mayor será el riesgo o la probabilidad de que obedezca a una causa patológica”; por ello, como norma general, consideramos como probablemente patológicos, a los sujetos que se alejan más de 3 SDS de la media; mientras que, los situados entre 2 y 3 SDS por encima o por debajo de la media serían casos límite, en ocasiones patológicos.
Cuanto más alejado esté un parámetro antropométrico de la media, mayor será el riesgo o la probabilidad de que obedezca a una causa patológica
La mayoría de los parámetros antropométricos están influenciados por factores genéticos asociados al origen étnico de la población y por factores ambientales. De ahí que, lo ideal sería disponer de estándares desarrollados para la población y etnia del sujeto estudiado. En los últimos 150 años, en Europa y EE.UU., se ha observado un incremento progresivo en la talla de la población (1-1,5 cm/década) a expensas fundamentalmente de un mayor crecimiento de las piernas, así como una mayor precocidad en la edad de inicio puberal e incrementos en el índice de masa corporal [IMC: peso (kg)/talla2 (m)]. Estos fenómenos, conocidos como “tendencia secular” del crecimiento y de la pubertad, obligan a que periódicamente deban actualizarse los estándares de referencia para estos parámetros. En muchos países, el incremento secular de la talla se ha enlentecido o casi detenido y la edad de la menarquia se ha situado alrededor de los 13 años; una situación que es diferente para el grado de adiposidad (IMC), que continúa incrementándose en muchos países de nuestro entorno(6).
En España, disponemos de varios estándares de referencia propios para los parámetros antropométricos más habituales: talla/longitud, velocidad de crecimiento (VC), peso, perímetro cefálico, IMC, talla sentado, relación peso/talla, velocidad de incremento del peso, perímetro braquial, pliegue tricipital, subescapular… (Hernández y cols., Carrascosa y cols. y Ferrández y cols., entre otros). En el año 2010, se han publicado los “Estudios Españoles de Crecimiento 2010” (EEC2010, disponibles libremente en la pagina web de la Asociación Española de Pediatría: http://www.aeped.es/noticias/estudios-espanoles-crecimiento-2010), resultantes de la fusión de los estudios transversales realizados en los últimos años en: Andalucía, Cataluña, País Vasco, Aragón y Madrid, que ha permitido demostrar la ausencia de diferencias significativas entre las poblaciones de los diferentes estudios y obtener un amplio estudio transversal desde el nacimiento a los 22 años (19.975 varones y 18.486 niñas), que refleja el crecimiento postnatal en sujetos sanos, caucásicos, de padres españoles. Además, se ha incorporado a este estudio un estudio longitudinal desde el nacimiento a la talla adulta (259 varones y 281 mujeres), con datos recogidos entre 1980 al 2002, por el Centro Andrea Prader de Zaragoza, que ha permitido entre otros resultados, desarrollar gráficas de talla y VC en función del tempo madurativo (maduradores tempranos, intermedios o tardíos)(7).
Un problema que se plantea, cada vez con mayor frecuencia, es qué valores de referencia utilizar en el caso de niños inmigrantes o adoptados de países en desarrollo. En un reciente consenso internacional, se ha recomendado utilizar en estos niños las gráficas del país de origen, y para los hijos de estos, las gráficas del país de adopción(8). Esto se debe, por un parte, a que las modificaciones nutricionales, socioeconómicas y de salud en general, consecuencia de la inmigración, determinan modificaciones en la talla adulta de los descendientes de estos inmigrantes, y por otra, a la postulada existencia de un factor regulador del crecimiento dependiente de la comunidad; según esta hipótesis, este factor “dependiente de la comunidad”, de mecanismo desconocido, determinaría la adecuación de la talla de los sujetos de una comunidad a la media de la de esa población(9).
Fiabilidad de las mediciones antropométricas
Uno de los aspectos que más condiciona la utilidad clínica de la antropometría es la falta de fiabilidad de las mediciones(5). Toda medición antropométrica conlleva un margen de error que suele expresarse como: “error técnico de la medición” (ETM). Se obtiene tomando una serie de duplicados (mínimo 50) de la medida en un grupo de sujetos. Cuando solo un observador realiza las mediciones, la ecuación para calcular el ETM = raíz cuadrada del sumatorio de las diferencias entre los duplicados (D) dividido por el número de individuos medidos (n) multiplicado por dos (ETM= ∑ D2 / 2n).
La fiabilidad de las mediciones requiere de: 1) aparatos de medición precisos; 2) personal entrenado en las técnicas auxológicas; y 3) controles periódicos de calidad, tanto del aparataje como del personal encargado de la recogida de los datos. Pese a ello, la reproductibilidad de las mediciones antropométricas es siempre escasa; ya que, los tres elementos de la medición (instrumento, observador y sujeto) son fuentes de error y la varianza de cada uno de ellos contribuye a la varianza total de la medición(2).
La talla y la velocidad de crecimiento (VC) son los parámetros antropométricos más importantes en la valoración del crecimiento de un niño y por ello nos vamos a referir especialmente a ellos, a la hora de evaluar la fiabilidad de sus determinaciones. Los aparatos para medir la altura de un sujeto pueden incluirse en tres grandes grupos: 1) estadiómetros, tableros verticales con una tabla horizontal contrapesada para ajustar a la cabeza, sin duda los más precisos; 2) minimetros, cintas metálicas que cuelgan de un gancho fijado a la pared y que se bajan hasta ajustarse a la cabeza del niño; y 3) tallímetros convencionales, escalas verticales con una barra horizontal movible. La disponibilidad de aparatos de medición precisos y el empleo de técnicas correctas de medición no es suficiente para conseguir una buena reproductibilidad; de hecho, mediciones repetidas del mismo niño, con el mismo aparato y por el mismo observador, raramente son iguales y menos aún si el observador es diferente5. Más del 90 % de la variabilidad intraobservador parece ser achacable al niño. Éste, al contrario de lo que ocurre con un objeto rígido, tiene una medida que varía ligeramente de un momento a otro. La variabilidad interobservador depende de pequeñas variaciones en la práctica de las técnicas de medición (posición de la cabeza, mayor o menor tracción, grosor del cabello…); así, entre observadores experimentados, pueden encontrarse diferencias en la medición de una talla concreta tan grandes como de 1,5 cm. Considerando, todas las fuentes de variación, un buen observador podría mantener su ETM para la talla por debajo de 2,5-3 mm, o lo que es lo mismo, en el 95 % de los casos, la medición que haga de un sujeto estará entre ± 5-6 mm del valor real.
Cuando el parámetro antropométrico que medimos requiere de mediciones separadas en el tiempo, como es el caso del incremento de talla (VC), la imprecisión aumenta; ya que, se suman dos errores de medición. Un buen observador con un ETM para la talla de 2,5 mm, tendría un ETMvc de unos 3,5 mm/año; por lo que, en el 95 % de los casos, la medición que haga de la VC de un sujeto estará entre ± 7 mm/año del valor real. Si la medición la realizan dos observadores diferentes, el error podría ser considerablemente mayor.
Valoración del crecimiento en la pubertad
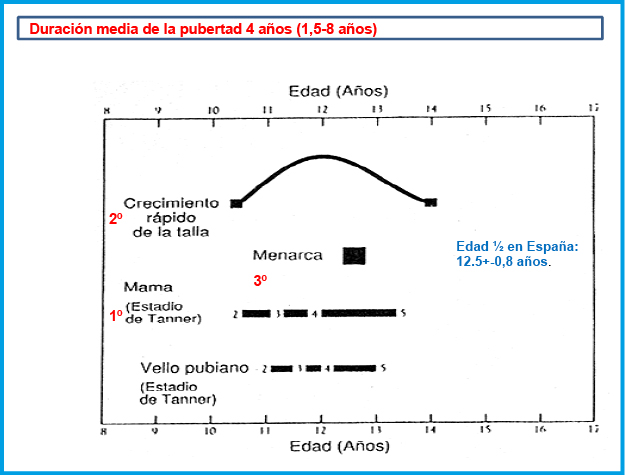
El fenómeno más característico del crecimiento puberal es el denominado “estirón puberal” (EP), consistente en una aceleración brusca e intensa del crecimiento en longitud, durante un periodo aproximado de 1,5 años, seguida de una desaceleración progresiva hasta que se cierran los cartílagos de crecimiento y el crecimiento cesa prácticamente por completo a una edad media de 17 años en las mujeres y de 21 años en los varones. El EP es precedido por una disminución progresiva de la VC a medida que la pubertad se acerca, la llamada “depresión prepuberal de la VC”, que es especialmente marcada y prolongada en los maduradores tardíos.
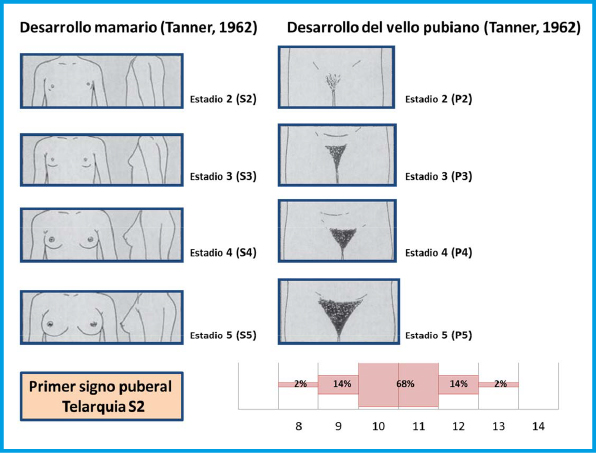
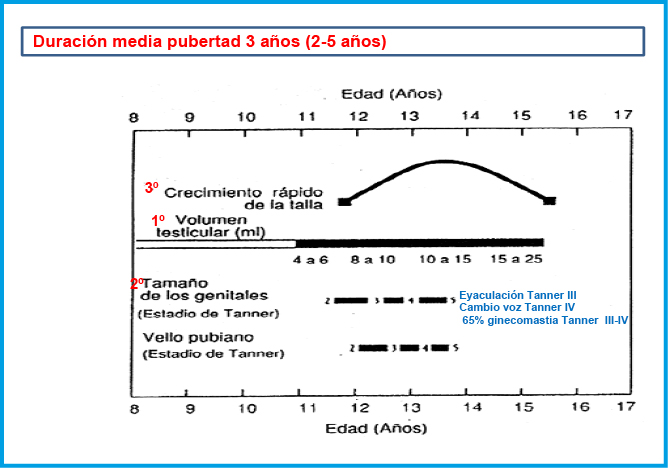
En las niñas, el EP se inicia temprano en el desarrollo puberal; de hecho, suele coincidir con el inicio de la pubertad y la aparición del botón mamario (estadio II de Tanner), a una edad media de 10,5-11 años(1,10). El pico de máxima VC se sitúa alrededor de los 9 cm/año y se produce habitualmente en el estadio III de Tanner, alrededor de los 12 años de edad. La 1ª menstruación (menarquia) suele tener lugar alrededor de 2 años después del inicio puberal, 12,5-13 años (estadio IV de Tanner), siendo el crecimiento postmenarquia muy variable, entre 4 y 11 cm (media de 6-7 cm). Por el contrario, en los varones, el EP no coincide con el inicio de la pubertad, sino que se inicia alrededor de un año después, a los 12,5-13 años, en un estadio III de Tanner y unos 2 años de media más tarde que en las niñas. El pico de máxima VC suele producirse en el estadio IV de Tanner y es también mayor que en las niñas, alrededor de unos 10-11 cm/año.
El EP es una reciente adquisición de la especie humana y su aparición o aumento de amplitud parece haber coincidido con la mejoría en las condiciones sociales, nutricionales y de salud en general; de hecho, en algunas poblaciones actuales que todavía viven en condiciones desfavorables (enfermedades crónicas, malnutrición o hipoxia por la altitud), el EP es todavía inaparente(6). La mayor amplitud en el EP es uno de los factores que más ha contribuido a la mejoría en el crecimiento experimentada en los últimos 150 años (tendencia secular del crecimiento). En las modernas poblaciones europeas, la ganancia de talla, desde el inicio del EP hasta la finalización del crecimiento, es de unos 30-35 cm en varones y de unos 25-30 cm en mujeres (15-20 % de la talla adulta)(6). El 99 % de la talla adulta de un sujeto se ha alcanzado cuando la edad ósea se sitúa alrededor de los 17 y 15 años en los varones y mujeres, respectivamente.
El EP muestra un patrón distal-a-proximal, con mayor crecimiento inicial de manos-pies y segmentos más distales de las extremidades, seguido de la parte proximal de las extremidades y, por último, habitualmente después de que se ha producido el pico de máxima VC, de las partes más centrales del esqueleto(6). Por tanto, medidas que relacionan la armonía corporal, como el cociente talla sentado/talla en bipestación o la braza experimentan modificaciones significativas a través de la pubertad que pueden dificultar su valoración. Por otra parte, aunque todas las estructuras corporales participan en el EP, lo hacen de manera desigual; de forma que, durante el EP crece proporcionalmente más el tronco que las extremidades. Por eso, cuando se acorta el periodo de crecimiento prepuberal, como sucede en los casos de pubertad precoz, el segmento inferior es proporcionalmente más corto en relación con la talla total; por el contrario, en las pubertades retrasadas o hipogonadismos, son habituales unas extremidades proporcionalmente más largas (hábito eunucoide).
La amplitud del EP no depende de la talla genética del sujeto y es similar en sujetos con talla familiar alta o baja, pero sí se ve afectada por el ritmo de maduración(10). Los maduradores rápidos tienen un estirón puberal más potente que los maduradores normales y estos, a su vez, mayor que el de los maduradores tardíos (figura 1), lo que contribuye a compensar el mayor o menor número de años de crecimiento prepuberal. Los dos años más de crecimiento prepuberal que tienen los niños y la mayor amplitud de su EP determinan los 12,5-13 cm de diferencia entre la talla adulta de ambos sexos, así como la mayor longitud proporcional en los varones de las extremidades respecto al tronco (mayor periodo de crecimiento prepuberal).
Durante el EP, se produce también un dimorfismo sexual en el crecimiento en anchura del tronco, con un mayor incremento del diámetro transversal de los hombros (diámetro biacromial) en los varones, aunque más tardío, y un mayor diámetro transversal de la pelvis en las mujeres (diámetro bi-ilíaco).
Aspectos metodológicos
Talla
Los niños por encima de los 2 años deben ser medidos en bipedestación, preferentemente con un aparato de precisión (estadiómetro) y lo que es más importante, con una técnica de medición correcta(5). Durante la medición, el niño debe apoyar los talones, las nalgas, la espalda y el occipucio contra un soporte vertical y el plano definido por el margen superior del orificio del conducto auditivo externo y el borde óseo inferior de la órbita (plano de Frankfurt) debe estar paralelo al suelo. La talla, suele expresarse en P para la edad y sexo; no obstante, cuando este parámetro se sitúa fuera de los límites considerados normales, es preferible su conversión a SDS, lo que nos aporta una idea más clara de cuánto se aleja dicho parámetro de la normalidad.
Velocidad de crecimiento (VC)
La VC es el incremento de talla por unidad de tiempo y es, probablemente, el parámetro antropométrico más difícil de interpretar, especialmente durante la pubertad, cuando las variaciones pueden ser mayores; ya que, además de presentar un patrón cíclico y estacional, está influenciada por: edad, sexo, ritmo madurativo y talla familiar, entre otros factores normales y patológicos(5). Se expresa en cm/año y se aplica a la edad intermedia entre las edades en que se realizó la observación; por ejemplo: si un niño creció 8 cm entre los 13 y 14 años, se aplicarían esos 8 cm en la gráfica de VC y en el cálculo de la SDS a los 13,5 años de edad. El tiempo transcurrido entre las dos mediciones debe ser calculado con exactitud utilizando el intervalo decimal y extrapolando el crecimiento obtenido a un año, mediante una simple regla de tres; por ej.: si un niño ha crecido 6,3 cm en un intervalo de 0,89 años, su VC sería igual a 6,3 / 0,89, es decir 7,08 cm/año. El intervalo ideal de observación es de un año (entre 0,88-1,12 años) y en ningún caso inferior a 6 meses; ya que, el error se incrementaría como resultado de las grandes fluctuaciones que, en periodos más cortos de tiempo, puede experimentar la VC; no obstante, si en el intervalo de tiempo disponible, se ha iniciado el EP, es preferible, para no minusvalorar su intensidad, utilizar el intervalo entre el inicio del EP y la fecha actual, siempre que sea igual o superior a 6 meses.
Interpretación de los resultados en función del ritmo madurativo y talla familiar
Interpretación en función del ritmo madurativo (edad biológica)
La edad biológica (EB) es un constructo teórico que hace referencia al grado de maduración física alcanzado (grado de organización y complejidad) y que sirve para relacionar individuos de distinta EC pero con similar grado de maduración(6). Las diferencias en el ritmo de maduración entre diferentes sujetos, aunque se hacen más aparentes en la pubertad, están presentes a lo largo de todo el desarrollo, incluso en el momento del nacimiento. Esta tendencia a desarrollar más rápido o más lento es lo que se conoce, en términos auxológicos, como “tempo de crecimiento”. La talla final de un sujeto y el tempo de crecimiento son prácticamente independientes, pero la talla alcanzada por un niño en un determinado momento sí está relacionada con su tempo de crecimiento, o lo que es lo mismo, con su EB; de ahí, la importancia, a la hora de analizar el crecimiento de un niño, de poder determinar cuál es su ritmo madurativo(11).
Dentro de los múltiples indicadores de maduración biológica disponibles (edad de desarrollo puberal, estadio de maduración, edad de la dentición, nivel mental, niveles séricos hormonales…), el método más utilizado para determinar la EB es el que deriva del análisis de los sucesivos estadios de maduración del esqueleto visualizados mediante radiografías. Esta metodología es lo que se conoce habitualmente como “edad ósea” (EO) o “esquelética”. En la práctica clínica, la EO: 1) es el principal indicador de maduración biológica (EB); 2) se correlaciona mejor que la EC con muchos parámetros: talla, VC, edad de la menarquia, edad de inicio puberal, masa ósea…); 3) es independiente del tamaño; y 4) tiene la ventaja sobre otras metodologías de que es aplicable a todo el periodo de crecimiento(11,12). Así, por ejemplo, en pacientes con ritmo de maduración adelantada o retrasada, es mejor correlacionar la talla con la EO que con la EC. De igual forma, si analizamos la edad de inicio puberal, observaremos que existe una variabilidad normal de unos 4-5 años, entre individuos del mismo sexo y con condiciones de vida similares(1). Esta variabilidad parece estar determinada por factores genéticos (75-80 % de la variabilidad) y ambientales (25-30 %), pero se reduce considerablemente si consideramos, en vez de la EC, la EO; de forma que, la pubertad se iniciaría cuando la EO alcanza los 10,5-11 años en las niñas y los 11,5-12 años en los niños.
La edad de inicio puberal muestra una variabilidad normal de unos 4-5 años, entre individuos del mismo sexo y con condiciones de vida similares. Esta variabilidad se reduce considerablemente si consideramos, en vez de la edad cronológica, la edad ósea (EO); de forma que, la pubertad se iniciaría cuando la EO alcanza los 10,5-11 años en las niñas y los 11,5-12 años en los niños
Desde el punto de vista metodológico, la determinación de la EO puede hacerse en cualquier área del esqueleto, pero, en la práctica, se utiliza, habitualmente, una radiografía anteroposterior de la mano y muñeca izquierdas. Con esta metodología, la radiación a la que se somete al niño es mínima (menos de 0,00012 milisievert o 0,012 mrem), inferior a la que recibiría por 20’ de exposición a la luz ambiente a nivel del mar(11), y posibilita, además, el análisis de un gran número de huesos largos y cortos. Dos son los principales métodos empleados en la valoración de la maduración ósea: los atlas y las técnicas de puntuación hueso-específicas(11, 12). En la práctica clínica, el método más utilizado es el atlas de Greulich y Pyle(13), no solo por su simplicidad, sino también, porque es un componente fundamental de dos de los métodos de predicción de talla adulta más ampliamente utilizados: el método de Bayley-Pinneau(14) y el método de Roche-Wainer-Thyssen(15). Algunos endocrinólogos pediátricos utilizan también para valorar la EO el método numérico hueso-específico de Tanner y cols. (TW)(16); si bien, tiene el inconveniente de precisar un mayor entrenamiento y un mayor consumo de tiempo.
El atlas de maduración esquelética de Greulich y Pyle (GP)(13) se divide en dos partes. La primera consta de dos series secuenciales de radiografías de mano-muñeca: varones y mujeres. Cada radiografía fue elegida entre 100 radiografías de niños de la misma edad, como la más representativa de la tendencia central. La página adyacente a cada radiografía modelo aporta información sobre la EO de cada uno de los huesos. La segunda parte del atlas es una descripción detallada de los indicadores de madurez de cada uno de los huesos. Aunque los autores recomiendan una forma más compleja para valorar la EO con este método, la mayoría de los usuarios del atlas, simplemente, comparan la radiografía problema con las radiografías secuenciales y le asignan la EO correspondiente a la más parecida. Si la radiografía es intermedia entre dos de las radiografías secuenciales, se le asigna una EO intermedia entre ambas. Un observador experimentado en el uso de este atlas tendría un ETM de ± 0,25 años; es decir, en el 95 % de los casos la EO calculada estaría entre ± 6 meses de la EO real; no obstante, en un estudio realizado entre radiólogos pediátricos el ETM fue prácticamente el doble y, probablemente, será mayor aún en evaluaciones rutinarias(6).
Los atlas presentan algunos problemas a la hora de evaluar la EO que conviene poner de manifiesto: 1) la utilización de la “edad” como unidad de medida puede dificultar la comprensión del fenómeno madurativo, ya que, estos “años” no son equivalentes entre niños/niñas (mayor ritmo madurativo en niñas) o en circunstancias que alteran el ritmo de evolución normal de la EO, como sería, por ejemplo, la presencia de esteroides sexuales en los trastornos de la cronología puberal; 2) los atlas establecen un orden de aparición y transformación de los huesos que, en la realidad, no siempre es constante y está sujeto a variaciones genéticamente determinadas o influidas por diferentes patologías, lo que da lugar a edades óseas “disociadas” (en el caso de la mano, la mayor disociación/discordancia suele producirse con los huesos del carpo, lo que unido a su menor relevancia en el proceso de crecimiento frente a la de las epífisis, hace que en los casos más difíciles convenga ignorarlos en la evaluación); 3) en los atlas, existe un gran intervalo de tiempo entre las radiografías modelo, lo que sugiere una maduración “a saltos”, cuando en la realidad es un proceso continuo (esta es la causa de que en la práctica clínica con frecuencia se asignen edades óseas intermedias a las de las radiografías modelo); 4) la tendencia a asignar una EO similar a la EC conlleva en los atlas una menor objetividad; y 5) los atlas nos proporcionan, únicamente, el promedio de maduración, pero no el rango de normalidad dentro del cual una determinada radiografía puede ser considerada normal. Estas son algunas de las razones por las que se desarrollaron los métodos de valoración mediante la puntuación hueso-específica.
Dentro de los métodos de puntuación hueso-específicos, el que más difusión ha tenido es el desarrollado, en 1962, por Tanner, Whitehouse y Healy (método TW1). En este método, cada hueso de la mano y muñeca se clasificaban separadamente en 8-9 estadios de maduración a los que se asignaba una puntuación. Estas puntuaciones se sumaban para obtener la maduración esquelética. Una versión modificada de ésta, y publicada en 1983, es la que más se ha utilizado en la clínica, el método TW2(16). En ella, además de otras modificaciones, se introducen puntuaciones diferentes según el sexo. Dentro del método TW2, se contemplan tres posibles formas de puntuación de la maduración ósea, la más utilizada es la “puntuación RUS” (Radius, Ulna and Short bones), que incluye la valoración de: las epífisis distales del radio y del cúbito y los metacarpianos y falanges del I, III y V dedos (13 huesos). La suma de las puntuaciones de cada uno de estos huesos es el grado de maduración esquelética, cuyo valor máximo es de 1.000 (adulto). De manera práctica, esta puntuación puede transformarse, con una tabla de equivalencias en EO, o bien, llevarse a una gráfica de distribución de las puntuaciones en relación con la edad cronológica, para establecer el percentil correspondiente para la EC. La fiabilidad del método TW2 ha sido analizada en numeroso estudios y los intervalos de confianza al 95 %, expresados como EO, para un mismo observador son de ± 0,5 a ± 0,8 años, y para dos observadores diferentes de, aproximadamente, ± 1 año.
El método TW2 presenta algunas ventajas sobre el atlas de GP: mayor objetividad, mayor sensibilidad a la hora de valorar pequeñas modificaciones de la edad ósea (intervalos de 0,1 año frente a intervalos de 0,5-1 año en el atlas) y la posibilidad, al trasformar la valoración ósea en un fenómeno cuantitativo, de establecer percentiles o DE mediante su procesamiento matemático. Pese a estas teóricas ventajas, la fiabilidad de ambos métodos es similar y depende, probablemente, más de la experiencia del observador que del método utilizado.
Un aspecto importante a tener en cuenta cuando comparamos maduraciones óseas, es que los resultados utilizando el atlas de GP y el método TW2 son diferentes. Para una misma radiografía, la EO obtenida con el atlas de GP es superior (0,5-1 año) a la obtenida con el método TW2. La causa de esta diferencia radica en el distinto nivel socioeconómico de las poblaciones estudiadas, mucho más bajo en la población utilizada en el método TW2. Esta diferencia en la EO obtenida por ambos métodos ha sido corregida en la nueva versión del método, TW3(17), publicado en 2001, con la incorporación a la muestra de más de 1000 radiografías, tomadas entre 1985 y 1995, de niños europeos y americanos. Como consecuencia, los valores obtenidos con el TW3 se asemejan mucho más a los obtenidos con el atlas de GP. Sorprendentemente, pese a las numerosas mejoras incorporadas en esta nueva edición, la difusión del método TW3 ha sido escasa y, hoy día, es difícil conseguir la publicación, cuya edición se agotó y no parece prevista su reedición.
Dada la importancia de la genética y el ambiente en la evolución de la maduración ósea, lo ideal sería disponer de estándares de normalidad para cada población concreta. En este sentido, Hernández y cols. publicaron, en 1991(18) un atlas de maduración ósea, semejante al de GP, junto con el método numérico correspondiente, semejante al TW2, pero realizado en una muestra representativa de la población española. Este libro aportaba, además, como método innovador de valoración de la maduración ósea, el método SHS, un método numérico, hueso-específico, muy semejante en su concepción al TW2 pero aplicado, en este caso, al pie-tobillo izquierdo y a niños hasta los 2 años, edades en las que el resto de los métodos son difícilmente aplicables por la falta de aparición de los núcleos de osificación de la mano.
La valoración de la maduración ósea entre distintos observadores puede ser variable. Esta falta de reproductibilidad obedece a múltiple motivos, entre otros: las características técnicas de la radiografía, falta de estadios intermedios, la subjetividad del observador, las variaciones en los tempos de maduración esquelética entre distintas poblaciones o la aplicación del método a patologías para las que no fue desarrollado (los métodos se desarrollaron a partir de poblaciones normales). Con el objeto de soslayar la subjetividad y mejorar su fiabilidad, en los últimos años se han desarrollado procedimientos para la valoración de la maduración ósea asistidos por ordenador que, basándose en el atlas de GH y, sobre todo, en el método TW3, permiten determinar de forma automática o semiautomática la maduración esquelética(6, 19). Estos métodos, pese a su indudable interés al eliminar la varianza en la determinación de la EO, no están exentos de problemas (infraestructura, necesidad de radiografías con colocación precisa de la mano y alta calidad técnica, tiempo consumido en su valoración, interpretación de variantes morfológicas de huesos…) que han limitado, al menos parcialmente, su utilización. Por otro lado, no eliminan completamente la evaluación radiológica por el profesional; dado que, es posible obtener otra información relevante desde el punto de vista clínico, de la visión de la radiografía que los métodos computarizados disponibles son incapaces de analizar: acortamientos o anomalías de los huesos, estimación indirecta de la masa ósea y, en general, anomalías asociadas a trastornos que afectan a la formación del cartílago o del hueso.
Interpretación de la talla en relación con la talla parental
La talla es posiblemente el principal parámetro antropométrico y muestra un modelo de herencia poligénico, no dominante y no ligado al sexo. El coeficiente de correlación entre la talla media de los padres (TMP) y la talla de los hijos, se incrementa desde los 2-3 años hasta aproximadamente los 9 años en las niñas y los 11 años en los niños, donde viene a ser de 0,75-0,80, cuando la talla se expresa en cm, y de 0,55-0,65, cuando se expresa en SDS. Por encima de esas edades, las diferencias en la maduración y en el tempo de crecimiento la disminuyen, aumentando nuevamente en las últimas etapas de la pubertad(20); por eso, muchos autores atribuyan a la impredecibilidad del EP (duración e intensidad) parte de los errores de predicción de talla adulta de los diferentes métodos. Más aún, se ha sugerido que las predicciones de talla adulta deberían realizarse antes del momento esperado de inicio puberal (EO < 12 años en varones y < 10,5 años en niñas); ya que, hay una escasa racionalidad para repetir estas predicciones durante la pubertad.
Las predicciones de talla adulta deberían realizarse antes del momento esperado de inicio puberal (edad ósea < 12 años en varones y < 10,5 años en niñas); ya que, hay una escasa racionalidad para repetir estas predicciones durante la pubertad
La posibilidad de predecir con cierta fiabilidad la talla definitiva de un sujeto o correlacionar su talla en un momento dado con la talla de sus progenitores son aspectos muy importantes en la valoración del crecimiento de un niño(11). Por una parte, nos ayudan a distinguir aquellos pacientes que son pequeños/altos, pero con una talla acorde con la talla familiar, de aquellos que son pequeños/altos para su propio potencial de crecimiento, o de aquellos que, simplemente, se encuentran retrasados o adelantados en su proceso de maduración. La forma de establecer esta correlación de la talla de un adolescente con la de sus progenitores consiste en realizar una predicción de su talla adulta y compararla con su talla diana (TD). La TD, también denominada talla genética, es, simplemente, la talla esperable para los hijos/as de una pareja determinada, asumiendo un proceso normal de herencia y unos efectos ambientales sobre el crecimiento similares en ambas generaciones. Para poder hacer un cálculo correcto, es necesario, además de disponer de unas tallas fiables de estos, que los padres hayan crecido en un ambiente que no haya restringido su crecimiento o que, al menos, no lo haya hecho en un grado mayor que el que disfrutan los hijos. Los padres tampoco han de haber padecido una enfermedad capaz de condicionar su talla adulta; de ser así, para los cálculos, la talla del progenitor puede ser sustituida por la media poblacional.
Se han descrito diferentes métodos para calcular la TD(6), pero su agudeza en la monitorización del crecimiento no ha sido nunca adecuadamente testada y la fórmula más comúnmente empleada en la práctica clínica, es la desarrollada por Tanner a partir de la TMP ajustada al sexo del niño; este ajuste toma en consideración la diferencia de 13 cm entre la talla media de varones y mujeres en la edad adulta. El intervalo de confianza al 95 % (rango de la talla diana) es de, aproximadamente, ±10 cm, en el caso de los varones, y de ± 9 cm, en el caso de las mujeres (± 2 veces la SDS residual de la regresión entre la TMP y la talla adulta de los hijos). Aunque en la práctica clínica ésta es la forma habitual de establecer la TD, el cálculo es ligeramente incorrecto; ya que, la fórmula no tiene en consideración determinados aspectos que pueden influir en la talla adulta, como: el fenómeno de “regresión a la media” (los hijos de padres más bajos que la media o de padres más altos que la media tienden a aproximarse más a la media de la población), el factor “dependiente de la comunidad”, la presencia de una marcada diferencia entre la talla de los progenitores o la tendencia secular del crecimiento, entre otros. Sea cual sea la fórmula utilizada para calcular la talla diana, su interés radica en la posibilidad de compararla con la predicción de talla del niño analizado. Si ésta se encuentra entre ± 5 cm de la TD, lo que correspondería a ≈ ±1 SDS (intervalo de confianza al 68 %), lo más probable es que no exista ningún problema de crecimiento; por el contrario, si la diferencia es mayor de 5 cm, y sobre todo si es mayor de 10 cm, las posibilidades de que exista una causa patológica responsable de la alteración del crecimiento se incrementan(11).
La predicción de la talla adulta en un sujeto determinado puede realizarse, también, mediante diferentes metodologías. La forma más sencilla de hacerlo, aunque no muy fiable, deriva del hecho de que la mayoría de los niños alcanzan un percentil de talla definitiva similar al percentil de talla que han seguido entre los 2 y 9 años. Por consiguiente, lo único que habría que hacer es extrapolar el percentil o la SDS de talla del niño a esa edad al percentil o SDS equivalente en talla definitiva (Talla Proyectada). Un aspecto que limita este método de predicción es que el tempo de crecimiento es extremadamente variable de unos sujetos a otros. Dado que la talla de un sujeto guarda mayor relación con la EO que con la EC, sería posiblemente más exacto utilizar el percentil o la SDS para la EO y extrapolarlo a la talla adulta, siempre que la diferencia no supere los 2 años; aunque este método ha sido ampliamente usado, no existen datos que establezcan su grado de exactitud o fiabilidad.
La importancia de la EO, más que la de la EC, a la hora de realizar predicciones de talla adulta es puesta de manifiesto por su utilización en los tres métodos de predicción de talla adulta más utilizados en la práctica clínica, los métodos de: Bayley-Pinneau(14), Roche-Wainer-Thissen(15) y TW2-3(16, 17).
• El método de Bayley-Pinneau (BP) fue desarrollado por Nancy Bayley y Samuel R. Pinneau en el año 1952(14) y es, probablemente, por su sencillez, el método de predicción de talla adulta más utilizado en el mundo. Se basa en la existencia de una alta correlación entre la EO, establecida a partir del atlas de GP, y el porcentaje de la talla adulta alcanzado. Las tablas fueron convenientemente reproducidas y corregidas en la edición del atlas de GP de 1959(13). Existen tablas para niños y niñas, diferenciando aquellos con maduraciones normales, aceleradas (edad ósea – edad cronológica ≥ 1 año) o lentas (edad cronológica – edad ósea ≥ 1 año). Así, por ejemplo, en un niño con un ritmo de maduración normal (EO≈EC), cuando su EO sea de 9 años, habrá alcanzado un 75,2 % de su talla adulta; por consiguiente, si en ese momento su talla es de 130 cm, su predicción de talla definitiva será de 172,9 cm. Una tabla accesoria con las SDS de la predicción para cada edad y sexo permiten el cálculo aproximado del intervalo de confianza. Una limitación importante del método es que no se modifican los cálculos si la EO está retrasada uno o más años; si bien, la falta de fundamentos experimentales aconseja que no se aplique a niños con retrasos o adelantos en la maduración ósea superiores a dos años. Los propios autores indican que cuando la EO está retrasada más de 2 años es probable que los niños alcancen una talla adulta menor de la prevista y, al contrario, niños con EO adelantada más de 2 años serán, probablemente más altos que lo predicho por el método.
• El método de Roche-Wainer-Thissen (RWT), publicado en el año 1975(15), es metodológicamente muy diferente del método de Bayley-Pinneau(14). Se basa en ecuaciones de regresión múltiple que se aplican a niños con edades comprendidas entre los uno y dieciseis años, con intervalos de 3 meses. Los parámetros incluidos en las ecuaciones de regresión son: la EO evaluada con el atlas de GP, la talla en decúbito en cm (≈ talla de pie + 1,25 cm), el peso en kilogramos y la talla media de los padres (TMP) en cm (TMP). Si la TMP es desconocida, puede substituirse por la talla media de la población; si bien, la fiabilidad de la predicción disminuye.
• El método de Mark 2- TW2 (M-TW2) fue publicado en el año 1983(16) y está basado, al igual que el de Roche-Wainer-Thissen, en ecuaciones de regresión múltiple. Las ecuaciones empleadas varían dependiendo de la edad, el sexo, la ocurrencia o no de la menarquia en las niñas y de la disponibilidad de datos (progresión de la edad ósea y velocidad de crecimiento). Los parámetros incluidos en las ecuaciones son: la EO, en este caso calculada con el método TW2-RUS, la talla, la EC, la VC en el último año (∆T) y el incremento de la EO en el último año (∆EO). Los valores de los distintos coeficientes de la ecuación (a, b, c, d, e y k), así como las SDS para calcular el intervalo de confianza, son dados en tablas. En la nueva revisión del método (TW3) se han realizado cambios considerables(12,17), también en el método de pronóstico de la talla final, incluyendo las ecuaciones empleadas y la población en la que se basan dichas ecuaciones (First Zurich Longitudinal Growth Study).
Los tres métodos descritos son útiles y relativamente fiables(12); si bien, existen una serie de limitaciones comunes a todos ellos, como son, entre otras: una cierta impredecibilidad, derivada de la variabilidad del brote de crecimiento puberal, el error derivado de utilizar datos incorrectos o no comprobados (error inherente a la determinación de la EO o a la medición de la talla) o la no consideración de la influencia de la obesidad en la EO. En este sentido, se ha sugerido que las predicciones de talla adulta precisarían de una corrección a la baja proporcional al número de SDS de IMC por encima de lo normal, especialmente en varones(6). Otra limitación importante a la hora de aplicar los distintos métodos de predicción de talla final es que todos ellos fueron desarrollados analizando poblaciones normales, pero de diferente área geográfica y condición social. En suma, su utilización clínica plantea tres problemas diferentes: 1) su aplicación a poblaciones de países diferentes; 2) su aplicación en casos de niños sanos constitucionalmente altos o bajos; y 3) su aplicación a niños con patología(12).
• En cuanto a su aplicación a poblaciones diferentes, los estudios realizados sugieren que no existen grandes diferencias, al menos, entre los países industrializados de origen étnico similar(16).
• En niños normales constitucionalmente altos o bajos, la fiabilidad de los tres métodos es buena(12); si bien BP y RWT tienden en general a sobrestimar la talla definitiva, mientras que M-TW2 tiende a infraestimarla, sobre todo en aquellos con retraso en la EO, siendo mayor el error cuanto mayor es el retraso madurativo. En niñas, aunque los resultados son muy escasos y algo diferentes de los observados en varones, las predicciones realizadas con BP y M-TW2 parecen ser las más fiables.
• En situaciones claramente patológicas (pubertad precoz, síndrome de Turner, retraso de crecimiento intrauterino, cuadros dismórficos o déficit de hormona de crecimiento, entre otras) la aplicación de estos métodos debe hacerse con extremada precaución, ya que no existen razones objetivas para que la metodología, desarrollada en sujetos normales, sea válida en estos casos. Los datos disponibles sugieren que, entre los métodos disponibles, el BP sería, posiblemente, el más fiable(20).
Antropometría nutricional
La antropometría nutricional tiene por objeto, a partir de la medición de diferentes parámetros corporales, determinar la situación y las variaciones del estado nutricional, así como algunos aspectos de la composición corporal. El uso de la antropometría para valorar el estado nutricional puede ser especialmente complejo en adolescentes, como consecuencia de los cambios normales que se producen en los índices antropométricos como consecuencia del desarrollo puberal. Los parámetros antropométricos directos más importantes en la valoración del estado nutricional son, además de la talla, el peso, los pliegues cutáneos y determinados perímetros corporales.
Peso para la edad y relación peso/talla (IMC)
El peso se debe medir con el paciente desnudo o con la menor ropa posible en una báscula de precisión previamente equilibrada, a la misma hora y preferiblemente por la mañana y en ayunas. El niño debe estar de pie, sin tocar nada e inmóvil; ya que, ambas circunstancias pueden modificar la medida. En los pacientes con amputaciones o alteraciones de los miembros, debería considerarse calcular el teórico peso del paciente en caso de no existir amputación, sumando al peso real un 5% más por miembro superior ausente o un 10 % en el caso de que la ausencia corresponda a un miembro inferior(3,4).
El peso para la edad y sexo es, probablemente, el parámetro antropométrico nutricional más utilizado, pero su utilidad como dato aislado es escasa y, para aumentar su sensibilidad como indicador del estado nutricional debe, al menos, relacionarse con la talla. La forma más sencilla de analizar esta relación es su comparación con curvas percentiladas de relación peso/talla (más utilizadas en lactantes y niños prepuberales) o mediante índices que relacionan ambos parámetros(5); de ellos, el más empleado es el denominado índice de masa corporal (IMC) o índice de Quetelet [Peso (kg) / Talla2 (m)].
El IMC está internacionalmente reconocido como un índice de sobrepeso/obesidad y malnutrición por defecto en adultos(6). A partir de los 18 años, se considera, habitualmente, como sobrepeso un IMC > 25 kg/m2 y obesidad >30 kg/m2, ligeramente más bajos para poblaciones asiáticas (muchas poblaciones asiáticas tienen proporcionalmente mayor masa grasa para un IMC determinado, que la población caucásica). La OMS define también, tres grados de delgadez: 1 (ligera), 2 (moderada) y 3 (severa), en función de que el IMC esté por debajo de 18,5, 17 y 16, respectivamente. En los niños y adolescentes, las marcadas variaciones del IMC con la edad, sexo y grado de desarrollo puberal hacen que estos criterios no sean utilizables y deban establecerse criterios por edad y sexo. Pese a que sus valores no presentan una distribución normal, percentiles y SDS (preferiblemente calculadas mediante el método LMS) para la edad y sexo son ampliamente utilizados para valorar el estado nutricional, así como el grado de sobrepeso o malnutrición. Las dificultades metodológicas y especialmente la epidemia de obesidad que asola los países occidentales, elevando en las gráficas de reciente construcción el nivel de los percentiles de IMC, ha condicionado que los puntos de corte (percentiles o SDS) utilizados para definir sobrepeso y obesidad o los distintos grados de delgadez o malnutrición en la infancia no estén claramente estandarizados [percentiles diferentes según los distintos países, distintas Sociedades y Organizaciones internacionales, o la propuesta de Tim J Cole(21) de utilizar, como puntos de corte de las definiciones de sobrepeso y obesidad, los percentiles que adquieren los valores de 25 y 30, respectivamente, en la edad adulta]. En nuestro medio, la Guía de Práctica Clínica para la Prevención y Tratamiento de la Obesidad Infanto-juvenil(22) postula como criterios para definir el sobrepeso y la obesidad los valores de los percentiles 90 y 97, respectivamente, específicos por edad y sexo de la distribución del IMC referido a los datos y curvas de Hernández y cols. del año 1988(23).
El IMC es internacionalmente utilizado como indicador indirecto de adiposidad y muestra una correlación razonablemente buena con otros métodos que estiman el porcentaje de grasa corporal (%GC), como con la absorciometría dual de rayos X (DXA) (r: 0,7-0,8), que es el método de referencia para la valoración de la composición corporal(5). Más aún, el incremento de IMC es considerado, en los estudios epidemiológicos, como un factor de riesgo para: hipertensión, enfermedad cardiovascular o diabetes tipo 2, entre otras enfermedades(6). Pese a todo lo anterior, lo cierto es que el IMC es más un indicador de exceso de peso para la talla, que de exceso de grasa, y sujetos muy musculados muestran un elevado IMC con bajo %GC. Esta limitación del IMC es especialmente importante durante la edad pediátrica, como consecuencia de los cambios asincrónicos que se producen en la masa grasa y en la masa libre de grasa durante el crecimiento. En concreto, durante la pubertad, los cambios en el peso son más marcados que los que afectan a la talla; motivo por el que el IMC, se incrementa rápidamente. Este incremento no debe interpretarse como el resultado de un incremento de la grasa corporal; ya que, aunque se produce un aumento del porcentaje de peso correspondiente a la grasa, (del 16 al 19 % en varones y del 17 al 25 % en mujeres), la mayor parte del incremento de peso corresponde a masa libre de grasa, especialmente en varones (músculo y hueso, especialmente)(24). El error de no considerar el incremento de IMC como un fenómeno propio de la pubertad ha hecho que, en ocasiones, niños o niñas con pubertad adelantada o precoz sean falsamente diagnosticadas de sobrepeso/obesidad. De ahí que, la interpretación del IMC en el periodo puberal debería hacerse con precaución y valorado más en función del grado de desarrollo puberal, responsable de estos cambios, que de la EC. Además, para discriminar si el aumento de peso se relaciona con un exceso de grasa (obesidad) o de masa magra (constitución atlética o adolescentes deportistas), es útil medir el perímetro braquial y los pliegues cutáneos.
El IMC es internacionalmente utilizado como indicador indirecto de adiposidad, pero se incrementa de forma normal durante la pubertad, sin que ello signifique un aumento de la adiposidad; de ahí que, su interpretación en este periodo debería hacerse con precaución, teniendo en consideración más el grado de desarrollo puberal, responsable de sus cambios, que la edad cronológica
Pliegues cutáneos
Los pliegues cutáneos son parámetros antropométricos útiles para informar, aunque sea indirectamente, sobre la composición corporal; de hecho, la medida del espesor del pliegue cutáneo es uno de los mejores indicadores de la cantidad total de grasa subcutánea, que es, aproximadamente, un 50 % de la grasa corporal total. Se realiza con un calibre de espesor especial (skinfold caliper, figura 2), cuya característica fundamental es la de ejercer una presión constante de 10 g/mm2 y cuya precisión es de 0,1-0,2 mm. El espesor del pliegue cutáneo puede medirse en diferentes zonas anatómicas (pliegue tricipital, subescapular, suprailíaco, bicipital, etc.), pero los pliegues más utilizados en la práctica clínica son: el tricipital y el subescapular izquierdos; ya que, permiten hacer una estimación de la distribución corporal de la grasa: generalizada (incremento de ambos pliegues) o de predominio troncular (incremento del pliegue subescapular).
Los pliegues cutáneos y los perímetros corporales son parámetros antropométricos útiles para informar, aunque sea indirectamente, sobre la composición corporal. La técnica de medición de los pliegues cutáneos es sencilla, pero requiere mucho entrenamiento y cuidado para ser precisa y su reproductibilidad, incluso en condiciones idóneas, es escasa
La técnica de medición de los pliegues cutáneos es sencilla(3-5), pero requiere mucho entrenamiento y cuidado para ser precisa y su reproductibilidad, incluso en condiciones idóneas, es escasa. El pliegue que se vaya a medir es pellizcado entre los dedos pulgar e índice de la mano izquierda del observador. El calibre se coloca, aproximadamente, 1 mm por debajo, perpendicular al pliegue. La mano derecha sostiene el calibre y la medida se lee cuando la aguja del medidor se estabiliza o, si no lo hace, a los 3 segundos de la aplicación:
• El pliegue tricipital. Se mide con el sujeto de pie y de espaldas al observador. Debe ser vertical, en el punto medio de la cara posterior del brazo izquierdo, mientras éste permanece extendido y relajado con la palma de la mano abierta y mirando a la cara lateral del muslo.
• El pliegue bicipital. Se mide igual y al mismo nivel del tricipital, pero en la cara anterior del brazo.
• El pliegue subescapular. Se mide, también, con el sujeto de pie y de espaldas al observador, con los hombros y brazos relajados e inmediatamente por debajo del ángulo inferior de la escápula izquierda. El pliegue puede ser vertical o ligeramente inclinado hacia abajo y hacia fuera, siguiendo la tendencia natural de la piel en esa zona.
• El pliegue suprailíaco. Se mide con el sujeto de pie. Debe ser horizontal, en la línea medio-axilar anterior y en la zona inmediatamente superior de la cresta ilíaca.
A partir del peso y de los pliegues cutáneos es posible estimar con bastante precisión y mediante simples fórmulas matemáticas la masa grasa e indirectamente la masa libre de grasa(25).
Perímetros corporales
Los perímetros corporales pueden aportar información sobre la composición corporal (perímetros del brazo, pierna, torácico, abdominal, cadera, etc.). En este sentido, los que tienen posiblemente un mayor interés clínico son el perímetro braquial y el perímetro abdominal.
• Perímetro braquial. Se mide en lado izquierdo, con el brazo extendido y completamente relajado, con una cinta métrica inextensible, a una altura en el punto medio entre el acromion y el olécranon(3,4). Estima, simultáneamente, el componente muscular y graso, por lo que su disminución es un buen indicador de malnutrición calórico-proteica, pero tiene el inconveniente de estar mal normalizado. Por su sencillez y precisión ha sido ampliamente utilizado como indicador nutricional en los países en vías de desarrollo. Un valor inferior al 75 % de la media para la edad indicaría malnutrición grave, entre el 75 y el 80 %, moderada, entre el 80 y el 85 %, leve, y por encima del 85 % se consideraría normal.
• Perímetro abdominal (PA). En los adultos, se ha demostrado que la circunferencia de la cintura es un excelente marcador de la cantidad de grasa abdominal, más sensible y específico que otros parámetros antropométricos que, como los pliegues cutáneos, son más difíciles de medir y de reproducir. Un PA en los adultos superior a los 102 cm en los hombres y a 88 cm en las mujeres, se considera como uno de los cinco parámetros del síndrome metabólico. Recientemente, se ha comenzado a estudiar el PA en los niños prepúberes y púberes de ambos sexos, habiéndose demostrado que, en ellos, la circunferencia de la cintura es también un buen indicador de la obesidad central, con utilidad clínica y epidemiológica como predictor de complicaciones metabólicas y de riesgo cardiovascular(26) cuando sus valores se sitúan por encima del percentil 90. Aunque disponemos de valores de perímetro abdominal en niños y adolescentes en población española, su medición no está suficientemente estandarizada (punto medio entre el límite inferior de las costillas y la cresta ilíaca, a nivel del ombligo…) y se ha sugerido que la medida se realice unos 4 cm por encima del ombligo(27), hasta que la comparación de las distintas formas de medición con los resultados de la RM abdominal (mejor prueba disponible para la medición de la grasa visceral) establezca cuál es la metodología idónea.
Más recientemente, se ha propugnado la utilización, como marcador de obesidad central y de cribado de síndrome metabólico en adultos, el cociente perímetro de cintura en cm/talla en cm (CCT); de forma que, definiríamos obesidad central o abdominal cuando el CCT sea mayor de 0,5, y sobrepeso abdominal cuando sea mayor de 0,45 en individuos de cualquier edad por encima de los 6 años. A partir de esta edad, el CCT es independiente de la edad, sexo, etnia y estadio puberal; por ello, es posible que pronto sea incluido como criterio de síndrome metabólico en adolescentes28.
Valoración clínica del desarrollo puberal
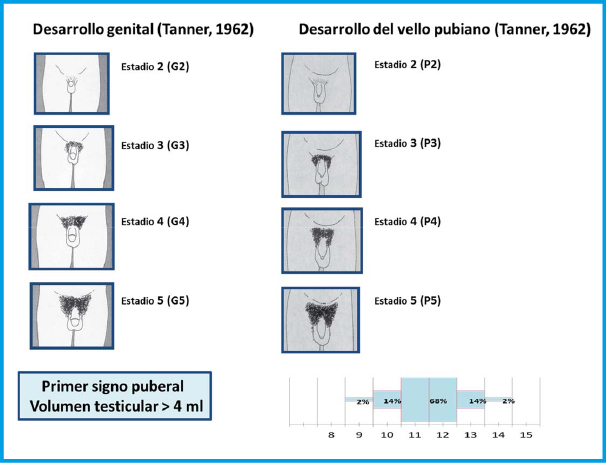
El inicio de la pubertad, desde el punto de vista clínico, lo marca la aparición y el desarrollo de los caracteres sexuales secundarios, que sigue una secuencia relativamente predecible que fue categorizada en cinco fases o estadios por James Tanner a principios de la década de los sesenta10. Tanner sólo incluyo en sus estadios puberales: el desarrollo de los genitales en el varón, de la mama en las niñas y del vello pubiano en ambos (tabla I).
En 1966, Andrea Prader, introdujo el orquidómetro (figura 3), un rosario de elipsoides de madera o plástico de tamaño progresivamente mayor, desde 1 a 25 ml. En condiciones normales, existe una aceptable correlación con los estadios de Tanner (tabla I), aunque no siempre es así; por ejemplo, se considera normal un volumen testicular, en un adulto, mayor o igual a 12 mL, aunque la mayoría de estos superan los 20 ml de volumen. La falta de correlación entre el volumen testicular y el estadio de Tanner, puede ser de utilidad en la práctica clínica como indicador de diferentes patologías (síndrome de Klinefelter, pseudopubertades precoces…)
La falta de correlación entre el volumen testicular y el estadio de Tanner, puede ser de utilidad en la práctica clínica como indicador de diferentes patologías (síndrome de Klinefelter, pseudopubertades precoces…)
La secuencia de eventos puberales, aunque no es exactamente la misma para cada niño o niña, es mucho menos variable que la edad a la que estos eventos ocurren10. En las niñas, la telarquia o aparición del botón mamario suele ser el primer signo de desarrollo puberal, a una edad media de 10,5-11 años (intervalo de 8 a 13 años); mientras que, en los varones, el inicio puberal lo marca el incremento del volumen testicular, que alcanza o supera los 4 mL de volumen o un diámetro mayor o igual a 25 mm, a una edad media de 11,5-12 años (intervalo de 9 a 14 años).
En las niñas, la telarquia o aparición del botón mamario suele ser el primer signo de desarrollo puberal; mientras que, en los varones, el inicio puberal lo marca el incremento del volumen testicular, que alcanza o supera los 4 mL de volumen
Aunque existe una gran variabilidad en la secuencia evolutiva de los caracteres sexuales secundarios, el incremento testicular en los varones y la telarquia en las mujeres suele preceder en unos meses al desarrollo del vello pubiano. En los varones, la ginecomastia puberal, la aparición de vello axilar (axilarquia) y el EP suelen iniciarse en el estadio III, coincidiendo con el aumento en longitud del pene, mostrando el pico de máxima VC, habitualmente, en estadio IV. El cambio en la voz y el vello de otras áreas corporales andrógeno-dependientes, como: pecho, cara, espalda y abdomen, suele iniciarse en la media pubertad (estadios III-IV). El vello en estas localizaciones progresa con mayor o menor rapidez a lo largo de los años, pero su distribución y magnitud dependen, en gran medida, de factores genéticos y raciales. En las niñas, el inicio del EP suele coincidir con la aparición del botón mamario (estadio II) y el pico de máxima VC con el estadio III. La menarquia es un fenómeno tardío en la pubertad de las mujeres y suele producirse en el estadio IV, unos dos años después de iniciado el desarrollo puberal. En los varones la edad de la espermarquia, primera eyaculación, es más difícil de establecer; ya que, con frecuencia, se produce de forma involuntaria durante la noche (polución nocturna), habitualmente durante la fase III o IV de la pubertad. Al igual que ocurre con la menarquia, que es seguida habitualmente de ciclos anovulatorios, la espermarquia no significa necesariamente fertilidad; ya que, inicialmente la cantidad de espermatozoides en el semen suele ser muy escasa.
Tablas y figuras
Tabla I. Estadios de desarrollo puberal de Tanner y correlación con volumen testicular (orquidómetro de Prader)*
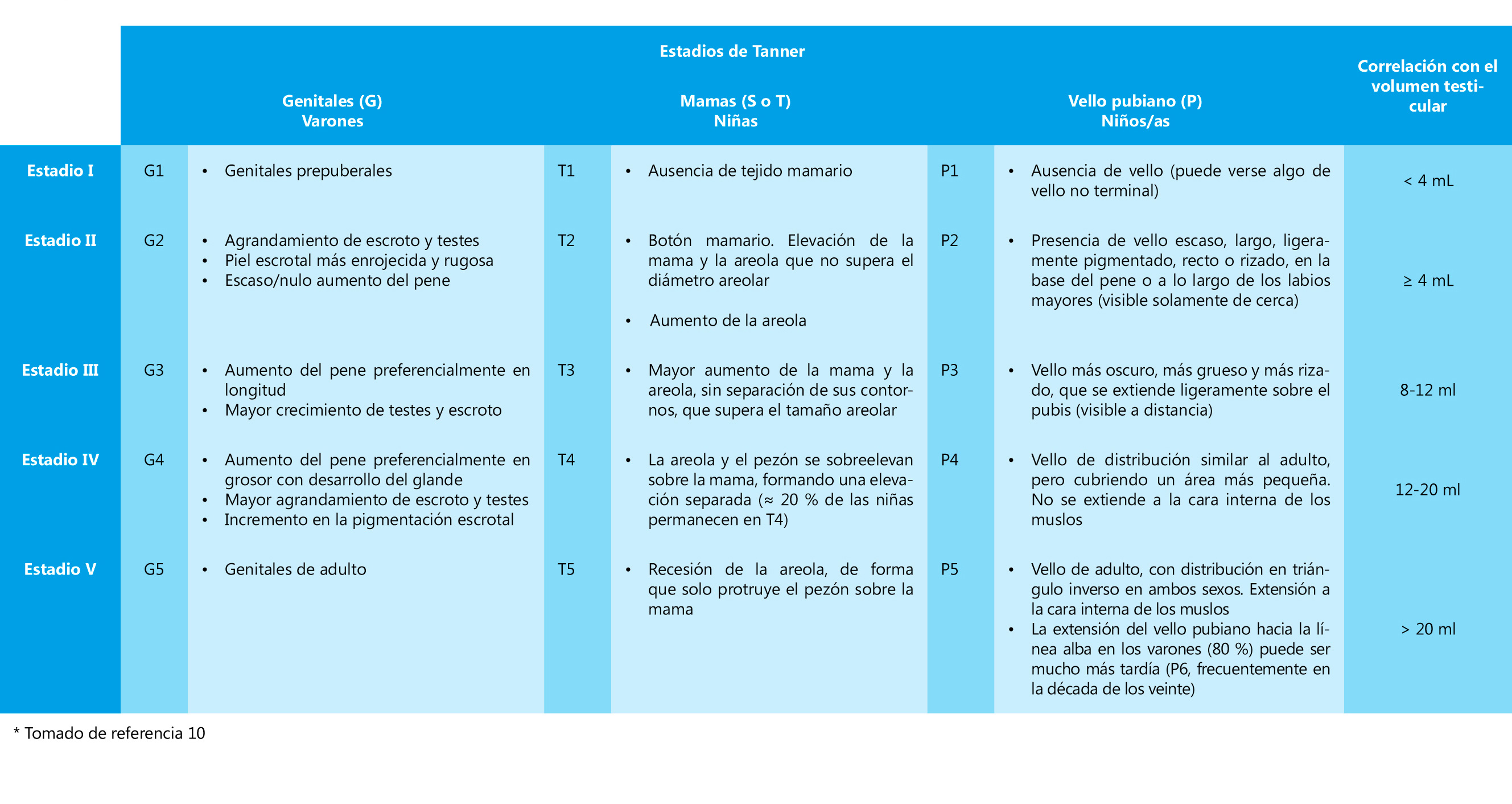
Figura 1.
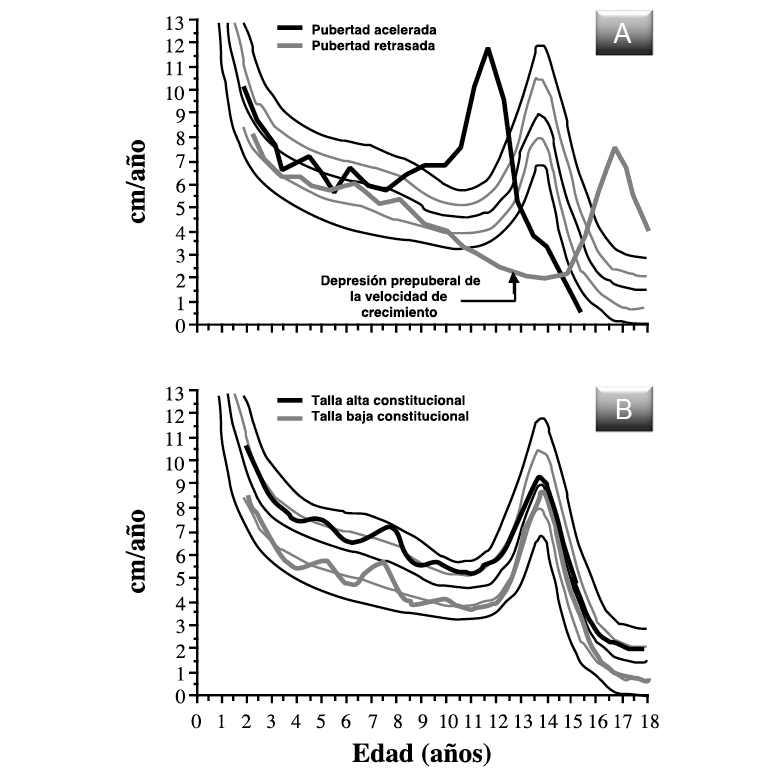
Figura 1. A) Curvas de velocidad de crecimiento (cm/año) en varones con pubertad acelerada y pubertad retrasada (variación de la amplitud del estirón puberal en función del tempo de maduración). B) Curvas de velocidad de crecimiento (cm/año) en varones con talla alta y talla baja constitucional (ausencia de variaciones en el estirón puberal en relación con la talla genética).
Figura 2.
Figura 2. Evolución de los pliegues cutáneos (tricipital y subescapular) en varones y mujeres (modificado de referencia 4). Se incluye fotografía del medidor/calibre de pliegues cutáneos (skinfold caliper), cuya característica fundamental es la de ejercer una presión constante de 10 g/mm2.
Figura 3.

Figura 3. Orquidómetro de Prader.
Bibliografía
1. Pozo J, Muñoz MT. Pubertad precoz y retraso puberal. Pediatr Integral 2015: XIX: 389-410.
2. Pozo J, Argente J. Crecimiento: valoración auxológica. En: Argente J, Carrascosa A, Gracia R, Hierro F, eds. Tratado de Endocrinología Pediatrica y de la Adolescencia (2ª Edición). Madrid: Doyma, 2000; págs: 177-201.
3. Lapunzina P, Aiello H. Manual de Antropometría Normal y Patológica: fetal, neonatal, niños y adultos. Barcelona: Masson S.A. 2002.
4. Hall JG, Allanson JE, Gripp KW, Slavotinek AM. Handbook of physical Masurements (second edition). Nueva York: Oxford University Press, 2007.
5. Pozo J. Valoración auxológica del crecimiento I. Pediatr Integral 2011; XV: 590-598.
6. Hermanussen M. Auxology. Studying Human Growth and development. Stuttgart (Germany): Schweizerbart Science Publishers, 2013.
7. Sánchez González E, Carrascosa Lezcano A, Fernández García JM, Ferrández Longás A, López de Lara D, López-Siguero JP. Estudios españoles de crecimiento: situación actual, utilidad y recomendaciones de uso. Anales de Pediatría, 2011; 74: 193.e1-e16.
8. Cohen P, Rogol AD, Deal CL, Saenger P, Reiter EO, Ross JL, et al; 2007 ISS Consensus Workshop participants. Consensus statement on the diagnosis and treatment of children with idiopathic short stature: a summary of the Growth Hormone Research Society, the Lawson Wilkins Pediatric Endocrine Society, and the European Society for Paediatric Endocrinology Workshop. J Clin Endocrinol Metab. 2008; 93: 4210-4217.
9. Hermanussen M, Meitinger T, Veldhuis JD, Low MJ, Pfäffle R, Staub K, et al. Adolescent Growth: Genes, Hormones and the Peer Group. Proceedings of the 20th Aschauer Soiree, held at Glücksburg castle, Germany, 15th to 17th November 2013. Pediatric Endocrinology Reviews, 2014; 11: 341-353.
10. Tanner J. Normal Growth and Techniques of Growth Assesssment. Clinics in Endocrinology and Metabolism, 1986; 15: 411-451.
11. Pozo J. Valoración auxológica del crecimiento II. Pediatr Integral 2011; XV: 691-701.
12. López-Siguero JP, Moreno-Molina JA. Maduración ósea y predicción de la talla adulta. En: Diéguez C e Yturriaga R, editores. Madrid: McGraw-Hill-Interamericana España SAU 2005; págs: 41-56.
13. Greulich WW, Pyle SI. Radiographic atlas of skeletal development of the hand and wrist (2nd Edition). Stanford (California): Standford University Press, 1959.
14. Bayley N, Pinnneau SR. Tables for predicting adult height from skeletal age revised for use with Greulich-Pyle hand standards. J Pediatr 1952; 40: 423-441.
15. Roche AF, Wainer H, Thissen D. The RWT method for the prediction of adult stature. Pediatrics 1975; 56: 1026-1033.
16. Tanner JM, Whitehouse RH, Cameron N, Marshall WA, Healy MJR, Goldstein H. Assessment of skeletal maturity and prediction of adult heigth (TW2 Method) 2nd Edition. London: Academic Press Limited, 1983.
17. Tanner JM, Healy MJR, Goldstein H, Cameron N. Assessment of skeletal maturity and prediction of adult heigth (TW3 Method). 3rd Edition. London: WB Saunders, Harcourt Publishers Ltd 2001.
18. Hernández M, Sánchez E, Sobradillo B, Rincón JM. Maduración ósea y predicción de talla. Atlas y métodos numéricos. Madrid: Díaz de Santos S.A., 1991.
19. van Rijn RR, Thodberg HH. Bone age assessment: automated techniques coming of age? Acta Radiol. 2013; 54: 1024-1029.
20. Preece MA. Prediction of adult height: Methods and problems. Acta Paediatr. Scand. 1988, 347 (Suppl): 4-11.
21. Cole TJ1, Lobstein T. Extended international (IOTF) body mass index cut-offs for thinness, overweight and obesity. Pediatr Obes. 2012; 7: 284-294.
22. Grupo de trabajo de la Guía de Práctica Clínica sobre la Prevención y el Tratamiento de la Obesidad Infantojuvenil. Centro Cochrane Iberoamericano, coordinador. Guía de Práctica Clínica sobre la Prevención y el Tratamiento de la Obesidad Infantojuvenil. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Agència d´Avaluació de Tecnologia i Recerca Mèdiques; 2009. Guías de Práctica Clínica en el SNS: AATRM Nº 2007/25.
23. Hernández M, Castellet J, Narvaiza JL, Rincón JM, Ruiz I, Sánchez E, et al. Curvas y tablas de crecimiento. Instituto de Investigación sobre Crecimiento y Desarrollo, Fundación Faustino Orbegozo. Madrid: Editorial Garsi; 1988.
24. Buckler JM. Growth at adolescence. En: Kelnar CJH, Savage MO, Saenger P, Cowell CT, eds. Growth disorders (second edition). London: Edward Arnold Ltd, 2007; págs.: 150-164.
25. Fuentes Lugo D. Determinación de la composición corporal en Pediatría. En: Muñoz-Calvo MT y Suárez-Cortina, coordinadores. Manual Práctico de Nutrición en Pediatría: Madrid: Ergon 2007; págs.: 13-29.
26. Bassali R, Waller JL, Gower B, Allison J, Davis CL. Utility of waist circumference percentile for risk evaluation in obese children. Int J Pediatr Obes. 2010; 5: 97-101.
27. Rudolf MC, Walker J, Cole TJ. What is the best way to measure waist circumference? Int J Pediatr Obes. 2007; 2: 58-61.
28. Santoro N, Amato A, Grandone A, Brienza C, Savarese P, Tartaglione N, et al. Predicting metabolic syndrome in obese children and adolescents: look, measure and ask. Obes Facts. 2013;6:48-56.
Bibliografía recomendada
• Hermanussen M. Auxology. Studying Human Growth and development. Stuttgart (Germany): Schweizerbart Science Publishers, 2013.
Libro de auxología de reciente aparición y asequible precio (40€), con una presentación muy docente y amena, que, en capítulos cortos, desarrolla los aspectos más clásicos y los recientes avances en el campo de la auxología. Muy recomendable para todos aquellos que quieran profundizar en este campo.