¿La enfermedad meningocócica eclipsada por la pandemia de COVID-19? Puesta al día de la vacunación antimeningocócica
¿La enfermedad meningocócica eclipsada por la pandemia de COVID-19? Puesta al día de la vacunación antimeningocócica
F. Moraga-Llop.
Pediatra. Vicepresidente de la Asociación Española de Vacunología. Barcelona.
Adolescere 2022; X (3): 60-69
Resumen
|
La enfermedad meningocócica continúa siendo un importante problema de salud pública por su letalidad, el elevado número de complicaciones y secuelas, y la gran repercusión familiar, social y económica que origina. Además, genera una gran alarma social porque puede destruir vidas en pocas horas, en especial en niños menores de 5 años, la mayoría previamente sanos. El meningococo incluye 12 serogrupos de los cuales seis (A, B, C, W, Y y X) causan más del 95% de los casos de enfermedad. Cinco de ellos son inmunoprevenibles con las vacunas conjugadas monovalentes A y C, y tetravalente ACWY, y la de proteínas recombinantes B. La incidencia de la enfermedad en España, en franca disminución desde principios de siglo, presentó un ligero ascenso en las cinco temporadas previas a la pandemia de COVID-19, aunque con tasas inferiores a 1 caso por 100.000 habitantes. La disminución posterior de la incidencia coincide con el descenso de las enfermedades de transmisión respiratoria durante la pandemia y se debe en gran parte a la implementación de medidas de prevención no farmacológicas. La enfermedad meningocócica es hoy inmunoprevenible; con las vacunas disponibles, la mayor protección se obtiene con la ACWY a los 2 y 4 meses, 12 meses y 12 años, y con la vacunación frente al serogrupo B del lactante y del adolescente. Palabras clave: Enfermedad meningocócica; Vacunas antimeningocócicas; Adolescencia; Meningococo B; Calendarios de vacunaciones. |
Abstract
|
Meningococcal disease continues to be an important public health problem due to its lethality, the high number of complications and sequelae, and the great family, social and economic repercussions it causes. In addition, it generates great social alarm because it can destroy lives in a few hours, especially in children under 5 years of age, most of whom were previously healthy. Meningococcus includes 12 serogroups of which six (A, B, C, W, Y and X) cause more than 95% of the cases of disease. Five of them are immunopreventable with monovalent conjugate vaccines A and C, and tetravalent ACWY, and recombinant protein B vaccine. The incidence of the disease in Spain, in sharp decline since the beginning of the century, showed a slight increase in the five seasons prior to the COVID-19 pandemic, although with rates of less than 1 case per 100,000 inhabitants. The subsequent decline in incidence coincides with the decline in respiratory-transmitted diseases during the pandemic and is largely due to the implementation of non-drug prevention measures. Meningococcal disease is now immunopreventable; with the available vaccines, the greatest protection is obtained with ACWY at 2 and 4 months, 12 months and 12 years, and with vaccination against serogroup B in infants and adolescents. Key words: Meningococcal disease; Meningococcal vaccines; Adolescence; Meningococcal B; Immunization schedules. |
La enfermedad meningocócica: una enfermedad inmunoprevenible
La incidencia de la enfermedad varía en el tiempo y es impredecible
La enfermedad meningocócica invasiva (meningitis meningocócica para gran parte de la población) continúa siendo un importante problema de salud pública por su letalidad, el elevado número de complicaciones y secuelas que comporta, y la gran repercusión familiar, social y económica que origina. Además, genera una gran alarma social porque puede destruir vidas en pocas horas, en especial en niños menores de 5 años, la mayoría previamente sanos, sin factores de riesgo.
Manifestaciones iniciales inespecíficas y de evolución impredecible
Las manifestaciones clínicas iniciales de la enfermedad suelen ser inespecíficas, pero la evolución puede ser dramática desde la aparición de un leve exantema maculopapuloso, que en pocas horas se convierte en petequial y este en equimosis y sufusiones hemorrágicas, es decir, todo el espectro clínico de la púrpura. Esta rápida progresión clínica conduce muchas veces a un diagnóstico y un tratamiento tardíos. La categorización del paciente, la valoración de su estado, la monitorización y la oportunidad del tratamiento, adecuándolo a la gravedad, son fundamentales. En la Tabla I se señalan las características más importantes de la enfermedad que justifican la vacunación, incluso en periodos, como el actual, con bajas tasas de incidencia.
Seis serogrupos (A, B, C, W, Y, X) causan la mayoría de los casos
Neisseria meningitidis incluye 12 serogrupos (en muchos textos se siguen citando de manera errónea 13, ya que el D se vio posteriormente que era C), de los cuales seis (A, B, C, W, Y y X; el primero y el último excepcionales en nuestro medio) causan más del 95% de las enfermedades meningocócicas (Tabla II).
La enfermedad meningocócica es hoy inmunoprevenible
Cinco de ellos son inmunoprevenibles con cuatro grupos de vacunas: una monovalente A, una monovalente C (dos especialidades), una tetravalente ACWY (tres especialidades) y otra frente al serogrupo B (dos especialidades). Están en estudio tres vacunas pentavalentes, de las cuales una incluye el serogrupo X en la tetravalente ACWYX, de gran interés para el continente africano, y otras dos ABCWY a partir de las dos vacunas antimeningocócicas B y las dos ACWY del mismo laboratorio (especialidades de GSK y de Pfizer), que serían de elección en Europa.
Derrotar a la meningitis en 2030: un reto de la Organización Mundial de la Salud para el decenio 2021-2030
Derrotar a la meningitis en 2030: un reto de la OMS
En noviembre de 2020, la 73ª Sesión de la Asamblea Mundial de la Salud de la Organización Mundial de la Salud (OMS) aprobó la hoja de ruta para derrotar la meningitis en 2030 (Defeating meningitis by 2030). Se trata de un plan ambicioso y muy necesario.
A pesar de los avances significativos en las últimas décadas, la meningitis sigue siendo un problema de salud pública en todo el mundo, con una alta tasa de letalidad y una tendencia a causar epidemias que suponen un gran desafío para los sistemas de salud, las economías y la sociedad. La meningitis causó unas 250.000 muertes en el año 2019 y dejó a una de cada cinco personas afectadas con secuelas graves, además de las graves consecuencias con impacto emocional, social y económico considerable en las personas, las familias y las comunidades.
La meningitis bacteriana constituye un grupo de enfermedades que en gran parte son prevenibles mediante la vacunación. Si bien la hoja de ruta para vencer la meningitis las aborda todas independientemente de su causa, se centra en especial en las producidas por bacterias para las que disponemos de vacunas. Existen vacunas frente a Haemophilus influenzae serotipo b, Streptococcus pneumoniae (de 10, 13, 15 y 20 serotipos) y N. meningitidis (serogrupos A, C, W, Y y B). Sin embargo, no está autorizada una vacuna frente a Streptococcus agalactiae, cuarto microorganismo causante de meningitis bacteriana. Estas cuatro bacterias fueron las causantes de más del 50% de las 250.000 muertes por meningitis en 2019.
La OMS, el 3 de noviembre de 2021, hizo una llamada a los científicos para que se acelere el desarrollo de vacunas maternas frente a la enfermedad por S. agalactiae, causante cada año de medio millón de embarazos pretérmino con 150.000 fallecimientos y 46.000 abortos. A pesar de la alta cobertura de profilaxis antibiótica que se consigue en algunos países, siguen existiendo graves problemas y riesgos para la salud.
La hoja de ruta de la OMS, conjuntamente con otros socios mundiales, establece una visión integral para 2030, «Hacia un mundo libre de meningitis», con tres objetivos: 1) eliminar las epidemias de meningitis bacteriana, 2) reducir los casos de meningitis bacteriana prevenibles por vacunación en un 50% y las muertes en un 70%, y 3) reducir la discapacidad y mejorar la calidad de vida tras la meningitis.
La OMS establece un camino para alcanzar dichos objetivos mediante acciones concertadas sobre cinco aspectos interconectados: 1) prevención y control de las epidemias; 2) diagnóstico y tratamiento; 3) vigilancia de enfermedades; 4) atención y apoyo a las personas afectadas por la meningitis y con secuelas; y 5) garantizar una alta concienciación sobre la meningitis, la consideración en los planes de los países y aumentar el derecho a la prevención, la atención y los servicios de atención posterior.
Uno de los grandes avances en la meningitis en los últimos años ha sido la introducción de una vacuna conjugada frente al meningococo del serogrupo A, MenAfriVac®, desarrollada para su uso en el cinturón africano de la meningitis, donde este serogrupo causaba entre el 80% y el 85% de las epidemias que ocurrían en los 26 países que lo integran.
Epidemiología de la enfermedad meningocócica en España. ¿Se ha visto afectada por la pandemia de COVID-19?
Determinar el serogrupo tiene una gran importancia epidemiológica y vacunológica
En España, la enfermedad meningocócica es de declaración obligatoria desde 1901 y debe notificarse con carácter urgente a la Red Nacional de Vigilancia Epidemiológica (RENAVE). En los últimos años, la disponibilidad en la mayoría de hospitales de la prueba de reacción en cadena de la polimerasa (PCR), realizada en sangre, líquido cefalorraquídeo, líquido articular, secreción conjuntival, etc., ha permitido confirmar y establecer el serogrupo de un mayor número de casos con sospecha clínica de enfermedad meningocócica. Es muy importante que los casos en los que se desconoce el serogrupo no sean más del 10% y debe disminuir el porcentaje de casos en los que no puede determinarse el serogrupo, para lo cual el laboratorio de referencia de Neisseria del Instituto de Salud Carlos III, de Madrid, puede ampliar el estudio de las cepas para determinar el serotipo, el serosubtipo, el inmunotipo y el genotipo, datos que tienen una gran trascendencia epidemiológica. Este hecho es de gran importancia epidemiológica y vacunológica para poder modificar las políticas vacunales, evaluar la efectividad vacunal y estudiar los fallos vacunales.
El cultivo, en especial de sangre y de líquido cefalorraquídeo, sigue siendo el método de referencia, pero en la actualidad la PCR permite el diagnóstico en los casos en que los cultivos han sido negativos, principalmente por una antibioticoterapia previa, y es una prueba de mejor rendimiento y mayor rapidez. En una serie de 75 pacientes con enfermedad meningocócica estudiados en el Hospital Universitari Vall d’Hebron de Barcelona, el diagnóstico de confirmación y el conocimiento del serogrupo se lograron en el 38,7% de los casos gracias a la PCR.
Incidencia de la enfermedad meningocócica durante la pandemia de COVID-19
La incidencia de la enfermedad meningocócica está en disminución desde principios de siglo
La incidencia de la enfermedad meningocócica en España, en franca disminución desde principios de siglo, presentó un ligero ascenso en las cinco temporadas previas a la pandemia de COVID-19 (2014-2015 a 2018-2019), aunque con tasas anuales bajas, inferiores a 1 caso por cada 100.000 habitantes. La máxima incidencia se observó, como en temporadas anteriores, en los lactantes menores de 12 meses (11,5 casos por 100.000 habitantes). La tendencia fue decreciente para el serogrupo B, que continúa siendo el más frecuente, y creciente para los serogrupos W e Y.
La disminución a partir de la temporada 2019-2020 de la incidencia de la enfermedad meningocócica coincide con el descenso observado en las enfermedades de transmisión respiratoria (en especial la gripe y, en el niño, las infecciones por virus respiratorio sincitial) durante la pandemia, y se debe en gran parte a la implementación de las medidas de prevención no farmacológicas para la COVID-19, sobre todo el distanciamiento físico y la mascarilla, que limitan la transmisión de microorganismos en general. El descenso fue más relevante entre abril y septiembre, meses en que las medidas de contención de la pandemia fueron más rigurosas. Otros factores que hay que tener en cuenta son la posible afectación de los sistemas de vigilancia epidemiológica por la pandemia y la introducción en 2019 de la vacuna antimeningocócica tetravalente a los 12 años en el calendario común de vacunación a lo largo de toda la vida.
La incidencia de la enfermedad meningocócica ha disminuido durante la pandemia
Este descenso “pandémico” se ha observado en muchos países de nuestro entorno, como el Reino Unido, Holanda y Francia. En todo el mundo, la repercusión de la pandemia sobre la epidemiología de las enfermedades de transmisión respiratoria ha sido muy importante. Brueggemann y cols. estudiaron los cambios en la incidencia de la enfermedad invasiva por S. pneumoniae, H. influenzae y N. meningitidis durante la pandemia de COVID-19 (solo incluyen datos desde el 1 de enero de 2018 hasta el 31 de mayo de 2020) en 26 países y territorios (37 laboratorios, dentro del programa Invasive Respiratory Infection Surveillance Initiative), y observaron una reducción sustancial y mantenida, significativa, en el número de casos de enfermedad invasiva por estos tres microorganismos entre marzo y mayo de 2020, lo que contrasta con las cifras de 2018 y 2019, que fueron muy similares y manteniendo los niveles prepandémicos. Para confirmar la plausibilidad de las medidas de contención en estos cambios de incidencia, lo compararon con los datos (de nueve laboratorios) de la enfermedad invasiva por S. agalactiae de transmisión no respiratoria, que permaneció igual que en los 2 años anteriores, al no estar afectada por las medidas de salud pública adoptadas por causa de la pandemia.
La COVID-19 también tuvo su repercusión en las coberturas vacunales. En España, a pesar de las recomendaciones establecidas por las autoridades sanitarias, las coberturas vacunales descendieron en todas las comunidades autónomas en los primeros 3 meses de la pandemia entre un 5 y un 60%, dependiendo de la edad y del tipo de vacuna. Las vacunaciones en las escuelas se suspendieron y solo se mantuvo, en general, la cobertura de la vacuna frente al tétanos, la difteria y la tosferina en las embarazadas. La disminución ha sido más manifiesta para las vacunas no financiadas: la primera dosis de vacuna antimeningocócica B disminuyó un 68,4% en la Comunidad Valenciana, y en Andalucía se observó un descenso de las dosis totales de esta vacuna (39%) y de la del rotavirus (18%). A partir del verano de 2020, y con el comienzo del curso escolar 2020-2021, las vacunaciones se han ido recuperando en nuestro país.
Datos de las temporadas pandémicas en España
En la temporada 2019-2020, en especial desde febrero-marzo hasta octubre de 2020, la incidencia de casos notificados disminuyó un 31,3% respecto a la temporada anterior 2018-2019 (270 casos confirmados vs. 390 casos, con tasas de incidencia de 0,57 y 0,83, respectivamente). El descenso fue en todos los serogrupos y en todos los grupos de edad. La máxima incidencia se observó también en los lactantes menores de 12 meses (9,4 casos por 100.000 habitantes).
Durante la temporada 2020-2021 siguió disminuyendo la incidencia de casos notificados, un 75% respecto a la temporada anterior 2019-2020 (64 casos confirmados vs. 270 casos, con tasas de incidencia de 0,14 y 0,57, respectivamente). El descenso fue en todos los grupos de edad y, en cuanto a los serogrupos, se observó un alto porcentaje de casos por serogrupo desconocido, del 28,1%, frente al 5,9% y el 12,9% en las temporadas 2018-2019 y 2019-2020, respectivamente. Hay que destacar el aumento significativo de los casos no serogrupados (hasta cinco veces más en la última temporada en relación con la última prepandémica) en las dos temporadas pandémicas, en relación probablemente con la saturación de los servicios clínicos y de microbiología.
Por último, los datos de la temporada 2021-2022 (de la semana 41/2021 a la 36/2022, a 4 semanas de la finalización de la misma, informe nº 38 de RENAVE) ya indican un aumento de la incidencia, con 89 casos notificados (81 casos confirmados vs. 57 casos en la misma semana de la temporada anterior). Esta tendencia a niveles de incidencia de la época prepandémica parece apreciarse también en otros países, como el Reino Unido y Francia.
Los datos de vigilancia epidemiológica comunicados por la UK Health Security Agency en enero de 2022 indican que entre septiembre y noviembre de 2021 se registró un aumento en el número de casos de enfermedad meningocócica por serogrupo B en estudiantes universitarios, coincidiendo con la retirada de las medidas de contención de la COVID-19 en julio de 2021. Según estos datos, los casos en personas de 15 a 19 años ahora superan los niveles previos a la pandemia, con casi todos los casos causados por el serogrupo B. De todos los casos confirmados en los grupos de edad de 15-19 y 20-24 años, el 85% (22 de los 26 casos confirmados) eran estudiantes universitarios. Por el contrario, el meningococo del grupo W representó solo el 6% de los casos y no se observaron casos por los serogrupos Y y C. Esto sugiere que el programa de vacunación ACWY, dirigido a adolescentes desde 2015, mantiene unas tasas bajas de la enfermedad; sin embargo, la baja inmunidad frente al serogrupo B (la vacunación se realiza en el primer año de vida) y la alta transmisión del meningococo entre adolescentes y adultos jóvenes dieron como resultado un repunte de la enfermedad por serogrupo B, en particular en estudiantes universitarios.
En Francia se han registrado 27 casos de meningitis B durante el último año. Desde el 1 de agosto de 2021, la incidencia de enfermedad por el serogrupo B en la región Auvernia-Ródano-Alpes (0,34/100.000 habitantes) se ha duplicado en comparación con el resto de Francia (0,16/100.000 habitantes). De los 27 casos ocurridos en la región, 12 estaban vinculados a una nueva cepa (ST-3753), cubierta por las dos vacunas antimeningocócicas B. De estos 12 casos, 11 tenían entre 16 y 21 años (92%), con una edad media de 20 años. Esta nueva variante ha provocado la muerte de un joven estudiante y dos formas clínicas graves, una con secuelas y otra con púrpura fulminante. La transmisión parece estar produciéndose en clubes nocturnos. La Agence Nationale de Sécurité du Médicament et des Produits de Santé está llevando a cabo acciones para atajar el brote, empezando por una gran campaña vacunal en la que se han enviado 56.000 cartas a jóvenes de edades comprendidas entre los 16 y los 24 años que viven o frecuentan las zonas hiperendémicas, pidiéndoles que acudan a su médico para la administración gratuita de ambas dosis. Además, se han puesto a disposición de la población herramientas comunicativas en la web pública sanitaria francesa, así como un listado de farmacias donde la vacuna está disponible. Los padres de la región con niños en edades comprendidas entre los 0 y los 2 años también han recibido el comunicado para promover la vacunación siguiendo las recomendaciones recientes y su inclusión en el calendario de vacunaciones de 2022.
Cambios en la distribución de serogrupos en la última década: incremento de la incidencia de los serogrupos W e Y
El serogrupo B es el más frecuente en España
Además del descenso de la incidencia de la enfermedad meningocócica, se han producido cambios en la distribución de los serogrupos y destaca el aumento de la incidencia de los serogrupos W e Y en varios países de Europa, primero en el Reino Unido desde 2010, que llevó en el año 2015 a nuevas recomendaciones vacunales, al igual que Holanda hizo 3 años después.
Hay que destacar un aumento de la incidencia de los serogrupos W e Y
En España, el número de casos por los serogrupos W e Y, desde 2014-2015 hasta 2018-2019, ha aumentado de 4 a 86 (48 en la anterior) y de 6 a 50 (37 en la anterior), respectivamente, pero con el mantenimiento del serogrupo B como el más frecuente (38,2% en la última temporada), aunque con menor tasa de incidencia. En la última temporada prepandémica, la distribución de los serogrupos por edades fue la siguiente: el serogrupo B fue el más frecuente en los menores de 1 año y en los grupos de 1-4 años, 5-9 años, 20-24 años y 45-54 años; el serogrupo W fue el mayoritario en los grupos de 15-19 años, 25-34 años, 55-64 años, 65-74 años y mayores de 84 años; el serogrupo Y predominó en los grupos de 10-14 años y 75-84 años; y el serogrupo C fue el más habitual en el grupo de 35-44 años. Estos cambios en la incidencia de los serogrupos destacan la importancia de la vigilancia epidemiológica.
Conclusión epidemiológica
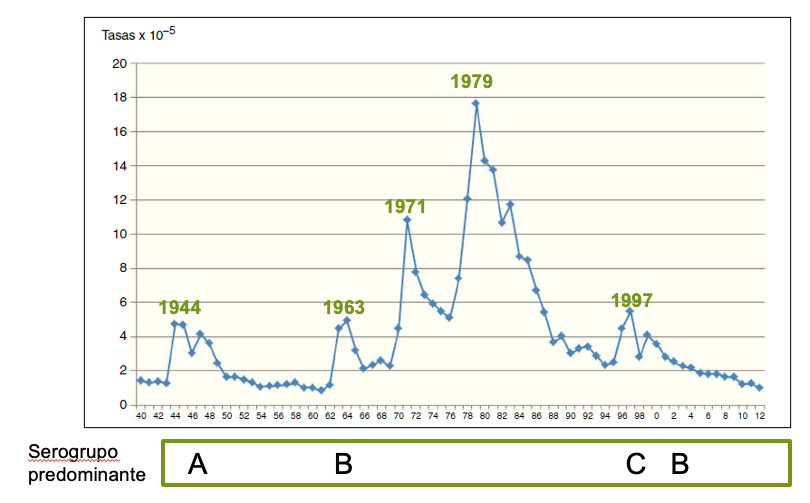
Conviene no olvidar, confirmando la impredecibilidad de la epidemiología de la enfermedad meningocócica, que durante el pasado siglo y desde 1940 se han producido cinco ondas epidémicas en España, con picos máximos en los años 1944, 1963, 1971, 1979 y 1997, destacando los dos de mayor incidencia de la década de 1970 (tasa en 1979: 17,9 casos por cada 100.000 habitantes, más de 20 veces superior a la de la temporada prepandémica). El serogrupo A en la primera onda y el C en la última fueron los causantes; en las tres ondas intermedias lo fue el serogrupo B. Desde principios de este siglo, y después de la incorporación de la vacuna frente al meningococo del serogrupo C en el calendario, el B continúa siendo el mayoritario, aunque en las cinco temporadas prepandémicas han aumentado los serogrupos W e Y (Fig. 1).
Vacunación antimeningocócica
Las vacunas antimeningocócicas tienen un pasado, un presente y un futuro (Tabla III). El pasado se inicia en el siglo XX con las vacunas de polisacáridos, al igual que sucedió con las vacunas primero frente a H. influenzae serotipo b y después frente a S. pneumoniae. El polisacárido capsular de los serogrupos A, C, W e Y es el componente de estas vacunas, que se autorizaron primero en formas monovalentes (A y C) y luego tetravalentes (ACWY). El polisacárido capsular del serogrupo B no se pudo formular para una vacuna por ser poco inmunógeno y por tener en su estructura un ácido siálico similar al presente en las células neuronales embrionarias humanas, que posibilita la aparición de fenómenos de autoinmunidad y de tolerancia inmunitaria.
Las vacunas de polisacáridos tienen limitaciones, ya que son poco inmunógenas y eficaces en niños menores de 18-24 meses, la inmunidad decrece con el tiempo (por lo que la duración de la protección es menor) e inducen escasa memoria inmunitaria después de una dosis de recuerdo (booster).
La siguiente línea de investigación fueron las vacunas conjugadas formuladas por la unión del polisacárido capsular a una proteína transportadora (CRM197, una mutante no tóxica de la toxina diftérica, el toxoide tetánico o el toxoide diftérico), que convierte la respuesta inmunitaria independiente del timo en dependiente de este, y que es inmunógena e inductora de memoria inmunitaria a partir de los 2 meses de edad. Sin embargo, la conjugación del polisacárido capsular B puso de manifiesto también tolerancia inmunitaria, con menores respuestas tras la administración de una dosis booster, por lo que se abandonó esta tecnología. Las dos vacunas disponibles frente al serogrupo B son recombinantes de proteínas expresadas en la superficie, una de ellas (Bexsero®) obtenida por vacunología inversa (reverse vaccinology) y la otra (Trumenba®) por la técnica proteómica.
El futuro de la vacunación antimeningocócica se centra en la investigación que se está llevando a cabo de tres vacunas combinadas pentavalentes. Una de ellas, de extraordinario interés para el continente africano, es la tetravalente con el serogrupo X (vacuna ACWYX). Las dos pentavalentes restantes, con el serogrupo B (vacunas ABCWY), que serían de elección para Europa, están fabricadas a partir de las dos vacunas meningocócicas B y ACWY disponibles actualmente (de GSK y de Pfizer).
Posibles beneficios de la vacunación antimeningocócica B: más allá de la prevención de la enfermedad meningocócica B
Protección cruzada con otros serogrupos de meningococo
La efectividad de las vacunas frente al meningococo del serogrupo B va más allá de este serogrupo; al tener proteínas comunes, sería un importante valor añadido que permitiría hablar de la primera vacuna panmeningocócica, como ya se señaló cuando fue autorizada. En el programa de vacunación del Reino Unido, la implantación de emergencia en 2015 de la vacuna tetravalente ACWY en el adolescente y la inclusión sistemática de la vacuna 4CMenB en el calendario del lactante se hicieron casi en el mismo periodo de tiempo. En 2020 y 2021, Ladhani y cols. reportaron un aumento del número de casos de enfermedad meningocócica por el serogrupo W en las temporadas 2014-2015 y 2015-2016, excepto en dos grupos de edad, los adolescentes de 15-19 años y los lactantes menores de 1 año, que presentaron una disminución del 31% y del 35%, respectivamente. El primer grupo se había vacunado con una vacuna tetravalente que contiene el componente W, y el segundo con la vacuna frente al serogrupo B, por lo que se puede pensar en una protección cruzada de esta vacuna frente al serogrupo W, que se ha confirmado en posteriores trabajos clínicos y de laboratorio (medición de la actividad bactericida frente a los distintos serogrupos).
Prevención de la gonorrea
Un efecto heterólogo de la vacuna 4CMenB es la prevención de la infección producida por otra Neisseria (la gonococia por Neisseria gonorrhoeae), como ya se demostró en un trabajo realizado con la vacuna OMV (vesícula de membrana externa que contiene porina A como antígeno principal) obtenida de una cepa epidémica neozelandesa de meningococo B (MeNZB), que es el cuarto componente de la vacuna 4CMenB, con una efectividad ajustada frente a la gonorrea del 31% (intervalo de confianza del 95% [IC95%]: 21-39). La proteína PorA 1.4 de la OMV y otros antígenos meningocócicos vacunales (NHBA, GNA1030 y GNA2091) tienen una elevada homología con proteínas expuestas en la superficie de N. gonorrhoeae, con cierto grado de protección cruzada.
Posteriormente, otros trabajos han confirmado estos datos. En un estudio realizado en jóvenes pertenecientes al Kaiser Permanente Southern California, más de 6.000 jóvenes vacunados con 4CMenB y un grupo control con más de 26.000 vacunados con vacuna tetravalente ACWY, se observó que la incidencia de gonorrea fue un 46% inferior en los primeros que en los segundos (análisis ajustado), mientras que la incidencia de la infección por Chlamydia fue similar en ambos grupos. En otro estudio de los Centers for Disease Control and Prevention de los Estados Unidos con 110.000 personas en las que se identificaron 18.099 casos de gonorrea, se estimó que la vacunación completa con dos dosis ofrecía una protección del 40% (IC95%: 23-53) contra la gonorrea, mientras que con una dosis era del 26% (IC95%: 12-37). Y en otro trabajo realizado en el sur de Australia, donde se desarrolló un programa de vacunación en 53.000 adolescentes, la protección con dos dosis fue del 33%.
Con estos resultados, la prevención de una de las enfermedades de transmisión sexual más frecuentes, con un aumento de casos en todo el mundo y un incremento de la resistencia a los antibióticos utilizados, podría ser un beneficio adicional de la vacuna 4CMenB; otro importante argumento para incluirla en el calendario del adolescente.
Estrategias de vacunación antimeningocócica en España
Vacunación MenACWY y MenB: recomendable en el lactante y el adolescente
A continuación se resumen los calendarios y las recomendaciones de las autoridades sanitarias y de algunas sociedades científicas sobre la estrategia de vacunación antimeningocócica en el niño sano y con enfermedades de base o condiciones de riesgo.
1. Calendario común de vacunación a lo largo de toda la vida del Consejo Interterritorial del Sistema Nacional de Salud 2022
La vacunación antimeningocócica en el calendario común (que no es único) del Consejo Interterritorial del Sistema Nacional de Salud del año 2022 solo contempla para el niño sano la vacuna conjugada monovalente frente al serogrupo C a los 4 y 12 meses, y la tetravalente ACWY a los 12 años.
2. Calendario de vacunación en menores y adolescentes (<18 años) con condiciones de riesgo 2022
Los grupos de riesgo que tienen indicadas las vacunaciones antimeningocócicas ACWY (Tabla IV) y B (Tabla V) son los que establece el Consejo Interterritorial del Sistema Nacional de Salud en 2022.
3. Calendarios de las comunidades autónomas de 2022
Algunas comunidades autónomas han establecido en sus calendarios otras vacunaciones adicionales a las recomendadas por el Consejo Interterritorial del Sistema Nacional de Salud:
- Vacuna antimeningocócica ACWY conjugada a los 12 meses en lugar de la monovalente C: Andalucía, Castilla y León, Galicia, Melilla y Murcia.
- Vacuna antimeningocócica B en el lactante: Andalucía, Canarias, Castilla y León, Cataluña y Galicia.
4. Calendario de la Asociación Española de Pediatría de 2022
- Vacuna antimeningocócica C conjugada a los 4 meses y ACWY conjugada a los 12 meses y a los 12 años, con rescate a lo largo de toda la adolescencia.
- Vacuna antimeningocócica B a los 2 y 4 meses, y a los 12-15 meses.
5. Recomendaciones de vacunaciones de la Sociedad Española de Medicina de la Adolescencia (SEMA) de 2021
Es un documento de consenso coordinado por la SEMA con la participación de ocho sociedades científicas: la Asociación Española de Pediatría (AEP), la Asociación Española de Pediatría de Atención Primaria (AEPap), la Asociación Española de Vacunología (AEV), la Sociedad Española de Infectología Pediátrica (SEIP), la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), la Sociedad Española de Médicos Generales y de Familia (SEMG), la Sociedad Española de Pediatría Extrahospitalaria y de Atención Primaria (SEPEAP), y la Sociedad Española de Urgencias Pediátricas (SEUP).
Incluye la vacuna antimeningocócica conjugada ACWY a los 12 años, con rescate a lo largo de toda la adolescencia, y la vacuna antimeningocócica B a los 14-18 años con una pauta de dos dosis.
6. Calendario posible con las vacunas disponibles: calendario de máximos de 2022
- Vacunación antimeningocócica conjugada ACWY del lactante (2 y 4 meses), a los 12 meses y a los 12 años, con rescate a lo largo de toda la adolescencia.
- Vacunación antimeningocócica B del lactante con rescate de los menores de 5 años y del adolescente.
Tablas y figuras
Tabla I. Características de la enfermedad meningocócica: el porqué de la vacunación
|
Tabla II. Serogrupos de Neisseria meningitidis y enfermedad inmunoprevenible
|
Tabla III. Vacunas antimeningocócicas (2022)
| A. De primera generación: vacunas del siglo XX |
– Bivalente AC: se usó en España en el brote de enfermedad por serogrupo C (1996-1999) |
| B. De segunda generación: vacunas del siglo XXI |
|
| C. Vacunas de tercera generación: combinadas pentavalentes (en investigación) |
|
Tabla IV. Vacunación antimeningocócica ACWY y poblaciones de riesgo
|
Tabla V. Vacunación antimeningocócica B y poblaciones de riesgo
|
Figura 1. Incidencia de la enfermedad meningocócica en España. Años 1940 a 2012
Modificada de: P. Garrido*, A.Prat y A.Domínguez.
Bibliografía
- Alderson MR, Arkwright PD, Bai X, Black S, Borrow R, Caugant DA, et al. Surveillance and control of meningococcal disease in the COVID-19 era: a Global Meningococcal Initiative review. J Infect. 2022;84:289-96.
- Baker CJ. Prevention of meningococcal infection in the United States: current recommendations and future considerations. J Adolesc Health. 2016;59:S29-eS37.
- Brueggemann AB, Jansen van Rensburg MJ, Shaw D, McCarthy ND, Jolley KA, Maiden MCJ, et al. Changes in the incidence of invasive disease due to Streptococcus pneumoniae, Haemophilus influenzae, and Neisseria meningitidis during the COVID-19 pandemic in 26 countries and territories in the Invasive Respiratory Infection Surveillance Initiative: a prospective analysis of surveillance data. Lancet Digit Health. 2021;3:e360-70.
- Campbell H, Saliba V, Borrow R, Ramsay M, Ladhani SN. Targeted vaccination of teenagers following continued rapid endemic expansion of a single meningococcal group W clone (sequence type 11 clonal complex), United Kingdom 2015. Euro Surveill. 2015;20:pii:21188.
- Campins Martí M, Moraga-Llop FA. COVID-19, una lección de la que hay que aprender. Pediatr Integral. 2020;24:128-31.
- Clark S, Campbell H, Mensah AA, Lekshmi A, Walker L, Ribeiro S, et al. An increase in group B invasive meningococcal disease among adolescents and young adults in England following easing of COVID-19 containment measures. 2022. Disponible en: SSRN: https://ssrn.com/abstract=3998164 or http://dx.doi.org/10.2139/ssrn.3998164.
- Comisión de Salud Pública: acuerdo alcanzado en relación a la vacunación frente a la enfermedad meningocócica invasiva. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/Acuerdo_CSP_Vacunacion_frente_meningitis.pdf.
- Fernández-San José C, Moraga-Llop FA, Codina G, Soler-Palacín P, Espiau M, Figueras C. La reacción en cadena de la polimerasa en el diagnóstico de la enfermedad meningocócica invasiva. An Pediatr (Barc). 2015;82:139-43.
- Garrido P, Prat A, Domínguez A. Enfermedad meningocócica en España (1940-2012). Tendencias de la incidencia y evolución de los serogrupos antes y después de las campañas de vacunación. Vacunas. 2013;14:145-54.
- Gil CJ. Novel assessment of a novel meningitis B vaccine. Lancet Infect Dis. 2013;13:381-2.
- Hidalgo Vicario MI, De Montalvo Jääskeläinen F, Martinón-Torres F, Moraga- Llop F, Cilleruelo Ortega MJ, Montesdeoca Melián A, et al. Calendario de vacunaciones del adolescente. Documento de consenso. Madrid: Undergraf; 2021. Disponible en: https://www.adolescenciasema.org/calendario-de-vacunaciones-del-adolescente/.
- Instituto de Salud Carlos III. Enfermedad meningocócica. Disponible en: https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Paginas/Meningococica.aspx.
- Ladhani SN, Giuliani M, Biolchi A, Pizza M, Beebeejaun K, Lucidarme J, et al. Effectiveness of meningococcal B vaccine against endemic hypervirulent Neisseria meningitidis W strain, England. Emerg Infect Dis. 2016;22:309-11.
- Ladhani SN, Campbell H, Andrews N, Parikh SR, White J, Edelstein M, et al. First real-world evidence of meningococcal group B vaccine, 4CMenB, protection against meningococcal group W disease: prospective enhanced national surveillance, England. Clin Infect Dis. 2021;73:e1661-8.
- Martinón-Torres F, Banzhoffb A, Azzari C, De Wals P, Marlow R, Marshall H, et al. Recent advances in meningococcal B disease prevention: real-world evidence from 4CMenB vaccination. J Infect. 2021;83:17-26.
- Moraga-Llop F, Martinón-Torres F, editores. La enfermedad meningocócica: pasado, presente y futuro. Girona: Editorial Gráficos Montseny; 2013.
- Moraga-Llop FA, Marès Bermúdez J. Estrategias dinámicas de prevención en la enfermedad meningocócica invasiva. Pediatr Integral. 2019;23:61-4.
- Moraga-Llop FA. Las vacunas caen durante la pandemia. Adolescere. 2020;8:3-6.
- Moraga-Llop FA, Fernández-Prada M, Grande-Tejada AM, Martínez-Alcorta LI, Moreno-Pérez D, Pérez-Martín JJ. Recuperando las coberturas vacunales perdidas en la pandemia de COVID-19. Vacunas. 2020;21:129-35.
- Moraga-Llop FA. Calendario de vacunaciones del adolescente. Adolescere. 2021;9:14-23.
- Ong JJ, Unemo M, Choong ALC, Zhao V, Chow EPF. Is the end of gonorrhoea in sight? Lancet Infect Dis. 2022;22:919-21.
- Organización Mundial de la Salud. Derrotar a la meningitis para 2030: una hoja de ruta mundial, 2021. Disponible en: https://www.who.int/es/publications/i/item/9789240026407.