Pubertad y adolescencia
Pubertad y adolescencia
M. Güemes-Hidalgo(1), M.J. Ceñal González-Fierro(2), M.I. Hidalgo Vicario(3).
(1)Departamento de Endocrinología, Great Ormond Street Hospital for Children NHS, Foundation Trust, Londres, Reino Unido. (2)Jefe del de servicio del Hospital Universitario de Móstoles. Madrid. (3)Pediatra. Doctora en Medicina. Acreditada en Medicina de la Adolescencia. CS Barrio del Pilar. DAN. Madrid.
Fecha de recepción: 7 de febrero 2017
Fecha de publicación: 28 de febrero 2017
Adolescere 2017; V (1): 7-22
Resumen
|
En este capítulo se exponen las diferencias entre pubertad y adolescencia, siendo la pubertad un evento biológico y su definición obedece a criterios puramente estadísticos. La adolescencia es un proceso más amplio con cambios físicos, psicosociales y emocionales que se inicia con la pubertad; el final no está claramente delimitado dependiendo de cuando se completa el desarrollo en los diferentes aspectos referidos. Se presentan las características normales de cada entidad así como las variantes dentro de la normalidad de la pubertad: la telarquia prematura aislada, la adrenarquia prematura idiopática, pubertad adelantada y el retraso constitucional del crecimiento y pubertad. Palabras clave: Pubertad, adolescencia, fisiología puberal, crecimiento, maduración. |
Abstract
|
In this chapter the differences between puberty and adolescence are exposed, puberty is a biological event and its definition purely obeys statistical criteria. Adolescence is a broader process with physical, psychosocial, and emotional changes that begins with puberty. The end of adolescence is not clearly delimited as it depends upon the completion of the different mentioned aspects. The normal characteristics of each entity as well as the variants within normality of puberty are presented: isolated premature thelarche, idiopathic premature adrenarche, advanced puberty and constitutional delay of growth and puberty. Key words: Puberty, adolescence, pubertal physiology, growth, maturation. |
Introducción. Diferencia entre pubertad y adolescencia
El término pubertad proviene del latín “pubere” que significa pubis con vello. Es un proceso biológico en el que se produce el desarrollo de los caracteres sexuales secundarios, la maduración completa de las gónadas y glándulas suprarrenales, así como la adquisición del pico de masa ósea, grasa y muscular y se logra la talla adulta. La definición de pubertad obedece a criterios estadísticos, es decir, si la aparición de los caracteres sexuales secundarios se encuentran dentro del intervalo de +-2,5 DE (desviación estándar) para sexo y población de referencia. Se considera inicio pubertal normal a la aparición de telarquia entre los 8-13 años en las niñas y el aumento del tamaño testicular entre los 9-14 años en los niños.
Se considera inicio pubertal normal a la aparición de telarquia entre los 8-13 años en las niñas y el aumento del tamaño testicular entre los 9-14 años en los niños
Adolescencia procede de la palabra latina “adolescere”, del verbo adolecer y en castellano tiene dos significados: tener cierta imperfección o defecto y también crecimiento y maduración. Es el periodo de tránsito entre la infancia y la edad adulta. Se acompaña de intensos cambios físicos, psicológicos, emocionales y sociales; se inicia con la pubertad (aspecto puramente orgánico), terminando alrededor de la segunda década de la vida, cuando se completa el crecimiento y desarrollo físico y la maduración psicosocial. La OMS considera adolescencia entre los 10 y 19 años y juventud al periodo entre los 19 y 25 años de edad. La SAHM (Sociedad Americana de Salud y Medicina de la Adolescencia) la sitúa entre los 10-21 años. Distinguiendo 3 fases que se solapan entre sí: adolescencia inicial (10-14 años), media (15-17 años) y tardía (18-21 años).
La SAHM (Sociedad Americana de Salud y Medicina de la Adolescencia) sitúa la adolescencia entre los 10-21 años
Los adolescentes no forman un grupo homogéneo, existe una amplia variabilidad en los diferentes aspectos de su desarrollo; además los aspectos biológicos pueden influir en el desarrollo psicológico. Cuando el proceso de desarrollo está muy adelantado o retrasado respecto a sus compañeros, el adolescente tiene a menudo dificultades de adaptación y baja autoestima; por ejemplo, una chica de 11 años cuyo cuerpo está desarrollado como una de 15, o el chico de 14 años con un cuerpo como otro de 10 años. Por otro lado, la adolescencia no es un proceso continuo y uniforme; los distintos aspectos biológicos, intelectuales, emocionales o sociales pueden no llevar el mismo ritmo madurativo y ocurrir retrocesos o estancamientos, sobre todo en momentos de estrés. Aunque este período puede ser muy tormentoso, la mayoría de los jóvenes y sus padres lo superan sin excesivos problemas.
Fisiología de la pubertad
El inicio de la pubertad es el resultado de la interacción de variables genéticas (70-80%) y factores reguladores -señales endógenas y ambientales- (20-30%): alimentación, disruptores endocrinos, ciclos luz-oscuridad, lugar geográfico, estímulos psíquicos y sociales… Los cambios hormonales son debidos a la interacción entre el sistema nervioso central (SNC), hipotálamo, hipófisis, gónadas y suprarrenales(1,2).
El inicio de la pubertad es el resultado de la interacción de variables genéticas (70-80%) y factores reguladores -señales endógenas y ambientales-
(20-30%)
Eje hipotálamo-hipófiso-gonadal
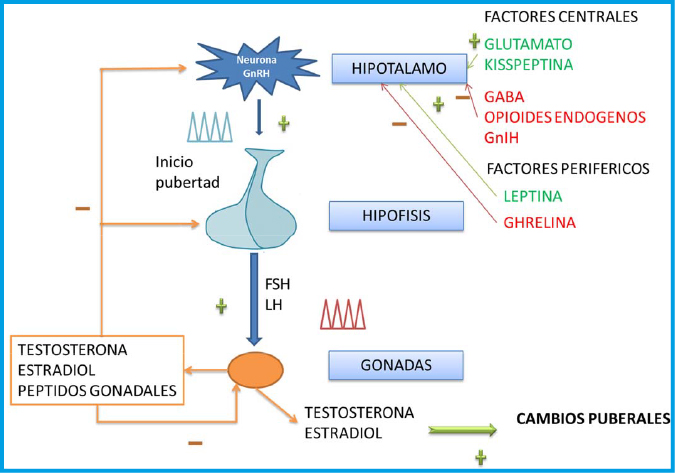
En la infancia y época prepuberal la hormona liberadora de gonadotropinas (GnRH) y las gonadotropinas hipofisarias (LH (hormona luteinizante) y FSH (hormona folículo-estimulante)) están inhibidas por acción de una supresión activa de la secreción de GnRH.
Se ha demostrado que las neuronas productoras de GnRH, son capaces de secretar GnRH de forma pulsátil, con autorritmicidad, y con independencia de estímulos externos.
Sin embargo, la amplitud de los pulsos secretorios de GnRH, cuyo incremento es lo característico del inicio de la pubertad, está regulada por la acción de señales estimulantes (sistema glutaminérgico, noradrenérgico, dopaminérgico, kisspeptinas) e inhibidoras (sistema gabaérgico, opiáceos endógenos) que actúan en el hipotálamo. La secreción de GnRH está, además, modulada por la interacción entre las neuronas que la producen y las células gliales circundantes, así como por el SNC(3,4,5).
Genética: Se ha observado que el inicio de la pubertad está regulado por una red nodal de genes, que regulan los cambios en los circuitos neuronales del núcleo arcuato del hipotálamo. Estos cambios son(4):
Se ha observado que el inicio de la pubertad está regulado por una red nodal de genes, que regulan los cambios en los circuitos neuronales del núcleo arcuato del hipotálamo
— Cambios transinápticos: (a) Aumento de los estímulos excitatorios de las neuronas secretoras de GnRH: vía glutamato y vía kisspeptina. (b) Disminución de los estímulos inhibitorios: por neuronas gabaérgicas, neuronas productoras de sustancias opioides y neuronas productoras de péptido relacionado con RFamide [ortólogo mamífero del péptido inhibidor de gonadotropinas (GnIH)](3,4,5).
— Cambios en las células gliales: las células gliales contribuyen a la activación de la secreción de GnRH por dos mecanismos:
• A través de la liberación de factores de crecimiento que actúan sobre receptores de las neuronas productoras de GnRH [factor de crecimiento transformador tipo b (TGFb), factor de crecimiento epidérmico (EGF) y factor de crecimiento similar a la insulina tipo 1 (IGF-1)].
• A través de cambios en la adhesividad de las células gliales sobre las neuronas productoras de GnRH(3,5).
Epigenética: Existen factores externos que modifican la expresión de los genes, influyendo en el momento de inicio puberal: nutrición, ejercicio, estrés o factores sociales y psicológicos, ritmo circadiano y horas de luz, y disruptores endocrinos ambientales, fundamentalmente pesticidas(4).
Existen factores externos que modifican la expresión de los genes, influyendo en el momento de inicio puberal
La GnRH induce, en las células gonadotropas hipofisarias, la síntesis y liberación pulsátil de las gonadotropinas hipofisarias, LH y FSH, que actúan en la gónada para inducir la maduración de las células germinales (óvulos o espermatozoides) y la producción de esteroides sexuales, así como de otros péptidos gonadales (inhibinas, activinas, folistatina), y otras hormonas circulantes (leptina), que ejercen a través de mecanismos de retrocontrol, acciones estimulantes e inhibidoras, a diferentes niveles del eje hipotálamo-hipófiso-gonadal (Figura 1).
La testosterona en el varón y el estradiol en la mujer, son los responsables del desarrollo de los caracteres sexuales secundarios y ejercen un retrocontrol negativo en hipotálamo e hipófisis, reduciendo la secreción de GnRH y gonadotrofinas.
Al inicio de la pubertad, LH y FSH son liberadas de forma pulsátil, durante la noche y posteriormente según avanza la pubertad durante todo el día.
Suprarrenales
Entre los 6-8 años de edad ósea se produce la adrenarquía o maduración de las suprarrenales, manifestándose con la aparición de vello púbico y/o axilar. Se inicia unos 2 años antes que el aumento de los esteroides gonadales, y es independiente del eje hipotálamo-hipófiso-gonadal(6).
La adrenarquia se inicia unos 2 años antes que el aumento de los esteroides gonadales, y es independiente del eje hipotálamo-hipófisogonada
Eje hipotálamo-hipófiso-somatomedínico
En la pubertad se produce la activación de este eje, dando lugar a un aumento en la producción en el hipotálamo de GHRH (hormona liberadora de hormona de crecimiento), en la hipófisis de GH (hormona de crecimiento) que a su vez aumenta los niveles de IGF-I (insulin-like growth factor 1), IGFBP-3 (insulin-like growth factor binding protein 3). Este incremento se produce antes en las mujeres que en los hombres.
Relación entre pubertad, nutrición y
masa ósea
Pubertad y nutrición: Existe una relación muy estrecha entre metabolismo y reproducción, debido a las señales periféricas que informan del estado nutricional del organismo al cerebro. De tal forma que la obesidad se relaciona con adelanto puberal y la desnutrición con retraso puberal(7). Se ha señalado a la leptina como favorecedora del desarrollo puberal, menos claro es el papel de la adiponectina. El péptido ghrelina, factor orexígeno secretado en las células oxínticas del estómago, parece que inhibe la secreción de gonadotrofinas y también se ha visto que disminuye durante la pubertad, lo que sugiere un papel permisivo. Actualmente se está estudiando el papel del sistema kisspectina(5,8). Igualmente, se están estudiando las niñas con antecedentes de nacidas pequeñas para la edad gestacional (PEG) y especialmente las que experimentaron un rápido crecimiento recuperador y ganancia ponderal, parece que están más expuestas a presentar adrenarquia prematura, adelanto puberal y síndrome de ovario poliquístico, aunque son necesarios más estudios.
La obesidad se relaciona con adelanto puberal y la desnutrición con retraso puberal
Pubertad y Masa ósea (MO): La mineralización ósea está determinada por la interacción de factores genéticos, ambientales y hormonales. Cada individuo tiene un potencial genético de desarrollo de la MO que solo se alcanza plenamente si los factores ambientales como la actividad física y la nutrición con aporte de calcio son óptimos. En los sujetos sanos la MO crece durante la infancia con un máximo durante la fase de adolescencia precoz e intermedia y se enlentece en la adolescencia tardía alcanzando el pico de masa ósea al final de la adolescencia. Un adecuado desarrollo óseo logrando un apropiado pico de masa ósea es fundamental para evitar la osteoporosis y la osteopenia en edades posteriores de la vida.
Un adecuado desarrollo óseo logrando un apropiado pico de masa ósea es fundamental para evitar la osteoporosis y la osteopenia en edades posteriores de la vida
Crecimiento y maduración física
Los cambios físicos en la pubertad son: Aceleración y desaceleración del crecimiento, cambios de la composición corporal y desarrollo de órganos y sistemas así como maduración sexual (gónadas, órganos reproductores y caracteres sexuales secundarios).
Crecimiento y desarrollo puberal
El comienzo y la progresión de la pubertad varían, como ya hemos comentado, de un adolescente a otro, con un amplio rango de normalidad.
En los últimos 150 años la pubertad se ha ido iniciando a edades cada vez más tempranas -tendencia secular del crecimiento y desarrollo- lo que se ha relacionado con las mejoras de las condiciones de vida como la nutrición y parece haberse atenuado en las dos últimas décadas del siglo XX(9).
En los últimos 150 años la pubertad se ha ido iniciando a edades cada vez más tempranas-tendencia secular del crecimiento y desarrollo- lo que se ha relacionado con las mejoras de las condiciones de vida como la nutrición y parece haberse atenuado en las dos últimas décadas del siglo XX
En el estudio longitudinal de la Fundación Andrea Prader, realizado en Aragón entre 1982-2002, la edad de inicio del desarrollo mamario era de 10,6±1,0 años, la edad media de inicio del desarrollo testicular de 12,3±1,1 años, y la edad media en la cual se presenta la menarquia entre 12,7±0,9 años(10).
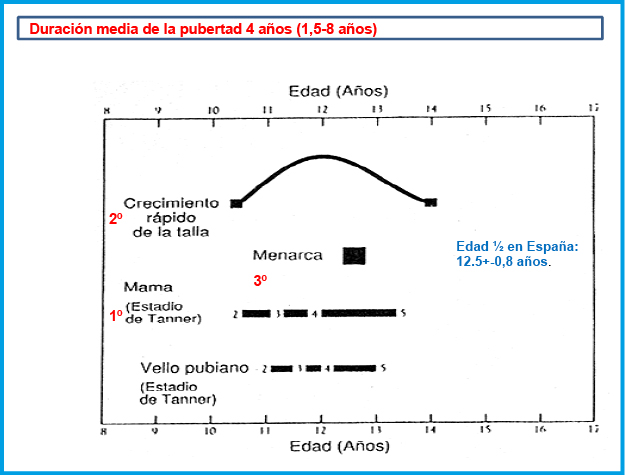
Existe una desaceleración del crecimiento que precede al pico de máxima velocidad de crecimiento, y que suele acontecer entre los 12 y 13 años en las chicas y entre los 14 y 15 años en los chicos. El crecimiento puberal supone del 20 al 25 % de la talla adulta definitiva. En ambos sexos, durante el segundo año del estirón es cuando el incremento es mayor, de 5,8 a 13,1 cm en los chicos y de 5,4 a 11,2 cm en las chicas. Cada persona tiene su propio patrón de desarrollo, cuanto más precoz es la edad de comienzo de la pubertad la ganancia de talla durante la pubertad es mayor.
Este crecimiento puberal no es armónico sino que se crece por “segmentos”, con crecimiento inicial del segmento inferior (extremidades inferiores) y con un orden de crecimiento de distal a proximal, crecen primero los pies. La talla definitiva, se alcanza entre los 16-17 años en las chicas, puede retrasarse hasta los 21 años en los chicos(11).
La talla definitiva, se alcanza entre los 16-17 años en las chicas, puede retrasarse hasta los 21 años en los chico
Cambios de la composición corporal y desarrollo de órganos y sistemas
El aumento de peso durante el estirón puberal llega a suponer alrededor del 50% del peso ideal del adulto. Las chicas acumulan más grasa que los chicos, y en éstos predomina el crecimiento óseo y muscular, produciendo al final del crecimiento un cuerpo más magro. En la edad adulta los hombres tienen un porcentaje de grasa entre el 12-16% mientras que las mujeres del 18-22%.
Las chicas acumulan más grasa que los chicos, y en éstos predomina el crecimiento óseo y muscular, produciendo al final del crecimiento un cuerpo más magro
Durante esta época se produce aumento de los diferentes órganos (corazón, pulmones, hígado, bazo, riñones), se ensancha la pelvis en las mujeres y los hombros en los varones, aumenta la fosfatasa alcalina según el grado de maduración del individuo y se produce un aumento de los glóbulos rojos y la hemoglobina en los varones debido a que la testosterona estimula la secreción de factores eritropoyéticos renales(11).
Se pensaba que para la adolescencia inicial el cerebro había logrado ya casi su tamaño de adulto, hoy sabemos desde los trabajos Giedd (2004)(12) que el cerebro madura de forma intermitente de la parte posterior a la anterior y no completa su maduración hasta los 25-30 años; depende de tres procesos:
El cerebro madura de forma intermitente de la parte posterior a la anterior y no completa su maduración hasta los 25-30 años
1) El rápido crecimiento neuronal-glial y la formación de nuevas conexiones sinápticas.
2) La eliminación selectiva o poda de las sinapsis menos eficientes (lo que no se usa se elimina).
3) La mielinización de los axones para facilitar y hacer más rápida la transmisión neuronal entre las diferentes partes del sistema nervioso, lo cual no se completa hasta los 25-30 años.
Se ha observado que las zonas del cerebro adolescente que buscan la recompensa, se desarrollan antes que las zonas relacionadas con la planificación y el control emocional (corteza prefrontal). Lo cual significa que la experimentación, exploración y asunción de riesgos durante la adolescencia son más de carácter normativo que patológico. También sabemos que el cerebro adolescente tiene una gran capacidad de cambiar y adaptarse. Eso implica que existen posibilidades reales de mejorar situaciones negativas que se produjeron en los primeros años de la vida.
Se ha observado que las zonas del cerebro adolescente que buscan la recompensa, se desarrollan antes que las zonas relacionadas con la planificación y el control emocional (corteza prefrontal)
Maduración sexual
Los cambios más llamativos tienen lugar en la esfera sexual y se culminan con la adquisición de la fertilidad. La edad cronológica tiene poca correlación con la maduración sexual y el crecimiento puede ser muy variable; por ello es necesario conocer en todo adolescente, el índice de maduración sexual que se evalúa mediante los estadios de Tanner (1962) y se basa en el desarrollo de los órganos genitales y caracteres sexuales secundarios (Figuras 2 y 3). Esto permite diferenciar la pubertad normal de la patológica(5,13).
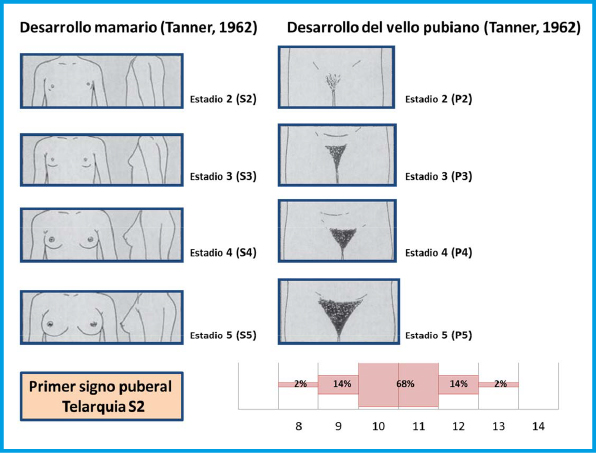
El primer signo de desarrollo puberal en las chicas es el aumento del botón mamario que puede iniciarse entre los 8-13 años, junto con aumento de la velocidad de crecimiento y acontece a una edad ósea de 11 años. Antes de los 8 años hablamos de pubertad precoz y después de los 13 de pubertad tardía.
El primer signo de desarrollo puberal en las chicas es el aumento del botón mamario que puede iniciarse entre los 8-13 años, junto con aumento de la velocidad de crecimiento y acontece a una edad ósea de 11 años
El pico de máxima velocidad de crecimiento, ocurre relativamente pronto (Tanner II-III) mientras que la menarquia es un evento tardío, suele presentarse unos dos años tras la telarquia y señala en general, la disminución del crecimiento. En el 60% de las chicas ocurre en el estadio IV de Tanner. La edad media en España es de 12,7+-0.9 años. La mejor referencia sobre su inicio, es la edad de la menarquia de la madre y hermanas. El crecimiento tras la menarquia puede ser variable entre 4,3 cm (P10) y 10,6 cm (P90), media de 7 cm. La duración media de la pubertad en las chicas es de 4 años (rango 1,5-8 años) (Figura 4).
En los varones la pubertad puede suceder dos años más tarde que en las chicas y por ello éstas pueden parecer más maduras físicamente que sus compañeros.
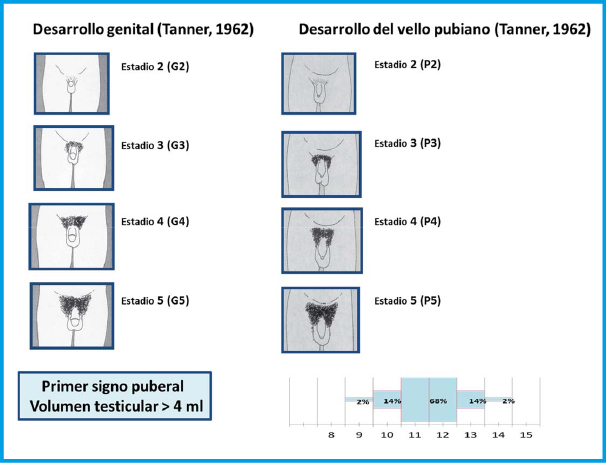
El primer signo de desarrollo puberal en los chicos es el aumento del volumen testicular así como enrojecimiento y rugosidad de la bolsa escrotal que puede empezar entre los 9-14 años y acontece a una edad ósea de 13 años
El primer signo de desarrollo puberal en ellos es el aumento del volumen testicular así como enrojecimiento y rugosidad de la bolsa escrotal que puede empezar entre los 9-14 años y acontece a una edad ósea de 13 años. Antes de los 9 años hablamos de pubertad precoz y después de los 14 de pubertad tardía. Un volumen de 4 ml (orquidómetro de Prader) o una longitud de 2,5 cm marcan el inicio puberal. Es seguido por el crecimiento del pene y la pubarquia.
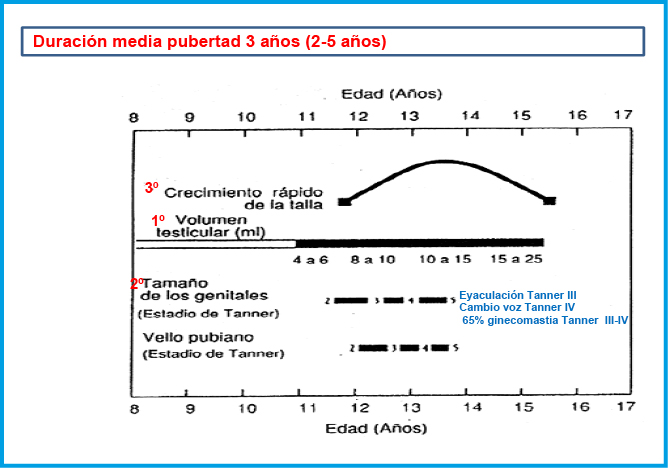
El pico de máxima velocidad de crecimiento es tardío en los chicos (Tanner IV) al igual que el cambio de voz. La eyaculación se produce generalmente en el Tanner III, estando la fertilidad asociada al estadío IV. Un 65% presentan ginecomastia principalmente en el Tanner III-IV; la consistencia es firme, no adherida, algo molesta a la presión y menor de 4 cm. Se debe tranquilizar ya que el 90% se resuelve en dos años. Si no se adapta a las características descritas habrá de estudiarse. La duración media de la pubertad en los chicos es de 3 años (rango 2-5 años) (Figura 5).
Variantes del desarrollo puberal normal
Adrenarquia prematura idiopática
Adrenarquia prematura es la aparición de vello púbico y/o axilar y/o aumento del olor corporal (olor apocrino) antes de los 8 años en niñas y de los 9 años en niños(14).
Tiene un claro predominio femenino (relación 9:1) y se caracteriza por ser un fenómeno independiente de la pubertad. No se acompaña de la aparición de otros signos puberales. La talla puede estar por encima de la talla genética pero sin aumento brusco del crecimiento, también es frecuente un discreto adelanto de la edad ósea. Se debe a una maduración temprana de la de la glándula suprarrenal, con un aumento de la producción de dehidroepiandrostendiona sulfato en la zona reticularis. Algunos estudios han mostrado mayor prevalencia de adrenarquia prematura en niñas con antecedentes de bajo peso para la edad gestacional.
La adrenarquia prematura idiopática no requiere tratamiento, pero se debe descartar la existencia de: Hiperplasia suprarrenal congénita forma no clásica o de tumores productores de andrógenos (origen ovárico o suprarrenal).
Telarquia prematura aislada
Es el desarrollo mamario uni o bilateral antes de los 8 años, sin evidencia de otros signos de pubertad(15).
Es relativamente frecuente, con una incidencia aproximada de hasta 21,2 casos por 100.000/año. En general, aparece antes de los 2 años y tiende a la regresión espontánea. Existe pico de presentación entre los 5 y 7 años, en estos casos se ha descrito mayor probabilidad de evolucionar a un cuadro de pubertad precoz central. Existen diferentes teorías sobre su etiología: Activación transitoria parcial del eje hipotálamo-hipofisario-gonadal con aumento de FSH. Fallo de la involución folicular con o sin formación ovárica quística. Sensibilidad excesiva del tejido mamario a la misma cantidad de estrógenos. Contaminantes ambientales (disruptores endocrinos) con actividad estrogénica. En telarquias exageradas se debe descartar la existencia de formas incompletas del síndrome de McCune-Albright.
En telarquias exageradas se debe descartar la existencia de formas incompletas del síndrome de McCune-Albright
La telarquia prematura aislada suele ser un proceso autolimitado que tiende a la regresión espontánea. No requiere tratamiento, aunque es recomendable realizar seguimientos periódicos hasta la desaparición de la misma.
Pubertad adelantada
Se considera cuando el desarrollo puberal se inicia entre los ocho y los nueve años en las niñas y entre los nueve y diez años en los niños, es una variante de la normalidad(16).
1. Aceleración constitucional del crecimiento y desarrollo: son niños/niñas con antecedentes familiares de pubertad temprana, su talla se sitúa en percentiles elevados de talla (>percentil 90-97), generalmente, por encima de la talla genética, con adelanto de la maduración ósea, con velocidad de crecimiento en percentiles elevados para edad y sexo de las tablas de referencia. Terminan su crecimiento antes que el resto y suelen alcanzar una talla acorde con la talla genética.
2. Obesidad: entre las niñas hay mayor riesgo de adelanto puberal, sobre todo en las que engordan a partir de los 6 años de edad. Se debe vigilar el adelanto de la pubertad en las niñas obesas teniendo en cuenta que puede ser difícil el diagnóstico diferencial entre una verdadera telarquia y adipomastia.
3. Adopción: las niñas adoptadas presentan mayor riesgo de pubertad precoz y pubertad adelantada que las niñas autóctonas del país.
Las niñas adoptadas presentan mayor riesgo de pubertad precoz y pubertad adelantada que las niñas autóctonas
del país
4. Antecedente de PEG: conviene revisar periódicamente en estos pacientes la posible aparición de adelanto puberal.
Conviene revisar periódicamente a los PEG por la posible aparición de adelanto puberal
Estos pacientes no precisan tratamiento, ya que no hay evidencia de que frenar la pubertad pueda mejorar la talla adulta. Si hay evidencia de que el brote puberal es mayor cuando se realiza antes.
Retraso constitucional del crecimiento y pubertad (RCCP)
El RCCP es una variante de la normalidad que constituye la causa más frecuente de retraso puberal, aproximadamente un 65% de los casos en niños y un 35% de las niñas
Se manifiesta en las niñas por ausencia de telarquia, a partir de los 13 años y, en los niños, por no objetivarse incremento del tamaño testicular (≥4 ml), a partir de los 14 años. Es una variante de la normalidad que constituye la causa más frecuente de retraso puberal, aproximadamente un 65% de los casos en niños y un 35% de las niñas(17). En su etiología destaca el componente genético (hasta en un 75% de las ocasiones existen antecedentes familiares).
Estos niños presentan unos datos antropométricos perinatales normales, con posterior desaceleración de la velocidad de crecimiento, en general, a partir de los 18 meses de vida, que les hace situar su talla por debajo del percentil tres o marcadamente por debajo de su talla genética, entre los dos y tres años de edad. Posteriormente su velocidad de crecimiento es normal, hasta la edad en que se inicia normalmente la pubertad, donde vuelven a presentar una desaceleración de la velocidad de crecimiento porque no inician el brote puberal. Presentan retraso de la edad ósea. Presentan un brote puberal tardío. En la mayoría de casos, suelen alcanzar su talla genética.
Aspectos psicosociales durante la adolescencia
Es sabido desde los trabajos de Piaget(18) que durante la adolescencia se pasa del pensamiento concreto al abstracto con proyección de futuro, característico de la madurez. Sobre los 12 años se alcanza el desarrollo cognitivo con capacidad de pensar en abstracto, a los 15-16 el desarrollo moral, saber lo que está bien y mal. Giedd en 2004(12) demostró, como hemos comentado, que hasta los 25-30 años no se alcanza el desarrollo completo de la corteza prefrontal, gracias a lo cual se adquiere la capacidad para discernir lo que conviene hacer (planificación, razonamiento y control de impulsos), es decir la maduración definitiva(19). Esto explica la implicación del joven, hasta entonces, en conductas de riesgo. A diferencia del adulto que tiene el lóbulo frontal totalmente desarrollado, un adolescente puede dejarse llevar por el primer impulso emocional de ira (amígdala) ante un compañero que le insulta y empezar una pelea, o comprometerse en conductas arriesgadas.
Aparte del importante crecimiento y desarrollo, los objetivos psicosociales a conseguir durante esta época son: lograr la independencia de los padres, tomar conciencia de la imagen corporal y aceptación del cuerpo. Establecer relaciones con los amigos así como la adopción de estilos de vida y eestablecer la identidad sexual, vocacional, moral y del yo (Ver Tabla 1).
Los objetivos psicosociales a conseguir en la adolescencia son: lograr la independencia de los padres, tomar conciencia de la imagen corporal. Establecer relaciones con los amigos así como la adopción de estilos de vida y establecer la identidad sexual, vocacional, moral y del yo
Valoración del desarrollo puberal y psicosocial en la consulta
Para conocer si es adecuado el desarrollo puberal y la evolución psicológica y social durante la adolescencia, es fundamental realizar una buena historia clínica y un completo examen
físico (2,19). Es importante la ayuda de la familia.
1. Anamnesis: En la entrevista con el adolescente se tendrá en cuenta de forma importante la confidencialidad, privacidad y establecer una buena relación de confianza con el joven, escuchando y observando.
• Además del motivo de consulta se abordarán todos los aspectos de la vida del adolescente. El acrónimo FACTORES (familia, amigos, colegio, tóxicos, objetivos, riesgos, estima y sexualidad) nos ayudara a recordar los aspectos a investigar.
Para la entrevista el acrónimo FACTORES (familia, amigos, colegio, tóxicos, objetivos, riesgos, estima y sexualidad) nos ayudara a recordar los aspectos a investigar
• Preguntar sobre su desarrollo psicosocial: independencia/imagen corporal/amigos/y su identidad sexual, vocacional, moral y del yo.
— Independencia de los padres: relaciones en casa, problemas, confianza
— Sobre su imagen corporal: cómo se ve, si le preocupa alguna parte de su cuerpo, si toma alguna medicación o hace algo raro con la alimentación
— Amigos: si es sociable, dificultad para relacionarse, que tal en el colegio (estudios, relaciones) si tiene pareja…
— Identidad: sentimientos, ánimo, valores, problemas y conductas de riesgo (drogas, sexo, TICs)
• Describir la secuencia de aparición de los caracteres secundarios
— Niño: ¿Desde cuándo ha notado el aumento del tamaño testicular? valorando la bolsa, la simetría de testículos; ¿Cuándo aumentó el tamaño del pene? ¿Cuándo se inició la axilarquia y la pubarquia? Valorar la curva de crecimiento.
— Niña: ¿cuando apareció la telarquia y si es fluctuante o progresiva, uni o bilateral?, ¿Si notó aumento sensibilidad en la zona areola? ¿Cuando apareció la pubarquia / axilarquia y si esta ha precedido o no a la telarquia? Valorar la curva de crecimiento si esta acelerada.
• Antecedentes personales: Embarazo, parto, datos antropométricos al nacer. Si hay antecedente de RN PEG, hay que investigar si tuvo un adecuado crecimiento o no fue así y precisó tratamiento con hormona de crecimiento. Conocer etnia, tiempo que lleva en España, si es adoptado, si hubo fertilización in vitro. Valorar la presencia de patología crónica. Realizar estudio nutricional, grado de actividad física y si hay distorsión de la imagen corporal. Valorar igualmente si el olfato es correcto.
• Antecedentes familiares. Descartar consanguinidad, etnia y país de los padres. Valorar la talla de los padres y la talla genética para comparar con los percentiles del hijo. Obtener los datos del desarrollo de los padres (menarquia madre, afeitado del padre). Si hay antecedente en mujeres de ovario poliquístico o de hirsutismo.
2. Examen físico completo teniendo en cuenta la intimidad y privacidad y dando un aire educacional, se recogerán:
Para el examen físico es necesario tener en cuenta la intimidad, privacidad y dar un aire educacional
Datos: Peso (percentil, DE), Talla (percentil, DE), IMC (percentil, DE), Tensión arterial (percentiles) velocidad crecimiento.
Inspección: fenotipo, vello, lesiones cutáneas (acné, manchas café-leche), bocio, telarquia, pubarquia, adipomastia, aumento tamaño bolsa escrotal.
Palpación: distinguir entre tejido glandular / adipomastia, tamaño y simetría testicular, bocio, megalias.
Auscultación cardiopulmonar y examen completo. Es necesario describir el estadio puberal de Tanner (figuras 1 y 2).
En los varones se debe valorar el tamaño testicular con el orquidómetro de Prader:
• < 4 Tanner I,
• >= 4 Tanner II,
• >= 8 Tanner III aunque lo marca el crecimiento de pene y vello;
• >= 12 coincide con Tanner IV
• >= 18-20 con Tanner V
Conclusión
La adolescencia y pubertad son procesos esenciales del desarrollo del ser humano. El papel del pediatra es prioritario ya que la mayoría de los problemas y procesos clínicos que aparecen pueden seguirse en Atención primaria pues, como vemos, no es necesario la realización de pruebas complementarias o tratamientos específicos salvo en las situaciones especiales descritas. No obstante se realizará la derivación a la atención especializada ante aquellos procesos de pubertad adelantada que progresa muy rápidamente, ante importante ansiedad familiar o del paciente, ante problemas psicosociales significativos y siempre que el profesional lo considere oportuno.
Tablas y figuras
Tabla I. Adquisición de objetivos psicosociales durante la adolescencia
|
Adolescencia inicial |
Adolescencia media |
Adolescencia tardía |
|
|
Independencia |
< Interés por padres Comportamiento/humor inestables |
> Conflicto con los padres, más tiempo amigos |
Reaceptación consejos/ Dudas para aceptarla |
|
Imagen corporal |
Preocupación por el Inseguridad Comparación |
Aceptación del cuerpo |
Aceptación cambios Imagen preocupa si anomalía |
|
Amigos |
Relaciones con amigos = |
> Integración amigos, |
< Importancia grupo < Experimentación > Relaciones íntimas |
|
Identidad |
> Capacidad cognitiva Intimidad Sentimientos sexuales No control impulsos |
> Capacidad intelectual > Sentimientos (otros) Omnipotencia … Conductas de riesgo |
P. Abstracto establecido Objetivos realistas Valores morales, Comprometerse y |
TCA: trastorno del comportamiento alimentario, CR: conductas de riesgo, (+ó ‐) aspectos positivos (deporte, relaciones…) y negativos (implicarse en conductas arriesgadas) P. abstracto: pensamiento abstracto
Figura 1. Eje hipotálamo-hipófiso-gonadal
Figura 2. Estadios de Tanner en la mujer.
Modificado de Muñoz Calvo MT, Pozo Román J. Pubertad normal y sus variantes. Pediatr Integral 2011; XV(6):507-518
Figura 3. Estadios de Tanner en el varón
Modificado de Muñoz Calvo MT, Pozo Román J. Pubertad normal y sus variantes. Pediatr Integral 2011; XV(6):507-518
Figura 4. Secuencia de eventos puberales en chicas.
Figura 5. Secuencia de eventos puberales en chicos.
Bibliografía
1. Basdemir D, Rogol AD. Maduración puberal. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (2ª edición). Madrid: Doyma; 2000. p. 843-66.
2. Hidalgo Vicario MI, Redondo Romero AM, Castellano Barca G, eds. Medicina de la adolescencia. Atención integral, 2.ª ed. Majadahonda, Madrid: Ergon, 2012.
3. Ojeda SR, Dubay C, Lomniczi A, Kaidar G, Matagne, Sandau US, et al. Gene networks and the neuroendocrine regulation of puberty. Mol Cell Endocrinol. 2010;324:3-11
4. Lomniczi A, Wright H, Ojeda SR. Epigenetic regulation of female puberty. Front Neuroendocrinol. 2015; 36C:
5. L. Soriano Guillen. Pubertad normal y variantes de la normalidad. Pediatr Integral 2015; XIX (6): 38
6. Muñoz Calvo MT, Pozo Román J. Pubertad normal y sus variantes. Pediatr Integral 2011; 15:507-518 0-388
7. Kaplowitz PB. Link between body fat and the timing of puberty. Pediatrics. 2008; 121: S208-17
8. Castellano JM, Tena-Sempere M. Metabolic regulation of Kisspeptin. Adv Exp Med Biol. 2013; 784: 363-83.
9. Parent AS, Teilmann G, Juul A, Skakkebaek NE, Toppari J, Bourguignon JP. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev. 2003; 668-93.
10. Ferrández Longás A. Estudio longitudinal de niños españoles normales desde el nacimiento hasta la edad adulta: datos antropométricos, puberales, radiológicos e intelectuales. Fundación Andrea Prader ISBN 609-3217-6, Zaragoza, 2005; 1-259 (EPI)
11. Carswell JM, Stafford DE. Normal physical growth and development. En: Neinstein LS, Gordon CM, Katzman DK, Rosen DS, Woods ER. Adolescent Health Care. A Practical Guide, 5.ª ed. Baltimore: Williams and Wilkins, 2008; 3-26.
12. Giedd. J. N. Structural magnetic resonance imaging of the adolescent brain. Annals of the New York Academy of Sciences, 2004, 1021, 77-85.
13. Tanner JM. Growth at adolescente. Oxford: Blackwell Scientific Publications Ltd; 1962. p. 37.
14. Williams RM, Ward CE, Hughes IA. Premature adrenarche. Arch Dis Child.2012; 97: 250-4.
15. Codner E, Román R. Premature thelarche from phenotype to genotype. Pediatr Endocrinol Rev. 2008; 5: 760-5.
16. Cassorla F, Codner E. Pubertad precoz y adelantada. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (2ª edición). Madrid: Doyma; 2000. p. 867-81.
17. Palmert MR, Dunkel L. Delayed puberty. N Engl J Med. 2012; 366: 443-53.
18. Piaget J. The intellectual development of the adolescent. En: Adolescence: Psychological perspectives. New York: Basic Books, 1969
19. MI Hidalgo Vicario. MJ Ceñal Gonzalez-Fierro. M. Güemes Hidalgo. Aspectos físicos, psicosociales y médicos. Principales cuadros clínicos. Medicine 2014; 11(61):3579-87