Proteinuria y hematuria
V. Martínez Suárez(1), S. Alperi García(2).
(1)Pediatra. Centro de Salud El Llano (Gijón).(2) UGC Pediatría. Hospital Universitario Virgen de las Nieves (Granada).
Fecha de recepción: 14 de octubre 2019
Fecha de publicación: 31 de octubre 2019
Adolescere 2019; VII (3): 22-35
Resumen
|
La hematuria y la proteinuria son hallazgos nefrourológicos comunes para el pediatra de Atención Primaria, sin requerir todos los niños las mismas investigaciones. Es importante confirmar primero su presencia y realizar una amplia anamnesis y exploración física, iniciando un proceso diagnóstico para excluir causas graves y diferenciar las manejables en centro de salud de aquellas que deben ser valoradas en el ámbito hospitalario. Su clasificación puede ser de gran ayuda para decidir qué exámenes complementarios son los más indicados en cada situación e investigar su etiología, dependiendo nuestra actuación de los medios disponibles y la proximidad de la unidad hospitalaria de referencia. La proteinuria se asocia con el desarrollo de enfermedad renal progresiva, siendo el factor aislado más significativo para determinar el avance y progresión de la nefropatía. La enfermedad renal es un posible diagnóstico y su evaluación resulta imprescindible. La hematuria es una de las manifestaciones más frecuentes de enfermedad nefrourológica, siendo necesario reconocer precozmente cualquier compromiso que necesite valoración especializada. Esta revisión proporciona un breve resumen de las causas más comunes de hematuria y proteinuria en pediatría, así como sugerencias para la evaluación y manejo de estos pacientes desde Atención Primaria.
Palabras clave: Hematuria; Proteinuria; Atención Primaria; Niños; Nefrología.
|
Abstract
|
Hematuria and Proteinuria are common findings for the primary care pediatrician, not requiring identical investigations in all children. It is important to confirm the diagnosis by first looking for the possible causes and performing an in depth physical examination. The rest of the evaluation is tailored according to the history and physical examination. The primary care pediatrician must learn to evaluate both aspects so as to differentiate patients who can be followed at primary care from those that should be assessed at the hospital level. Proteinuria is associated with progressive renal disease, being the most significant risk factor in the development and evaluation of renal injury. When proteinuria is present in the urinalysis, kidney disease is a possible diagnosis and its evaluation is needed. Hematuria is a common finding of renal tract disease. The detection of blood in a child ́s urine needs to be confirmed in a complete urinalysis with microscopic examination. Serious and treatable progressive conditions need to be identified and differentiated. This review will discuss the major causes of hematuria and proteinuria in the pediatric population, providing a brief summary of the most common causes and suggestions for a rational approach to the patient´s evaluation and management in primary care.
Key words: Hematuria; Proteinuria; Primary care; Children; Nephrology.
|
El pediatra general debe saber hacer una evaluación básica de la mayoría de los trastornos nefrourológicos. Para ello, además de estar familiarizado con los síntomas y signos relacionados con las principales patologías, ha de conocer qué pruebas puede realizar y en qué momento deben ser solicitadas, interpretando correctamente sus resultados(1).
La hematuria y la proteinuria son problemas frecuentes y el pediatra general debe conocer su evaluación inicial y orientar su manejo
La mayoría de los pediatras de Atención Primaria tienen en su consulta tiras de orina, bolsas recolectoras, sondas y material para obtención de una muestra de orina en condiciones adecuadas; tienen acceso a los estudios de imagen de primera línea y a las pruebas de laboratorio necesarias para la confirmación diagnóstica y valoración de la gravedad de los principales síndromes nefrourológicos. Aunque cuando se enfrentan a un niño con datos de una
posible alteración renal o de las vías urinarias suelen o bien enviarlo a una unidad hospitalaria sin realizar investigación alguna, o iniciar un proceso diagnóstico sistematizado que puede rendir la información necesaria para excluir causas graves y precisar aquellas que en teoría podrían ser manejadas desde el centro de salud. De ambas actitudes, esta última es la más lógica y resulta menos gravosa; por tanto, la que debemos de plantearnos.
El análisis de orina combinado con una anamnesis y exploración física exhaustiva indica en muchos casos la causa de la hematuria y proteinuria en el niño
En todo caso, nuestra actuación también va estar condicionada por los medios disponibles y por la proximidad de una unidad hospitalaria de referencia. Es necesario recordar algunos puntos sobre las muestras de orina que pueden evitar errores frecuentes. Su obtención se realizará en condiciones adecuadas (sin modificaciones de horarios ni de dieta y en recipiente especial), con un procesamiento (conservación, marcado y envío) bien organizado y en los tiempos requeridos (de acuerdo con el laboratorio de nuestro hospital de referencia). Casi todos los estudios básicos de orina se pueden completar a partir de una muestra de 10 ml. La recogida de orina de 24 horas debe ser considerada por el pediatra general como una prueba de segunda línea y aplicable de forma ambulatoria exclusivamente en el niño mayor y dentro de un ambiente familiar favorable. Cuando dentro de los estudios se quiera valorar algún parámetro sanguíneo la extracción debe de ser simultánea a la recogida de la muestra de orina.
Proteinuria
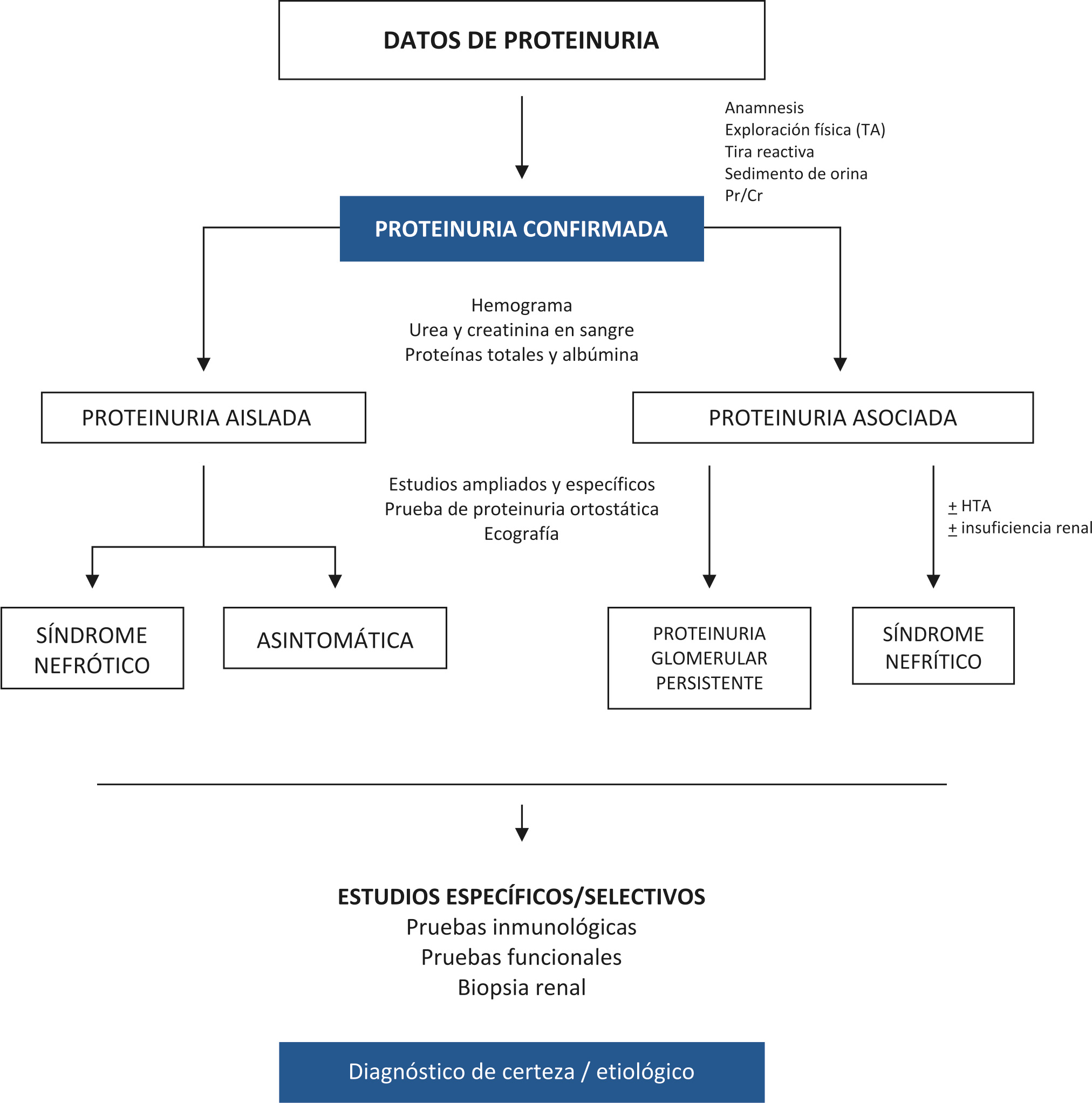
La proteinuria debe considerarse como un marcador de lesión renal y constituye uno de los datos clínicos más importantes para el nefrólogo; es, además, el factor aislado más significativo para determinar el avance y progresión de la nefropatía. Existen proteinurias aisladas, las cuales no siempre se asocian con disfunción renal patológica, como lo es la proteinuria ortostática, que no requiere más que un seguimiento periódico; y proteinurias asociadas, producto de alguna disfunción renal o sistémica, como lo es un síndrome nefrótico, que pueden necesitar la valoración o internamiento hospitalario para estimar la afectación del estado general y descartar posibles complicaciones, incluido el progreso hacia un fallo renal.
La presencia de hematuria y proteinuria asociadas aumenta la probabilidad de enfermedad renal significativa, siendo necesario la derivación a un especialista o centro de referencia
Definición de la proteinuria
La proteinuria puede objetivarse y estudiarse desde tres niveles(1,2).
Cualitativamente. La presencia de albúmina en la orina en cantidad excesiva indica glomerulopatía o defecto en su reabsorción tubular, pero en este último caso existirá aumento en mayor medida de otras proteínas como la β-2 microglobulina. Es útil, en esta situación, analizar la relación entre albúmina y β-2 microglobulina urinarias (mg/mg). Los valores normales de este cociente se encuentran entre 30 y 200. Valores menores a 30 corresponden a proteinurias tubulares, mientras que en las proteinurias glomerulares dicho cociente alcanza valores entre 1.000 y 15.000. Sin embargo, la intensidad de la proteinuria glomerular no siempre tiene una buena correlación con el grado de lesión, de modo que una proteinuria de rango nefrótico puede corresponder a lesiones glomerulares mínimas y una proteinuria de rango no nefrótico puede corresponder a lesiones glomerulares avanzadas.
Semicuantitativamente. La proteinuria de 24 horas se puede estimar a partir de una sola micción, evitando el problema que supone la recolección de orina de 24 horas en pacientes de corta edad.
El método más extendido, sencillo y asequible es la tira reactiva, que detecta fundamentalmente albúmina. Tiene elevada especificidad pero es menos sensible que los métodos cuantitativos. Sus principales limitaciones son los falsos negativos en orinas muy diluidas y falsos positivos en orinas muy concentradas, con pH alcalino o tras el uso de desinfectantes. Tiene una buena correlación con el cociente urinario albúmina/creatinina. La muestra de orina más fiable y menos sujeta a variaciones es la orina de la noche (primera micción de la mañana) (Tabla I).
La eliminación urinaria de albúmina en niveles no detectables por métodos de laboratorio habituales semicuantitativos constituye la llamada microalbuminuria. En niños pueden considerarse como valores normales cifras inferiores a 46 (mg/g) en menores de 2 años y a 33 (mg/g) en mayores de 2 años(3).
La importancia práctica de la determinación de este índice radica en su especificidad como indicador de lesión glomerular(4).
Cuantitativamente. Consiste en medir la cantidad de proteínas eliminadas por unidad de tiempo. Para evitar la aportación de la proteinuria ortostática se prefiere la medida a partir de las 12 horas de sueño. La cantidad de proteína obtenida (en miligramos) se divide entre el número de horas que duró la recolección y se relaciona con la superficie corporal (en m2), considerándose como valor normal el inferior a 4 mg/m2/hora (en todo caso menor de 150 mg/día), como proteinuria moderada 4-40 mg/m2/hora; y proteinuria masiva o de rango nefrótico por encima de 40 mg/m2/ hora(3).
La proteinuria confirmada cualitativa y semicuantitativamente ha de ser cuantificada e interpretada en el contexto general del paciente
La medida del cociente albúmina/creatinina o de proteína/creatinina en una muestra aislada de orina ofrece una estimación adecuada de su excreción en orina de 24 horas y se utiliza de manera fiable como método diagnóstico y de seguimiento de la proteinuria en niños(5) (Tabla II).
De valor complementario es el estudio de la selectividad de proteinuria, realizada midiendo la depuración de 2 proteínas de diferente peso molecular: transferrina (88.000 Da) e inmunoglobulina G (160.000 Da). Se determina la concentración de ambas en orina y plasma y se calcula el índice de selectividad o cociente entre los aclaramientos de IgG y transferrina. Esta prueba sirve para estimar la selectividad del filtro glomerular en relación al tamaño de las moléculas que permite su paso al espacio de Bowman. Su valor normal es menor de 0,1 (indica buena selectividad); de 0,1 a 0,2 indica mediana selectividad y mayor de 0,2 indica pobre selectividad. El síndrome nefrótico con proteinuria de buena selectividad generalmente es corticosensible y se asocia con lesiones glomerulares mínimas. Cuando la selectividad es baja responde peor al tratamiento y se suele asociar a lesiones glomerulares complejas(1,4).
Clasificación fisiopatológica(2,6,7)
Tal como se ha referido, la proteinuria se puede dividir en dos grandes grupos: la proteinuria aislada (no asociado a patología renal o sistémica) y la proteinuria asociada (evidencia de patología renal o sistémica), cada uno asociado a diferentes entidades clínicas (Tabla III).
Proteinurias aisladas
Proteinuria funcional
Es una forma común de proteinuria que se presenta asociada a la fiebre, ejercicio excesivo, exposición al frío, el estrés emocional, las convulsiones e inclusive al embarazo normal. No existen defectos renales intrínsecos. Es causada por cambios hemodinámicos que favorecen un aumento en la filtración glomerular de las proteínas plasmáticas, se suele resolver espontáneamente en unos días y no se asocia con patología renal progresiva.
Proteinuria transitoria idiopática
Este tipo de proteinuria es bastante frecuente en niños, adolescentes y adultos jóvenes. Representa la variedad más común de las proteinurias benignas. Estos pacientes son asintomáticos y generalmente se descubre casualmente en algún examen de control o en estudios de tamizaje, considerados hoy sin justificación en su utilidad clínica.
Proteinuria intermitente idiopática
Los pacientes con este tipo de proteinuria benigna presentan proteinuria independiente de la posición corporal en al menos un 50% de las muestras de orina recogidas al azar, pero no en todas. La mayoría de los pacientes son jóvenes y presentan exámenes de función renal normal. Estudios de seguimiento de hasta 40 años han mostrado que la evolución de estos pacientes, en ausencia de enfermedades sistémicas asociadas, es bastante buena y no difieren de la de la población general. Al ser la progresión a la insuficiencia renal poco probable se recomienda un seguimiento anual en Atención Primaria.
Proteinuria ortostática (postural)
Es la variedad de proteinuria benigna mejor estudiada. En esta entidad la excreción proteica es mayor al estar de pie que al estar acostado: las personas con proteinuria ortostática no presentan proteinuria cuando están echadas (tras el descanso nocturno), lo que resulta decisivo en el diagnóstico y permite diferenciarla del verdadero nefrópata que sí presentan proteinuria al estar en esa posición. Afecta principalmente a los adolescentes y rara vez se diagnostica en pacientes mayores de 30 años. Existen dos variedades: 1-transitoria, la cual solo se evidencia en unas cuantas oportunidades, y probablemente corresponde a una proteinuria funcional; y 2- persistente, la cual se presenta a lo largo de los años y generalmente mejora y desaparece con el crecimiento, durante la adolescencia. Los cambios hemodinámicos asociados a este tipo de proteinuria corresponden a dos modelos: 1) los pacientes que presentan una hipersensibilidad hacia la vasoconstricción arteriolar mediada por la angiotensina II, y 2) una compresión física de alguna de las venas renales (principalmente la izquierda), de manera que se pueda producir una sobrecarga en un riñón ya predispuesto (estos casos se corresponden con biopsias renales en las que se observan depósitos de C3/C4).
Proteinuria aislada persistente
Corresponde a un grupo de pacientes con proteinuria en todas o casi todas las muestras tomadas al azar, sin importar su posición (de pie / acostado), que no presentan patología asociada o alteraciones en las pruebas de función renal. Se manifiesta en niños, adolescentes y adultos jóvenes, y existe una preponderancia masculina. Algunos estudios han mostrado que hasta un 60% tienen una alteración renal histológica de tipo mínimo. Actualmente no existen estudios a largo plazo que permitan definir su evolución, y al comprender un grupo heterogéneo que pudiera presentar grandes variaciones en la etiología se recomienda un seguimiento periódico.
Proteinuria asociada
Proteinuria no nefrótica
Se deben considerar en este grupo patologías tubulointersticiales y vasculares como la nefritis intersticial, la nefropatía por reflujo, el riñón poliquístico, la nefropatía medicamentosa (AINES/aminoglucósidos), exposición a metales pesados y las nefropatías asociadas a hipercalemia e hiperuricemia. También debe recordarse que la necrosis tubular aguda puede llevar a proteinuria masiva. Algunas enfermedades sistémicas como el lupus eritematoso sistémico y las discrasias sanguíneas, pueden producir estas proteinurias. También ciertas enfermedades congénitas con nefropatía, como la cistinosis, enfermedad de Wilson, la enfermedad de Fanconi y la anemia de células falciformes. La microalbuminuria, como variedad de proteinuria glomerular se puede detectar precozmente en los pacientes diabéticos y se puede usar como un marcador pronóstico de la nefropatía diabética en pacientes insulino-dependientes. La proteinuria tubular suele ser de tipo ligera-moderada y se caracteriza por presentar proteínas de bajo peso molecular, principalmente las beta2-microglobulinas y otras como las lisozimas e insulina. En la fisiopatología de la proteinuria tubular la albúmina tiene un papel secundario. Finalmente, la proteinuria por sobrecarga se presenta cuando hay un aumento importante en la concentración plasmática de proteínas, como en la hemoglobinuria por anemia hemolítica y la mioglobinuria en la rabdomiolisis severa, además de en ciertas enfermedades menos frecuentes.
Proteinuria nefrótica
El síndrome nefrótico se caracteriza por una tétrada diagnóstica: proteinuria masiva, hipoalbuminemia, edema e hiperlipidemia. La gran pérdida urinaria de proteínas lleva a la hipoalbuminemia y esta a los edemas e hiperlipidemia, lo cual predispone al paciente a eventos tromboembólicos, disfunción renal tubular y mayor susceptibilidad a las infecciones. Si hay presencia de un sedimento urinario persistentemente anormal se debería tener en cuenta la presencia de una glomerulonefritis primaria o secundaria a enfermedades sistémicas tipo lupus eritematoso o vasculitis, aunque el lupus sistémico ocasionalmente se asocia con glomerulonefritis membranosa y proteinuria sin sedimento. Cuando se han descartado otras posibilidades de glomerluopatías secundarias, como amiloidosis, nefrotoxicidad e inclusive hipertensión prolongada desconocida, se debe pensar en enfermedad glomerular primaria. La glomerulonefritis membranosa, la glomerulosclerosis focal segmentaria y la nefrosis lipoidea (o de mínimos cambios) son las causas primarias más comunes, especialmente esta última. La nefropatía por IgA también puede presentarse con proteinuria nefrótica, aunque la hematuria es lo más llamativo en este síndrome, a veces manifestándose de forma recurrente.
El síndrome nefrótico se caracteriza por una tétrada diagnóstica: proteinuria masiva, hipoalbuminemia, edema e hiperlipidemia
Tratamiento
No disponemos de un medicamento que actúe directamente y de forma específica sobre la proteinuria, pero el control de las patologías de fondo puede modificar el nivel de proteinuria. En los casos de pérdida significativa de proteínas se recomienda una dieta con entre 40 y 60 g de proteínas al día; para los edemas se sugiere la restricción sódica y el uso de diuréticos. Se debe valorar el empleo de estatinas para la dislipidemias; y en pacientes con hipoalbuminemia importante es preciso considerar la profilaxis de anticoagulación. Debe controlarse la presión arterial, utilizando si fuera necesario furosemida (oral o iv, a veces simultáneamente a la perfusión de albúmina), inhibidores de la enzima convertidora de la angiotensina o bloqueadores de los receptores de angiotensina II. En patologías autoinmunes con glomerluopatia se han utilizado diferentes tratamientos imunosupresores con respuestas variables.
La hematuria -emisión simultánea de sangre y orina durante la micción- es una de las manifestaciones más frecuentes de enfermedad nefrourológica y puede originarse en cualquier lugar de la vía urinaria, desde el glomérulo hasta el meato uretral. Sus connotaciones diagnósticas y pronósticas pueden ser muy diferentes, por lo que la presencia en nuestra consulta de un niño con sospecha de hematuria siempre representa un reto asistencial.
Su incidencia y prevalencia varían según se trate de estudios de despistaje o de series casuísticas, del tipo de población estudiada, edad de los pacientes y sexo. Esto hace que los datos publicados no sean fácilmente comparables. Pero hoy en día, las pruebas generalizadas e indiscriminadas de cribado de enfermedad renal no están justificadas en ningún caso. Estas, por tanto, deben realizarse sólo de forma dirigida cuando existan factores familiares o individuales de riesgo y ante la sospecha de enfermedad.
Planteamiento general
Desde el punto de vista etiológico, la hematuria puede estar relacionada con una gran variedad de patologías, urológicas o nefrológicas, benignas o potencialmente graves. No todos los niños con hematuria, por tanto, precisarán las mismas investigaciones, debiendo orientarse las pruebas diagnósticas a partir de una historia clínica completa, estructurada y adaptada a las características del caso.
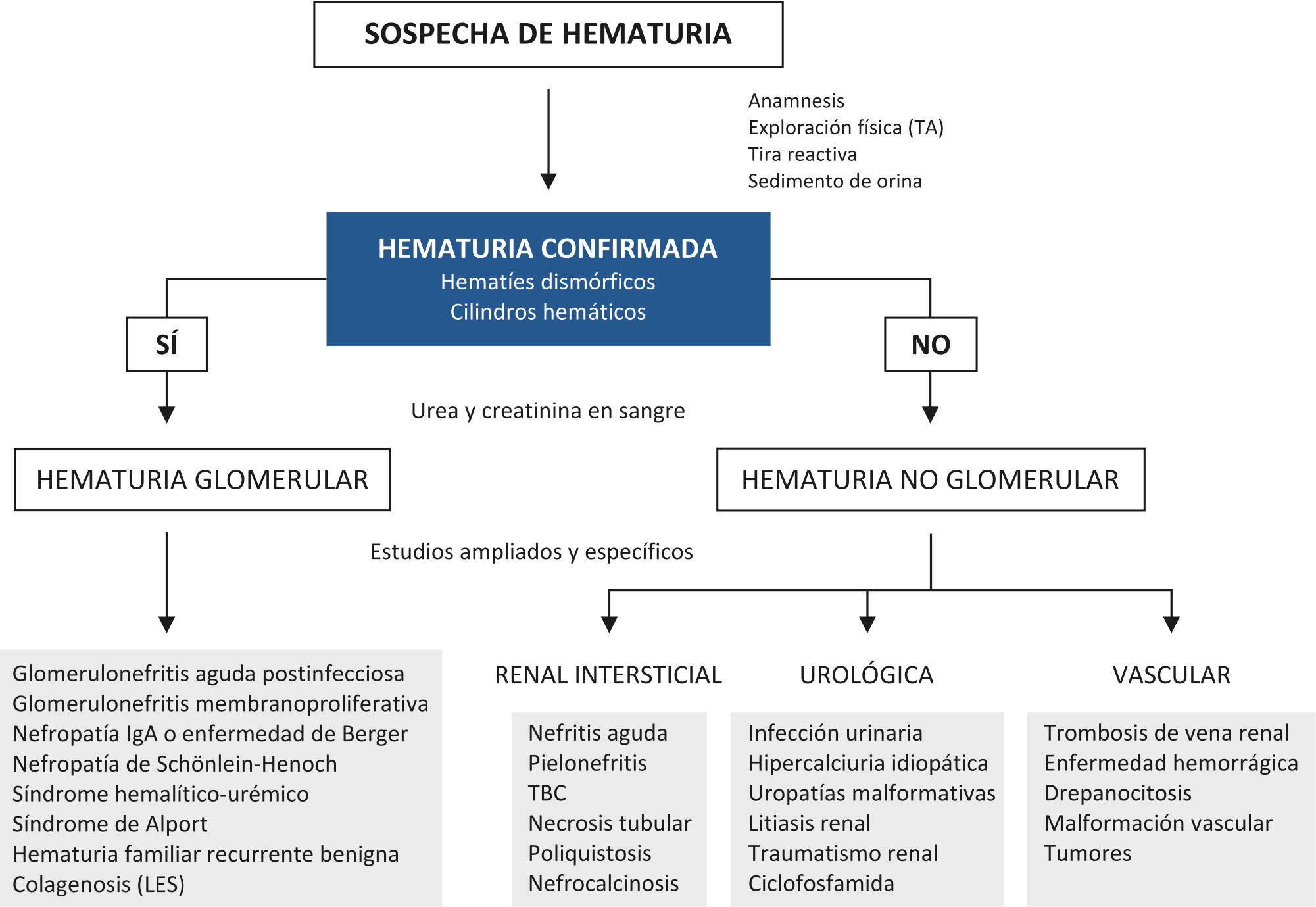
Así, ante un niño con sospecha de hematuria debemos plantearnos la verificación de tres pasos sucesivos: confirmación de la hematuria; reconocimiento precoz de cualquier compromiso nefrourológico o sistémico que aconseje su valoración especializada; y de no ser necesaria su remisión a una unidad de nefrología pediátrica, localizar anatómicamente su origen (glomerular o no-glomerular) y avanzar lo más posible en el diagnóstico etiológico.
Confirmación de la hematuria(8)
El número de hematíes que se pueden encontrar en la orina en situaciones normales no debe ser superior a 3 por campo microscópico de alta resolución, más de 5/mm3 de orina fresca y centrifugada o más de 5000/minuto en el recuento de Addis. Por encima de esos valores hablamos de hematuria, que puede ser macroscópica (detectable a simple vista, casi siempre > 500.000 hematíes/mm3) o microscópica (identificada mediante tira reactiva o estudio del sedimento urinario en el microscopio)(1,9-11).
El número de hematíes que se pueden encontrar en la orina en situaciones normales no debe ser superior a 3 por campo microscópico de alta resolución, más de 5/mm3 de orina fresca y centrifugada o más de 5000/minuto en el recuento de Addis
El niño con hematuria macroscópica suele consultar espontáneamente por el aspecto de sus orinas, mientras que la existencia de hematuria microscópica suele identificarse durante la realización de un estudio de la orina en un niño que consulta por alguna manifestación de enfermedad, tenga o no esta causa nefrourológica. Ante una orina con sospecha de contener sangre, por tanto, nuestra primera valoración suele ser el examen visual o directo (uroscopia), que incluye la observación del color y aspecto de la muestra (permitiendo identificar la presencia de sangre, coágulos, turbidez, posos, etc.). Debemos recordar que orinas turbias sin sangre se pueden observar en las leucociturias intensas, exceso de fosfatos en orinas alcalinas y saturación por uratos; y que la orina oscura y espumosa es sugerente de proteinuria y reflejo de patología glomerular. Y que la hematuria macroscópica “marrón”, con aspecto de agua de té o coca-cola, debe hacernos pensar en una enfermedad glomerular, que puede presentar como manifestaciones concomitantes proteinuria, hipertensión arterial (HTA), edema o azotemia. Por el contrario, la macrohematuria de origen extrarrenal suele ser rojo brillante y puede asociarse a coágulos sanguíneos.
No obstante, la señal más frecuente de la presencia de sangre es la observación de una tira de orina alterada. Este procedimiento -de fácil manejo, bajo coste y alta fiabilidad- se basa en la actividad peroxidasa de la hemoglobina y mioglobina para catalizar la conversión del peróxido de hidrógeno y el cromógeno tetrametilbenzidina en cromógeno oxidado de color verde-azul. Las tiras pueden detectar concentraciones de 5-10 eritrocitos intactos por microlitro, que se corresponden con 2-5 por campo de microscopía de alto poder de resolución. De forma semicuantitativa permiten estimar la intensidad de la hematuria (entre 0 y 4 cruces en las más usadas), considerándose significativas las determinaciones de más de una cruz (2 o superior). Aunque pueda ser cosa ya sabida, hay que insistir en que la tira debe ser completamente impregnada en su porción funcional, limpiar el exceso de orina y realizar la lectura en el tiempo recomendado en su prospecto de instrucciones. La demora en su lectura y contaminación con ciertas sustancias cromógenas dará lugar a lecturas falsamente positivas. También la sangre menstrual y la orina muy alcalina pueden dar resultados falsamente significativos. El valor de este procedimiento, no obstante, es altísimo ante un niño que se presenta en nuestra consulta con “orinas oscuras” o de aspecto “anormal”, ya que permite descartar determinadas sustancias que colorean la orina y pueden aparentar una hematuria (Tabla IV). Un resultado positivo obliga siempre a su confirmación mediante el estudio del sedimento(9-12).
Anamnesis y exploración dirigidas
Junto a las tiras reactivas y al motivo de consulta específico, las pruebas o estudios a realizar han de ser siempre orientados por la historia clínica (Tabla II), investigando en primer lugar la presencia de antecedentes personales o familiares de riesgo, como traumatismos o ejercicio intenso, ingesta de ciertos fármacos (anticoagulantes, ciclofosfamida), hidronefrosis prenatal, infecciones de orina (ITU), o litiasis y enfermedades metabólicas o renales en padres, hermanos y parientes próximos. Tendremos que investigar la existencia de síntomas irritativos o dolor, y realizar una exploración general y nefrourológica completa, que debiera incluir la toma de tensión arterial en forma adecuada (trasladada a percentiles correspondientes a su sexo y talla), verificación de la presencia de edemas, palidez o lesiones en la piel (púrpura, petequias), dolor abdominal o lumbar, y palpación abdominal detenida en busca de posibles masas o megalias. Debemos buscar signos de enfermedades sistémicas con repercusión renal, señales de traumatismos, genitales anormales, indicios de abuso y cuerpos extraños en las niñas.
Ante una hematuria aislada debemos buscar signos de enfermedades sistémicas con repercusión renal, señales de traumatismos, genitales anormales, indicios de abuso y cuerpos extraños en las niñas
Falsas hematurias
La presencia de hematuria no significa necesariamente la confirmación de una situación patológica, ya que estados febriles y esfuerzos violentos o continuados por parte del niño pueden originar hematurias denominadas fisiológicas. Es importante también tener presente la relación de alimentos y medicamentos que pueden teñir la orina de color más o menos rojizo, dando lugar a pseudohematurias o “falsas hematurias”. Son sustancias endógenas que pueden teñir la orina, la mioglobina liberada por el músculo en el curso de alteraciones metabólicas (rabdomiolisis, hipopotasemia, hipofosfatemia), infecciosas (legionelosis, gripes), traumatismos o quemaduras; la hemoglobina que se puede liberar tras la lisis intravascular de los glóbulos rojos en el curso de una crisis de anemia hemolítica (hemoglobinurias); y otros pigmentos como porfirinas, melanina, uratos y ácido homogentísico que plantean a veces dudas diagnósticas en la valoración inicial de unas orinas “oscuras”. Pigmentos exógenos, como las anilinas, que colorean la orina de naranja y pueden hacernos pensar en la presencia de una hematuria, igual que pigmentos naturales de algunos alimentos que alteran el aspecto de la orina y pueden generar alguna confusión. Entre ellos, la remolacha (coloración rosada), las moras (rojiza), ruibarbo (roja en orinas alcalinas) y la paprica y otras pimientas (naranja). También pueden remedar una verdadera hematuria determinados productos medicamentosos, como antiinflamatorios (salicilatos, ibuprofeno), la nitrofurantoína, las sulfamidas, metronidazol y rifampicina; fármacos usados para tratar la lepra como la clofacina, de escasa utilización en niños; antipalúdicos, como la quinina; laxantes (dapsona, cáscara sagrada, fenolftaleína, sen), fenotiazinas (especialmente la clorpromacina), la metildopa, la fenindiona (anticoagulante), antiepilépticos como la fenitoína, antitumorales (adriamicina, azatioprina, doxorubicina) y relajantes musculares como el metacarbamol o la clorzoxazona.
Es importante también tener presente la relación de alimentos y medicamentos que pueden teñir la orina de color más o menos rojizo, dando lugar a pseudohematurias o “falsas hematurias”
Estudios complementarios básicos
El examen sistemático automatizado nos permitirá contar el número de hematíes presentes en la orina, así como tener información sobre cualquier otra alteración que nos ayude a interpretar la hematuria y dirija el plan de actuación; por ejemplo, la densidad urinaria, la presencia de proteínas, de leucocitos y nitritos. Pero será el examen microscópico de la orina centrifugada el que nos aportará información decisiva. El análisis citológico es sencillo y realizado mediante microscopía de contraste de fases y por un observador experimentado permite establecer una presunción diagnóstica en la mayoría de casos. Permite, así, establecer la distinción entre una hematuria de origen glomerular (nefrológica) y de origen urológico (no glomerular), condicionando los pasos posteriores. La hematuria glomerular se caracteriza por la presencia de hematíes de diferentes tamaños, dismórficos y de contornos irregulares; y el resultado se considera según sean más del 80% de los hematíes normales (no glomerular) o presenten alteraciones más del 80% (origen renal o glomerular). Más concluyente aún puede ser la obtención mediante autoanalizador de curvas de distribución volumétrica de los hematíes presentes en la orina, con curvas irregulares y asimétricas. También se considera indicador de patología glomerular con cien por cien de sensibilidad y especificidad la observación de más de un 5 por ciento de hematíes dismórficos tipo G1, que adoptan forma de “donut” con una o más gemaciones. Junto a esta valoración de las características de los hematíes el microscopio nos puede informar de la presencia de cilindros hemáticos, que indican también patología glomerular. Además, el número de cilindros con hematíes se considera un dato de valor pronóstico de la hematuria, ya que se ha correlacionado con el de crescentes epiteliales en la biopsia renal; por lo que un número elevado de eritrocitos en orina (>500.000/minuto) acompañado de una cantidad elevada de cilindros hemáticos puede indicar la presencia de crescentes glomerulares y recomendar la realización de biopsia. Otros signos recogidos del examen microscópico pueden resultar útiles para orientar o apoyar el diagnóstico, como el hallazgo de leucocitos (ITU, nefritis intersticial), bacterias (ITU), proteínas o cristales (hiperuricosuria, litiasis por cálculos de fosfatos, cálcicos o de cistina).
Estudios ampliados
Una aproximación más amplia al niño con hematuria puede hacer necesario un estudio sanguíneo con un hemograma y reactantes de fase aguda (participación sistémica), bioquímica básica (estudio de la función renal y alteraciones metabólicas), estudios inmunológicos ante la sospecha de glomerulonefritis (inmunoglobulinas totales y sus clases, fracción C3 del complemento, ASLO, anti-DNAasa B) o lupus eritematoso sistémico con participación renal (C3, ANA). Aquellos niños con hematuria persistente y proteinuria moderada/masiva, elevación de la creatinina plasmática, descenso de C3 prolongado (superior a 10 semanas) o HTA debieran ser remitidos de forma urgente o preferente a una unidad de nefrología pediátrica para control, realizar estudios específicos, para su seguimiento o practicar una biopsia y estudios anatomopatológicos que puedan precisar el diagnóstico y orientar el tratamiento (Tabla V). Paralelamente debe solicitarse una ecografía renal y de vías urinarias que puede evidenciar la existencia de aumento de tamaño y densidad del parénquima renal que nos informe sobre un proceso inflamatorio glomerular y descartar, entre otras, patologías tumorales.
Principales categorías diagnósticas(8)
Una vez que la presencia de hematuria se confirma es necesario disponer de pautas de actuación que partiendo de categorías clínicas sencillas orienten el diagnóstico etiológico. Desde un punto de vista práctico, la hematuria puede presentarse bajo tres patrones definidos, con características específicas desde los puntos de vista pronóstico y terapéutico: 1. Hematuria macroscópica; 2. Hematuria microscópica aislada, detectada en muchas ocasiones de forma casual; 3. Hematuria microscópica asociada, ya sea con sintomatología urinaria o sistémica y/o presencia de proteinuria.
Hematuria macroscópica
La valoración de la hematuria macroscópica confirmada difiere significativamente de la microscópica. Su prevalencia se ha estimado en el 0,13%, según datos retrospectivos de un servicio de urgencias y publicados por Ingelfinger y cols. Estos niños suelen consultar por orinas oscuras sin otra clínica o con síntomas sugerentes de infección (disuria, dolor abdominal, frecuencia o urgencia). En algunos casos es posible recoger antecedentes familiares de litiasis renal. En una valoración etiológica aproximativa debemos tener en cuenta que la mayoría de los casos pueden deberse a una causa fácilmente reconocible o aparente (56% en la citada serie), siendo la infección de orina la más frecuente (26%). Entre las menos evidentes o que precisaron medios diagnósticos especiales se citan la hematuria macroscópica recurrente, nefritis agudas, obstrucción pieloureteral, cistitis quísticas y tumores; pero 23% fueron etiquetadas de “ITU sin confirmar” y 9% como de etiología desconocida. Es posible que muchas de esas “ITU sin confirmar” se correspondan con cistitis hemorrágicas por adenovirus, tal como ha sido descrito por Mufson y cols. Otras hematurias macroscópicas sin filiar se han relacionado con hipercalciuria idiopática y hiperuricosuria, y según algunas series recientes es posible que un número elevado de las mismas puede atribuirse a estos dos trastornos.
La ausencia de diagnóstico definitivo tras la valoración inicial (anamnesis, exploración física, urinocultivo, elemental y sedimento de orina con calcio/creatinina) debe conducirnos al despistaje clínico y analítico de causas potencialmente graves de origen glomerular (glomerulonefritis aguda, púrpura de Schönlein-Henoch, síndrome hemolítico urémico, glomerulonefritis membranoproliferativa, nefropatía IgA y glomeruloesclerosis segmentaria y focal). Pero en el diagnóstico diferencial deben incluirse los defectos de la membrana basal glomerular, urolitiasis asintomática, drepanocitosis, malformaciones vasculares y otras patologías vesicales.
La valoración inicial de una hematuria debe conducirnos al despistaje clínico y analítico de causas potencialmente graves de origen glomerular
Hematuria microscópica aislada(14)
A diferencia de la hematuria macroscópica, suele ser un hallazgo casual. En un gran número de ocasiones traduce un fenómeno transitorio, lo que para la mayoría de los autores justifica retrasar toda evaluación clínica de carácter etiológico durante un período tan prolongado como hasta dos años, en los que no debe realizarse más intervención que el seguimiento regular mediante la exploración física, la toma de tensión arterial y el estudio sistemático y de sedimento urinario. En caso de persistir más de un año podría solicitarse su valoración por la unidad de nefrología pediátrica de referencia.
La forma microscópica aislada es la causa más frecuente de hematuria y casi siempre benigna, aunque exige un control clínico y analítico a veces prolongado
La hipercalciuria idiopática y las enfermedades hematúricas familiares o genéticas (Alport, enfermedad de la membrana basal fina) son la causa más frecuente de hematuria microscópica asintomática. Aunque existe una amplia lista de otras causas de hematuria microscópica aislada, un número importante son etiquetadas de idiopáticos. En su valoración el rendimiento diagnóstico de los exámenes complementarios, como creatinina y sedimento sérico, cistografía y cistoscopia son bajos, por lo que no se deben realizar más que en casos muy limitados. Más dudas puede plantear la posibilidad de practicar una ecografía abdominal, pues varios autores no encontraron más allá de un 6% de anomalías nefrourológicas asociadas (en muchas ocasiones con dudosa relación con la hematuria), el efecto tranquilizador de los padres y la capacidad de los modernos aparatos para identificar la presencia de microlitiasis en los cálices renales, pueden ser suficiente para justificar su indicación. La realización de una biopsia renal en ausencia de hematuria familiar, afectación de la función renal, proteinuria o hipertensión, en muy raras ocasiones añadiría información clínica de interés en relación al diagnóstico y pronóstico(15).
Hematuria microscópica con otras manifestaciones de enfermedad
Deben ser incluidos en este grupo aquellos niños con hematuria microscópica y manifestaciones sistémicas de enfermedad (fiebre, anemia, astenia, hipertensión arterial), manifestaciones localizadas (exantema, artritis, dolor abdominal) o acompañada de signos y síntomas de afectación nefrourológica, como síntomas miccionales, masa renal o proteinuria. Cada una de estas situaciones debe ser evaluada atendiendo a la expresividad clínica, llevando la profundidad de los estudios hasta donde aconseje el estado del paciente, el apremio de aclarar la duda diagnóstica y la propia experiencia del pediatra.
La presencia de hematuria microscópica con proteinuria significativa (superior a dos cruces en la tira o proteína/creatinina > 0,2) debe ser considerada con especial interés, ya que esta situación traduce siempre afectación glomerular que puede requerir una evaluación exhaustiva y a veces inmediata. Aunque los individuos normales pueden excretar pequeñas cantidades de proteína en orina, su presencia elevada y/o persistente debe considerarse un marcador de lesión renal y a la vez causa de daño renal progresivo. Debe recordarse que la intensidad de la proteinuria observada se correlaciona negativamente con su desaparición y de forma positiva con la existencia de enfermedad renal significativa.
Por el contrario, en un grupo importante de casos se ha observado que ambos signos tienden a remitir de forma espontánea, por lo que en los casos de hematuria-proteinuria leve sin otra clínica parece recomendable la repetición del sistemático y sedimento en varias ocasiones (por ejemplo, cada 3 semanas 3 ó 4 veces) antes de ser enviado a la consulta especializada. La nefropatía IgA y la glomerulonefritis aguda postinfecciosa son las dos entidades que veremos más frecuentemente asociando hematuria microscópica y proteinuria.
Principales entidades clínicas que pueden cursar con hematuria(8,11)
El conocimiento de los trastornos más frecuentes que se acompañan de hematuria y la cuenta de sus características clínicas definitorias nos ayudarán a orientar las pruebas a realizar y a precisar el diagnóstico (Tabla VI).
Causas glomerulares
Enfermedad de Berger
En su forma clásica se presenta como hematuria macroscópica recurrente, ocasionalmente con proteinuria de grado variable, en un varón (3 niños/niña) de entre 5 a 15 años. La hematuria aparece típicamente tras un episodio de infección aguda de las vías respiratorias superiores, persistiendo durante días o semanas sin hipertensión ni signos de insuficiencia renal. Puede reaparecer tras nuevas infecciones respiratorias, siendo la causa más frecuente de hematuria recidivante en el niño. Su sustrato histológico puede variar desde la normalidad hasta la presencia de depósitos mesangiales de IgA de distribución segmentaria y focal (nefropatía IgA).
Glomerulonefritis aguda postestreptocócica
Su presentación característica es como síndrome nefrítico, con hematuria macroscópica, proteinuria, oliguria, hipertensión arterial y edemas, en un niño de 5 a 10 años y tras un proceso infeccioso amigdalar o dérmico de 1 a 4 semanas antes. El descenso de la fracción C3 del complemento y su restauración en niveles normales en los dos meses siguientes es un criterio diagnóstico principal, junto a la evidencia de infección pasada por estreptococo piógeno (SBHA), aunque sólo en un bajo número de casos se logra aislar la cepa nefritogénica. Puede observarse también aumento de la creatinina sérica. La persistencia de una microhematuria durante meses no modifica el pronóstico. La elevada frecuencia de las formas subclínicas y atípicas sugiere que una gran proporción de las hematurias microscópicas detectadas de forma casual puedan ser glomerulonefritis agudas en fase de resolución. Aunque no es común el desarrollo de glomenulonefritis rápidamente progresiva, de mal pronóstico, esta situación debe sospecharse por la intensidad y persistencia de la insuficiencia renal.
Púrpura de Schönlein-Henoch
Es una causa frecuente de hematuria cuyo diagnóstico se fundamenta en la clínica (púrpura simétrica en zonas declives y de extensión de extremidades, dolor abdominal, artritis y afectación renal que suele expresarse como hematuria macro o microscópica). La presencia proteinuria y/o insuficiencia renal determina la importancia del cuadro y pueden presentarse hasta 3 meses después.
Defectos hereditarios de la membrana basal glomerular
El síndrome de Alport asocia sordera neurosensorial, alteraciones oculares (lenticono o maculopatía) y una nefropatía que puede expresarse con hematuria e insuficiencia renal progresiva; la herencia es autonómica dominante ligada al sexo, con peor pronóstico en los varones. La enfermedad de la membrana basal fina, con microhematuria familiar aislada de carácter benigno (a diferencia del síndrome de Alport), debe ser sospechada en los casos de microhematuria persistente con padres o hermanos también con hematuria. El diagnóstico en ambos casos lo confirma la biopsia con estudio de microscopía electrónica en el que se observan alteraciones específicas en la membrana basal de los capilares glomerulares.
Síndrome hemolítico urémico
Con la tríada típica de insuficiencia renal de grado y evolución variable, anemia hemolítica microangiopática y plaquetopenia. Estos datos suelen precederse de una gastroenteritis o enfermedad respiratoria vírica. Frecuentemente existe afectación neurológica.
Lupus eritematoso diseminado
Es característica la afectación multisistémica, hipocomplementemia crónica y la presencia de anticuerpos antinucleares.
Hepatitis B
Con presencia de glomerulonefritis membranosa que puede dar lugar a un síndrome nefrótico y hematuria.
Causas no glomerulares
Infección urinaria
La hematuria puede acompañar a una ITU, especialmente a las cistitis. La confirmación de infección debe hacerse mediante cultivo y debe desaparecer la hematuria tras el tratamiento.
Hipercalciuria idiopática
Definida por la excreción urinaria de calcio superior a 4 mg/Kg/24 horas o por un cociente Ca/Cr mayor de 0,2 en dos determinaciones en segunda micción de la mañana. Entre el 30 al 50% de casos existen antecedentes de litiasis renal. Además de la hematuria puede asociarse dolor abdominal.
Litiasis renal
El diagnóstico se establece mediante ecografía, que permite detectar incluso cálculos radiopacos y de pequeño tamaño. En la mayoría de casos no se acompaña de dolor abdominal. La confirmación del cálculo debe hacernos poner en marcha un estudio metabólico de diagnóstico etiológico.
Tumores
Son causa infrecuente de hematuria en la edad pediátrica. El nefroblastoma, que se suele manifestar como masa abdominal palpable, es el más común. El adenocarcinoma de células claras, el hemangioma renal y el rabdomiosarcoma vesical pueden dar lugar también a hematurias, a veces con sangrados francos y eliminación de coágulos durante la micción.
Traumatismo renal
La hematuria puede ser la manifestación inmediata o diferida de un traumatismo. Pueden acompañarse de impactación de coágulos en la pelvis renal o uréteres que den lugar a dolor y/o oliguria.
La ecografía puede recomendar la realización de otros estudios de imagen (TAC, urografía) para localizar la lesión, su extensión y posibles extravasaciones. Suele señalarse que la hematuria macroscópica subsiguiente a mínimos traumatismo renales debe de hacernos pensar en una hidronefrosis o una enfermedad quística.
Enfermedades hematológicas y vasculares
Entre ellas las hemofilias, el síndrome de coagulación vascular diseminada y trombocitopenias de cualquier causa, en las que la hematuria no suele ser la causa de presentación de la enfermedad. Además, la nefropatía de células falciformes (en africanos, por tanto, probablemente de diagnóstico más frecuente cada año); y la trombosis de venas renales (hematuria macroscópica, masa uni o bilateral con hipertensión), que será confirmada mediante ecografía doppler.
Riñón poliquístico infantil
La forma autosómica dominante es la más frecuente. La ecografía puede reconocer una gran masa renal con deformación de los cálices. Tiene carácter autosómico recesivo y presentarse como hematuria macro o microscópica.
Una situación especial es la presencia de hematuria en el recién nacido, que debe hacernos pensar en una trombosis de la vena renal, una uropatía obstructiva y una enfermedad quística renal autosómica recesiva.
La hematuria en un recién nacido debe ser evaluada con sumo cuidado, ya que puede representar la manifestación de enfermedad grave de evolución rápida
Tablas y figuras
Tabla I. Escala de lectura de las proteínas
|
COLOR
|
Amarillo
|
Amarillo-verde
|
Verde claro
|
Verde oscuro
|
Azul
|
|
Cruces
|
–
|
+
|
++
|
+++
|
++++
|
|
mg %
|
10-30
|
30-100
|
100-299
|
300-999
|
> 1000
|
Tabla II. Clasificación de las proteinurias
|
PROTEINURIA
|
Fisiológica
|
Ligera
|
Moderada
|
Masiva
|
|
mg/m2/hora
|
< 4
|
4-20
|
20-40
|
> 40
|
|
Albúm/ Creat
|
< 0,2
|
0,2-1
|
1-3
|
> 3
|
Tabla III. Principales causas de proteinuria
|
1-. Incremento de proteínas plasmáticas
|
- Proteinuria de Bence Jones del mieloma
- Lisozimuria de algunas leucemias
|
|
2-. Glomerular por hiperfiltración
|
- Transitoria Fiebre, ejercicio, convulsiones, frío, deshidratación
- Ortostática
- Permanente Nefropatía por reflujo, insuficiencia renal crónica
|
|
3-. Glomerular por defecto en la permeabilidad
|
- Síndrome nefrótico idiopático
- Síndrome nefrótico congénito
- Glomerulonefritis aguda
- Glomerulonefritis crónicas primaria y secundarias
- Nefritis hereditarias
|
|
4-. Tubular por defecto de reabsorción o hipersecreción
|
- Enfermedad túbulo-intersticial Nefropatía por reflujo, nefritis intersticial, pielonefritis aguda, enfermedades congénitas
|
Tabla IV. Diagnóstico diferencial de las orinas coloreadas
|
TRASTORNO
|
TIRA REACTIVA
|
ASPECTO DE LA ORINA
|
PRESENCIA DE HEMATÍES
|
COLOR DEL
SUERO
|
|
HEMATURIA
|
+
|
Turbio
|
+
|
Normal
|
|
Mioglobinuria
|
+
|
Transparente
|
–
|
Normal
|
|
Hemoglobinuria
|
+
|
Transparente
|
–
|
Rosado
|
|
Otros
|
–
|
Transparente
|
–
|
Normal
|
Tabla V. Características de la hematuria y enfermedades relacionadas
|
Anamnesis personal
|
|
Frecuencia, disuria, dolor suprapúbico o en fosa renal
|
ITU o urolitiasis
|
|
Enfermedad previa:
Respiratoria (vírica, EBHA) o dérmica
|
Glomerulonefritis aguda postinfecciosa
Nefropatía IgA
|
|
Hematuria macroscópica
|
Glomerulonefritis aguda postinfecciosa
Nefropatía IgA
|
|
Fármacos
|
Nefritis intersticial
|
|
Trauma
|
Contusión renal
|
|
Antecedentes familiares
|
|
Hematuria microscópica
|
Hematuria familiar benigna
Síndrome de Alport
Hipercalciuria
|
|
Sordera
|
Síndrome de Alport
|
|
Enfermedad renal
|
Síndrome de Alport
Enfermedad quística renal
|
|
Urolitiasis
|
Hipercalciuria
|
|
Anemia falciforme
|
Nefropatía falciforme
|
|
Examen físico
|
|
Hipertensión arterial
|
Insuficiencia renal crónica
Enfermedad renal quística
Nefropatía por reflujo
|
|
Hipocrecimiento
|
Insuficiencia renal crónica
|
|
Exantema (petequias, púrpura, malar)
|
Púrpura de Schönlein-Henoch
Lupus eritemaso sistémico
|
|
Edema
|
Proteinuria (síndrome nefrótico)
Retención de líquidos
Fracaso renal agudo
|
|
Masa abdominal
|
Enfermedad renal quística
Hidronefrosis
Tumor
|
|
Dolor costovertebral o suprapúbico
|
ITU
|
|
Palidez
|
Síndrome hemolítico-urémico
Glomerulonefritis crónica
Insuficiencia renal crónica
|
Tabla VI. Hematuria confirmada
|
Criterios de remisión a una unidad especializada
|
- Dificultades personales/organizativas para realizar diagnóstico/seguimiento
- Ante la sospecha de enfermedad sistémica
- Afectación del estado general o riesgo de lesión renal permanente
- Signos de enfermedad glomerular: HTA, IRA, proteinuria leve persistente (más de 4 semanas) o moderada/masiva con o sin edemas
- Masa abdominal
- Poliquistosis renal
- Litiasis renal
- Ansiedad o solicitud familiar
|
Bibliografía
1. Martínez V. Estudio básico de la función renal, en Pediatría Extrahospitalaria. Fundamentos Clínicos de Atención Primaria, de Muñoz Calvo MT, Hidalgo Vicario I. Ed Ergón Madrid 2.008:467-73.
2. Martínez V. Hematuria y proteinuria en la infancia, de la SEMA. Editores: MI Hidalgo Vicario, AM Redondo Romero, G Castellano Barca 2ª edición, 2012 Ed. Ergon SA.Madrid. ISBN: 978-84-8473-999-9. Pag 677-684.
3. Martínez V. Principales valores analíticos de referencia en urgencias pediátricas, dentro del libro Urgencias de 0 a 100 años, editado por Panamericana, Madrid 2017.
4. Vogt B. Nephrology Update: Glomerular Disease in Children. FP Essent. 2016; 444:30-40.
5. Yang CY, Chen FA, Chen CF, et al. Diagnostic accuracy of urine protein/creatinine ratio is influenced by urine concentration. PLoS One 2015; 10(9):e0137460.
6. Noone D, Licht C. Chronic kidney disease: a new look at pathogenetic mechanisms and treatment options. Pediatr Nephrol 2014;29(5):779–92.
7. Wenderfer SE, Gaut JP. Glomerular Diseases in Children. Adv Chronic Kidney Dis 2017; 24:364-71.
8. Martínez V. Hematuria: diagnóstico diferencial. En Tratado de Pediatría Extrahospitalaria de la SEPEAP segunda Edición. Ergón, Madrid 2010; pág 519-26.
9. Viteri B, Reid-Adam J. Hematuria and Proteinuria in Children. Pediatr Rev. 2018;39(12): 573–87. doi:10.1542/pir.2017-0300.
10. Denver D, Brown MD, Kimberly J, Reidy MD. Approach to the Child with Hematuria. Pediatric Clinics of North America 2019; 66 (1);15-30.
11. Diven SC, Travis LB. A practical primary care approach to hematuria in children. Pediatr Nephrol 2000; 14:65-72.
12. Meyers KEC. Evaluation of hematuria in children. Clin Pediatr Noth Am 2004; 31:559-73.
13. Kincaid-Smith P, Fairley K. The investigation of hematuria. Semin Nephrol 2005; 25:127-35.
14. Clark, M., Aronoff, S. Del Vecchio, M. (2015). Etiologies of asymptomatic microscopic hematuria in children – systematic review of 1092 subjects. Diagnosis 2015; 2(4): 211-6. doi:10.1515/dx-2015-0020.
15. Fiorentino M, Bolignano D, Tesar V, Pisano A, Van Biesen W, D’Arrigo G, Tripepi G, Gesualdo L. Renal Biopsy in 2015- From Epidemiology to Evidence-Based Indications. Am J Nephrol 2016; 43:1-19. doi: 10.1159/000444026.
Bibliografía recomendada
- Martínez V. Estudio básico de la función renal, en Pediatría Extrahospitalaria. Fundamentos Clínicos de Atención Primaria, de Muñoz Calvo MT, Hidalgo Vicario I. Ed Ergón Madrid 2.008:467-73.
- Vogt B. Nephrology Update: Glomerular Disease in Children. FP Essent. 2016; 444:30-40.
- Noone D, Licht C. Chronic kidney disease: a new look at pathogenetic mechanisms and treatment options. Pediatr Nephrol 2014;29(5):779–92.
- Viteri B, Reid-Adam J. Hematuria and Proteinuria in Children. Pediatr Rev. 2018;39(12): 573–87. doi:10.1542/pir.2017-0300.