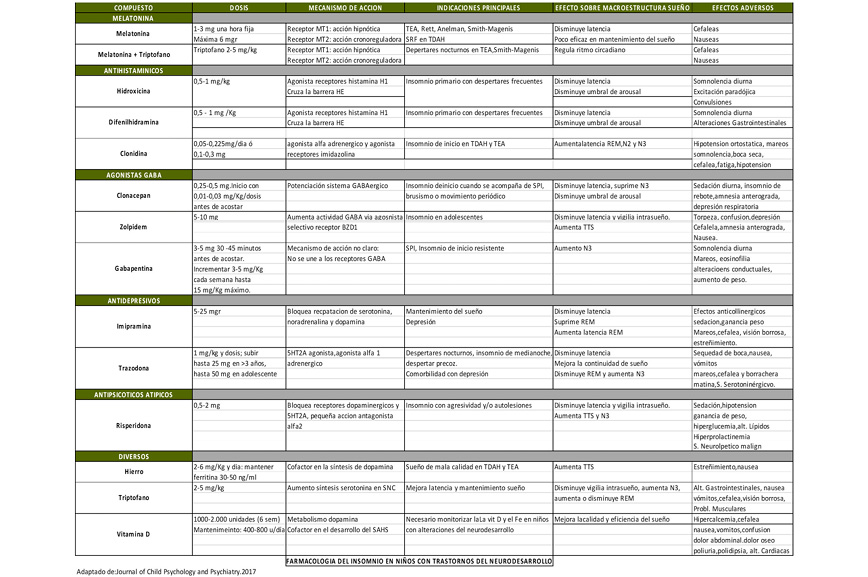
¿Qué sabemos de la microbiota?
¿Qué sabemos de la microbiota?
S. Gómez Senent.
Médico Adjunto. Servicio de Aparato Digestivo. Hospital Universitario La Paz, Madrid.
Adolescere 2022; X (3): 84-90
Resumen
|
La microbiota intestinal es el conjunto de microrganismos que habitan en nuestro intestino, hay grupos de especies estables y otras variables. Encontramos diferentes tipos de microorganismos y en distinta concentración, a lo largo de nuestro tracto gastrointestinal. En el estómago y duodeno tenemos cantidades muy bajas, debido fundamentalmente al ácido gástrico. En yeyuno e íleon disminuye la concentración de oxígeno y aumenta la población de microrganismos, y en el colon es donde hay mayor concentración de microorganismos. En numerosos estudios se describe la relación entre determinados tipos de microbiota intestinal y una gran variedad de enfermedades. Palabras clave: Microbiota intestinal, Autismo; Obesidad. |
Abstract
|
The intestinal microbiota is the set of microorganisms that inhabit our intestine, where there are groups of stable species and other variables. Different types of microorganisms and in different concentrations are found throughout our gastrointestinal tract. In the stomach and duodenum we have very low amounts, mainly due to the gastric acid. In the jejunum and ileum, the oxygen concentration decreases and the population of microorganisms increases, and the colon is where there is a higher concentration of microorganisms. Numerous studies describe the relationship between certain types of gut microbiota and a wide variety of diseases. Key words: Intestinal microbiota; Autism; Obesity. |
Composición de la microbiota intestinal
Las bacterias de la microbiota intestinal presentan una estructura muy particular que se asemeja a un gran árbol con pocas ramas principales. Éstas, a su vez, se dividirían en numerosos brazos. Las ramas principales serían los órdenes, representados por sólo seis de los más de cien que existen en la naturaleza: firmicutes (51-76%), bacteroidetes (16-42%), actinobacterias (2-20%), verrucomicrobia (2%), proteobacteria (1%) y fusobacteria (1%).
Los brazos que descienden de esas ramas principales serían los géneros y especies. Y son numerosísimos. Los géneros más representativos de firmicutes son: faecalibacterium, roseburia y clostridium. Por su parte, los más característicos del orden de los bacteroidetes, serían bacteroides y prevotella. El género bifidobacterium es el más representativo de las actinobacterias intestinales. Además de bacterias, en nuestro intestino también encontramos archaeas, virus y formas eucariotas (levaduras y protozoos).
El análisis de los genes que se obtuvieron a partir de muestras de heces en adultos europeos logró identificar un total de 3,3 millones de genes. Se estima que cada persona alberga una media de 600.000 genes en el tracto gastrointestinal, de los cuales aproximadamente la mitad son comunes al 50% de los individuos. De los genes identificados, el 98% son bacterianos, y se describieron entre 100 y 1.150 especies bacterianas, con una media por persona de 160 especies.
Aunque los microorganismos más predominantes son las bacterias, también en nuestra microbiota existen virus, hongos y arqueas
Aunque los microorganismos más predominantes son las bacterias, también en nuestra microbiota existen virus, hongos y arqueas.
Funciones de la microbiota intestinal
Las funciones cruciales de nuestra microbiota intestinal son metabólicas, defensivas y tróficas
Nuestra microbiota intestinal lleva a cabo principalmente tres funciones cruciales para nuestro organismo:
- Función metabólica: consiste en la recuperación de energía y nutrientes de los alimentos.
- Funciones defensivas: que constituyen el denominado efecto barrera: la presencia de bacterias comensales en sus propios nichos previene la invasión de microbios de fuera y evita su potencial infectividad.
- Funciones tróficas: las bacterias de nuestro intestino presentan en su superficie una serie de proteínas, que actúan como estimulantes de nuestro sistema inmunológico. De este modo, el contacto continuo entre la microbiota y el sistema inmunitario induce la maduración de éste último en las primeras etapas de la vida y actúa como una especie de entrenamiento continuado que lo mantiene en buena forma para poder repeler con eficacia a los agentes infecciosos.
El ecosistema intestinal desde el nacimiento hasta la edad adulta
El establecimiento de la microbiota intestinal en humanos comienza a producirse incluso antes de nuestro nacimiento
El establecimiento de la microbiota intestinal en humanos comienza a producirse incluso antes de nuestro nacimiento. Hasta hace pocos años, estaba generalmente aceptado que el feto era estéril y que el primer contacto con microorganismos se producía en el momento del parto. Hoy, sin embargo, existen varios trabajos -uno de los más importantes publicado en 2014 por el Dr. Aagaard-, que apuntan a una colonización microbiana del feto durante el periodo gestacional. A tenor de estos estudios, se ha descubierto que existen tanto factores perinatales como posnatales que ejercen cierta influencia sobre el desarrollo de la microbiota durante los primeros años de vida.
Factores perinatales
Fundamentalmente son de cinco clases:
Factores externos
Durante el embarazo, la madre se ve sometida a la influencia de algunos elementos externos como el estrés, el tabaco y hábitos de vida poco saludables
Durante el embarazo, la madre se ve sometida a la influencia de algunos elementos externos, tales como el estrés, el tabaco y otros hábitos de vida poco saludables. El efecto de estos factores en el establecimiento de la microbiota del feto ha sido analizado en diversos estudios. En uno de ellos -el llevado a cabo por el equipo del Dr. Zijlmans-, se comprobó que niños de madres con un alto estrés acumulado durante el embarazo tienen un mayor número de bacterias con potencial dañino (relacionados con los géneros Escherichia, Serratia y Enterobacter) y una menor abundancia de bifidobacterias y bacterias lácticas, lo cual podría estar relacionado con unos mayores niveles de inflamación. Además, otros factores como la exposición con el humo del tabaco durante la gestación, se han relacionado con una diferente composición de la microbiota en neonatos.
Edad gestacional
La edad gestacional influye de forma decisiva en la composición de la microbiota del neonato
La edad gestacional influye de forma decisiva en la composición de la microbiota del neonato. Las últimas semanas de embarazo son determinantes en la correcta maduración del intestino y el sistema inmunológico. Los niños prematuros, en los que no se han producido estas últimas etapas de maduración, poseen una microbiota que, comparada con la de neonatos nacidos a término, está caracterizada por una pronunciada disbiosis (desequilibrio de la microbiota intestinal), esto se corrobora en los estudios de los doctores Hilla y Arboleya. Además, el hecho de que el sistema inmunológico no esté bien desarrollado, conlleva a una mayor incidencia de algunas enfermedades. Otros factores asociados a la prematuridad, como el frecuente uso de antibióticos, o las prolongadas estancias hospitalarias durante los primeros días de vida, también influyen en el desarrollo de una microbiota intestinal alterada.
Obesidad de la madre
La composición y el desarrollo de la microbiota intestinal de niños están relacionados con el índice de masa corporal, el peso y la ganancia de peso de la madre durante el embarazo
Se sabe que los niños nacidos de madres obesas tienen un mayor riesgo de desarrollar obesidad en la infancia. Y se ha sugerido que este efecto podría estar relacionado con alteraciones en la microbiota, concretamente con la trasmisión de microorganismos obesogénicos -aquellos que tienen más capacidad para captar energía de los nutrientes de la dieta- de la madre al hijo. Por otra parte, un estudio publicado en 2011 en la revista International Journal of Obesity, muestra que la composición y el desarrollo de la microbiota intestinal de niños están relacionados con el índice de masa corporal, el peso y la ganancia de peso de la madre durante el embarazo.
Tipo de parto
Independientemente de otros factores, el hecho de que el parto sea natural, o por cesárea, condiciona el establecimiento y posterior desarrollo de la microbiota del niño. Esto hace que la composición de la microbiota, sobre todo durante las primeras etapas de la vida, sea diferente:
Los niños nacidos por cesárea tienen en su microbiota microorganismos que provienen del contacto con la piel y del ambiente hospitalario
- Parto vaginal: el recién nacido adquiere una parte importante de su microbiota durante el paso por la vagina, por lo que predominarán microorganismos característicos de la vagina, como los lactobacilos.
- Cesárea: los niños nacidos por cesárea tienen en su microbiota microorganismos que provienen del contacto con la piel y del ambiente hospitalario, como los estafilococos Klebsiella, Enterobacter y Clostridium. Los niños nacidos por cesárea también tienen una menor diversidad microbiana en su microbiota. Estas diferencias entre las microbiotas (cesárea vs. término) decrecen gradualmente, aunque la disbiosis puede persistir durante largos periodos de tiempo.
Dadas las diferencias entre un bebé nacido por vía vaginal o por cesárea, se llevó a cabo un estudio publicado en la revista Nature en 2016, cuyo objetivo era igualar la microbiota de los bebés nacidos por cesárea. Dicho experimento consistía en introducir una gasa en el canal del parto, impregnándolo de la microbiota de la madre en el momento en que ésta se ponía de parto. La gasa fue depositada en un recipiente estéril. Y, una vez que el niño nació por cesárea, se le impregnó la gasa por la boca, la cara y su cuerpo. Días después, se efectuó una comprobación de la microbiota del bebé y se constató que, efectivamente, estaba colonizada por la microbiota de la madre.
Uso de antibióticos
La administración de antibióticos, durante las etapas finales de gestación, se produce normalmente para evitar la infección perinatal por estreptococo del grupo B, que se determina en la semana 37 de gestación, tal como se describió en 2015 en la revista Journal of Pediatrics. Se ha demostrado que este tratamiento produce un impacto no solo en la microbiota de la madre, sino también en el establecimiento de la microbiota en el neonato. Como consecuencia, se produce un retraso en la colonización de microorganismos beneficiosos y un aumento de microorganismos potencialmente patógenos.
Factores posnatales
De los que destacaré principalmente cuatro: alimentación, genoma, entorno y empleo de antibióticos.
Durante los primeros meses de vida el bebé, ste entra en contacto con un ambiente extraordinariamente rico en microorganismos y su cuerpo ha de aprender a convivir con ellos. En este sentido, el correcto desarrollo y la maduración de nuestro aparato gastrointestinal y del sistema inmunológico -que se producen en armonía con el establecimiento de la microbiota-, son esenciales para alcanzar un estado fisiológico saludable en edades más avanzadas.
En estas primeras etapas, se desarrolla la tolerancia oral, un proceso a través del cual nuestro sistema inmunológico reconoce los antígenos de la dieta y de nuestra microbiota como propios y evita una reacción adversa contra ellos. Y, en el intestino, se establecen algunos microorganismos, como las bifidobacterias, que nos van a ayudar a aprovechar nutrientes fundamentales para nuestro desarrollo.
Alimentación
En los niños alimentados con leche materna se ha observado una población más abundante de bifidobacterias en su microbiota
Los trabajos científicos que comparan la influencia de la alimentación con leche materna con la de leche de fórmula llegan generalmente a las mismas conclusiones. En los dos grupos se produce un patrón de colonización diferente, que se caracteriza por una población más abundante de bifidobacterias en los niños alimentados con leche materna. Asimismo, es importante resaltar que la alimentación con leche materna se ha asociado con una menor frecuencia de obesidad en adolescencia y edad adulta, con una menor incidencia de enterocolitis necrotizante y diarrea durante los primeros meses de vida, así como con una menor incidencia de enfermedades inflamatorias intestinales y diabetes tipo 2.
Por el contrario, la microbiota de niños alimentados con leche de fórmula se caracteriza por tener una mayor diversidad de microorganismos, con abundancia de bacterias potencialmente dañinas, que se ha asociado con un mayor riesgo de desarrollar enfermedad atópica en etapas posteriores.
Otro factor que condiciona el tipo de microorganismos presentes en nuestro intestino durante el primer año de vida es el paso de la lactancia a la alimentación sólida. Tras el destete, se producen importantes modificaciones en el perfil de nutrientes ingeridos por el niño, introduciéndose por primera vez en la dieta los alimentos de origen vegetal, la carne y el pescado. En consecuencia, es en este momento cuando se empiezan a producir cambios en la microbiota, que tendrán como resultado el establecimiento de una microbiota más parecida a la de la edad adulta.
Factores genéticos
Hay asociaciones entre las características del genoma humano y la composición de la microbiota intestinal
En los últimos años, se han publicado varios estudios -como los de W. Turpin y M. J. Bonder-, en los que se establecen asociaciones entre las características del genoma humano y la composición de la microbiota intestinal. Por ejemplo, se ha comprobado que el patrón de colonización microbiano es muy similar en hermanos gemelos (univitelinos), difiere en los mellizos (gemelos bivitelinos). Y esta diferencia es mayúscula en sujetos sin ningún tipo de parentesco. Lo cual es indicativo del grado de la importancia del fondo genético del individuo en el desarrollo de la microbiota. Se ha comprobado, asimismo, que existen grupos de microorganismos heredables, como es el caso de la colonización por bifidobacterias.
Factores del entorno
Existen diferencias en la microbiota en función de la zona geográfica donde vivamos, así como el tipo de dieta de esa región o de ciertos elementos étnicos y/o culturales. Algunos factores relacionados con el entorno familiar, como la convivencia con hermanos, también han mostrado un papel relevante en el desarrollo de la microbiota, durante los primeros años de vida. Así, en algunos estudios se ha descrito que la convivencia con hermanos mayores, durante los primeros meses de vida, incrementa las poblaciones de bifidobacterias, y que la diversidad de la microbiota está directamente relacionada con el número de hermanos. Por otra parte, también se ha descrito que la presencia de mascotas en el ambiente familiar puede influir en el desarrollo de la microbiota intestinal, durante los primeros meses de vida. Y se han publicado estudios, como el de J. Penders, que describen una mayor diversidad en la microbiota de niños que viven con mascotas, menor abundancia de bifidobacterias y presencia de bacterias relacionadas con una menor incidencia de enfermedad atópica y obesidad en niños.
Uso de antibióticos
Durante los primeros meses de vida, el uso de antibióticos, es un factor que condiciona el posterior desarrollo de nuestra microbiota, e incrementa el riesgo de padecer diferentes enfermedades
Sobre todo durante los primeros meses de vida, es un factor que condiciona el posterior desarrollo de nuestra microbiota, e incrementa el riesgo de padecer diferentes enfermedades. Muchos de los estudios, como el de K. Korpela en 2017, relacionan las disbiosis inducidas por tratamientos antibióticos con posteriores problemas de salud. En un trabajo realizado en 2011 con miles de niños, se llegó a comprobar que la exposición a antibióticos durante los primeros seis meses de vida aumenta el riesgo de sobrepeso en niños de siete años nacidos de madres con peso normal. Cada vez hay más estudios que indican una asociación entre las disbiosis inducidas por antibióticos y el desarrollo de obesidad.
Microbiota y relación con algunas enfermedades en adolescencia
Obesidad y diabetes mellitus 2
La obesidad y la diabetes mellitus tipo 2 han alcanzado tasas preocupantes en los países industrializados. Además de ciertos factores de riesgo genético que contribuyen a la obesidad, existe un gran número de factores ambientales que influyen en su aparición, como el exceso de calorías en la alimentación, la composición de los alimentos, el grado de ejercicio físico o el gasto energético.
La disbiosis microbiana que se produce en determinadas circunstancias, también contribuye al desarrollo de la diabetes tipo 2 y obesidad
La obesidad se está incrementando en todas las franjas de edad, niveles socioeconómicos o género, por lo que no es posible establecer una única causa de este crecimiento. Los estudios científicos recientes indican que la microbiota intestinal o, mejor dicho, la disbiosis microbiana que se produce en determinadas circunstancias, también contribuye al desarrollo de la diabetes tipo 2 y obesidad. Este argumento se apoya en el hecho de que el conjunto de genes microbianos que pueden detectarse en individuos obesos es inferior al de individuos sanos, lo que indica una menor diversidad bacteriana.
Una dieta inadecuada ejerce un cambio en la microbiota que, a su vez, causa un impacto en el desarrollo de la obesidad, la resistencia a la insulina y trastornos asociados al síndrome metabólico –que es como se conoce a un grupo de factores de riesgo de enfermedad cardíaca, diabetes y otros problemas de salud. Asimismo, el ambiente en casa y centros educativos, los hábitos alimentarios de los padres, la disponibilidad de alimentos y la tendencia al sedentarismo, también se encuentran entre las posibles razones de un cambio en la microbiota que provoque el desarrollo de la obesidad.
En varios estudios se ha asociado la obesidad a una mayor proporción del filo Firmicutes respecto al de Bacteroidetes en la microbiota intestinal
La obesidad en la infancia aumenta la posibilidad de ser obeso en la etapa adulta, así como el riesgo de desarrollar las patologías asociadas de síndrome metabólico, riesgo cardiovascular y diabetes tipo 2. En varios estudios se ha asociado la obesidad a una mayor proporción del filo Firmicutes respecto al de Bacteroidetes en la microbiota intestinal. La mayor cantidad de bacterias del filo Bacteroidetes se asocia con mayor formación de ácido propiónico, butírico y acético, que se han descrito como protectores frente a la obesidad.
La contribución de la microbiota intestinal a la recuperación de energía de la dieta, así como el papel de los metabolitos microbianos en la regulación del almacenamiento de grasas son aspectos que apuntan a que exista un papel de los microorganismos en el desarrollo de la obesidad.
Ratones libres de microrganismos -que se han colonizado con la microbiota fecal procedentes de ratones obesos- han desarrollado obesidad y síndromes asociados, aunque no estén sobrealimentados. En los estudios se revela que la microbiota obesogénica es rica en genes relacionados con la recuperación de la energía y que, mediante componentes de la pared de los microbios, contribuye al desarrollo de un estado inflamatorio de bajo grado que se observa en la obesidad, participando en señales inflamatorias y de la regulación del sistema inmune. Esta inflamación se relaciona con un aumento de la permeabilidad intestinal provocado por la microbiota obesogénica y por un consumo elevado de grasa.
Salud mental
Se han relacionado muchas enfermedades del campo de la Salud Mental con una alteración del eje microbiota-intestino-cerebro
En los últimos años, se han relacionado muchas enfermedades del campo de la Salud Mental con una alteración del eje microbiota-intestino-cerebro. Este eje se basa en la comunicación neuroinmunoendocrina, la cual se establece tanto a nivel general como en cada órgano, permitiendo una adecuada homeostasis y, consecuentemente, la salud del individuo. La microbiota intestinal se va a comunicar con los sistemas homeostáticos (el nervioso, el endocrino y el inmunitario) en el intestino y, desde esa localización, a través de diferentes vías, con el cerebro, influyendo en su funcionamiento.
Pero, además de ayudar a mantener las funciones cerebrales, la microbiota intestinal también puede influir en el desarrollo de trastornos psiquiátricos y neurológicos, incluyendo patologías relacionadas con el estrés, como la ansiedad y la depresión, o trastornos del comportamiento como el autismo. Como la microbiota juega un papel importante en el neurodesarrollo cerebral en edades tempranas de la vida, la disbiosis puede contribuir a alteraciones del neurodesarrollo y a enfermedades mentales en edades posteriores.
Autismo
Cada vez hay más pruebas que sugieren que la microbiota intestinal tiene un papel en la fisiopatología del trastorno del espectro autista (TEA). Las diferencias en la composición de la microbiota intestinal en niños con TEA en comparación con hermanos no afectados y/o sanos se han reportado en varios estudios, como el de los Dres. Mingyu y Xuefeng. Las tasas de diagnóstico de TEA han aumentado dramáticamente en los últimos años. Factores de riesgo no genéticos, entre ellos los factores relacionados con la madre y el embarazo, como las infecciones intrauterinas y la exposición a los medicamentos, han aumentado a un ritmo que no puede ser explicado únicamente mediante factores genéticos. Además, hay un creciente interés en la microbiota intestinal en relación con el TEA.
Trastorno de déficit de atención e hiperactividad
El Trastorno por Déficit de Atención e Hiperactividad (TDAH) es uno de los trastornos del neurodesarrollo más frecuentemente diagnosticados en la etapa infantil.
La causa del TDAH es compleja y se ha indicado que es multifactorial. Dentro de los factores etiológicos destaca el fuerte componente genético, que representa sobre un 70-80%, pero también hay factores ambientales que incluyen los asociados al embarazo y el parto (como la prematuridad y el bajo peso al nacimiento) y unos determinantes psicosociales como la adopción o el abuso infantil.
Entre los factores implicados en el desarrollo de TDAH que se han descrito con posible patogenicidad destacan los colorantes artificiales en la dieta y las dietas con alto contenido en grasas saturadas y azúcares refinados, y baja en frutas y verduras.
La mayoría de las guías clínicas recomiendan un tratamiento combinado que incluya el farmacológico, el psicológico y el psicopedagógico e incluso la modulación de la microbiota intestinal.
Los estudios realizados en personas con TDAH, concluyen que se encuentran alteraciones en la microbiota al compararlo con personas sin TDAH, aunque los resultados son diferentes en los diversos estudios, lo que puede justificarse por las diferencias en el tamaño muestral (que suele contar con pocos pacientes incluidos), la edad estudiada, el clima, la dieta, y el uso de medicamentos (fundamentalmente antibióticos), entre otros.
Anorexia nerviosa
Numerosos estudios han encontrado diferencias en la composición microbiana intestinal de las personas con anorexia nerviosa (AN) y sujetos normales, aunque con una gran variabilidad y poca especificidad en los resultados, de forma que los resultados resultan poco específicos y podrían atribuirse tanto al propio trastorno –que se caracteriza por el desequilibrio dietético para reducir el nivel calórico– como a la “rehabilitación” nutricional llevada a cabo con el enfoque convencional.
Entre los hallazgos más destacables, podemos mencionar la disminución de la bacteria, Akkermansia muciniphila, o la elevación de Methanobrevibacter smithii, que elimina el exceso de hidrógeno de la fermentación bacteriana de los polisacáridos.
No está claro en qué medida la disbiosis contribuye a la sintomatología característica de la AN, como la pérdida de peso y otras manifestaciones psicopatológicas
No está claro en qué medida la disbiosis contribuye a la sintomatología característica de la AN, como la pérdida de peso y otras manifestaciones psicopatológicas.
Para profundizar en este dilema, se llevó a cabo un experimento en el que se reconstituyó el microbioma de ratones libres de gérmenes a partir de la microbiota de cuatro pacientes con AN de tipo restrictivo (ratones AN) o cuatro individuos de control sanos (ratones CS), y se examinaron los efectos sobre el aumento de peso y las características de comportamiento.
En comparación con los ratones CS, los ratones AN mostraron una disminución en el aumento de peso corporal, concomitante con una ingesta reducida de alimentos. La relación de eficiencia alimentaria (aumento de peso corporal/ingesta de alimentos) también fue significativamente menor en ratones AN que en ratones CS, lo que sugiere que la disminución del apetito y la capacidad de convertir los alimentos ingeridos en unidades de sustancia corporal pueden contribuir a un aumento de peso deficiente.
En humanos, se ha informado de resultados positivos sobre el peso o la restauración de la diversidad microbiana con intervenciones regeneradoras del microbioma intestinal –en este caso el trasplante fecal. Sin embargo, se necesitan datos sobre la eficacia clínica de determinados probióticos en la AN.
Bibliografía
- Arumugam M, Raes y cols. Enterotypes of the human gut microbiome. Nature.2011;473:174-80.
- Aagaard K, Ma J, Antony KM, y cols. The placenta harbors a unique microbiome. Science Translational Medicine. 2014; 6: 237-65.
- Zijlmans MA, Korpela K, y cols. Maternal prenatal stress is associated with the infant intestinal microbiota. Psychoneuroendocrinology. 2015; 53: 233-45.
- Arboleya S, Binetti A, y cols. Establishment and development of intestinal microbiota in preterm neonates. FEMS Microbiology Ecology. 2012; 79: 763-72. 5.
- Hill CJ, Lynch DB, y cols.Evolution of gut microbiota composition from birth to 24 weeks in the INFANTMET Cohort. Microbiome. 2015; 5: 4.
- Ajslev TA, Andersen CS, y cols. Childhood overweight after establishment of the gut microbiota: the role of delivery mode, prepregnancy weight and early administration of antibiotics. International Journal of Obesity. 2011; 35: 522-9.
- Dominguez-Bello MG, De Jesus-Laboy KM,y cols Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nature Medicine. 2016; 22: 250-3.
- Arboleya S, Sánchez B y cols. Intestinal microbiota development in preterm neonates and effect of perinatal antibiotics. Journal of Pediatrics. 2015; 166: 538-44.
- Cryan JF, O’Riordan K. The gut microbiome in neurological disorders. Lancet Neurol 2020;19(2):179-194.
- Li Q, Han Y. The Gut Microbiota and Autism Spectrum Disorders. Front. Cell. Neurosci., 28 April 2017.
- Xu M, 1, Xu X. Association Between Gut Microbiota and Autism Spectrum Disorder: A Systematic Review and Meta-Analysis. Front. Psychiatry, 17 July 2019.
- Griffiths J, Mazmanian S. Emerging evidence linking the gut microbiome to neurologic disorders. Genome Medicine (2018) 10:98.