Enfermedad inflamatoria intestinal
Enfermedad inflamatoria intestinal
J. Martín de Carpi.
Unidad para el Cuidado Integral de la EII pediátrica (UCIEII-P). Servicio de Gastroenterología, Hepatología y Nutrición Pediátrica. Hospital Sant Joan de Déu.
Fecha de recepción: 17-01-2021
Fecha de publicación: 28-02-2021
Adolescere 2021; IX (1): 53-61
Resumen
|
La Enfermedad Inflamatoria Intestinal (Colitis Ulcerosa, Enfermedad de Crohn) constituye a día de hoy una de las enfermedades crónicas digestivas más frecuentes en la población mundial. Pese a ser una enfermedad de predominio en la edad adulta (con un pico de incidencia en el adulto joven y un segundo pico menor por encima de los 65 años), su aparición en la edad pediátrica es cada vez más habitual. Si bien se trata de enfermedades que pueden aparecer a cualquier edad, el pico de presentación en la infancia se sitúa entre los 11-13 años. El adolescente afecto de Enfermedad Inflamatoria Intestinal presenta una serie de peculiaridades que pueden condicionar de manera importante su evolución, seguimiento y pronóstico. La demora en el diagnóstico en edades en que la asistencia pediátrica no suele ser continuada, las implicaciones psicológicas y afectivas, la responsabilidad en el autocuidado, la transición entre los cuidados pediátricos y los del adulto, las limitaciones derivadas de la enfermedad en las actividades propias de la edad y en el inicio de las relaciones afectivas y sexuales, o la adherencia mantenida al tratamiento son aspectos clave en la evolución de estos pacientes durante la adolescencia. Palabras clave: Enfermedad de Crohn; Colitis Ulcerosa; Adherencia; Transición retraso diagnóstico; Abordaje multidisciplinar. |
Abstract
|
Inflammatory Bowel Disease (Ulcerative Colitis, Crohn’s Disease) constitutes one of the most frequent chronic digestive diseases in the world. Despite being a disease prevalent in adulthood (with a peak incidence in young adults and a second lower peak above 65 years-old), its appearance in pediatric age is becoming increasingly common. Although these are diseases that can appear at any age, the peak of presentation in childhood is between 11-13 years. The adolescent with Inflammatory Bowel Disease presents a number of characteristics that can significantly condition its progression, follow-up and prognosis. The delay in diagnosis at ages when pediatric care is usually not continuous, the psychological and affective implications, the responsibility in self-care, the transition between pediatric and adult care, the limitations derived from the disease impacting their activities, at a time of initiation in affective and sexual relationships, or the adherence to treatment are key aspects in the evolution of these patients during adolescence. Key words: Crohn’s disease; Ulcerative Colitis; Adherence; Transition; Diagnostic delay; Multidisciplinary approach. |
Introducción
Bajo el término Enfermedades Inflamatorias Intestinales (EII) se engloban una serie de entidades caracterizadas por su origen multifactorial (fruto de la interacción de factores genéticos, ambientales e inmunológicos del individuo), su carácter crónico y la existencia de fenómenos inflamatorios a lo largo del tubo digestivo. Básicamente se identifican dos procesos, que si bien pueden compartir una serie de características, difieren en algunas otras. La enfermedad de Crohn puede afectar a todo el tubo digestivo, si bien los tramos más habitualmente implicados son el ileon terminal y el colon en diferente extensión. La afectación puede ser transmural, lo que puede ocasionar el desarrollo, aparte de las formas exclusivamente luminales o mucosas, de fenotipos estenosantes o fistulizantes, y puede acompañarse de diferente grado de lesión perianal (fundamentalmente en forma de fístulas o abscesos). La colitis ulcerosa se caracteriza por inflamación mucosa que afecta exclusivamente al colon, en diferente grado de extensión, desde formas distales localizadas (procto-sigmoiditis y colitis izquierda) hasta formas extensas o pancolitis. De cara a establecer las medidas diagnósticas, terapéuticas, de seguimiento y pronósticas adecuadas, será importante establecer el diagnóstico más acertado posible desde las primeras fases de la enfermedad, ya que el abordaje de ambas enfermedades puede diferir en algunas cuestiones. Para aquellas entidades cuyas características no permiten a priori la diferenciación clara entre ambos procesos, se acuñó el término de Enfermedad Inflamatoria no clasificada, cuyo comportamiento, si bien en términos generales semeja al de la Colitis Ulcerosa, en ocasiones puede con el tiempo definirse más hacia alguno de los dos procesos.
La Enfermedad Inflamatoria Intestinal (enfermedad de Crohn, colitis ulcerosa) constituye a día de hoy una de las enfermedades digestivas crónicas de mayor importancia en el paciente pediátrico y adolescente, por el importante aumento en su frecuencia, su morbilidad, sus implicaciones en la vida adulta y sus posibles complicaciones
La EII debuta mayoritariamente en la edad adulta, con un pico importante de incidencia en el adulto joven, si bien es una enfermedad que cada vez se diagnostica en mayor número en la edad pediátrica. Diferentes estudios a nivel mundial han puesto de manifiesto un aumento claro de la incidencia de la EII en el niño y adolescente a lo largo de las últimas décadas, incluido nuestro medio(1,2). Si bien estas enfermedades pueden debutar en los niños a cualquier edad, el pico mayor de presentación en Pediatría se encuentra entre los 11 y 13 años. Por ello, es importante que los profesionales de la salud encargados de la asistencia al niño y al adolescente tengan en cuenta que, aunque sigue siendo una patología numéricamente no demasiado frecuente, constituye una posibilidad diagnóstica en la cual la detección precoz, la derivación temprana y la instauración de medidas efectivas desde los primeros momentos de su desarrollo condicionarán un mejor control de la misma, una menor posibilidad de desarrollar complicaciones, un mejor pronóstico a largo plazo y una mejoría en la calidad de vida presente y futura para el paciente.
Etiopatogenia y factores de riesgo
La Enfermedad Inflamatoria Intestinal se engloba dentro de las enfermedades inmuno-mediadas y de etiología multifactorial. Puede aparecer asociada en el individuo o en el contexto familiar a otras enfermedades denominadas autoinmunes, como son psoriasis, artritis-espondilitis, tiroiditis, enfermedad celiaca o hepatitis autoinmune. Salvo los casos de aparición en los primeros años de vida (las formas denominadas como EII de debut precoz por debajo de los 10 años, de inicio muy precoz por debajo de los 6, o incluso neonatales) que generalmente se piensa pueden ser expresión de enfermedades monogénicas, la EII de aparición en el niño mayor y adolescente seguiría el patrón de la del adulto, en la que se han aislado múltiples genes que podrían estar relacionados. La hipótesis más aceptada es que en individuos con determinada predisposición genética (carga personal o familiar), incidirían una serie de factores externos (dieta, eventos previos, infecciones, ambientales) que desencadenarían una respuesta anómala (hiper-respuesta) del sistema inmune propio, lo que pondría en marcha y perpetuaría los mecanismos implicados en la inflamación intestinal. En base a estudios publicados en los últimos años, cada vez se da mayor importancia al papel que la microbiota intestinal y los efectos desencadenados por la misma pudieran tener en la patogenia de la enfermedad, de ahí que se hayan investigado diferentes tratamientos vinculados con la modificación de la misma, con resultados contradictorios.
¿Por qué es importante pensar en la Enfermedad Inflamatoria Intestinal en el adolescente?
Uno de los factores que pueden influir en un peor pronóstico de la EII en cuanto a aparición de complicaciones y en una respuesta más pobre al tratamiento es la demora en el diagnóstico. En la edad pediátrica las consecuencias deletéreas de este retraso son especialmente importantes, ya que la enfermedad se presenta en fases críticas del crecimiento y desarrollo del paciente, lo que puede interferir en dichos procesos y en ocasiones de manera permanente (talla final, densidad mineral ósea). Es por ello que en el niño y adolescente será especialmente importante establecer la sospecha de manera precoz, así como poner en marcha las estrategias adecuadas de cara a alcanzar el diagnóstico antes de que el proceso interfiera de manera importante en la salud del paciente. Un reciente estudio promovido dentro de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP) evalúa el retraso diagnóstico en la EII pediátrica en nuestro medio(3). Dicho periodo de retraso se compone de diferentes subperiodos, algunos de ellos dependientes del momento de consulta por parte del paciente y su familia al sistema de salud, y otros dependientes de la agilidad y capacidades del propio sistema de salud y sus profesionales. En dicho registro, el retraso diagnóstico en nuestro medio para los niños con EII era de 4.4 meses, siendo significativamente mayor en el caso de la Enfermedad de Crohn que en la Colitis Ulcerosa, que suele manifestarse más abruptamente en forma de diarrea sanguinolenta (6.3 [IQR 3.3–12.3] vs. 3 [IQR 1.6–5.6] meses, p = 0.0001). De entre los diferentes tiempos contribuyentes al mismo, el que cuantitativamente era mayor era aquel que iba desde la primera visita a un médico hasta que llegaba a un especialista en Gastroenterología Pediátrica (2.4 meses [IQR 1.03–7.17] en la enfermedad de Crohn vs. 0.83 meses [IQR 0.30–2.50] en la colitis ulcerosa, p = 0.0001). Otro dato interesante es que el 78,3% de los pacientes habían visitado más de un facultativo hasta el momento del diagnóstico (con un 30% habiendo acudido a 4 o más profesionales médicos). Hay que tener en cuenta que todo ese retraso (con las consiguientes oportunidades pérdidas de diagnóstico) pueden condicionar como hemos dicho una serie de consecuencias en el paciente, que pueden empeorar tanto su salud física como emocional(4). Queda claro por tanto que a la hora de conseguir una buena orientación y derivación del paciente pediátrico con EII existe mucho margen de mejora.
Es importante realizar la sospecha de manera precoz y establecer el diagnóstico antes de que el proceso interfiera en la salud del adolescente
Para poder poner en marcha los estudios pertinentes encaminados al diagnóstico de la enfermedad en el niño y adolescente, será fundamental que el personal sanitario encargado de su cuidado tenga presente esta posibilidad a la hora de enfrentarse al paciente. Si bien la forma de presentación en el adulto habitualmente es clara (inicio más o menos brusco de diarreas, emisión de sangre y moco con las deposiciones, pérdida de peso, malestar general, dolor abdominal acompañante), en el niño los síntomas (sobre todo en la enfermedad de Crohn en la que la llamada triada clásica de diarrea, pérdida de peso y dolor abdominal solo aparece al diagnóstico en un cuarto de los pacientes) son muchas veces más larvados y subagudos. Aparte de ello, algunos de los síntomas más típicos los comparten a estas edades otras entidades, como son las gastroenteritis infecciosas, víricas o bacterianas, la enfermedad celiaca, las intolerancias/alergias alimentarias. Por tanto, para un pediatra de ámbito no especializado, que habitualmente no tiene experiencia con estas enfermedades en los niños, puede ser complicado de primeras pensar en la posibilidad de una EII como una de las opciones diagnósticas, sobre todo en ausencia de una visión más longitudinal del paciente y de su evolución previa. Otros datos más sutiles en la historia clínica del niño y adolescente, como puede ser la pérdida progresiva de peso, el retraso de crecimiento, la fiebre persistente en ausencia de foco infeccioso claro, la amenorrea primaria o secundaria, la presencia de manifestaciones extraintestinales (MEI) que con relativa frecuencia acompañan a estas enfermedades, pueden contribuir a establecer la sospecha diagnóstica. De la misma forma, y en referencia a lo comentado anteriormente, la existencia de casos en la familia debería contribuir a valorar en su justa medida la posibilidad de debut de una EII en un paciente con síntomas sugestivos. En la Tabla I se muestran los síntomas más frecuentes de presentación en la EII del niño y adolescente y en la Tabla II se recogen algunas de las MEI más habituales.
En el caso del adolescente, se debería prestar atención especialmente a aquel paciente con historia más o menos larga de procesos diarreicos, continuados o autolimitados, etiquetados muchas veces como episodios recurrentes de gastroenteritis agudas, con pérdida de peso, astenia e hiporexia (en algunos casos orientados como sugestivos de trastornos de la conducta alimentaria) y en ocasiones acompañados de empeoramiento del estado de ánimo, aislamiento y retracción. Hay que tener en cuenta que el adolescente muchas veces no contará aquellos síntomas relacionados con la defecación y que pueden parecerles vergonzantes (despeños diarreicos, moco y sangre con las heces, escapes de materia fecal en la ropa interior…) Así mismo, es importante preguntar y buscar activamente la posibilidad de enfermedad perianal asociada, ya que en función de la gravedad (desde mamelones cutáneos y fisuras más o menos asintomáticos hasta fístulas productivas y abscesos a tensión) pueden ser también ocultados por el paciente. En la valoración de la evolución previa del proceso, se recomienda contrastar, siempre que sea posible, las medidas antropométricas actuales con los datos previos de peso y talla, ya que en ocasiones un estancamiento o pérdida no muy llamativa puede haber pasado desapercibidos o atribuidos a otros motivos (ejercicio, práctica de deporte, dietas autoimpuestas).
En el adolescente se debe prestar atención a procesos diarreicos acompañados de pérdida de peso, astenia e hiporexia, y a veces alteraciones del estado de ánimo y aislamiento
¿Qué se puede hacer desde atención primaria para agilizar el diagnóstico de una EII?
Los pacientes con EII pueden presentar anemia, ferropenia, elevación de reactantes de fase aguda y niveles elevados de calprotectina fecal, como marcador de inflamación intestinal
Una vez que nos encontremos con un paciente con sospecha de EII, la realización de una serie de pruebas rápidas nos puede aportar una información inicial importante. El paciente con EII puede presentar anemia en mayor o menor grado, ferropenia (habitualmente con mala respuesta a la ferroterapia), elevación moderada de reactantes de fase aguda (velocidad de sedimentación globular, proteína C reactiva, trombocitosis) y otros datos sugestivos de malabsorción debida a la extensión de la lesión intestinal (hipoalbuminemia). La determinación de la calprotectina fecal (proteína citosólica de los neutrófilos cuya detección en heces constituye un marcador muy sensible de inflamación intestinal) puede aportar peso a la posibilidad de un proceso inflamatorio frente a otros cuadros funcionales en los que no debería elevarse. Si bien su especificidad es muy baja, lo que indica que puede estar elevada en otros procesos relativamente frecuentes en niños pequeños (gastroenteritis infecciosas y parasitosis, rectocolitis alérgica, pólipo juvenil aislado, gastritis por Helicobacter pylori…), la detección de valores elevados en un adolescente con síntomas sugestivos debería poner sobre aviso acerca de la posibilidad de un debut de EII. Una vez detectados algunos de estos datos desde Atención Primaria, o incluso en su ausencia pero con datos clínicos de mayor o menor duración y que condicionan un deterioro progresivo del estado general del paciente, se debería agilizar la vía de derivación a la atención pediátrica especializada sin mayor demora, evitando esperas no justificadas o la realización de otras pruebas menos relevantes (pruebas de alergia/intolerancia alimentaria, pruebas inespecíficas de diagnóstico por la imagen, estudio de infección por Helicobacter pylori…). Por esta necesidad de establecer un diagnóstico precoz, la EII es una de esas enfermedades para las cuales el diseño de circuitos de derivación ágiles y rápidos entre atención primaria y atención especializada hospitalaria cobra especial importancia.
Para un mejor pronóstico son fundamentales el diagnóstico precoz y el tratamiento efectivo desde fases iniciales de la enfermedad, para los cuales la labor de detección desde los niveles de Atención Primaria puede ser decisiva
El proceso diagnóstico de la EII pediátrica por parte de las unidades especializadas
En aras a realizar el diagnóstico de certeza de manera sistematizada, evitando los diagnósticos inespecíficos o no concluyentes, la Sociedad Europea de Gastroenterología Hepatología y Nutrición Pediátrica estableció en el año 2005 los denominados Criterios de Oporto, posteriormente revisados en el año 2014(5). Dichos criterios, que deberían cumplirse por parte de todas las unidades hospitalarias que tratan pacientes pediátricos con EII, tratan de establecer el algoritmo más adecuado para un diagnóstico diferencial y de certeza en los casos con sospecha de EII pediátrica, definiendo además las formas atípicas de la enfermedad (colitis ulcerosa atípica, EII no clasificada) en función de una serie de criterios clínicos, endoscópicos e histológicos. Según estos criterios de Oporto (Figura 1), en todo paciente pediátrico con sospecha de EII debería realizarse:
- Analítica de sangre con determinación de hemograma, marcadores de inflamación, albúmina, transaminasas y gammaGT.
- Determinación de calprotectina fecal (CF), como marcador superior a cualquier otro parámetro sanguíneo de inflamación intestinal.
- Estudio de infecciones entéricas bacterianas (Salmonella, Shigella, Yersinia, Campylobacter) incluyendo toxina para Clostridium difficile.
- Estudio básico de inmunodeficiencia primaria en la EII de debut < 2 años de edad.
- Ileocolonoscopia y endoscopia digestiva alta a todos los pacientes.
- Biopsias múltiples de todos los segmentos explorados (al menos 2 por tramo).
- Prueba de imagen para la valoración del intestino delgado. Actualmente, y dadas sus ventajas en cuanto a información que aporta y seguridad, se considera que la prueba de elección es la entero resonancia magnética (eRM). La cápsula endoscópica (CE) constituye una alternativa en pacientes en los que la endoscopia y/o las otras pruebas de imagen no hayan sido diagnósticas o en los que no se haya podido realizar la entero-RM.
A la hora de definir adecuadamente la localización, gravedad y extensión de la enfermedad una vez realizado el diagnóstico, se recomienda realizar una clasificación fenotípica lo más ajustada posible de cara a establecer la estrategia terapéutica más adecuada. En este sentido y con el objetivo de estandarizar dicha clasificación, en el año 2011 se propuso la clasificación de París (Tabla III), que complementa y modifica en algunos aspectos a la previamente vigente de Montreal(6). Así como debe realizarse una evaluación adecuada de la afectación intestinal y de sus consecuencias, al momento del diagnóstico se debe realizar también una evaluación global de la situación del paciente con especial atención a la esfera psico-social y nutricional. El abordaje del paciente pediátrico con EII debe realizarse de forma multidisciplinar desde el momento del diagnóstico implicando para ello un equipo amplio que pueda abordar las diferentes esferas de la vida del niño y adolescente que puedan verse afectadas por una enfermedad crónica como esta (psicólogos, psiquiatras, dietistas, enfermería especializada, trabajadores sociales…)
Tratamiento precoz, individualizado y multidisciplinar en la EII pediátrica
Tal y como se ha comentado, el tratamiento debe instaurarse de manera precoz. El arsenal terapéutico en el caso de la EII pediátrica es básicamente el mismo que el disponible para la enfermedad del adulto, si bien las particularidades del niño y adolescente implican una serie de especificidades que deben ser tenidas en cuenta. El objetivo ideal será iniciar tratamientos eficaces, con rapidez de acción, que favorezcan una buena cumplimentación (aspecto importante en el paciente pediátrico) y con un perfil de seguridad adecuado, ya que van a ser pacientes que precisarán cumplir dicho tratamiento durante etapas prolongadas de su vida. Se tratará de establecer el tratamiento más adecuado a cada paciente, en función de una serie de circunstancias, como son el tipo de enfermedad (enfermedad de Crohn, colitis ulcerosa, EII no clasificada), el fenotipo de la misma, la gravedad de la presentación (lo que puede condicionar la posible respuesta a los tratamientos secundaria a la agresividad de la enfermedad), la repercusión en el estado general en el momento del diagnóstico o la presencia de manifestaciones extraintestinales asociadas. Todo ello viene definido en las guías específicas de tratamiento de la EII, publicadas en los últimos años(7,8,9). La principal diferencia respecto a las recomendaciones del tratamiento en la enfermedad del adulto viene determinada por el menor uso de fármacos con posibles efectos adversos importantes a corto y a largo plazo (fundamentalmente los esteroides) en aras del uso de terapias más seguras (como puede ser el tratamiento dietético en la enfermedad de Crohn) y el uso más precoz de fármacos altamente efectivos que puedan lograr una remisión mantenida en el tiempo, preservando así los fenómenos de crecimiento y desarrollo (como pueden ser los tratamientos biológicos). La edad al diagnóstico constituye otro factor importante a la hora de valorar la estrategia terapéutica más adecuada. En el niño pequeño y escolar, la implicación de los cuidadores va a facilitar una correcta adherencia al tratamiento y un adecuado seguimiento cercano de cara a valorar la respuesta al mismo. En los pacientes pre-adolescentes, interesará especialmente lograr de manera rápida la remisión clínica, y que esta se mantenga en el tiempo, con el fin de preservar de manera efectiva el estirón puberal y la maduración sexual. En el caso del paciente adolescente, se deberá buscar su complicidad a la hora de conseguir una adecuada implicación y una correcta adherencia, ya que en buena parte va a depender de su propia actitud y predisposición. Medidas terapéuticas que con la colaboración de los padres en edades menores pueden ser más sencillas de cumplir, como es el caso de la nutrición enteral exclusiva y prolongada como inducción, pueden ser más complicadas en el caso del adolescente. Así mismo, determinados efectos adversos cosméticos relacionados con la medicación (acné, aumento de peso y facies de luna llena en relación a los esteroides sistémicos; hirsutismo, hiperplasia gingival secundarios a ciclosporina), aunque transitorios, pueden ser especialmente mal tolerados por los adolescentes.
Por último, determinados efectos adversos graves relacionados con los inmunosupresores tiopurínicos han sido descritos específicamente en pacientes varones adolescentes y adultos jóvenes, como es el caso del linfoma hepato-esplénico de células T, con una tasa muy alta de letalidad. Todo ello debería ser tenido en cuenta a la hora de individualizar los tratamientos en estas edades. Paralelamente al inicio del tratamiento de su enfermedad, el momento del diagnóstico debería ser un momento en el cual instaurar y reforzar una serie de medidas de auto-cuidado y de buenos hábitos de salud, como deben ser una alimentación variada y equilibrada y prevención de hábitos tóxicos, en especial el tabaquismo, que ha demostrado ser un claro factor de mal pronóstico (peor respuesta a los tratamientos, mayor necesidad de cirugía) en la enfermedad de Crohn. En la Tabla IV se resumen los tratamientos más habitualmente utilizados en la EII pediátrica.
Se deben iniciar tratamientos eficaces, con rapidez de acción, que favorezcan una buena cumplimentación y un perfil de seguridad adecuado
¿Cómo se puede colaborar desde atención primaria al seguimiento y control de la EII?
Pese a tratarse de una enfermedad compleja cuyo seguimiento (que debe ser cercano y accesible por parte del paciente) debe realizarse en unidades multidisciplinares y especializadas, los profesionales de atención primaria pueden jugar un papel muy importante en dicho seguimiento. Como lamentablemente sucede con otras enfermedades crónicas pediátricas, en ocasiones los pacientes centralizan su atención en el ámbito hospitalario, perdiendo el contacto con sus médicos de Atención Primaria.
Si en todo paciente debería evitarse esta situación, en el caso del paciente adolescente todavía más, pues disponer además de una vía añadida de control y seguimiento puede ser de especial interés. El contacto con un profesional de salud de proximidad y confianza puede ser una ayuda a la hora de reforzar algunos de los siguientes aspectos importantes:
Pese a tratarse de una enfermedad de seguimiento básicamente hospitalario (por su complejidad, necesidad de tratamientos específicos y posibles complicaciones), el seguimiento conjunto con la Atención Primaria puede aportar importantes beneficios, especialmente en el paciente adolescente
- Detección de recaídas de la enfermedad, para lo cual el profesional de Atención Primaria debe ser conocedor de los síntomas y signos de alarma sugestivos de reactivación de la enfermedad. Realizar un cribado en Atención Primaria de los síntomas para descartar otros procesos intercurrentes puede contribuir a no demorar el tratamiento de dichos procesos si así lo requiriesen.
Será recomendable reforzar todos los aspectos asociados a unos hábitos saludables: alimentación equilibrada, ejercicio físico, prevención del tabaquismo y del consumo de otros tóxicos o la prevención de enfermedades de transmisión sexual y de embarazos no deseados, cumplimentación del programa de vacunación
- Contribución y seguimiento de la adherencia al tratamiento, para lo cual se recomienda un adecuado conocimiento de la medicación del paciente, colaborando además a su prescripción y acceso ambulatorio. La toma diaria de comprimidos, la colocación frecuente de tratamiento tópico rectal o la administración ambulatoria de fármacos de administración parenteral (metotrexato o antiTNF subcutáneos) pueden constituir una carga difícil de asumir para el paciente adolescente, que debería además responsabilizarse él mismo de su cumplimentación. Ofrecer un apoyo de proximidad ante dicha situación puede ser beneficioso.
- Vigilancia y detección de posibles efectos adversos de dicha medicación, para lo cual el profesional debería estar familiarizado con aquellos más frecuentes, que se exponen en la Tabla V.
- Refuerzo de hábitos de vida saludables y prevención de hábitos tóxicos. Será recomendable reforzar todos aquellos aspectos asociados a unos hábitos saludables, como es la alimentación equilibrada, el ejercicio físico, la prevención del tabaquismo y del consumo de otros tóxicos o la prevención de enfermedades de transmisión sexual y de embarazos no deseados.
- Administración y cumplimentación del programa de vacunación. Los pacientes con EII bajo tratamiento inmunosupresor tienen un riesgo superior de infecciones prevenibles. En lo posible, la inmunización debe ser optimizada antes de iniciar tratamientos inmunosupresores ya que pueden tener posibles repercusiones en su seguridad y eficacia. Así mismo, en aquellos pacientes en tratamiento inmunosupresor, las vacunas con virus/bacterias vivos/atenuados deberían postponerse hasta el momento de su suspensión, según las recomendaciones del grupo de trabajo de EII de la ESPGHAN publicadas en el año 2012(10). En aquellos pacientes con tratamiento inmunosupresor se recomienda así mismo la administración anual de la vacuna de la gripe.
- Detección de patología psico-social asociada. Diversos estudios han puesto de manifiesto un mayor riesgo de trastornos de ansiedad-depresión en adolescentes afectos de EII. Las limitaciones físicas, el descontento con la propia imagen corporal y la naturaleza de los síntomas predominantes pueden influir en dicha situación. Así mismo, estos pacientes presentan un mayor riesgo de absentismo y fracaso escolar. Desde Atención Primaria se debe contribuir a la normalización de la vida del adolescente con una enfermedad crónica en fase de estabilidad. Se recomienda potenciar la auto-confianza, evitando la sobreprotección y la imposición de limitaciones no estrictamente necesarias.
Desde Atención Primaria se debe contribuir a la normalización de la vida del adolescente con una enfermedad crónica en fase de estabilidad. Se recomienda potenciar la auto-confianza, evitando la sobreprotección y la imposición de limitaciones no estrictamente necesarias
Tablas y figuras
Tabla I. Manifestaciones clínicas más frecuentes en la EII pediátrica
|
Enfermedad de Crohn |
Colitis Ulcerosa |
|
Dolor abdominal |
Rectorragia |
|
Diarrea |
Diarrea |
|
Pérdida de peso |
Urgencia, tenesmo |
|
Aftas orales |
Dolor abdominal |
|
Afectación perianal (fisuras, skin tags, abscesos, fístulas) |
Pérdida de peso |
Tabla II. Manifestaciones extraintestinales más frecuentes en la EII
|
Tabla III. Clasificación de París de la EII pediátrica
|
Enfermedad de Crohn |
|
|
Edad diagnóstico |
A1a: 0 a ≤ 10 años y A1b: 10 a ≤ 17 años A2: 17-40 años A3: > 40 años |
|
Localización |
L1: tercio distal íleon +/- ciego L2: colon L3: ileocólica L4a: afectación alta proximal a Treitz L4b: afectación alta distal a Treitz y proximal al tercio distal de íleon |
|
Patrón |
B1: no estenosante, no penetrante B2: estenosante B3: penetrante B2B3: coexistencia de ambos patrones simultáneamente o en diferentes momentos evolutivos p: afectación perianal |
|
Crecimiento |
G0: no afectación G1: retraso de crecimiento |
|
Colitis ulcerosa |
|
|
Extensión |
E1: proctitis ulcerosa E2: colitis izquierda (distal al ángulo esplénico) E3: colitis extensa (distal al ángulo hepático) E4: pancolitis (proximal al ángulo hepático) |
|
Gravedad |
S0: no brote grave S1: brote grave (Pediatric Ulcerative Colitis Index ≥ 65) |
Tabla IV. Resumen de los tratamientos en la EII pediátrica
|
Enfermedad de Crohn |
Colitis ulcerosa |
||
|
Inducción a la remisión |
Mantenimiento |
Inducción a la remisión |
Mantenimiento |
|
|
|
|
Tabla V. Efectos adversos más frecuentes de los fármacos utilizados en la EII pediátrica
|
Fármaco |
Efectos adversos |
|
Salicilatos (mesalazina) |
Molestias digestivas leves (diarrea, náuseas, dolor cólico, flatulencias), hipersensibilidad (manifestaciones cutáneas, discrasias sanguíneas), neumonitis, hepatitis, pancreatitis, nefrotoxicidad |
|
Esteroides sistémicos |
Piel: estrías, hirsutismo, acné; Ojos: glaucoma, cataratas; Cardiovascular: hipertensión arterial, ateroesclerosis; GI: úlcera péptica, pancreatitis; Endocrino: diabetes, hipertrigliceridemia, retraso de crecimiento, cara de luna llena; Músculo-esquelético: miopatía, osteoporosis; SNC: trastornos afectivos, trastorno del sueño; Inmunosupresión |
|
Tiopurinas |
Idiosincráticos: síndrome gripal, rash, dolor abdominal y pancreatitis (3-10% pacientes en la 2ª-3ª semana de tratamiento) Dosis dependiente: mielosupresión (leuco y neutropenia), elevación de transaminasas, intolerancia digestiva (dolor abdominal, náuseas, vómitos) Riesgo aumentado de infecciones víricas y oportunistas Riesgo aumentado de linfoma |
|
Metotrexato |
Gastrointestinales (estomatitis, náuseas, vómitos y diarrea), elevación de transaminasas, hepatotoxicidad, fibrosis hepática Neumonitis intersticial Riesgo de infecciones oportunistas (Pneumocystis carinii, Herpes Zoster, VEB, Listeria, CMV |
|
Infliximab (anti-TNF)α |
Agudas: fiebre, escalofríos, prurito, rash cutáneo, broncoespasmo, sudoración, malestar general, cefalea, náuseas, vómitos, palidez, hipotensión, taquicardia, anafilaxia Tardías: artralgias, mialgias, fiebre, exantema o edema Aumento de infecciones y neoplasias |
|
Adalimumab (anti-TNF)α |
Dolor o enrojecimiento en la zona de punción Mareo, cefalea, malestar general, dolor abdominal, diarrea, rash cutáneo Aumento de infecciones y neoplasias |
Figura 1. Criterios de Oporto para el diagnóstico de EII pediátrica
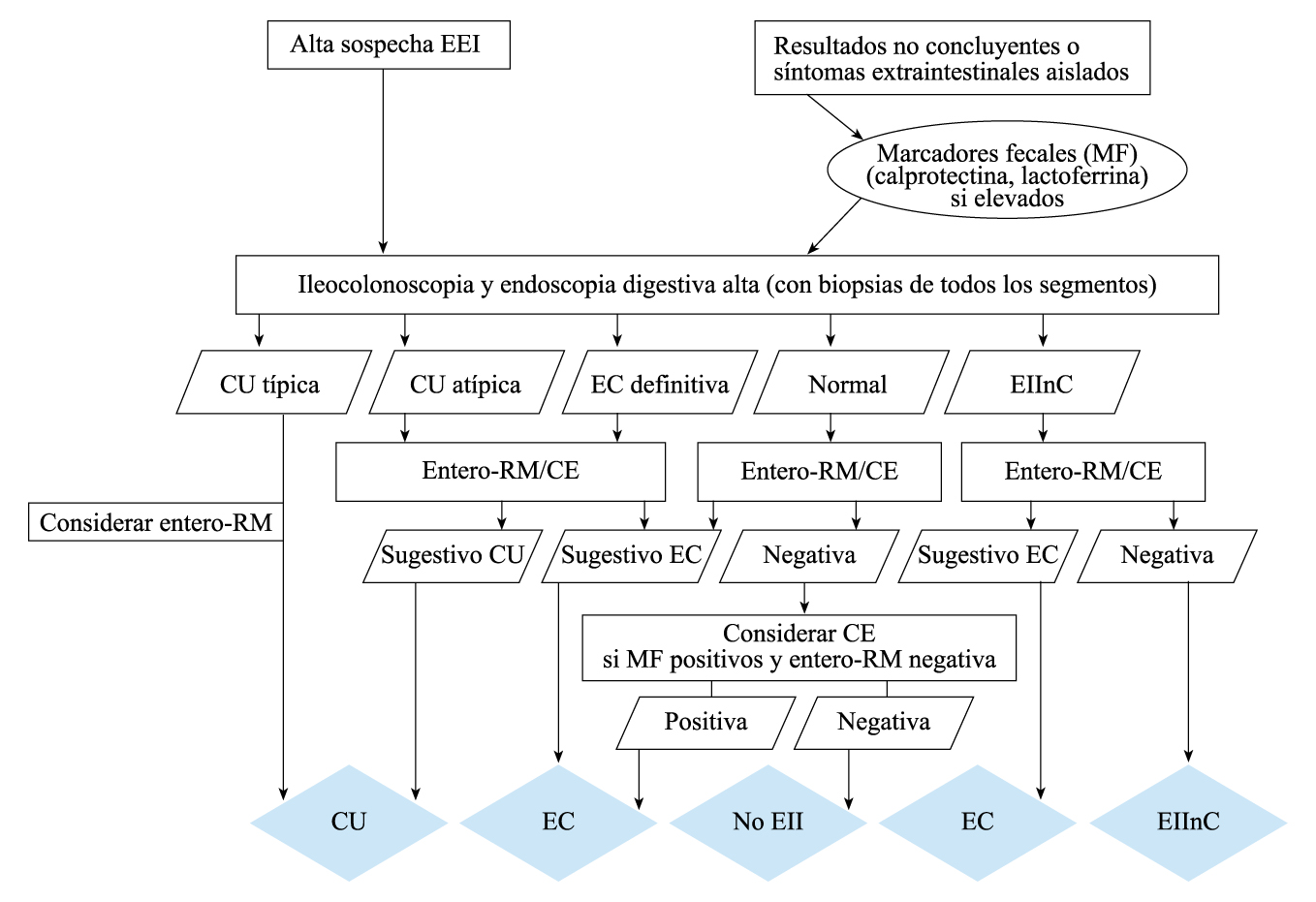
Nota: La CU atípica incluye 5 fenotipos recientemente definidos (preservación rectal, ileitis por reflujo, parche cecal en colitis distal, afectación de tramos digestivos altos, afectación transmural en colitis aguda grave). CU: colitis ulcerosa; EC: Enfermedad de Crohn; EIInc: Enfermedad Inflamatoria Intestinal no clasificada; MF: marcadores fecales; CE: cápsula endoscópica.
Bibliografía
- Martín de Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E, et al. Increasing incidence of pediatric Inflammatory Bowel Disease in Spain (1996-2009): the SPIRIT registry. Inflamm Bowel Dis 2013; 19:73-80.
- Martín de Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E, et al. The complete picture of changing pediatric inflammatory bowel disease incidence in Spain in 25 years (1985-2009): The EXPERIENCE registry”. J Crohns Colitis. 2014;8:763-9.
- Jiménez Treviño S, Pujol Muncunill G, Martín-Masot R, Rodríguez Martínez A, Segarra Cantón O, Peña Quintana L, et al. Spanish Pediatric Inflammatory Bowel Disease Diagnostic Delay Registry: SPIDER Study From Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica. Front Pediatr 2020 Oct 15;8:584278. doi: 10.3389/fped.2020.584278.
- Martín de Carpi J, Jiménez Treviño S, Pujol Muncunill G, Martín Masot R, Navas López VM. Time to diagnosis in paediatric inflammatory bowel disease: Key points for an early diagnosis. An Pediatr (Barc) 2020 Apr;92(4):242.e1-242.e9.
- Levine A, Koletzko S, Turner D, Escher JC, Cucchiara S, de Ridder L, et al. ESPGHAN Revised Porto Criteria diagnosis of Inflammatory Bowel Disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58: 795-806.
- Levine A, Griffiths A, Markowitz J, Wilson DC, Turner D, Russell RK, et al. Pediatric modification of the Montreal classification for inflammatory bowel disease: the Paris classification. Inflamm Bowel Dis 2011;17:1314-21.
- van Rheenen PF, Aloi M, Assa A, Bronsky J, Escher JC, Fagerberg UL, et al. The Medical Management of Paediatric Crohn’s Disease: an ECCO-ESPGHAN Guideline Update. J Crohns Colitis 2020 Oct 7:jjaa161. doi: 10.1093/ecco-jcc/jjaa161. Online ahead of print.
- Turner D, Ruemmele FM, Orlanski-Meyer E, Griffiths AM, Martin de Carpi J, Bronsky J, et al. Management of paediatric ulcerative colitis, Part 1: Ambulatory care- an evidence-based guideline from ECCO and ESPGHAN. J Pediatr Gastroenterol Nutr 2018; 67:257-91.
- Turner D, Ruemmele FM, Orlanski-Meyer E, Griffiths AM, Martin de Carpi J, Bronsky J, et al. Management of pediatric ulcerative colitis, Part 2: Acute severe colitis; an evidence-based consensus guideline from ECCO and ESPGHAN. J. Pediatr Gastroenterol Nutr. 2018; 67: 292-310.
- Veereman-Wauters G, de Ridder L, Veres G, et al. Risk of infection and prevention in pediatric patients with IBD: ESPGHAN IBD Porto Group Commentary. J Pediatr Gastroenterol Nutr 2012;54:830-7.