Tumor testicular en el paciente adolescente
Tumor testicular en el paciente adolescente
P. Guillén Redondo(1), A. L. Luis Huertas(2)
(1)Residente. (2)Facultativo especialista de Área. Cirugía Pediátrica. Hospital Universitario Infantil Niño Jesús de Madrid.
Fecha de recepción: 1 de octubre 2019
Fecha de publicación: 31 de octubre 2019
Adolescere 2019; VII (3): 51e.24-51.e29
Resumen
|
Varón de 16 años con una masa testicular izquierda sugestiva de tumor germinal en ecografía, con marcadores tumorales negativos, y ausencia de diseminación en el estudio de extensión. Tras orquiectomía inguinal, se apreció elevación de AFP y βHCG, y adenopatías retroperitoneales captantes en PET-TC, por lo que se instauró quimioterapia. En el estudio de control, se confirmó el crecimiento de las adenopatías retroperitoneales con marcadores negativos, por lo que se indicó una linfadenectomía retroperitoneal. Palabras clave: Neoplasias testiculares; Neoplasias de Células Germinales y Embrionarias; Biomarcadores de tumor; Escisión de ganglio linfático. |
Abstract
|
We present the case of a 16-year-old boy with a left testicular mass. Ultrasound suggested germ-cell tumor, biomarkers were negative, and no tumor spread was found in imaging studies. After orchiectomy, elevation of AFP and βHCG, and retroperitoneal lymph nodes in PET-CT, were detected. He received chemotherapy, but lymph nodes grew despite treatment, and biomarkers remained negative. A retroperitoneal lymphadenectomy was performed. Key words: Testicular Neoplasms; Germ-cell and Embryonal Neoplasms; Biomarkers; Lymph Node Excision |
Introducción
Los tumores testiculares son tumores raros en población pediátrica, suponiendo el 0,5% de los tumores malignos en niños menores de 15 años. Su incidencia aumenta considerablemente entre los 15 y los 19 años, así como el riesgo de diseminación tumoral.
La incidencia de los tumores testiculares aumenta considera-blemente entre los 15 y los 19 años, así como el riesgo de diseminación tumoral
En más del 90% de los casos, los tumores testiculares derivan de las células germinales, y el 10% restante son tumores estromales derivados de los cordones sexuales (tumores de células de Leydig/Sertoli) o de células de la granulosa. Existen además los tumores paratesticulares, en su mayoría benignos, siendo el rabdomiosarcoma la variedad histológica maligna más frecuente.
Respecto al grupo de los tumores testiculares de células germinales (TTCG), el 50% del total son seminomas, y el otro 50% corresponde a tumores germinales no seminomatosos (TTCGNS). Sin embargo, los seminomas son extremadamente raros en edad pediátrica, y prácticamente inexistentes en época prepuberal.
La edad a la que se presentan los tumores testiculares determina el tipo histológico, el comportamiento y el pronóstico de la enfermedad, debido a la diferencia en su origen y etiopatogenia (parece que los tumores germinales postpuberales se originan a partir de neoplasias in situ de células germinales); así como en su biología y características genéticas. Esto obliga a aplicar protocolos de diagnóstico y tratamiento diferentes en el tumor germinal en el adolescente.
Caso clínico
Un varón de 16 años acude al servicio de Urgencias por una tumoración en testículo izquierdo de un mes de evolución, de crecimiento progresivo. En la historia no se registran otros síntomas, ni traumatismo previo.
En la exploración física, se observan ambos testes en bolsa escrotal, sin cambios cutáneos, con aumento de tamaño testicular izquierdo. A la palpación, se aprecia una tumoración de consistencia pétrea, levemente dolorosa, en el polo inferior del testículo izquierdo. El testículo derecho no muestra alteraciones en la exploración, y no se palpan adenopatías inguinales.
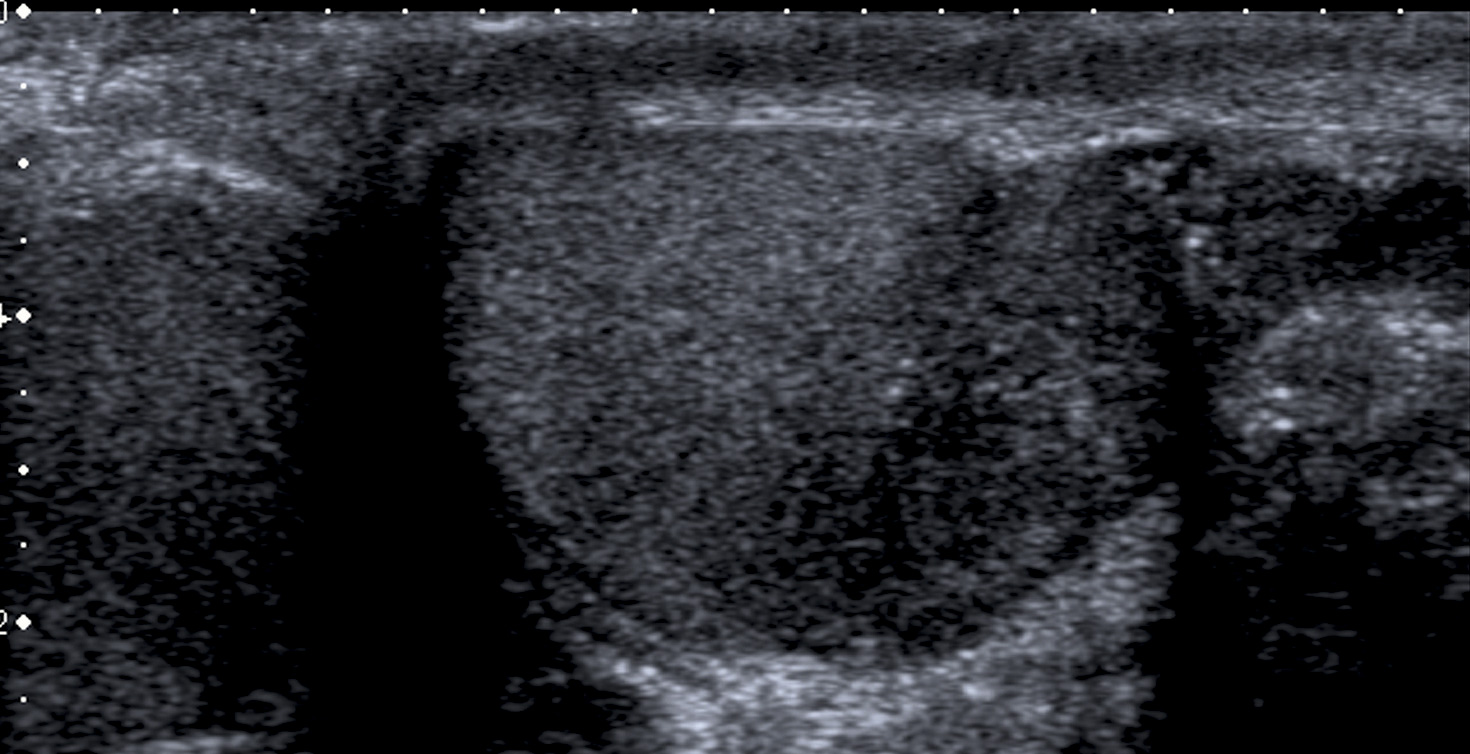
En el estudio de imagen mediante ecografía-doppler testicular, se identifica una masa en el polo inferior del testículo izquierdo, ligeramente exofítica, de aproximadamente 19 x 12 x 15 mm, heterogénea, hipervascularizada, con límites mal definidos, y múltiples imágenes puntiformes hiperecogénicas en su interior sugerentes de calcificaciones (Figura 1).
La analítica sanguínea muestra elevación de LDH, y los marcadores tumorales (AFP, BCGH) son negativos (Tabla I).
En el diagnóstico de extensión, mediante radiografía de tórax y TC abdominopélvico, se confirma la ausencia de lesiones sugestivas de diseminación tumoral. Se diagnostica la presencia de dos venas cavas inferiores como variante anatómica.
Tras la valoración de las pruebas complementarias, y con el diagnóstico de tumor testicular germinal localizado, se indica la realización preferente de orquiectomía izquierda mediante abordaje inguinal, con ligadura individualizada de los elementos del cordón espermático, y sección posterior del mismo a nivel de orificio inguinal profundo.
El estudio anatomopatológico se informa como tumor mixto de células germinales no seminomatoso, con predominio de carcinoma embrionario (95%), y pequeña proporción de teratoma (3%) y tumor del seno endodérmico (2%). Los márgenes quirúrgicos se consideran libres de tumor, y se confirma la ausencia de infiltración de cordón espermático y epidídimo.
Con el diagnóstico de TCGNS estadio I, se decide de forma consensuada en el Comité de Tumores Sólidos del centro, el seguimiento clínico y radiológico, sin otros tratamientos adyuvantes. Se planifica la realización de marcadores tumorales, radiografía de tórax, y ecografía abdominal y testicular mensual, así como TC cervico-toraco-abdomino-pelvico cuatrimestral, durante el primer año.
A los dos meses de la orquiectomía, el paciente presenta recaída tumoral, diagnosticada por la elevación de marcadores tumorales: AFP (48,52 ng/mL) y de βHCG (8,57 mlU/mL); y crecimiento de adenopatías retroperitoneales en ecografía abdominal, con captación en el PET-TC. En esta situación de enfermedad en estadio IIA, se inicia tratamiento quimioterápico (QMT), consistente en 4 ciclos de JEB (bleomicina, etopósido y cisplatino) según protocolo para cáncer testicular.
En la evaluación tras el cuarto ciclo de QMT, se evidencia crecimiento de las adenopatías retroperitoneales, sin captación en PET-TC; así como la presencia de una tumoración de aspecto multiquístico sobre adenopatía retroperitoneal izquierda previa, a nivel del hilio renal izquierdo. Los niveles de AFP y de βHCG se encuentran dentro de los límites de la normalidad.
Ante la presencia de enfermedad retroperitoneal con marcadores tumorales negativos, se indica la realización de Linfadenectomía retroperitoneal por vía laparoscópica.
Como hallazgos quirúrgicos, se confirma la existencia de adenopatías retroperitoneales en el territorio aorto-cavo. Sobre la cara anterior de aorta y vena cava inferior izquierda, se halla una tumoración redondeada bilobulada de aspecto mixto sólido-quístico de aproximadamente 7 cm en eje longitudinal y 4 cm en eje transversal, a nivel de la desembocadura de la vena renal izquierda. Se realiza una extirpación completa macroscópica de dicha tumoración y se continúa la LRP a nivel de ambos espacios interaortocavos y a nivel preaórtico, con límite superior en hilio renal e inferior a nivel de la bifurcación ilíaca.
El examen anatomopatológico diagnosticó la tumoración de teratoma maduro, y descartó infiltración neoplásica en las adenopatías extirpadas.
Al año de seguimiento, se llevó a cabo la colocación de una prótesis testicular izquierda y la retirada del acceso venoso central con reservorio.
En el momento actual, a los dos años de evolución, el paciente permanece asintomático, con marcadores tumorales negativos y normalidad de las pruebas de imagen.
Discusión
La incidencia de los tumores testiculares en el adolescente aumenta y representa el 14% de todos los tipos de cáncer en este grupo de edad. De forma global, y dadas sus características histológicas y de biología molecular, los tumores presentes en pacientes menores de 14 años son de pronóstico más favorable al de los adolescentes (15-19 años), de comportamiento más parecido al tumor testicular del adulto.
Los tumores presentes en pacientes menores de 14 años son de pronóstico más favorable al de los adolescentes (15-19 años), de comportamiento más parecido al tumor testicular del adulto
La mayoría de los casos se presentan, como en nuestro paciente, como una masa testicular no dolorosa o aumento del tamaño testicular detectados por palpación; y debe plantearse el diagnóstico diferencial con cuadros de escroto agudo, como torsión testicular, rotura testicular u orquitis, así como otras tumoraciones paratesticulares. Otros tumores testiculares no germinales como los tumores estromales gonadales (de células de Leydig, de Sertoli o de la granulosa) pueden presentarse también como masas asintomáticas, excepto los que son virilizantes/feminizantes, que pueden producir una pubertad precoz.
En la población prepuberal, el 70-75% de los tumores testiculares son benignos, siendo la mitad de ellos teratomas. En el grupo de pacientes con tumores malignos, el 85% presentan un estadio I al diagnóstico. En relación con la diseminación, solo 5% de los tumores testiculares son metastásicos al diagnóstico, a diferencia de lo que ocurre en la adolescencia, con el 20-30% de enfermedad metastásica en el momento del diagnóstico, preferentemente pulmonar o ganglionar.
La gran mayoría de los tumores testiculares malignos pediátricos son tumores germinales (>90%), con una presentación bimodal según la edad, con dos picos de incidencia: menores de 1 año y mayores de 15 años.
El TTCG más frecuente en periodo prepuberal es el teratoma maduro como tumor benigno, y tumor del saco vitelino o del seno endodérmico como tumor maligno (14% del total).
Entre los pacientes postpuberales, los tumores mixtos de células germinales constituyen el grupo mayoritario, y su componente histológico más frecuente es el carcinoma embrionario, coincidente con la histología de nuestro paciente. Los teratomas de comportamiento maligno son más habituales en este grupo de edad, con una frecuencia similar a la de los adultos.
Tras la sospecha clínica, el primer paso en el diagnóstico es la obtención de marcadores tumorales (AFP, BGHC y LDH) y la realización de ecografía- doppler escrotal y testicular bilateral como primera prueba de imagen
Tras la sospecha clínica, el primer paso en el diagnóstico es la obtención de marcadores tumorales (AFP, BGHC y LDH) y la realización de ecografía- doppler escrotal y testicular bilateral como primera prueba de imagen. Ésta presenta una sensibilidad en torno al 100% para tumores testiculares, y permite la diferenciación entre lesión testicular y paratesticular.
Para el estadiaje, debe realizarse una Rx de tórax (si hay sospecha de metástasis pulmonares, se indicará TC de tórax), y TC o RM abdominopélvica para el estudio de enfermedad ganglionar retroperitoneal.
Los niveles de AFP, βHCG y LDH son necesarios en el seguimiento de la enfermedad, y suponen uno de los parámetros considerados en el estadiaje del cáncer testicular. La AFP es producida por el tumor de saco vitelino y ocasionalmente por carcinoma embrionario; hay que tener en cuenta la posibilidad de elevación fisiológica en niños menores de 2 años. La β-HCG se eleva masivamente en el coriocarcinoma, y a veces moderadamente en seminoma y carcinoma embrionario. Los niveles altos de LDH se correlacionan con enfermedad diseminada, y su elevación tras tratamiento puede significar recaída tumoral.
Los niveles de AFP, βHCG y LDH deben normalizarse tras la orquiectomía si la enfermedad está localizada en el testículo. Se deben obtener de nuevo a las 3-4 semanas para la realización del estadiaje postorquiectomía.
Como se ha comentado anteriormente, debido a las diferencias según la edad en la biología, comportamiento y pronóstico tumoral, el estadiaje del cáncer de testículo se realiza mediante diferentes sistemas de clasificación en función del grupo etario. Así, en los pacientes prepuberales se toma como referencia la clasificación COG (Childrens Oncology Group), mientras que en adolescentes el estadiaje se basa en la clasificación TNM-S de la American Joint Committee on Cancer Staging. En ambos casos, el estadiaje se valora en función del tamaño tumoral (T), la presencia de enfermedad ganglionar (N) o metastásica a distancia (M) y los niveles de marcadores tumorales (S). Además, el grupo internacional de trabajo del cáncer testicular IGCCCG (International Germ Cell Cancer Collaborative Group) clasifica a los pacientes en tres grupos de riesgo: Bajo, Intermedio o Alto, según el tipo histológico, los niveles de AFP, βHCG y LDH; y la localización y diseminación tumoral (Tabla II).
En relación con el tratamiento, la orquiectomía radical por vía inguinal se considera el tratamiento quirúrgico de elección en todos los pacientes con tumor testicular. Sin embargo, en los últimos años surge la controversia sobre la indicación de orquiectomía parcial en pacientes seleccionados con sospecha de tumoración testicular benigna. De este modo, pacientes en edad prepuberal con marcadores tumorales negativos pueden ser candidatos para la realización de biopsia testicular intraoperatoria previa al clampaje atraumático del cordón espermático, continuando con la extirpación tumoral con márgenes quirúrgicos libres y preservando el resto del tejido testicular (“sparing surgery”), en el caso de la confirmación de un teratoma maduro u otra variante histológica benigna.
La orquiectomía radical por vía inguinal se considera el tratamiento quirúrgico de elección en todos los pacientes con tumor testicular. Sin embargo, en los últimos años surge la controversia en pacientes seleccionados con sospecha de tumoración testicular benigna
En los tumores germinales localizados (estadio I), está universalmente admitido el seguimiento clínico tras la orquiectomía, sin aplicar otros tratamientos complementarios. Otras opciones son la aplicación de QMT a dosis bajas o la linfadenectomía retroperitoneal (LRP) postorquiectomía. Parece haberse demostrado mayor eficacia en la prevención de recurrencias con QMT respecto a la LRP, pero no existe diferencia en cuanto a supervivencia, por lo que las tres pautas de tratamiento se consideran seguras y válidas.
La LRP estaría preferentemente indicada en los pacientes que rechacen el tratamiento quimioterápico o cuando existan contraindicaciones de este. Consiste en la extirpación de las cadenas ganglionares retroperitoneales, bien para diagnóstico de infiltración neoplásica no visible en pruebas de imagen (LRP primaria) o como tratamiento de adenopatías o masas retroperitoneales visibles sospechosas de enfermedad tumoral. Como ventaja de la LRP primaria, identifica pacientes con enfermedad retroperitoneal oculta, y en pacientes en los que se confirma la ausencia de infiltración ganglionar (pN0), permite reducir la intensidad de la vigilancia. No obstante, los beneficios deben balancearse con los riesgos de la cirugía (dolor, infección, sangrado, lesión visceral, ileo, linfocele, eyaculación retrógrada).
En caso de afectación ganglionar visible, puede indicarse como alternativa al tratamiento con QMT en los pacientes con marcadores positivos, y es obligada en el caso de que éstos sean negativos. En los casos de enfermedad ganglionar retroperitoneal, se considera curativa en 50-70% de los pacientes en estadio IIa-IIb (pN1 o pN2).
En estadio II, la QMT con bleomicina, etopósido y derivados del platino, es la primera línea de tratamiento, ya que tiene menos índice de recidiva que la LRP primaria (9-17% vs 30% en IIa, 13-39% vs 50% en IIb). No obstante, si tras finalizar el tratamiento quimioterápico existe tumor residual y los marcadores se han negativizado, la LRP postquimioterapia está claramente indicada, ya que puede tratarse de adenopatías reactivas o de teratomas maduros no secretores que no se benefician de la QMT; como en el caso de nuestro paciente.
Esta intervención permitió además realizar un estadiaje histológico de las cadenas ganglionares susceptibles de diseminación, y constatar la ausencia de enfermedad metastásica no visible en imagen, evitando un nuevo ciclo de quimioterapia innecesario que potencialmente dañaría la gónada contralateral.
La tasa de curación completa en pacientes prepuberales es casi del 100%, incluso en los pacientes que requieren quimioterapia de rescate por recaída. En pacientes postpuberales, la tasa de supervivencia a los 5 años es del 87%. Como secuela a largo plazo, cabe destacar el compromiso temporal o permanente de la fertilidad por los efectos de la QMT en el tejido gonadal restante. Para conservar la fertilidad, la técnica más efectiva es la criopreservación de esperma, que idealmente debe realizarse antes de comenzar el tratamiento quimioterápico.
Como conclusión, la aparición de una masa testicular no dolorosa en el paciente adolescente debe hacer sospechar la existencia de un tumor germinal, e iniciar de forma preferente el estudio diagnóstico necesario para su confirmación y estadiaje.
La aparición de una masa testicular no dolorosa en el paciente adolescente debe hacer sospechar la existencia de un tumor germinal, e iniciar de forma preferente el estudio diagnóstico necesario para su confirmación y estadiaje
A pesar de que, de forma global, el pronóstico de estos pacientes es muy favorable, se debe descartar de forma precoz la afectación ganglionar retroperitoneal, que puede abordarse mediante LRP o tratamiento quimioterápico. La LRP se considera el tratamiento de elección en los casos de enfermedad ganglionar y marcadores tumorales negativos.
Tablas y figuras
Tabla I. Analítica sanguínea obtenida al diagnóstico
|
Marcador |
Valor |
Rango de normalidad |
|
LDH |
332 U/L |
100 – 250 U/L |
|
CA 125 |
11.9 U/mL |
< 46 U/mL |
|
Alfafetoproteína (AFP) |
8,75 ng/mL |
1 – 15 ng/mL |
|
βHCG |
2,98 mlU/mL |
< 5 mlU/mL |
|
Inhibina A |
1,9 pg/mL |
< 2 pg/mL |
|
Inhibina B |
147 pg/mL |
25 – 325 pg/mL |
Tabla II. Clasificación del riesgo del cáncer testicular según el IGCCCG (International Germ Cell Cancer Collaborative Group)
Figura 1. Tumoración testicular izquierda (flecha blanca) en ecografía
Bibliografía
- Verrill C, Yilmaz A, Srigley J, Amin M, Compérat E, Egevad L et al. Reporting and Staging of Testicular Germ Cell Tumors. The American Journal of Surgical Pathology. 2017;41(6):e22-e32.
- Grantham E, Caldwell B, Cost N. Current urologic care for testicular germ cell tumors in pediatric and adolescent patients. Urologic Oncology: Seminars and Original Investigations. 2016;34(2):65-75.
- M.P. Laguna (Chair), P. Albers, W. Albrecht, F. Algaba, C. Bokemeyer, J.L. Boormans, G. Cohn-Cedermark, et al. EAU Guidelines: Testicular Cancer | Uroweb. 2019. Available from: https://uroweb.org/guideline/testicular-cancer/
- Flechtner H, Fischer F, Albers P, Hartmann M, Siener R. Quality-of-Life Analysis of the German Prospective Multicentre Trial of Single-cycle Adjuvant BEP Versus Retroperitoneal Lymph Node Dissection in Clinical Stage I Nonseminomatous Germ Cell Tumours. European Urology. 2016;69(3):518-525.
- Eggener S, Carver B, Sharp D, Motzer R, Bosl G, Sheinfeld J. Incidence of Disease Outside Modified Retroperitoneal Lymph Node Dissection Templates in Clinical Stage I or IIA Nonseminomatous Germ Cell Testicular Cancer. Journal of Urology. 2007;177(3):937-943.